一种通过槟榔碱与脯氨酸含量检测槟榔幼苗干旱状态的方法
1.本发明属于生理与生物化学技术领域,尤其涉及一种通过槟榔碱与脯氨酸含量检测槟榔幼苗干旱状态的方法。
背景技术:
2.目前:槟榔(areca catechu l.)隶属于棕榈科(palmae),槟榔属(areca),是多年生的常绿乔木。槟榔因其助消化、抗菌等重要的药用价值,被称为中国4大南药之首。原产于东南亚,在我国主要分布于台湾、海南、广西、广东、云南、福建的南部地区,是海南省第二大经济作物,槟榔产业的发展前景是十分广阔的。在海南,每年11月到第二年4月,常出现长期的连续干旱,导致了槟榔生长发育迟缓,延长了槟榔的结果期,进而严重影响了其产量。
3.脯氨酸作为植物体内的相容溶质和渗透保护剂,是一种小分子,具有低分子量、高溶解性等特点,在植物的有机渗透调节中起着重要作用。一方面,作为活性氧的清除剂,是改善渗透压损伤的能量来源;另一方面,稳定蛋白质和膜,还可以降低膜的渗透势,防止细胞内脱水。它们聚集在细胞内,维持细胞周围和胞浆之间渗透差异的平衡。因此,测定脯氨酸的含量常可以作为诊断干旱状态的方法。但直至现在,还未见关于槟榔碱在渗透调节中所起的作用的报道。
4.目前,对于脯氨酸含量的测定,通常的检测方法包括分光光度法、高效液相色谱法、电位滴定法、薄层扫描法、示波极谱法等。其中,高效液相色谱法、薄层扫描法等方法灵敏度高、准确性好,但是测量成本高,所需仪器设备昂贵,操作繁琐。
5.通过上述分析,现有技术存在的问题及缺陷为:
6.现有技术中,测量成本高,仪器设备昂贵,操作繁琐。
7.方法单一,大多仅通过测量脯氨酸含量、sod酶活性、电导率、丙二醛(mda)含量来判断槟榔的干旱状态。
8.解决以上问题及缺陷的难度为:相关文献报道较少,在农业实际生产中应用较少。
9.解决以上问题及缺陷的意义为:丰富了检测槟榔幼苗干旱状态的方法;极大地改善农业生产,解决农业生产上的技术难题,解决大规模槟榔幼苗干旱的防治问题。
技术实现要素:
10.针对现有技术存在的问题,本发明提供了一种通过槟榔碱与脯氨酸含量检测槟榔幼苗干旱状态的方法。
11.本发明是这样实现的,一种通过槟榔碱与脯氨酸含量检测槟榔幼苗干旱状态的方法包括:
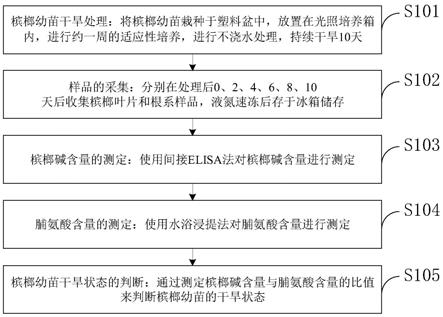
12.步骤一,槟榔幼苗干旱处理:将槟榔幼苗栽种于塑料盆中,放置在光照培养箱内,进行约一周的适应性培养,进行不浇水处理,持续干旱10天;
13.步骤二,样品的采集:分别在处理后0、2、4、6、8、10天后收集槟榔叶片和根系样品,液氮速冻后存于冰箱储存;
14.步骤三,槟榔碱含量的测定:使用间接elisa法对槟榔碱含量进行测定;
15.步骤四,脯氨酸含量的测定:使用水浴浸提法对脯氨酸含量进行测定;
16.步骤五,槟榔幼苗干旱状态的判断:通过测定槟榔碱含量与脯氨酸含量的比值来判断槟榔幼苗的干旱状态。
17.进一步,步骤一中,选取长势一致的1
‑
2叶龄槟榔幼苗,所述槟榔幼苗每周浇一次1/2hoagland营养液,所述hoagland营养液的ph=6.0。
18.进一步,所述光照培养箱的温度为26℃,光照时间为:光16h/暗8h。
19.进一步,步骤三中,所述使用间接elisa法对槟榔碱含量进行测定,包括:
20.(1)样品提取液的准备;
21.(2)包被:将96孔酶标板中各孔加入12ml包被缓冲液,置于37℃孵育3h或置于4℃冰箱孵育,弃液,用洗涤液冲洗酶标板3次;
22.(3)封闭:将酶标板中各孔加入150μl封闭液,置于37℃孵育30min;
23.(4)标品、样品及抗体的准备:分别配置6000ng/ml、2000ng/ml、666.7ng/ml、222.2ng/ml、74.1ng/ml、24.7ng/ml、8.23ng/ml的槟榔碱标品;将样品提取液分别用样品稀释液稀释1500倍;将抗体用样品稀释液稀释;
24.(5)加样孵育:将标品及样品的稀释液分别以50μl/孔加到酶标板对应孔中;置于37℃孵育30min;弃液,用洗涤液冲洗酶标板3次;
25.(6)加二抗:将辣根过氧化物酶标记的羊抗小鼠抗体稀释1000倍;以100μl/孔加到酶标板对应孔中;弃液,用洗涤液冲洗酶标板4
‑
6次;
26.(7)显色:准备底物显色液,将底物显色液以100μl/孔加到酶标板对应孔中,常温显色20min;
27.(8)终止反应:将终止液以50μl/孔加到酶标板对应孔中;
28.(9)观察结果:用酶联免疫检测仪在490nm下测定吸光值。
29.进一步,所述样品提取液的准备,包括:
30.①
称取槟榔样品粉末50mg;
31.②
加入1ml浓度为50%甲醇,所述甲醇为用去离子水稀释色谱级无水甲醇;
32.③
超声处理30min
‑
1h;
33.④‑
20℃静置3
‑
5h;
34.⑤
室温涡旋混匀;
35.⑥
10000g离心10min,取上清;
36.⑦
使用1ml一次性使用无菌注射器吸取(4)中溶液,用0.45μm有机相针式滤器过滤。
37.进一步,步骤(2)中,所述包被缓冲液加入3μl包被抗原。
38.进一步,步骤四中,所述使用水浴浸提法对脯氨酸含量进行测定,包括:
39.(1)标准曲线的制作;
40.(2)样品脯氨酸的提取:分别称取槟榔幼苗叶片和根系各阶段的0.1g样品,至2.0ml的离心管中,各加1ml 3%的磺基水杨酸溶液,90℃水浴振荡10
‑
15min;室温12000g离心10min;取上清,过滤备用;
41.(3)样品中脯氨酸的测定:每种样品的滤液都设置三个重复。
42.进一步,所述标准曲线的制作,包括:
43.①
取7个25ml玻璃试管,编成1
‑
7号,按顺序向各离心管中加入试剂;
44.②
混匀,95℃水浴30min,冷却到室温;
45.③
各管中分别加5.0ml甲苯,充分混匀以萃取脯氨酸;
46.④
黑暗下静置2
‑
3h;
47.⑤
待溶液分层后,吸取甲苯层溶液于96孔板中,各孔200μl,各管重复3次;
48.⑥
使用酶标仪,于520nm波长下测定吸光值a,δa=a
‑
a空白;
49.⑦
δa所对应的各管脯氨酸含量分别为:0.00μg、0.08μg、0.16μg、0.32μg、0.48μg、0.64μg、0.8μg;
50.⑧
以脯氨酸含量为横坐标,δa为纵坐标,绘制标准曲线,所述标准曲线方程为:y=0.4209x
‑
0.0013。
51.进一步,所述样品中脯氨酸的测定,包括:
52.①
按顺序向各离心管中加入试剂,混匀,95℃水浴加热30min,冷却至室温;
53.②
各离心管中分别加入800μl甲苯;
54.③
充分混匀以萃取脯氨酸;
55.④
黑暗下静置2
‑
3h;
56.⑤
待溶液分层后,吸取甲苯层溶液于96孔板中,各孔200μl,各管重复3次;
57.⑥
使用酶标仪,于520nm波长下测定吸光值a,δa=a样品
‑
a空白;
58.⑦
样品中脯氨酸含量计算如下:
59.脯氨酸含量(μg/g)=[(δa+0.0013)
÷
0.4209]
÷
[(v1
÷
v)
×
(v3
÷
v2)]
÷
m=316.78
×
(δa+0.0013)
[0060]
v1
‑‑‑
加入到反应体系中的样品提取液体积,0.3ml;v
‑‑‑
样品提取液总体积,1ml;v2
‑‑‑
甲苯萃取总体积,0.8ml;v3
‑‑‑
酶标仪上样的体积,0.2ml;m
‑‑‑
样品质量,0.1g。
[0061]
进一步,步骤五中,所述通过测定槟榔碱含量与脯氨酸含量的比值来判断槟榔幼苗的干旱状态,包括:
[0062]
对于地上部,槟榔碱含量与脯氨酸含量的比值大于300,对于地下部,槟榔碱含量与脯氨酸含量的比值大于500,则判定槟榔碱幼苗处于早期干旱;
[0063]
对于地上部,槟榔碱含量与脯氨酸含量的比值小于300,对于地下部,槟榔碱含量与脯氨酸含量的比值小于500,则判定槟榔碱幼苗处于晚期干旱。
[0064]
结合上述的所有技术方案,本发明所具备的优点及积极效果为:
[0065]
本发明通过测定槟榔碱含量与脯氨酸含量,并且计算二者比值,即可判断槟榔幼苗的干旱状态,只需取槟榔幼苗的微量组织,即可进行测定,测量结果相对准确,易于判断。
[0066]
本发明使用免疫化学分析法测量槟榔碱的含量,利用特异性识别槟榔碱的单克隆抗体,通过间接竞争elisa方法,对槟榔碱的含量进行测定,操作简便、灵敏度高。
[0067]
本方法提供了测定槟榔碱及脯氨酸含量的方法(分别使用间接elisa法测定槟榔碱含量、使用水浴浸提法测定脯氨酸含量),通过计算槟榔碱与脯氨酸含量的比值,能直接判断槟榔幼苗的干旱状态,直接用于生产实践中,简化农业生产中对槟榔幼苗的干旱状态(早期干旱/晚期干旱)的判断过程。
附图说明
[0068]
为了更清楚地说明本技术实施例的技术方案,下面将对本技术实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
[0069]
图1是本发明实施例提供的通过槟榔碱与脯氨酸含量检测槟榔幼苗干旱状态的方法流程图。
[0070]
图2是本发明实施例提供的槟榔碱含量测定的标准曲线图。
[0071]
图3是本发明实施例提供的测得的叶片样品与根系样品的槟榔碱含量随干旱时间变化曲线图。
[0072]
图4是本发明实施例提供的脯氨酸含量测定的标准曲线图。
[0073]
图5是本发明实施例提供的测得叶片样品与根系样品中的脯氨酸含量随干旱时间变化曲线图。
[0074]
图6是本发明实施例提供的地上部与地下部的槟榔碱含量与脯氨酸含量的比值随干旱时间变化曲线图。
具体实施方式
[0075]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0076]
针对现有技术存在的问题,本发明提供了一种通过槟榔碱与脯氨酸含量检测槟榔幼苗干旱状态的方法,下面结合附图对本发明作详细的描述。
[0077]
如图1所示,本发明实施例提供的通过槟榔碱与脯氨酸含量检测槟榔幼苗干旱状态的方法包括:
[0078]
s101,槟榔幼苗干旱处理:将槟榔幼苗栽种于塑料盆中,放置在光照培养箱内,进行约一周的适应性培养,进行不浇水处理,持续干旱10天;
[0079]
s102,样品的采集:分别在处理后0、2、4、6、8、10天后收集槟榔叶片和根系样品,液氮速冻后存于冰箱储存;
[0080]
s103,槟榔碱含量的测定:使用间接elisa法对槟榔碱含量进行测定;
[0081]
s104,脯氨酸含量的测定:使用水浴浸提法对脯氨酸含量进行测定;
[0082]
s105,槟榔幼苗干旱状态的判断:通过测定槟榔碱含量与脯氨酸含量的比值来判断槟榔幼苗的干旱状态。
[0083]
下面结合具体实施例对本发明进一步进行说明。
[0084]
1.槟榔幼苗干旱处理
[0085]
选取长势一致的1
‑
2叶龄槟榔幼苗(每周浇一次1/2hoagland营养液(ph=6.0)),栽种于12cm
×
12cm的塑料盆中,幼苗放置在光照培养箱内(温度26℃左右,光16h/暗8h),进行约一周的适应性培养。
[0086]
将槟榔幼苗进行不浇水处理,持续干旱10天。
[0087]
2.样品的采集:
[0088]
分别在处理后0、2、4、6、8、10天后收集槟榔叶片和根系样品,液氮速冻后存于
‑
80℃冰箱储存(每次至少取3株以上样品)。
[0089]
3.槟榔碱含量的测定:
[0090]
本步骤使用间接elisa法对槟榔碱含量进行测定。
[0091]
(1)样品提取液的准备:
[0092]
①
称取槟榔样品粉末50mg;
[0093]
②
加入1ml浓度为50%甲醇(用去离子水稀释色谱级无水甲醇);
[0094]
③
超声处理30min
‑
1h;
[0095]
④‑
20℃静置3
‑
5h;
[0096]
⑤
室温涡旋混匀;
[0097]
⑥
10000g离心10min,取上清;
[0098]
⑦
使用1ml一次性使用无菌注射器(武汉市王冠医疗器械有限责任公司,货号wg0000)吸取(4)中溶液,用0.45μm有机相针式滤器(尼龙)(上海安谱实验科技股份有限公司,货号scaa
‑
103)过滤;
[0099]
(2)包被:
[0100]
①
12ml包被缓冲液中加入3μl包被抗原;
[0101]
②
96孔酶标板中各孔加入100μl
①
中溶液;
[0102]
③
置于37℃孵育3h(注意保湿),或置于4℃冰箱孵育;
[0103]
③
弃液,用洗涤液冲洗酶标板3次;
[0104]
(3)封闭:
[0105]
①
酶标板中各孔加入150μl封闭液
[0106]
②
置于37℃孵育30min(注意保湿);
[0107]
(4)标品、样品及抗体的准备:
[0108]
①
分别配置6000ng/ml、2000ng/ml、666.7ng/ml、222.2ng/ml、74.1ng/ml、24.7ng/ml、8.23ng/ml的槟榔碱标品;
[0109]
②
将样品提取液分别用样品稀释液稀释1500倍;
[0110]
③
将抗体用样品稀释液稀释
[0111]
(5)加样孵育:
[0112]
①
将标品及样品的稀释液分别以50μl/孔加到酶标板对应孔中;
[0113]
②
置于37℃孵育30min;
[0114]
③
弃液,用洗涤液冲洗酶标板3次;
[0115]
(6)加二抗:
[0116]
①
将辣根过氧化物酶标记的羊抗小鼠抗体(gam
‑
hrp)稀释1000倍;
[0117]
②
以100μl/孔加到酶标板对应孔中;
[0118]
③
弃液,用洗涤液冲洗酶标板4
‑
6次;
[0119]
(7)显色:
[0120]
①
准备底物显色液:如12ml底物缓冲液中加24mg邻苯二胺,混匀后加入4.8μlh2o2;
[0121]
②
将底物显色液以100μl/孔加到酶标板对应孔中;
[0122]
③
常温显色20min;
[0123]
(8)终止反应:将终止液以50μl/孔加到酶标板对应孔中;
[0124]
(9)观察结果:用酶联免疫检测仪(酶标仪),在490nm下测定吸光值。
[0125]
4.脯氨酸含量的测定
[0126]
本步骤使用水浴浸提法对脯氨酸含量进行测定。
[0127]
(1)标准曲线的制作:
[0128]
①
取7个25ml玻璃试管(带塞子),编成1
‑
7号,按下表顺序向各离心管中加入试剂。
[0129][0130]
②
混匀,95℃水浴30min(插紧塞子,防止水分散失),冷却到室温;
[0131]
③
各管中分别加5.0ml甲苯,充分混匀以萃取脯氨酸;
[0132]
④
黑暗下静置2
‑
3h;
[0133]
⑤
待溶液分层后,吸取甲苯层溶液于96孔板(康宁corning3599,96孔细胞培养板)中,各孔200μl,各管重复3次;
[0134]
⑥
使用酶标仪,于520nm波长下测定吸光值a,δa=a
‑
a空白(1号管为空白对照);
[0135]
⑦
δa所对应的各管脯氨酸含量分别为:0.00μg,0.08μg,0.16μg,0.32μg,0.48μg,0.64μg,0.8μg。
[0136]
⑧
以脯氨酸含量为横坐标,δa为纵坐标,绘制标准曲线。
[0137]
如图4所示,标准曲线方程:y=0.4209x
‑
0.0013。
[0138]
(2)样品脯氨酸的提取:分别称取槟榔幼苗叶片和根系各阶段的0.1g样品,至2.0ml的离心管中,各加1ml 3%的磺基水杨酸溶液,90℃水浴振荡10
‑
15min;室温12000g离心10min;取上清,过滤备用。
[0139]
(3)样品中脯氨酸的测定:每种样品的滤液都设置三个重复。
[0140]
①
按下表顺序向各离心管中加入试剂。(空白组只需要一管)
[0141]
试剂名称/μl样品组空白组样品提取液300\蒸馏水\300冰醋酸300300茚三酮600600
[0142]
混匀,95℃水浴加热30min(盖紧盖子,防止水分散失),冷却至室温;
[0143]
②
各离心管中分别加入800μl甲苯;
[0144]
③
充分混匀以萃取脯氨酸;
[0145]
④
黑暗下静置2
‑
3h;
[0146]
⑤
待溶液分层后,吸取甲苯层溶液于96孔板(康宁corning3599,96孔细胞培养板)中,各孔200μl,各管重复3次;
[0147]
⑥
使用酶标仪,于520nm波长下测定吸光值a,δa=a样品
‑
a空白;
[0148]
⑦
样品中脯氨酸含量(μg/g鲜重)计算如下:
[0149]
脯氨酸含量(μg/g)=[(δa+0.0013)
÷
0.4209]
÷
[(v1
÷
v)
×
(v3
÷
v2)]
÷
m=316.78
×
(δa+0.0013)
[0150]
v1
‑‑‑
加入到反应体系中的样品提取液体积,0.3ml;v
‑‑‑
样品提取液总体积,1ml;v2
‑‑‑
甲苯萃取总体积,0.8ml;v3
‑‑‑
酶标仪上样的体积,0.2ml;m
‑‑‑
样品质量,0.1g。
[0151]
5.槟榔幼苗干旱状态的判断
[0152][0153][0154]
所以,可通过测定槟榔碱含量与脯氨酸含量的比值来判断槟榔幼苗的干旱状态。对于地上部,槟榔碱含量与脯氨酸含量的比值大于300,对于地下部,槟榔碱含量与脯氨酸含量的比值大于500,则说明槟榔碱幼苗处于早期干旱。对于地上部,槟榔碱含量与脯氨酸含量的比值小于300,对于地下部,槟榔碱含量与脯氨酸含量的比值小于500,则说明槟榔碱幼苗处于晚期干旱。
[0155]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1