间充质干细胞衰老的检测方法与流程
1.本技术属于生物检测技术领域,尤其涉及一种间充质干细胞衰老的检测方法。
背景技术:
2.间充质干细胞(mesenchymal stem cells,mscs)是一种多能干细胞,具有自我更新、多向分化、免疫调节和抗炎的能力,在组织修复和再生中发挥着重要作用。在某些生理和实验条件下,mscs可分化成特定细胞,如成骨细胞、脂肪细胞和神经细胞等,还可在激活后被募集到组织损伤部位,再生新的组织并修复缺损。mscs具有其成体干细胞无法比拟的优势,包括来源广泛、取材容易、分离操作简单、免疫原性低、伦理争议少等,因此以mscs为基础的干细胞疗法近年来受到广泛关注,为治疗各种难治性疾病带来了新的契机。能够获得足够“数量”和“质量”的干细胞,是mscs作为干细胞药物应用于临床规模化治疗的前提条件。
3.但在间充质干细胞的临床应用过程中,特别是随着体外传代次数的递增,复制性衰老问题始终伴随左右,对其治疗效果产生了严重的影响,增加了间充质干细胞产品临床输注的潜在风险,因此,准确判断间充质干细胞的衰老状态至关重要。目前间充质干细胞衰老的传统检测方法:有形态学观察法、β
‑
半乳糖苷酶染色法、wb(western blot,即蛋白免疫印迹)实验检测p53、p21和p16表达。
4.形态学观察法,简单方便、可视性强,但容易受到个人判断的干扰,因此其一般仅用于定性分析、难以做到准确的定量检测。β
‑
半乳糖苷酶染色法,需要对细胞进行固定,不可避免地对细胞结构造成损伤和破坏;且实验时间长,染色时间长(>12h),不利于大规模样品的实时检测;另外,由于衰老细胞与非衰老细胞的区分完全依赖于实验人员的主观判断,有一定的误差。利用wb实验检测p53、p21和p16表达,样本处理需要完全破碎细胞提取蛋白;实验操作步骤繁琐,实验时间长,整个检测过程大于48小时;且检测结果也需要人主观判断,无法精确定量检测。因此,目前对间充质干细胞衰老缺乏简单高效的检测方法。
技术实现要素:
5.本技术的目的在于提供一种间充质干细胞衰老的检测方法,旨在一定程度上解决现有间充质干细胞衰老的检测方法操作复杂,检测存在误差,不利于对样品大规模检测等问题。
6.为实现上述申请目的,本技术采用的技术方案如下:
7.第一方面,本技术提供一种间充质干细胞衰老的检测方法,包括以下步骤:
8.获取待检测的间充质干细胞,采用cd26流式抗体对所述待检测的间充质干细胞进行染色处理后,重悬细胞,检测间充质干细胞中c
‑
26的表达量。
9.进一步地,所述检测间充质干细胞中cd26的表达量的步骤包括:通过对间充质干细胞中cd26的荧光强度进行定量检测,得到cd26的表达量。
10.进一步地,所述检测间充质干细胞中cd
‑
26的表达量的方法包括:采用流式细胞仪
进行检测。
11.进一步地,所述染色处理的条件包括:在温度为20~25℃的避光条件下染色30min。
12.进一步地,所述染色处理的步骤包括:采用biolegend公司的cd26流式抗体对所述待检测的间充质干细胞进行染色。
13.进一步地,所述重悬细胞的步骤包括:采用pbs溶液重悬所述染色处理后的细胞。
14.进一步地,所述获取待检测的间充质干细胞的步骤包括:获取原代间充质干细胞,对所述原代间充质干细胞进行传代培养,得到所述待检测的间充质干细胞。
15.进一步地,所述传代培养的步骤包括:将所述原代间充质干细胞接种于培养基中,接种密度为5000~6000个/cm2,待细胞生长至汇合度85~95%,对细胞依次进行消化和中止消化,得到所述待检测的间充质干细胞。
16.进一步地,所述消化采用的试剂选自:胰酶;所述中止消化采用的试剂选自:间充质干细胞完全培养基。
17.进一步地,所述待检测的间充质干细胞选自:p2代间充质干细胞、p3代间充质干细胞、p4代间充质干细胞、p5代间充质干细胞、p6代间充质干细胞、p7代间充质干细胞、p8代间充质干细胞、p9代间充质干细胞、p10代间充质干细胞等中的至少一种。
18.本技术第一方面提供的间充质干细胞衰老的检测方法,获取待检测的间充质干细胞后,采用cd26流式抗体对所述待检测的间充质干细胞进行染色处理后,通过检测间充质干细胞中cd26的表达情况判断间充质干细胞的衰老情况。本技术对间充质干细胞衰老程度的检测方法,通过采用cd26流式抗体进行染色,既可以用于检测活细胞也可以用于检测固定细胞,且染色时间短,检测步骤操作简单,检测效率高,灵敏度高,适用于对大规模样品进行快速检测。
附图说明
19.为了更清楚地说明本技术实施例中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
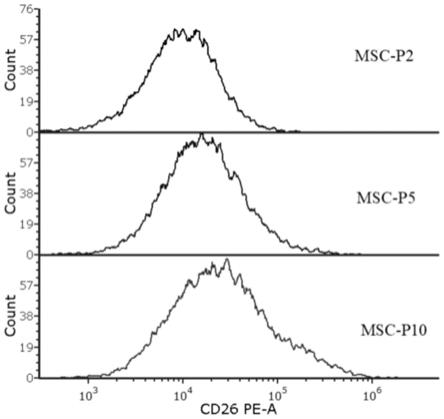
20.图1是本技术实施例1提供的不同代次间充质干细胞的cd26的表达量流式叠加图;
21.图2是本技术实施例1提供的不同代次间充质干细胞的cd26的平均荧光强度统计图;
22.图3是本技术实施例2提供的不同代次间充质干细胞的cd26的表达量流式叠加图;
23.图4是本技术实施例2提供的不同代次间充质干细胞的cd26的平均荧光强度统计图;
24.图5是本技术实施例3提供的不同浓度h2o2诱导间充质干细胞的cd26的表达量流式叠加图;
25.图6是本技术实施例3提供的不同浓度h2o2诱导间充质干细胞的cd26的表达量流式叠加图。
具体实施方式
26.为了使本技术要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本技术进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本技术,并不用于限定本技术。
27.本技术中,术语“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b的情况。其中a,b可以是单数或者复数。字符“/”一般表示前后关联对象是一种“或”的关系。
28.本技术中,“至少一个”是指一个或者多个,“多个”是指两个或两个以上。“以下至少一项(个)”或其类似表达,是指的这些项中的任意组合,包括单项(个)或复数项(个)的任意组合。例如,“a,b或c中的至少一项(个)”,或,“a,b和c中的至少一项(个)”,均可以表示:a,b,c,a
‑
b(即a和b),a
‑
c,b
‑
c,或a
‑
b
‑
c,其中a,b,c分别可以是单个,也可以是多个。
29.应理解,在本技术的各种实施例中,上述各过程的序号的大小并不意味着执行顺序的先后,部分或全部步骤可以并行执行或先后执行,各过程的执行顺序应以其功能和内在逻辑确定,而不应对本技术实施例的实施过程构成任何限定。
30.在本技术实施例中使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本技术。在本技术实施例和所附权利要求书中所使用的单数形式的“一种”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。
31.本技术实施例说明书中所提到的相关成分的重量不仅仅可以指代各组分的具体含量,也可以表示各组分间重量的比例关系,因此,只要是按照本技术实施例说明书相关组分的含量按比例放大或缩小均在本技术实施例说明书公开的范围之内。具体地,本技术实施例说明书中的质量可以是μg、mg、g、kg等化工领域公知的质量单位。
32.术语“第一”、“第二”仅用于描述目的,用来将目的如物质彼此区分开,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。例如,在不脱离本技术实施例范围的情况下,第一xx也可以被称为第二xx,类似地,第二xx也可以被称为第一xx。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。
33.本技术实施例第一方面提供一种间充质干细胞衰老的检测方法,包括以下步骤:
34.s10.获取待检测的间充质干细胞,采用cd26流式抗体对待检测的间充质干细胞进行染色处理后,重悬细胞,检测间充质干细胞中cd26的表达量。
35.本技术实施例第一方面提供的间充质干细胞衰老的检测方法,获取待检测的间充质干细胞后,采用cd26流式抗体对待检测的间充质干细胞进行染色处理后,通过检测间充质干细胞中cd26的表达量情况判断间充质干细胞的衰老情况。本技术实施例对间充质干细胞衰老程度的检测方法,通过采用cd26流式抗体进行染色,既可以用于检测活细胞也可以用于检测固定细胞,且染色时间短,检测步骤操作简单,检测效率高,灵敏度高,适用于对大规模样品进行快速检测。
36.本技术实施例cd26流式抗体,亦称二肽基肽酶iv、dpp
‑
4,是一种ii型跨膜糖蛋白,能直接与多种细胞表面或细胞内分子相互作用,通过其二肽基肽酶活性调节受体特异性和各种趋化因子和细胞因子的功能。cd26分子表达于多种组织(肝、肾、肠、前列腺等)的上皮细胞的表面,也表达于免疫细胞(t淋巴细胞、活化的b、nk细胞、髓系细胞)。因此,本技术实施例cd26易于染色间充质干细胞,通过检测间充质干细胞表面cd26(dpp4)的表达程度,可
实现对间充质干细胞的衰老程度进行评估。检测到的间充质干细胞中cd26的表达量越多,则细胞衰老程度越高。
37.在一些实施例中,染色处理的条件包括:在温度为20~25℃的避光条件下染色30min,在该条件下cd26流式抗体对间充质干细胞染色效果好。
38.在一些实施例中,染色处理的步骤包括:采用biolegend公司的cd26流式抗体对待检测的间充质干细胞进行染色。在一些具体实施例中,将100万细胞数的待检测的间充质干细胞用0.5ml pbs重悬后,加入5μl biolegend公司的cd26流式抗体进行染色处理。
39.在一些实施例中,采用cd26流式抗体对待检测的间充质干细胞进行染色处理后,重悬细胞的步骤包括:采用pbs溶液重悬染色处理后的细胞,pbs溶液对间充质干细胞重悬效果好,也可以采用其他合适的试剂进行重悬。
40.在一些实施例中,检测间充质干细胞中cd26的表达量的步骤包括:通过对间充质干细胞中cd26的荧光强度进行定量检测,通过荧光强度的高低可判断cd26的表达量,再判断细胞的衰老程度。通过实施例研究发现,随着细胞衰老程度增加,cd26的表达量增多,检测到的cd26平均荧光强度也随之增加。在一些具体实施例中,对间充质干细胞中cd
‑
26的平均荧光强度进行统计计算,通过平均荧光强度的高低可更直观的反应cd26的表达量,从而更好地判断间充质干细胞的衰老程度。
41.在一些实施例中,检测间充质干细胞中cd26的表达量的方法包括:采用流式细胞仪进行检测。本技术实施例采用流式细胞仪进行检测,通过分析平均荧光强度(mfi)可精准检测cd26的表达量,从而准确判断细胞的衰老程度,避免人为因素造成的主观误差,提供检测准确度。并且,利用流式细胞仪,检测速率快,耗时短,可对大规模样品的进行快速检测,提高了检测效率。
42.在一些实施例中,获取待检测的间充质干细胞的步骤包括:获取原代间充质干细胞,对原代间充质干细胞进行传代培养,得到待检测的间充质干细胞。由于原代细胞的细胞表型功能还不稳定,因此本技术实施例通过对原代间充质干细胞进行传代培养后,再对传代细胞进行染色,并检测其衰老程度。
43.在一些实施例中,传代培养的步骤包括:将原代间充质干细胞接种于培养基中,接种密度为5000~6000个/cm2,待细胞生长至汇合度85~95%,对细胞依次进行消化和中止消化,得到待检测的间充质干细胞。在一些具体实施例中,细胞接种密度可以是5000~5200个/cm2、5200~5500个/cm2、5500~5800个/cm2、5800~6000个/cm2等,细胞生长汇合度可以是85~90%、90~95%等。
44.在一些具体实施例中,传代培养的步骤包括:将原代间充质干细胞接种于培养基中,接种密度为5000~6000个/cm2,待细胞生长至汇合度85~95%,去掉培养瓶中细胞培养基,加入适量的胰酶进行消化,加入间充质干细胞完全培养基中止消化,然后1000rpm,离心5min,去掉上清液,用间充质干细胞完全培养基重悬细胞,得到传代后的间充质干细胞。在一些实施例中,还可以对间充质干细胞进行多次传代培养,对不同代次的细胞进行检测。
45.在一些实施例中,待检测的间充质干细胞选自:p2代间充质干细胞、p3代间充质干细胞、p4代间充质干细胞、p5代间充质干细胞、p6代间充质干细胞、p7代间充质干细胞、p8代间充质干细胞、p9代间充质干细胞、p10代间充质干细胞等中的至少一种。本技术实施例检测方法可用于检测不同传代的间充质干细胞的衰老程度,既可以对p2、p3等种子库细胞进
行检测,也可以对p4、p5等工作库细胞进行检测,还可以对p6~p10等高次代细胞库细胞进行检测,检测范围广,检测灵敏度高。
46.在一些具体实施例中,间充质干细胞衰老的检测方法,包括步骤:取原代间充质干细胞,接种到细胞培养基,接种密度5000
‑
6000个/cm2,待细胞生长至汇合度90%左右,去掉培养瓶中细胞培养基,加入适量的胰酶进行消化,加入间充质干细胞完全培养基中止消化,1000rpm,离心5min,去掉上清液,得到传代细胞;采用间充质干细胞完全培养基重悬细胞,重复传代培养,将细胞的培养代次传至第10代;取p2代、p5代、p10代的间充质干细胞,去掉培养瓶中细胞培养基,加入适量的胰酶进行消化,加入间充质干细胞完全培养基中止消化,1000rpm,离心5min,去掉上清液;pbs溶液重悬间充质干细胞,加入cd26流式抗体进行染色,室温避光孵育30min,加入1ml pbs溶液,1000rpm,离心5min,去掉上清液。pbs重悬细胞,采用流式细胞仪检测间充质干细胞cd26的表达。
47.为使本技术上述实施细节和操作能清楚地被本领域技术人员理解,以及本技术实施例间充质干细胞衰老的检测方法的进步性能显著的体现,以下通过多个实施例来举例说明上述技术方案。
48.为了验证cd26可以作为人间充质干细胞复制性衰老的标记,利用流式细胞仪直接检测人间充质干细胞cd26的表达。
49.实施例1
50.一种人间充质干细胞衰老的检测方法。包括步骤:
51.1)取一种冻存的p1代的人间充质干细胞,水浴锅37℃复苏,1000rpm,离心5min,去掉上清液。
52.2)间充质干细胞完全培养基重悬细胞,接种到t25细胞培养瓶,接种密度5000
‑
6000个/cm2,此为p2细胞;
53.3)待细胞生长至汇合度90%,去掉培养瓶中细胞培养基,加入适量的胰酶进行消化,加入间充质干细胞完全培养基中止消化,1000rpm,离心5min,去掉上清液;
54.4)间充质干细胞完全培养基重悬细胞,接种到t25细胞培养瓶,接种密度5000
‑
6000个/cm2;
55.5)重复步骤3)和4),将细胞的培养代次传至第10代;
56.6)取p2代、p5代、p10代的间充质干细胞,去掉培养瓶中细胞培养基,加入适量的胰酶进行消化,加入间充质干细胞完全培养基中止消化,1000rpm,离心5min,去掉上清液;
57.7)pbs溶液重悬间充质干细胞,加入cd26流式抗体进行染色,室温避光孵育30min,加入1ml pbs溶液,1000rpm,离心5min,去掉上清液;
58.8)300ul pbs重悬细胞,上流式细胞仪检测人间充质干细胞cd26的表达。
59.实施例2
60.一种人间充质干细胞衰老的检测方法。包括步骤:
61.1)取另一种冻存的p1代的人间充质干细胞,水浴锅37℃复苏,1000rpm,离心5min,去掉上清液。
62.2)间充质干细胞完全培养基重悬细胞,接种到t25细胞培养瓶,接种密度5000
‑
6000个/cm2,此为p2细胞;
63.3)待细胞生长至汇合度90%,去掉培养瓶中细胞培养基,加入适量的胰酶进行消
化,加入间充质干细胞完全培养基中止消化,1000rpm,离心5min,去掉上清液;
64.4)间充质干细胞完全培养基重悬细胞,接种到t25细胞培养瓶,接种密度5000
‑
6000个/cm2;
65.5)重复步骤3)和4),将细胞的培养代次传至第10代;
66.6)取p2代、p5代、p10代的间充质干细胞,去掉培养瓶中细胞培养基,加入适量的胰酶进行消化,加入间充质干细胞完全培养基中止消化,1000rpm,离心5min,去掉上清液;
67.7)pbs溶液重悬间充质干细胞,加入cd26流式抗体进行染色,室温避光孵育30min,加入1ml pbs溶液,1000rpm,离心5min,去掉上清液;
68.8)300ul pbs重悬细胞,上流式细胞仪检测人间充质干细胞cd26的表达。
69.为了验证cd26可以作为人间充质干细胞诱导衰老的标记,采用过氧化氢诱导间充质干细胞衰老后再利用流式细胞仪直接检测人间充质干细胞cd26的表达。
70.实施例3
71.1)取冻存的p3代的人间充质干细胞,水浴锅37℃复苏,1000rpm,离心5min,去掉上清液;
72.2)间充质干细胞完全培养基重悬细胞,接种到t25细胞培养瓶,接种密度10000
‑
12000个/cm2,二氧化碳培养箱中培养;
73.3)第二天,每组间充质干细胞分别加入不同浓度的过氧化氢(将人间充质干细胞分为5组,第一组不加过氧化氢,作为阴性对照(nc组);第二组加入浓度为10μm过氧化氢;第三组加入浓度为20μm过氧化氢;第四组加入浓度为30μm过氧化氢;第五组加入浓度为40μm过氧化氢;每组设置三个平行对照,然后在二氧化碳培养箱中继续培养24小时;
74.4)过氧化氢诱导衰老结束后,取出间充质干细胞,去掉培养瓶中细胞培养基,加入适量的胰酶进行消化,加入间充质干细胞完全培养基中止消化,1000rpm,离心5min,去掉上清液;
75.5)pbs溶液重悬间充质干细胞,加入cd26流式抗体进行染色,室温避光孵育30min,加入1ml pbs溶液,1000rpm,离心5min,去掉上清液;
76.6)300ul pbs重悬细胞,采用流式细胞仪检测人间充质干细胞cd26的表达。
77.进一步的,为了验证本技术实施例人间充质干细胞衰老的检测方法的进步性,对实施例检测结果进行了如下检测:
78.实施例1~3通过流式细胞仪检测到的cd
‑
26的平均荧光强度值如下表1所示(每个实施例分别进行了设置了三组样品,分别对三组样品进行了检测):
79.表1
[0080][0081]
通过上述表1测试结果可知,随着间充质干细胞衰老程度增加,通过流式细胞仪检测到的荧光强度也逐渐增加,表面cd26的表达量也逐渐增加。因而,采用cd26流式抗体标记间充质间细胞后,可通过检测间充质干细胞中cd
‑
26的表达量,即检测cd26的平均荧光强度,来判断间充质干细胞的衰老程度。
[0082]
另外,实施例1同一来源不同代次(p2代、p5代、p10代)的人间充质干细胞的cd26的表达量检测如附图1~2所示,其中,图1为实施例1不同代次人间充质干细胞的cd26的表达量的叠加图(横坐标为平均荧光强度,纵坐标为细胞数量);图2为实施例1不同代次人间充质干细胞的cd26的平均荧光强度(mfi)统计图(横坐标为组别,纵坐标为平均荧光强度),**p<0.01;***p<0.001。
[0083]
实施例2对另一种同一来源不同代次(p2代、p5代、p10代)的人间充质干细胞的cd26的表达量检测如附图3~4所示,其中,图3为实施例2不同代次人间充质干细胞的cd26的表达量的叠加图(横坐标为平均荧光强度,纵坐标为细胞数量);图4为实施例2不同代次人间充质干细胞的cd26的平均荧光强度(mfi)统计图(横坐标为组别,纵坐标为平均荧光强度),**p<0.01;***p<0.001。
[0084]
通过实施例1和2的测试结果可知,随着细胞代次的增加,细胞逐渐衰老,其cd26的平均荧光强度逐渐增强,对应cd26的表达量逐渐增多,说明cd26可作为间充质干细胞衰老的标记,通过检测cd
‑
26平均荧光强度的高低可判断cd26的表达量,从而判断间充质干细胞的衰老程度,且通过流式细胞仪进行检测,高效、快捷、方便,准确性高。
[0085]
实施例3中采用不同浓度过氧化氢处理人间充质干细胞24小时后,采用流式细胞术检测细胞的cd
‑
26的表达量。其中,附图5为不同浓度过氧化氢诱导人间充质干细胞的cd26的表达量叠加图(横坐标为平均荧光强度,纵坐标为细胞数量);图6为不同浓度过氧化
氢诱导人间充质干细胞的cd26的平均荧光强度(mfi)统计图(横坐标为组别,纵坐标为平均荧光强度),***p<0.001。
[0086]
通过实施例3测试结果可知,过氧化氢会诱导人间充质干细胞会加速细胞氧化衰老,随着过氧化氢的浓度增加,细胞衰老程度升高,cd26的平均荧光强度逐渐增强,其cd26的表达量也逐渐增多,进一步说明cd26的表达量越高说明细胞衰老程度越严重,本技术人间充质干细胞衰老的检测方法,可以快速精准的检测人间充质干细胞的诱导衰老程度。
[0087]
以上所述仅为本技术的较佳实施例而已,并不用以限制本技术,凡在本技术的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1