一种α2巨球蛋白快速检测试剂盒及检测方法与流程
一种
α
2巨球蛋白快速检测试剂盒及检测方法
技术领域
1.本发明涉及生物学检测方法技术领域,具体涉及一种α2巨球蛋白快速检测试剂盒及检测方法。
背景技术:
2.α2巨球蛋白(α2
‑
macroglobulin,α2mg或amg)是血浆中分子量最大的蛋白质。分子量约为65.2万
‑
80万,含糖量约8%,由4个亚单位组成。它与淋巴网状系统细胞的发育和功能有密切联系。α2mg最突出的特性是能与多种分子和离子结合。特别是它能与不少蛋白水解酶结合而影响这些酶的活性。如与许多肽链内切酶(包括丝氨酸、巯基、羧基蛋白水解酶和一些金属蛋白水解酶)的结合。这些蛋白水解酶有纤维蛋白溶酶、胃蛋白酶、糜蛋白酶、胰蛋白酶及组织蛋白酶d等。研究表明,α2mg与蛋白水解酶相互作用可使α2mg的分子构象发生变化,当酶处于复合物状态时,酶的活性部位没有失活,但不容易作用于大分子底物,若底物为分子量小的蛋白质,即使有其它抗蛋白酶的存在,也能被α2mg
‑
蛋白酶复合物所催化而水解。这样,α2mg起到有选择地保护某些蛋白酶活性的作用,这在免疫反应中可能具有重要意义。α2mg是由肝细胞与单核吞噬细胞系统中合成,半寿期约5天,但当与蛋白水解酶结合成为复合物后其清除率加速。在低白蛋白血症时,α2mg含量可增高,可能系一种代偿机制以保持血浆胶体渗透压。妊娠期及口服避孕药时血浓度增高。胰腺炎及前列腺癌时含量降低。可采用免疫化学法测定,正常成人参考值为1500
‑
3500μg/ml,婴幼儿及儿童血浆α2
‑
巨球蛋白含量约为成人的2倍
‑
3倍。但目前市面上的α2mg检测试剂盒普遍存在检测准确度不高、检测时间长,不适宜快速或大规模检测等问题。
技术实现要素:
3.为解决上述现有检测方法不精细、不准确、检测时间长等问题,本发明提供一种新的α2巨球蛋白快速检测试剂盒及检测方法,方案如下:
4.一种α2巨球蛋白快速检测试剂盒,包括以下组分:
5.试剂a:包括磷酸盐缓冲液;
6.试剂b:包括抗α2巨球蛋白抗体;
7.标准品溶液:含α2巨球蛋白标准品的溶液;
8.质控溶液:含α2巨球蛋白标准品的溶液。
9.优选地,所述试剂a中还包括月桂醚,浓度为2.0
‑
10.0g/l。
10.优选地,所述试剂a中还包括乙二醇、乙二胺四乙酸锌钠。
11.优选地,所述试剂a中聚乙二醇浓度为0.05
‑
0.08wt%,乙二胺四乙酸锌钠浓度为0.05
‑
0.1wt%
12.优选地,所述试剂b中抗α2巨球蛋白抗体包括多克隆抗体或单克隆抗体,其中多克隆抗体包括鼠抗人、兔抗人、羊抗人、鸡抗人、鸭抗人α2巨球蛋白抗体中的一种或二种以上。
13.优选地,所述试剂b中,抗α2巨球蛋白抗体的浓度为10
‑
500mg/ml。
14.优选地,所述试剂b中还包括磷酸盐缓冲液、mops缓冲液或taps缓冲液。
15.优选地,所述试剂b中还包括浓度为0.05
‑
0.09wt%的聚乙二醇和浓度为0.3
‑
0.6wt%的海藻糖。
16.优选地,所述试剂b中还包括0.03
‑
0.09wt%的氯化钾。
17.优选地,所述试剂b中还包括0.05
‑
0.08wt%的透明质酸钠。
18.优选地,设试剂b中聚乙二醇、海藻糖、氯化钾、透明质酸钠浓度分别为c1、c2、c3、c4,则c1=2c3;c2=8c4。
19.优选地,所述标准品溶液中的α2巨球蛋白标准品为自然抗原或人工合成抗原。所述标准品溶液中还包括去离子水、磷酸盐缓冲液、mops缓冲液或taps缓冲液。
20.优选地,所述质控溶液中的α2巨球蛋白标准品与所述标准品溶液中的α2巨球蛋白标准品来源相同,所述质控溶液中包括的其他组分与所述标准品溶液中包括的其他组分相同,所述质控溶液包括的α2巨球蛋白标准品浓度包括15mg/l、30mg/l、100mg/l、500mg/l中的二种以上。
21.本发明还提供利用上述试剂盒快速检测样本中α2巨球蛋白的方法,包括以下步骤:
22.s1、将试剂a与样本混合,混合,孵育;
23.s2、读取吸光度值,记为吸光度值ⅰ;
24.s3、加入试剂b,混合,孵育,再次读取吸光度值,记为吸光度值ⅱ;
25.s4、计算吸光度值ⅱ与吸光度值ⅰ的差值,根据标准品溶液中的α2巨球蛋白浓度与所得差值,制作所得差值对样本中α2巨球蛋白浓度的回归方程logit
‑
logit5p函数曲线,根据待测样本所得差值,代入函数曲线计算待测样本中α2巨球蛋白的浓度。
26.优选地,s1所述样本用量30.0μl,试剂a用量200μl,孵育温度37℃,孵育时间1
‑
5分钟。
27.优选地,s3所述试剂b用量40μl,孵育温度37℃,孵育时间1
‑
5分钟。
28.优选地,所述试剂a的制备方法包括:将试剂a中包括的全部物质添加到其中的缓冲液中,混合均匀;当所述试剂a中包括聚乙二醇时,将试剂a中包括的全部物质除聚乙二醇外均添加到其中的缓冲液中,混合均匀,然后再添加聚乙二醇,混合均匀。
29.优选地,所述试剂b的制备方法包括:将试剂b中包括的全部物质添加到其中的缓冲液中,混合均匀,当试剂b中包括海藻糖时,在最后加入海藻糖,混合均匀。当试剂b中包括透明质酸钠时,在最后加入透明质酸钠,混合均匀。
30.优选地,s1所述样本包括标准品溶液、质控溶液或α2巨球蛋白待测样本中的一种或二种以上。
31.优选地,s1中的样本为准品溶液时,准品溶液中,α2巨球蛋白标准品浓度包括10mg/l、15mg/l、30mg/l、60mg/l、100mg/l、250mg/l、500mg/l。
32.优选地,s4还包括试剂盒精密度试验:s1所述样本包括两种浓度的质控溶液,对每份质控溶液进行20次检测,将共20次检测结果计算平均值、标准差和变异系数,cv≤6.0%可视为当前检测方法准确度合格。
33.优选地,所述读取吸光度值,主/副波长分别为340nm/700nm。所述方法采用全自动生化分析仪进行,进行待测样本检测时采用的全自动生化分析仪进行与计算其浓度所使用
的函数曲线检测时采用的全自动生化分析仪型号相同、检测过程中参数相同。
34.有益效果
35.本发明的有益效果在于:
36.本发明采用非常简单的试剂组合物、非常短的时间(样本与试剂a混合),即可实现对含α2巨球蛋白的样本中α2巨球蛋白的稳定,减少在试验过程中蛋白分解变形导致的准确性降低,且在试剂a中的两种有效组分中,乙二胺四乙酸锌钠起到至关重要的作用。
37.试剂b中同时加入聚乙二醇和海藻糖后,线性范围显著增加,单纯加入二者其一时并不能达到如此显著的效果。
38.试剂b中加入氯化钾后,有效提高了检测速度。
39.试剂b中加入透明质酸钠后,进一步有效提高检测速度。
40.通过实施例及对比例验证,采用本发明提供各组分比例组成的试剂盒检测α2巨球蛋白,通过控制乙二醇、海藻糖、氯化钾、透明质酸钠浓度浓度比,使得试剂盒中无需使用α2
‑
巨球蛋白抗体包被胶乳颗粒即可实现抗体稳定,在检测时间内体系不易浑浊,抗干扰能力强。在样本混合试剂b后放置5min以上不进行后续步骤即失去效果,体系容易浑浊。
41.本发明提供的上述方法,所得回归函数曲线在15
‑
500mg/l范围内均具备良好的线性,检测限为15mg/l,检测时间可由现有方法的15min左右缩减至5min左右,大大提高了检测速度。
具体实施方式
42.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
43.除非特别指出,以下实施例和对比例为平行试验,采用同样的处理步骤和参数。以下实施例采用的全自动生化分析仪为日立7060全自动生化分析仪,采用的分析方法为两点终点法,但本发明提供的方法适用于市面上绝大多数全自动生化分析仪,分析方法、参数等也可在试剂使用原理范围内进行适当调整。
44.实施例1试剂a制备
45.试剂aⅰ46.试剂a:包括磷酸盐缓冲液。
47.试剂aⅱ48.试剂a:包括磷酸盐缓冲液;还包括月桂醚,浓度为4.0g/l。
49.试剂a的制备方法包括:将试剂a中包括的全部物质均添加到其中的缓冲液中,混合均匀。
50.试剂aⅲ51.试剂a:包括磷酸盐缓冲液;还包括月桂醚,浓度为4.0g/l;还包括乙二醇、乙二胺四乙酸锌钠。聚乙二醇浓度为0.06wt%,乙二胺四乙酸锌钠浓度为0.07wt%
52.试剂a的制备方法包括:将试剂a中包括的全部物质均添加到其中的缓冲液中,混合均匀。
53.经验证,采用本发明提供的试剂a配方,能够仅在试剂a与样本混合过程的短时间内,实现对含α2巨球蛋白样本中α2巨球蛋白的稳定,有效减少后续检测过程中样本中α2巨球蛋白的变性或降解等过程,提高检测方法的灵敏度和准确性。该手段在较长时间内有效,在样本混合试剂a后放置7min以上不进行后续步骤即失去效果,基本可以满足α2巨球蛋白检测的使用场景。
54.对比例1试剂a制备
55.试剂aⅳ56.试剂a:包括磷酸盐缓冲液;还包括月桂醚,浓度为4.0g/l;还包括乙二胺四乙酸锌钠。乙二胺四乙酸锌钠浓度为0.07wt%
57.试剂a的制备方法包括:将试剂a中包括的全部物质均添加到其中的缓冲液中,混合均匀。
58.经验证,在减少聚乙二醇后,该方法稳定性有所下降,能够仅在试剂a与样本混合过程的短时间内,实现对含α2巨球蛋白的样本中α2巨球蛋白的稳定,有效减少后续检测过程中样本中α2巨球蛋白的变性或降解等过程,提高检测方法的灵敏度和准确性,但该手段仅在短时间内有效,在样本混合试剂a后放置3min以上不进行后续步骤即失去效果,对检测操作的要求较高,适用场景较少,容易出现失误。
59.试剂a
ⅴ
60.试剂a:包括磷酸盐缓冲液;还包括月桂醚,浓度为4.0g/l;还包括乙二醇。聚乙二醇浓度为0.06wt%。
61.试剂a的制备方法包括:将试剂a中包括的全部物质均添加到其中的缓冲液中,混合均匀。
62.经验证,在减少乙二胺四乙酸锌钠后,虽然也能够起到一定的稳定α2巨球蛋白的作用,但效果明显下降,检测准确性有所下降。
63.实施例2试剂b制备
64.试剂bⅰ65.试剂b:包括羊抗人α2
‑
巨球蛋白抗体;还包括磷酸盐缓冲液,羊抗人α2
‑
巨球蛋白抗体的浓度为100mg/ml。
66.试剂b的制备方法包括:将试剂b中包括的全部物质添加到其中的缓冲液中,混合均匀。
67.与试剂bⅱ相比,抗体出现轻微的浑浊,可知,此时的配方比例单纯使用羊抗人α2
‑
巨球蛋白抗体是不够稳定的,检测试剂盒抗干扰能力较弱。
68.试剂bⅱ69.制备羊抗人α2
‑
巨球蛋白抗体包被胶乳颗粒:按照3:1比例取粒径120nm和200nm表面羧基化的聚苯乙烯胶乳颗粒,加入ph为6.5的n
‑
氨基甲酰甲基乙磺酸(aces)缓冲液20ml,使胶乳颗粒终浓度为1.2%,然后加入适量羊抗人α2
‑
巨球蛋白抗体、edc及nhs,室温下搅拌反应3小时左右,14000rpm离心15分钟,去除上清,所得沉淀即为羊抗人α2
‑
巨球蛋白抗体包被胶乳颗粒。
70.试剂b:包括羊抗人α2
‑
巨球蛋白抗体包被胶乳颗粒;还包括磷酸盐缓冲液,其中以羊抗人α2
‑
巨球蛋白抗体的浓度计算,羊抗人α2
‑
巨球蛋白抗体浓度为100mg/ml。
71.试剂b的制备方法包括:将试剂b中包括的全部物质添加到其中的缓冲液中,混合均匀。
72.试剂bⅲ73.试剂b:包括羊抗人α2
‑
巨球蛋白抗体包被胶乳颗粒;还包括磷酸盐缓冲液,其中以羊抗人α2
‑
巨球蛋白抗体的浓度计算,羊抗人α2
‑
巨球蛋白抗体浓度为100mg/ml,浓度为0.06wt%的聚乙二醇和浓度为0.4wt%的海藻糖。
74.试剂b的制备方法包括:将试剂b中包括的全部物质添加到其中的缓冲液中,混合均匀。
75.试剂b
ⅲ‑276.试剂b:包括羊抗人α2
‑
巨球蛋白抗体包被胶乳颗粒;还包括磷酸盐缓冲液,其中以羊抗人α2
‑
巨球蛋白抗体的浓度计算,羊抗人α2
‑
巨球蛋白抗体浓度为100mg/ml,浓度为0.06wt%的聚乙二醇。
77.试剂b的制备方法包括:将试剂b中包括的全部物质添加到其中的缓冲液中,混合均匀。
78.试剂b
ⅲ‑379.试剂b:包括羊抗人α2
‑
巨球蛋白抗体包被胶乳颗粒;还包括磷酸盐缓冲液,其中以羊抗人α2
‑
巨球蛋白抗体的浓度计算,羊抗人α2
‑
巨球蛋白抗体浓度为100mg/ml,浓度为0.4wt%的海藻糖。
80.试剂b的制备方法包括:将试剂b中包括的全部物质添加到其中的缓冲液中,混合均匀。
81.从验证数据可见,试剂b中同时加入聚乙二醇和海藻糖后,线性范围显著增加,单纯加入二者其一时并不能达到如此显著的效果。
82.试剂bⅳ83.试剂b:包括羊抗人α2
‑
巨球蛋白抗体包被胶乳颗粒;还包括磷酸盐缓冲液,其中以羊抗人α2
‑
巨球蛋白抗体的浓度计算,羊抗人α2
‑
巨球蛋白抗体浓度为100mg/ml,浓度为0.06wt%的聚乙二醇和浓度为0.4wt%的海藻糖,浓度为0.05wt%的氯化钾。
84.试剂b的制备方法包括:将试剂b中包括的除海藻糖外的全部物质添加到其中的缓冲液中,混合均匀,在最后加入海藻糖,再次混合均匀。
85.经验证可知,试剂b中加入氯化钾后,有效提高了检测速度。
86.试剂b
ⅴ
87.试剂b:包括羊抗人α2
‑
巨球蛋白抗体包被胶乳颗粒;还包括磷酸盐缓冲液,其中以羊抗人α2
‑
巨球蛋白抗体的浓度计算,羊抗人α2
‑
巨球蛋白抗体浓度为100mg/ml,浓度为0.06wt%的聚乙二醇和浓度为0.4wt%的海藻糖,浓度为0.05wt%的氯化钾,浓度为0.06wt%的透明质酸钠。
88.试剂b的制备方法包括:将试剂b中包括的除海藻糖、透明质酸钠外的全部物质添加到其中的缓冲液中,混合均匀,加入海藻糖,再次混合均匀,最后加入透明质酸钠,混合均匀。
89.经验证可知,试剂b中加入透明质酸钠后,进一步有效提高检测速度。
90.试剂b
ⅵ
91.试剂b:包括羊抗人α2
‑
巨球蛋白抗体;还包括磷酸盐缓冲液,其中羊抗人α2
‑
巨球蛋白抗体浓度为100mg/ml,浓度为0.06wt%的聚乙二醇和浓度为0.4wt%的海藻糖,浓度为0.05wt%的氯化钾,浓度为0.06wt%的透明质酸钠。
92.试剂b的制备方法包括:将试剂b中包括的除海藻糖、透明质酸钠外的全部物质添加到其中的缓冲液中,混合均匀,加入海藻糖,再次混合均匀,最后加入透明质酸钠,混合均匀。
93.与试剂b
ⅴ
相比,抗体出现轻微的浑浊,可知,此时的配方比例单纯使用羊抗人α2
‑
巨球蛋白抗体是不够稳定的,检测试剂盒抗干扰能力较弱。
94.试剂b
ⅶ
95.试剂b:包括羊抗人α2
‑
巨球蛋白抗体;还包括磷酸盐缓冲液,其中羊抗人α2
‑
巨球蛋白抗体浓度为10
‑
500mg/ml,浓度为0.05
‑
0.09wt%的聚乙二醇和浓度为0.3
‑
0.6wt%的海藻糖,浓度为0.03
‑
0.09wt%的氯化钾,浓度为0.05
‑
0.08wt%的透明质酸钠。
96.设聚乙二醇、海藻糖、氯化钾、透明质酸钠浓度分别为c1、c2、c3、c4,则c1=2c3;c2=8c4:
97.试剂b
ⅶ‑
1:包括浓度为0.06wt%的聚乙二醇和浓度为0.4wt%的海藻糖,浓度为0.03wt%的氯化钾,浓度为0.05wt%的透明质酸钠;
98.试剂b
ⅶ‑
2:包括浓度为0.08wt%的聚乙二醇和浓度为0.4wt%的海藻糖,浓度为0.04wt%的氯化钾,浓度为0.05wt%的透明质酸钠;
99.试剂b的制备方法包括:将试剂b中包括的除海藻糖、透明质酸钠外的全部物质添加到其中的缓冲液中,混合均匀,加入海藻糖,再次混合均匀,最后加入透明质酸钠,混合均匀。
100.与试剂b
ⅵ
、试剂b
ⅴ
相比,抗体未出现浑浊,可知,此时的配方比例可单纯使用羊抗人α2
‑
巨球蛋白抗体,体系稳定性强,检测试剂盒抗干扰能力较弱。
101.实施例3α2
‑
巨球蛋白检测方法,包括以下步骤:
102.s1、将试剂a与样本混合,混合,孵育;
103.s2、读取吸光度值,记为吸光度值ⅰ;
104.s3、加入试剂b,混合,孵育,再次读取吸光度值,记为吸光度值ⅱ;
105.s4、计算吸光度值ⅱ与吸光度值ⅰ的差值,根据标准品溶液中的α2巨球蛋白浓度与所得差值,制作所得差值对样本中α2巨球蛋白浓度的回归方程logit
‑
logit5p函数曲线,根据待测样本所得差值,代入函数曲线计算待测样本中α2巨球蛋白的浓度。
106.s1所述样本用量30.0μl,试剂a用量200μl,孵育温度37℃,孵育时间1
‑
5分钟。
107.s3所述试剂b用量40μl,孵育温度37℃,孵育时间1
‑
5分钟。
108.s1所述样本包括标准品溶液、质控溶液和α2巨球蛋白待测样本。
109.s1中的样本为准品溶液时,准品溶液中,α2巨球蛋白标准品浓度包括0(去离子水空白样本)、10mg/l、15mg/l、30mg/l、60mg/l、100mg/l、250mg/l、500mg/l。
110.s4还包括试剂盒精密度试验:s1所述样本包括两种浓度的质控溶液,对每份质控溶液进行20次检测,将共20次检测结果计算平均值、标准差和变异系数,cv≤6.0%可视为当前检测方法准确度合格。
111.所述读取吸光度值,主/副波长分别为340nm/700nm。
112.α2巨球蛋白待测样本采用配制的不同浓度的α2巨球蛋白标准品溶液,以便验证方法的可行性、检测限及准确度,待测样本α2巨球蛋白标准品浓度包括:0(去离子水空白样本)、10、15、30、60、100、200、250、500mg/l,每个浓度样本每个实施例进行10次平行试验。
113.实施例3采用的试剂及结果见下表:
114.[0115][0116]
[0117]
试验编号4、5、6的特别限定:分别在试剂b孵育后继续放置3min、7min、10min后再进行后续步骤。试验编号8、9、10的特别限定:分别在试剂b孵育后再继续放置3min、7min、10min后再进行后续步骤。试验编号1
‑
14、16
‑
18、24
‑
26中,步骤s1孵育时间4min,步骤s3孵育时间5min,试验编号15步骤s3孵育时间3min,试验编号19步骤s3孵育时间3min,试验编号20步骤s3孵育时间1min,试验编号22步骤s3孵育时间3min,试验编号23步骤s3孵育时间1min。
[0118]
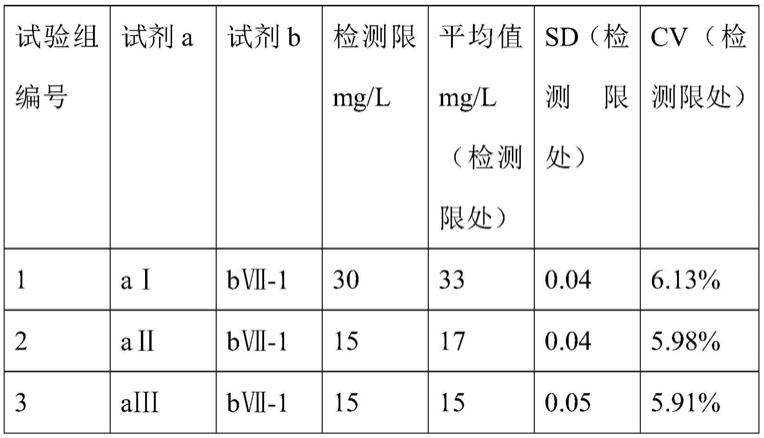
检测限及线性范围的确定以试验组编号3为例:
[0119][0120]
从上表可确定试验组编号3的检测限为15mg/l。标准曲线r2为0.999,线性范围,15
‑
500mg/l。试验编号12、13、14、16、17线性范围分别为15
‑
200mg/l,15
‑
200mg/l,15
‑
500mg/l,15
‑
250mg/l,15
‑
250mg/l。
[0121]
以上对本发明优选的具体实施方式和实施例作了详细说明,但是本发明并不限于上述实施方式和实施例,在本领域技术人员所具备的知识范围内,还可以在不脱离本发明构思的前提下作出各种变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1