稳定、可视化的白蛋白检测剂的制备及应用的制作方法
1.本发明涉及生物医药领域,具体地,本发明涉及稳定、可视化的白蛋白检测剂的制备方法,更具体地,本发明涉及一种上转换纳米粒子、复合纳米粒子、制备上转换纳米粒子的方法、制备复合纳米粒子的方法、检测白蛋白含量的方法及判断细胞分化状态的方法。
背景技术:
2.小鼠白蛋白(msa)由小鼠肝细胞分泌后进入血液,是血浆中的主要蛋白质,维持机体营养和渗透压。在细胞分化过程中,白蛋白的浓度可以间接地反映干细胞向肝细胞分化的程度。目前生物学关于白蛋白的检测主要采用酶联免疫检测(elisa)法,但是,elisa方法存在以下问题:(1)elisa法往往采用单一荧光检测,容易受背景荧光、液体环境等影响,造成测量误差,且检测灵敏度较低;(2)大多数elisa检测剂属于有机物,检测剂的物理化学性质不稳定,斯托克斯位移小,造成测量误差;(3)某些生物标记物的检测只能在体外进行,无法实现体内实时、动态监测。因此迫切需要一种受周围环境影响小、稳定性高、可以实时并用于细胞内白蛋白浓度的高效检测。
3.近年来,上转换纳米粒子(ucnps)在生物传感领域展现出广阔的前景,ucnps具有粒径小、形状可调、稳定性高、发射带宽窄、荧光寿命长、发射范围广、生物相容性好、表面易修饰等优点。小粒径、强荧光发射的ucnps经过表面修饰后,可以在其表面加载抗原、抗体、有机小分子等;这些材料的加载赋予了ucnps众多的功能,使其作为一类多功能的复合纳米粒子,在生物医学等领域发挥着重要作用,但目前并未出现将上转换纳米粒子用于活细胞或类器官等样本进行白蛋白的高效、实时动态检测。
技术实现要素:
4.本技术是基于发明人对以下事实和问题的发现和认识作出的:
5.发明人经过大量的实验研究,惊喜地发现一种稳定、可视化、可活体内实时检测的白蛋白检测剂,所述检测剂受环境影响小、稳定性好,在不同液体中均可以实现白蛋白浓度的准确检测;并且可以实现细胞内部白蛋白实时、动态、可视化的检测,可以实现小鼠肝脏类器官的荧光成像;此外,该检测剂无需标记,操作简单,使用方便,生物相容性好,检测灵敏度高。
6.为此,在本发明的第一方面,本发明提出了一种上转换纳米粒子。根据本发明的实施例,包括:核层,所述核层包括nayf4:yb
3+
/er
3+
;以及壳层,所述壳层设置在所述核层的外表面,所述壳层包括nayf4。根据本发明实施例的上转换纳米粒子,在可见光照射下可发出绿色和红色荧光,当所述可见光波长为535nm~550nm时出现绿色荧光发射峰;当所述可见光波长为645nm~665nm出时现红色荧光发射峰,其中荧光强度灵敏度较高,减少周围环境的影响后,可显著提高检测白蛋白的灵敏度,稳定、有效的利用荧光强度和荧光强度比技术获得白蛋白浓度。
7.根据本发明的实施例,上述上转换纳米粒子还可以进一步包括如下附加技术特征
至少之一:
8.根据本发明的实施例,所述核层的粒径为25nm。
9.根据本发明的实施例,所述壳层的粒径为35nm。
10.根据本发明的实施例,所述y
3+
是以ycl3·
6h2o的形式提供的,所述yb
3+
是以ybcl3·
6h2o的形式提供的,所述er
3+
是以ercl3·
6h2o的形式提供的。根据本发明实施例的形式提供y
3+
、yb
3+
和er
3+
制备得到的上转换纳米粒子具有更好的发光效果。
11.根据本发明的实施例,所述核中y
3+
、yb
3+
、er
3+
的摩尔比为78~82:16~20:1~2。
12.根据本发明的实施例,所述核中y
3+
、yb
3+
、er
3+
的摩尔比为40:9:1。
13.在本发明的第二方面,本发明提出了一种复合纳米粒子。根据本发明的实施例,包括:第一方面所述的上转换纳米粒子、白蛋白抗体(antibody,ab)以及孟加拉红溴己酸之间。根据本发明实施例的复合纳米粒子可以对不同液体环境中存在的白蛋白进行有效检测,且在双光子显微镜的激光照射下,可以实现类器官明亮的荧光成像,对类器官细胞内的白蛋白进行动态的可视化检测;采用溶剂热制备核壳结构纳米粒子,再通过配体交换加载表面修饰剂,利用胺基羧基脱水缩合加载抗体ab和猝灭剂孟加拉红溴己酸(rbha),在合适的距离内,孟加拉红溴己酸可有效猝灭上转换纳米粒子的荧光。
14.根据本发明的实施例,上述复合纳米粒子还可以进一步包括如下附加技术特征至少之一:
15.根据本发明的实施例,所述白蛋白抗体包括人源白蛋白抗体或鼠源白蛋白抗体。所述白蛋白存在于含有pbs的溶液、含有dmem和fbs溶液(dfs)或含有adgs培养基的溶液、细胞或类器官中的至少之一。
16.根据本发明的实施例,所述adgs培养基包括:advanced dmem/f12,b27,n2,青链霉素混合液,n-乙酰半胱氨酸,glutamax,表皮生长因子(egf),fgf10,胃泌素(gastrin),a83-01,4-羟乙基哌嗪乙磺酸(hepes),chir99021,肝细胞生长因子(hgf),尼克酰胺,y-27632,r-spondin1,tnf-α。
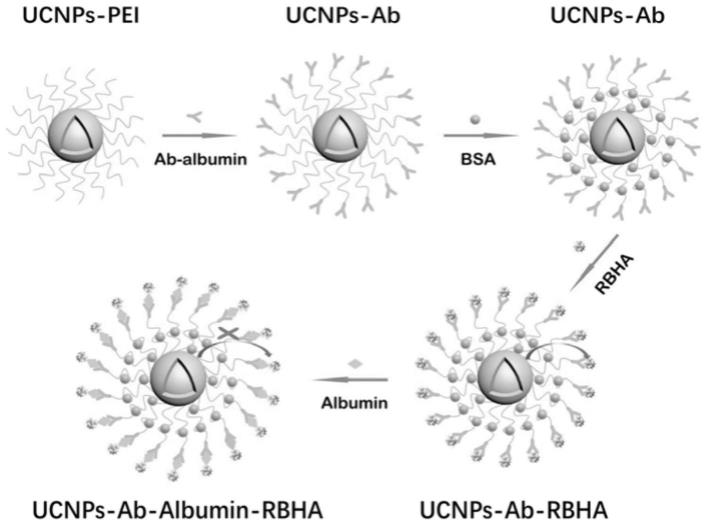
17.根据本发明的实施例,进一步包括牛血清白蛋白(bsa)和聚乙烯亚胺(pei)。
18.根据本发明的实施例,所述白蛋白抗体通过共价键与加载有聚乙烯亚胺的上转化纳米颗粒进行连接。
19.根据本发明的实施例,所述白蛋白抗体与加载有聚乙烯亚胺的上转化纳米颗粒的质量比为7:500。
20.根据本发明的实施例,所述孟加拉红溴己酸是通过共价键与所述白蛋白抗体进行连接。
21.根据本发明的实施例,所述孟加拉红溴己酸与所述白蛋白抗体的质量比为25:2。
22.根据本发明的实施例,所述孟加拉红溴己酸由孟加拉红与溴己酸反应获得的。
23.在本发明的第三方面,本发明提出了一种制备第一方面所述的上转换纳米粒子的方法。根据本发明的实施例,包括:1)将y
3+
盐、yb
3+
盐、er
3+
盐与油酸、十八烯在氮气存在下进行第一加热处理,任选地,所述加热处理是在温度为120~170℃进行的;2)将步骤1)所得产物冷却至室温后,与氢氧化钠、氟化铵、甲醇进行混合;3)将步骤2)所得产物分别于50~90℃加热25~35min,280~320℃加热50~70min;4)将步骤3)所得产物进行冷却、洗涤、离心处理,以获得所述核层;5)将y
3+
盐、油酸、十八烯在氮气存在下进行第二加热处理,任选地,
所述第二加热处理是在温度为120~170℃进行的;6)将步骤5)所得产物冷却至室温后,与步骤4)所得核层进行混合,并于70℃加热30min;7)将步骤6)所得产物进行冷却、洗涤、离心处理,以获得所述上转换纳米粒子。根据本发明实施例的方法所制备的上转换纳米粒子可以在红外线照射下发出红色和绿色荧光,稳定、有效的利用荧光强度和荧光强度比技术得到白蛋白浓度。
24.根据本发明的实施例,上述方法还可以进一步包括如下附加技术特征至少之一:
25.根据本发明的实施例,y
3+
是以ycl3·
6h2o的形式提供的,所述yb
3+
是以ybcl3·
6h2o的形式提供的,所述er
3+
是以ercl3·
6h2o的形式提供的。当y
3+
盐以ycl3·
6h2o的形式提供,yb
3+
盐以ybcl3·
6h2o的形式提供,er
3+
盐以ercl3·
6h2o的形式提供时制备得到的上转换纳米粒子具有更好的发光效果。
26.根据本发明的实施例,所述核层中y
3+
、yb
3+
、er
3+
的摩尔比为78~82:16~20:1~2。
27.根据本发明的实施例,所述核层中y
3+
、yb
3+
、er
3+
的摩尔比为40:9:1。
28.在本发明的第四方面,本发明提出了一种制备第二方面所述复合纳米粒子的方法。根据本发明的实施例,包括:1)将第一方面或按照第三方面所述方法制备的上转换纳米粒子与环己烷、n,n-二甲基甲酰胺、四氟硼酸亚硝(nobf4)进行第一混合和第一离心处理,获得沉淀物;2)将所述沉淀物与含有聚乙烯亚胺的dmf进行第二混合和第二离心处理,以获得物质上转换纳米粒子-聚乙烯亚胺(ucnps-pei);3)将白蛋白抗体与edc、nhs进行第三混合处理,以获得活化的白蛋白抗体;4)将所述活化的白蛋白抗体与所述上转换纳米粒子-聚乙烯亚胺进行进行第四混合和第三离心处理,以获得上转换纳米粒子-抗体(ucnps-ab);5)将孟加拉红溴己酸与edc、nhs进行第五混合处理,以获得活化的孟加拉红溴己酸;6)将活化的孟加拉红溴己酸与所述上转换纳米粒子-抗体按照1:20~1:7的摩尔比进行第六混合和第四离心处理,以获得所述复合纳米粒子(上转换纳米粒子-抗体-孟加拉红溴己酸,ucnps-ab-rbha)。根据本发明实施例的方法制备的所述复合纳米粒子可以有效的对不同液体环境中存在的白蛋白进行有效检测,且在双光子显微镜的激光照射下,可以实现类器官明亮的荧光成像,对类器官细胞内的白蛋白进行动态的可视化检测。
29.根据本发明的实施例,上述方法还可以进一步包括如下附加技术特征至少之一:
30.根据本发明的实施例,所述孟加拉红溴己酸吸收峰为555nm。
31.根据本发明的实施例,所述孟加拉红溴己酸与所述上转换纳米粒子-抗体按照1:16的摩尔比进行混合处理。
32.根据本发明的实施例,所述第六混合进行180-210min。不存在albumin的体系中,ucnps-ab与rbha距离较近,受激光激发的ucnps将能量传递给rbha,造成本身绿色荧光强度降低,当活化的孟加拉红溴己酸与所述上转换纳米粒子-抗体在本发明所述的条件下共同孵育180-210min,检测到ucnps-ab-rbha的荧光强度较低。
33.根据本发明的实施例,所述第六混合进行210min。不存在albumin的体系中,ucnps-ab与rbha距离较近,受激光激发的ucnps将能量传递给rbha,造成本身绿色荧光强度降低,当活化的孟加拉红溴己酸与所述上转换纳米粒子-抗体在本发明所述的条件下共同孵育210min,检测到ucnps-ab-rbha的荧光强度显著降低。
34.在本发明的第五方面,本发明提出了一种检测白蛋白的方法。根据本发明的实施例,包括:1)将第二方面或按照第四方面所述方法制备的所述复合纳米粒子与待测样本进
行接触;2)用980nm近红外光激发所述组合物与待测样本的接触产物,使其发出红色和绿色荧光;3)基于绿色荧光的发射强度,获得所述待测样本的白蛋白的浓度。根据本发明实施例的方法可以有效的对不同液体环境中存在的白蛋白进行有效检测,且在双光子显微镜的激光照射下,可以实现类器官明亮的荧光成像,对类器官细胞内的白蛋白进行动态的可视化检测。
35.根据本发明的实施例,上述方法还可以进一步包括如下附加技术特征至少之一:
36.根据本发明的实施例,所述待测样本含有白蛋白。
37.根据本发明的实施例,所述待测样本含有人源或鼠源白蛋白。
38.根据本发明的实施例,所述待测样本包含,含有pbs的溶液、含有fbs+dmem的溶液、含有生长因子和培养基的溶液、细胞、类器官中的至少之一。
39.根据本发明的实施例,所述细胞为hepg2或hacat。
40.根据本发明的实施例,所述类器官为肝脏类器官。
41.根据本发明的实施例,所述复合纳米粒子与待测样本接触时间为180-210min。包含albumin的体系中,白蛋白与ucnps-ab通过抗原抗体相互作用结合在一起,导致ucnps-ab与rbha距离被拉长,受激光激发的ucnps不能将能量传递给rbha,造成本身绿色荧光强度恢复,对于不同浓度的白蛋白,恢复的荧光强度不同,当活化的孟加拉红溴己酸与所述上转换纳米粒子-抗体在本发明所述的条件下共同孵育180-210min,检测到ucnps-ab-rbha的荧光强度逐渐升高。
42.根据本发明的实施例,所述复合纳米粒子与待测样本接触时间为210min。包含albumin的体系中,白蛋白与ucnps-ab通过抗原抗体相互作用结合在一起,导致ucnps-ab与rbha距离被拉长,受激光激发的ucnps不能将能量传递给rbha,造成本身绿色荧光强度恢复,对于不同浓度的白蛋白,恢复的荧光强度不同,当活化的孟加拉红溴己酸与所述上转换纳米粒子-抗体在本发明所述的条件下共同孵育180-210min,检测到ucnps-ab-rbha的荧光强度显著升高。
43.根据本发明的实施例,进一步包括:基于荧光的发射强度,获得绿色荧光与红荧光强度的比值;依据绿色荧光与红色荧光强度的比值获得所述待测样本中白蛋白的含量。将复合纳米粒子与待测样本共同孵育,如hepg2和hacat,复合纳米粒子通过胞吞的方式进入细胞,由于不同细胞中白蛋白的浓度不同,导致纳米粒子恢复的荧光强度不同,从而可以通过比较荧光强度和荧光强度比的变化,实现白蛋白的检测。
44.在本发明的第六方面,发明提出了一种判断细胞分化状态的方法。根据本发明的实施例,包括利用第五方面所述方法对第n天所述细胞分泌白蛋白的含量与第0天所述细胞分泌白蛋白含量进行检测的步骤,其中,n为不小于0的整数;根据所述细胞第n天分泌白蛋白含量较第0天分泌白蛋白的含量的变化,判断细胞分化状态。根据本发明实施例的方法可以有效的对活细胞进行实时动态检测,以准确判断细胞的分化状态。
45.根据本发明的实施例,上述方法还可以进一步包括如下附加技术特征至少之一:
46.根据本发明实施例,所述细胞第n天分泌白蛋白含量较第0天分泌白蛋白的含量显著增加是细胞正分化或已分化的指示。
47.根据本发明实施例,所述细胞为类器官细胞。
48.根据本发明实施例,所述类器官为肝脏胆管类器官。
49.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
50.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
51.图1是根据本发明实施例的白蛋白检测剂的制备过程示意图及其检测原理图;
52.图2是根据本发明实施例的nayf4:yb
3+
/er
3+
、nayf4:yb
3+
/er
3+
@nayf4的发射光谱图,其中,横坐标表示波长,纵坐标表示荧光强度;
53.图3是根据本发明实施例的pei、ucnps-pei、ucnps-ab的傅里叶红外吸收光谱图,其中,横坐标表示波数,纵坐标表示透射率;
54.图4是根据本发明实施例的不同白蛋白浓度下ucnps-ab-rbha和ucnps-ab-go的荧光强度图,其中,横坐标表示白蛋白浓度,纵坐标表示荧光强度;
55.图5是根据本发明实施例的rbha的吸收光谱图,以及ucnps-pei、ucnps-ab-rbha的发射光谱图,其中,横坐标表示波长,纵坐标表示荧光强度;
56.图6是根据本发明实施例的pbs溶液中不同ab浓度下ucnps-ab的荧光强度图,其中,横坐标表示抗体浓度,纵坐标表示荧光强度;
57.图7是根据本发明实施例的相同孵育时间下,加入不同rbha浓度后ucnps-ab-rbha的荧光强度图,其中,横坐标表示孟加拉红溴己酸浓度,纵坐标表示荧光强度;
58.图8是根据本发明实施例的ucnps-ab加入相同质量的rbha,不同孵育时间下ucnps-ab-rbha的荧光强度,其中,横坐标表示时间,纵坐标表示荧光强度;
59.图9是根据本发明实施例的白蛋白与ucnps-ab-rbha孵育不同时间后ucnps-ab-albumin-rbha的荧光强度图,其中,横坐标表示时间,纵坐标表示荧光强度;
60.图10是根据本发明实施例的不同溶液的荧光发射光谱、绿光强度、荧光强度比随白蛋白浓度的变化结果图,横坐标表示白蛋白浓度,纵坐标表示荧光强,其中,
61.a、b、c为pbs溶液的荧光发射光谱、绿光强度、荧光强度比随白蛋白浓度的变化结果图,
62.d、e、f为dmem+fbs溶液中荧光发射光谱、绿光强度、荧光强度比随白蛋白浓度的变化结果图,
63.g、h、i为生长因子+培养基溶液中荧光发射光谱、绿光强度、荧光强度比随白蛋白浓度的变化结果图;
64.图11是根据本发明实施例的白蛋白检测剂进入hacat和hepg2细胞的荧光图像结果图,其中,标记dapi的图片为双光子显微镜照射下观察到的细胞核dapi荧光发射(420nm发射),标记980/561的图片指的是近红外980nm激发后,在561nm发射波长下检测到纳米颗粒的荧光图,由于只有hepg2细胞够更高效地表达和分泌白蛋白,故只有hepg2细胞组在980nm激发,560nm发射检测处有较强的荧光发射;以及
65.图12是根据本发明实施例的白蛋白检测剂进入胆管类器官和肝实质类器官的荧光图像结果图,其中,标记dapi的图片为双光子显微镜照射下观察到的细胞核dapi荧光发射(420nm发射),标记980/561的图片指的是近红外980nm激发后,在561nm发射波长下检测
到纳米颗粒的荧光图,由于只有肝实质类器官够更高效地表达和分泌白蛋白,故只有肝实质类器官组在980nm激发,560nm发射检测处有较强的荧光发射。
具体实施方式
66.下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
67.本文中,所述nayf4:yb
3+
/er
3+
是指yb
3+
和er
3+
共掺杂nayf4上转换发光材料,六方相nayf4具有良好的热稳定性和化学稳定性。其中稀土离子yb
3+
/er
3+
是通过取代nayf4中y
3+
的位置,从而进入基质主晶格。因此,在xrd衍射图样中是纯的nayf4六方相,而没有其他杂峰出现。另外,六方相nayf4具有较低的声子能量,因而具有较高的上转换效率。
68.本文中,所述nayf4:yb
3+
/er
3+
@nayf4是指yb
3+
和er
3+
共掺杂nayf4的核壳结构上转换纳米粒子。在一些实施方案中,本发明提出了一种上转换纳米粒子,包括:核层,所述核层包括nayf4:yb
3+
/er
3+
;以及壳层,所述壳层设置在所述核层的外表面,所述壳层包括nayf4:yb
3+
/er
3+
@nayf4。六方相nayf4具有良好的热稳定性和化学稳定性。其中稀土离子yb
3+
/er
3+
是通过取代nayf4中y
3+
的位置,从而进入基质主晶格。因此,在xrd衍射图样中是纯的nayf4六方相,而没有其他杂峰出现。另外,六方相nayf4具有较低的声子能量,因而具有较高的上转换效率,在980nm近红外光照射下可发出绿色和红色荧光,当所述可见光波长为535nm~550nm时出现绿色荧光发射峰,所述上转换纳米粒子在绿光区域的发射峰为541nm;当所述可见光波长为645nm~665nm出时现红色荧光发射峰,其中荧光强度比测温灵敏度较高,减少周围环境的影响,提高检测灵敏度,稳定、有效的利用荧光强度和荧光强度比得到白蛋白浓度。
69.在一些具体实施方案中,所述核层的粒径为25nm。
70.在一些具体实施方案中,所述核层的粒径为35nm。
71.在一些具体实施方案中,所述y
3+
是以ycl3·
6h2o的形式提供的,所述yb
3+
是以ybcl3·
6h2o的形式提供的,所述er
3+
是以ercl3·
6h2o的形式提供的。
72.在一些具体实施方案中,所述核层中y
3+
、yb
3+
、er
3+
的摩尔比为78~82:16~20:1~2。
73.在一些具体实施方案中,所述核层中y
3+
、yb
3+
、er
3+
的摩尔比为40:9:1。所述核层中yb
3+
、er
3+
的掺杂浓度分别为16%~20%(摩尔浓度),1%~2%(摩尔浓度),所述核层中yb
3+
、er
3+
的掺杂浓度分别为18%,2%时,发光效果更好;所述壳层中不掺杂激活剂离子,包裹惰性壳层可以有效避免核中激活剂离子与溶剂的接触,从而降低纳米粒子的表面猝灭效应。
74.在一些实施方案中,本发明提出了一种复合纳米粒子,包括:所述的上转换纳米粒子、白蛋白抗体以及孟加拉红溴己酸,所述白蛋白抗体搭载于所述上转换纳米粒子的外表面,并且所述白蛋白抗体加载于所述上转换纳米粒子与所述孟加拉红溴己酸之间。复合纳米粒子可以有效的对不同液体环境中存在的白蛋白进行有效检测,且在双光子显微镜的激光照射下,可以实现类器官明亮的荧光成像,对类器官细胞内的白蛋白进行动态的可视化检测;采用溶剂热制备核壳结构纳米粒子,再通过配体交换加载pei表面修饰剂,利用胺基羧基脱水缩合加载抗体ab和猝灭剂孟加拉红溴己酸,在合适的距离内,孟加拉红溴己酸可有效猝灭上转换纳米粒子的荧光;其中,ab通过化学键与孟加拉红溴己酸连接。
75.在一些具体实施方案中,基于所述复合纳米粒子的总质量,加入的白蛋白抗体浓度为56μg/ml。
76.在一些具体实施方案中,所述白蛋白抗体包括人源白蛋白抗体或鼠源白蛋白抗体。所述白蛋白存在于含有pbs的溶液、含有fbs+dmem溶液、含有生长因子的溶液、细胞、类器官中的至少之一。
77.在一些具体实施方案中,进一步包括牛血清白蛋白和聚乙烯亚胺。
78.在一些具体实施方案中,所述白蛋白抗体通过共价键与加载有聚乙烯亚胺的上转化纳米颗粒进行连接。
79.在一些具体实施方案中,所述白蛋白抗体与加载有聚乙烯亚胺的上转化纳米颗粒的质量比为7:500。
80.在一些具体实施方案中,所述孟加拉红溴己酸是通过共价键与所述白蛋白抗体进行连接。
81.在一些具体实施方案中,所述孟加拉红溴己酸与所述白蛋白抗体的质量比为25:2。
82.在一些具体实施方案中,所述孟加拉红溴己酸由孟加拉红与溴己酸反应获得的。
83.在一些实施方案中,本发明提供了一种制备所述的上转换纳米粒子的方法,包括:1)将y
3+
盐、yb
3+
盐、er
3+
盐与油酸、十八烯在氮气存在下进行第一加热处理,任选地,所述加热处理是在温度为120~170℃进行的;2)将步骤1)所得产物冷却至室温后,与氢氧化钠、氟化铵、甲醇进行混合;3)将步骤2)所得产物分别于50~90℃加热25~35min,280~320℃加热50~70min;4)将步骤3)所得产物进行冷却、洗涤、离心处理,以获得所述核层;5)将y
3+
盐、油酸、十八烯在氮气存在下进行第二加热处理,任选地,所述第二加热处理是在温度为120~170℃进行的;6)将步骤5)所得产物冷却至室温后,与步骤4)所得核层进行混合,并于70℃加热30min;7)将步骤6)所得产物进行冷却、洗涤、离心处理,以获得所述上转换纳米粒子。根据本发明实施例的方法所制备的上转换纳米粒子可以在红外线照射下发出红色和绿色荧光,稳定、有效的利用荧光强度和荧光强度比技术得到白蛋白浓度。
84.在一些具体实施方案中,y
3+
是以ycl3·
6h2o的形式提供的,所述yb
3+
是以ybcl3·
6h2o的形式提供的,所述er
3+
是以ercl3·
6h2o的形式提供的。当y
3+
盐以ycl3·
6h2o的形式提供,yb
3+
盐以ybcl3·
6h2o的形式提供,er
3+
盐以ercl3·
6h2o的形式提供时制备得到的上转换纳米粒子具有更好的发光效果。
85.在一些具体实施方案中,所述核层中y
3+
、yb
3+
、er
3+
的摩尔比为78~82:16~20:1~2。
86.在一些具体实施方案中,所述核层中y
3+
、yb
3+
、er
3+
的摩尔比为40:9:1。
87.在一些实施方案中,本发明提供了一种制备所述复合纳米粒子的方法,包括:1)将所述上转换纳米粒子与环己烷、n,n-二甲基甲酰胺、四氟硼酸亚硝进行第一混合和第一离心处理,获得沉淀物;2)将所述沉淀物与含有聚乙烯亚胺的dmf进行第二混合和第二离心处理,以获得物质上转换纳米粒子-聚乙烯亚胺;3)将白蛋白抗体与edc、nhs进行第三混合处理,以获得活化的白蛋白抗体;4)将所述活化的白蛋白抗体与所述上转换纳米粒子-聚乙烯亚胺进行进行第四混合和第三离心处理,以获得上转换纳米粒子-抗体;5)将孟加拉红溴己酸与edc、nhs进行第五混合处理,以获得活化的孟加拉红溴己酸;6)将孟加拉红溴己酸与所
述上转换纳米粒子-抗体按照1:20~1:7的摩尔比进行第六混合和第四离心处理,以获得所述复合纳米粒子。本发明采用溶剂热制备核壳结构纳米粒子,再通过配体交换加载pei表面修饰剂,利用胺基羧基脱水缩合加载抗体ab和猝灭剂孟加拉红溴己酸,在合适的距离内,孟加拉红溴己酸可有效猝灭上转换纳米粒子的荧光。
88.在一些具体实施方案中,所述孟加拉红溴己酸吸收峰为555nm。
89.在一些具体实施方案中,所述孟加拉红溴己酸与所述上转换纳米粒子-抗体按照1:16的摩尔比进行混合处理。
90.在一些具体实施方案中,所述第六混合进行200-220min。不存在albumin的体系中,ucnps-ab与rbha距离较近,受激光激发的ucnps将能量传递给rbha,造成本身绿色荧光强度降低,当活化的孟加拉红溴己酸与所述上转换纳米粒子-抗体在本发明所述的条件下共同孵育200-210min,检测到ucnps-ab-rbha的荧光强度较低。
91.在一些具体实施方案中,所述第六混合进行210min。不存在albumin的体系中,ucnps-ab与rbha距离较近,受激光激发的ucnps将能量传递给rbha,造成本身绿色荧光强度降低,当活化的孟加拉红溴己酸与所述上转换纳米粒子-抗体在本发明所述的条件下共同孵育210min,检测到ucnps-ab-rbha的荧光强度显著降低。
92.在一些具体实施方案中,所述保护气为本领域常规使用的保护气,比如氮气。
93.一些具体实施方案中,制备核层纳米颗粒时,y
3+
盐、yb
3+
盐、er
3+
盐与氟化铵的摩尔比为(78~82):(16~20):(1~2):(390~410),在本发明的一些实施方式中,该摩尔比为80:18:2:400。
94.在一些具体实施方案中,在制备核层纳米颗粒时,其包括将y
3+
盐、油酸和十八烯(油酸和十八烯作为溶剂)混合,然后此溶液在氮气保护下加热到130℃~160℃,直到形成浅黄色透明溶液,随后溶液自然冷却至室温;然后加入氢氧化钠、氟化铵的甲醇溶液,加热混合溶液至60℃~80℃并保持20min~40min,移除甲醇;将上述溶液在氮气保护下加热到280℃~320℃并保持0.5h~1.5h;随后溶液自然冷却到室温;在冷却后的溶液中加入过量乙醇,离心得到nayf4:yb
3+
/er
3+
@nayf4纳米颗粒,并将其分散于22.5ml环己烷。
95.在一些具体实施方案中,包括加载pei的步骤,在50ml离心管中加入3ml环己烷、5ml n,n-二甲基甲酰胺(dmf),称量四氟硼酸亚硝(nobf4)100mg加入此离心管,取7.5ml分散有nayf4:yb
3+
/er
3+
@nayf4的环己烷溶液加入并搅拌0.5h,离心去除上清,将沉淀分散于5ml溶有100mg pei的dmf并搅拌24h,离心并水洗两次得到上转换纳米粒子-pei,分散于20ml pbs溶液。
96.在一些具体实施方案中,包括加载ab的步骤,取2mg/ml的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)200μl,2mg/ml的n-羟基琥珀酰亚胺(nhs)100μl,1μg/ml的ab 56μl加入离心管,活化2h。加入200μl pbs分散的上转换纳米粒子-pei,孵育过夜,得到上转换纳米粒子-ab。
97.在一些具体实施方案中,包括加载孟加拉红溴己酸的步骤:取250μg/ml的孟加拉红溴己酸200μl,加入0.5mg/ml的edc 200μl,0.5mg/ml的nhs 100μl,活化2h。将上述溶液超声1min,加入0.3mg/ml的bsa 200μl,孵育0.5h。将活化后的孟加拉红溴己酸加入上转换纳米粒子-ab,孵育2h,离心得到ucnps-ab-rbha并分散于100μl pbs。
98.在一些具体实施方案中,孟加拉红溴己酸由以下反应得到:取孟加拉红与溴己酸
加入到丙酮和水的混合溶液加热到反应后,去除丙酮,然后在水和乙酸乙酯的混合溶液中萃取,即得孟加拉红溴己酸。需注意的是,根据本发明的方法启示,本领域技术人员能够在此基础上进行用量的筛选、温度等的选择,以期获得更高孟加拉红溴己酸的收率或者采用进一步纯化或其他处理方式以获得纯度更好的孟加拉红溴己酸。
99.在一些具体的实施方案中,所述孟加拉红溴己酸通过以下方法制备:取100mg孟加拉红与19.6mg溴己酸加入到50ml丙酮和水的混合溶液(v
丙酮
:v
水
=7:3)加热到75℃,反应24h后,通过旋蒸去除丙酮,然后在水和乙酸乙酯的40ml混合溶液(v
乙酸乙酯
:v
水
=1:1)中萃取,再冻干得到孟加拉红溴己酸。
100.在一些具体实施方案中,所述孟加拉红溴己酸与上转换纳米粒子的用量关系(摩尔比)为(1~2):(14~20),当所述孟加拉红溴己酸与上转换纳米粒子的用量关系(摩尔比)为1:16时效果更佳。
101.在一些实施方案中,本发明提供了一种检测白蛋白的方法,包括:1)将所述复合纳米粒子与待测样本进行接触;2)用980nm近红外光激发所述组合物与待测样本的接触产物,使其发出红色和绿色荧光;3)基于绿色荧光的发射强度,获得所述待测样本的白蛋白的浓度。所述方法可以有效的对不同液体环境中存在的白蛋白进行有效检测,且在双光子显微镜的激光照射下,可以实现类器官明亮的荧光成像,对类器官细胞内的白蛋白进行动态的可视化检测。
102.在一些具体实施方案中,所述待测样本含有白蛋白。
103.在一些具体实施方案中,所述待测样本含有人源或鼠源白蛋白。
104.在一些具体实施方案中,本发明实现了不同液体环境中albumin的有效检测,包括以下液体环境:pbs溶液、fbs+dmem溶液或adgs培养基的溶液。
105.在一些具体实施方案中,adgs培养基包括:advanced dmem/f12,b27,n2,青链霉素混合液,n-乙酰半胱氨酸,glutamax,表皮生长因子(egf),fgf10,胃泌素(gastrin),a83-01,4-羟乙基哌嗪乙磺酸(hepes),chir99021,肝细胞生长因子(hgf),尼克酰胺,y-27632,r-spondin1,tnf-α。
106.在一些具体实施方案中,所述不同溶液中白蛋白的检测操作为:取上述方法制备好的ucnps-ab-rbha(100μl)分别分散于含有pbs溶液、fbs和dmem溶液、adgs培养基溶液的离心管,分别取这三种溶液分散的、不同浓度的白蛋白加入,共同孵育1.5h,测试孵育之后溶液的发射光谱。
107.在一些具体实施方案中,pbs溶液中白蛋白的可检测浓度范围15~285ng/ml,fbs和dmem溶液中白蛋白的可检测浓度范围是45~315ng/ml,adgs培养基溶液中白蛋白的可检测浓度范围是5~315ng/ml。
108.在一些具体实施方案中,adgs培养基包括:advanced dmem/f12,b27,n2,青链霉素混合液,n-乙酰半胱氨酸,glutamax,表皮生长因子(egf),fgf10,胃泌素(gastrin),a83-01,4-羟乙基哌嗪乙磺酸(hepes),chir99021,肝细胞生长因子(hgf),尼克酰胺,y-27632,r-spondin1,tnf-α。
109.在一些具体实施方案中,所述细胞为hepg2、hacat。将ucnps-ab-rbha与hepg2和hacat细胞共同孵育,ucnps-ab-rbha纳米粒子通过胞吞的方式进入细胞,由于不同细胞中白蛋白的浓度不同,导致纳米粒子荧光恢复的强度不同,从而可以通过比较荧光强度的变
化,实现细胞内白蛋白的检测。
110.在一些具体实施方案中,ucnps-ab-rbha与细胞的共同孵育时间为2h,孵育溶液为fbs+dmem溶液。
111.在一些具体实施方案中,所述类器官为肝脏类器官。将ucnps-ab-rbha与类器官共同孵育一段时间,在双光子显微镜的激光照射下,可以实现类器官明亮的荧光成像。
112.在一些具体实施方案中,所述复合纳米粒子与待测样本接触时间为180-210min。包含albumin的体系中,白蛋白与ucnps-ab通过抗原抗体相互作用结合在一起,导致ucnps-ab与rbha距离被拉长,受激光激发的ucnps不能将能量传递给rbha,造成本身绿色荧光强度恢复,对于不同浓度的白蛋白,恢复的荧光强度不同,当活化的孟加拉红溴己酸与所述上转换纳米粒子-抗体在本发明所述的条件下共同孵育180-210min,检测到ucnps-ab-rbha的荧光强度逐渐升高。
113.在一些具体实施方案中,所述复合纳米粒子与待测样本接触时间为210min。包含albumin的体系中,白蛋白与ucnps-ab通过抗原抗体相互作用结合在一起,导致ucnps-ab与rbha距离被拉长,受激光激发的ucnps不能将能量传递给rbha,造成本身绿色荧光强度恢复,对于不同浓度的白蛋白,恢复的荧光强度不同,当活化的孟加拉红溴己酸与所述上转换纳米粒子-抗体在本发明所述的条件下共同孵育180-210min,检测到ucnps-ab-rbha的荧光强度显著升高。
114.在一些具体实施方案中,进一步包括:基于荧光的发射强度,获得绿色荧光与红色荧光强度的比值;依据绿色荧光与红色荧光强度的比值获得所述待测样本中白蛋白的含量。
115.在一些实施方案中,本发明提供了一种判断细胞分化状态的方法,包括利用所述检测白蛋白的方法对第n天所述细胞分泌白蛋白的含量与第0天所述细胞分泌白蛋白含量进行检测的步骤,其中,n为不小于0的整数;根据所述细胞第n天分泌白蛋白含量较第0天分泌白蛋白的含量的变化,判断细胞分化状态。所述方法可以有效的对活细胞进行实时动态检测,以准确判断细胞的分化状态。将ucnps-ab-rbha与类器官共同孵育一段时间,在双光子显微镜的激光照射下,可以实现类器官明亮的荧光成像。
116.在一些具体的实施方案中,所述细胞为类器官。
117.在一些具体的实施方案中,所述类器官为肝脏胆管类器官。
118.本发明所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到,未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
119.实施例1上转换纳米粒子核壳结构的制备
120.在本实施例中,制备的上转换纳米粒子核壳结构的绿光发射峰在541nm,红光发射峰在655nm,制备所述上转换纳米粒子地实验操作步骤如下:
121.(1)在三口烧瓶中加入ycl3·
6h2o(1.78mmol,89%),ybcl3·
6h2o(0.2mmol,10%),ercl3·
6h2o(0.02mmol,1%),再加入6ml油酸,15ml十八烯,然后此溶液在氮气保护下加热到150℃,直到形成浅黄色透明溶液,随后将浅黄色透明溶液自然冷却至室温。
122.(2)取4mmol氟化铵、2.5mmol氢氧化钠溶解于8ml甲醇溶液,将此溶液加入步骤(1)所述溶液中,将获得的混合溶液加热至70℃并保持30min,移除甲醇。
123.(3)将步骤(2)获得溶液在氮气保护下加热到300℃并保持1h,随后将溶液自然冷却到室温。
124.(4)在步骤(3)获得的冷却后的溶液中加入过量乙醇(40ml),于10000r/min转速下离心10min得到nayf4:yb
3+
/er
3+
纳米颗粒(核层),并将nayf4:yb
3+
/er
3+
纳米颗粒(核层)分散于10ml环己烷中备用。
125.(5)nayf4:yb
3+
/er
3+
@nayf4纳米颗粒的合成过程与nayf4:yb
3+
/er
3+
纳米颗粒的合成过程相似。在三口烧瓶中加入ycl3·
6h2o(1mmol,90%),再加入6ml油酸,15ml十八烯,然后此溶液在氮气保护下加热到150℃,直到形成浅黄色透明溶液,随后将浅黄色透明溶液自然冷却至室温。
126.(6)加入分散有nayf4:yb
3+
/er
3+
纳米颗粒的环己烷溶液5ml,加热混合溶液至70℃并保持30min,移除环己烷;冷却后加入溶解有4mmol氟化铵和2.5mmol氢氧化钠的甲醇溶液8ml,加热混合溶液至70℃并保持30min,移除甲醇。
127.(7)将步骤(6)获得的移除甲醇后的混合溶液在氮气保护下加热到300℃并保持1h,随后将溶液自然冷却到室温。
128.(8)在步骤(7)获得的冷却后的溶液中加入过量乙醇(40ml),于10000r/min转速下离心10min,得到ucnps核壳结构纳米粒子。制备的核层以及壳层结构发射光谱如图2所示,结果表明含有惰性壳层包裹的上转换纳米粒子(nayf4:yb
3+
/er
3+
@nayf4,即ucnps)经980nm的近红外光激发后所检测到的荧光强度高于无惰性壳层包裹的核层结构(nayf4:yb
3+
/er
3+
),因此,所述上转换纳米粒子的壳层可以实现发光内核与外部溶剂的有效隔离,降低表面猝灭的影响,从而提高纳米粒子的荧光强度,使得白蛋白的检测浓度更加准确。
129.实施例2复合纳米粒子的制备
130.本实施例展示了复合纳米粒子的制备方法,具体实验操作如下:
131.1、ucnps加载pei制备ucnps-pei
132.在50ml离心管中加入3ml环己烷、5ml n,n-二甲基甲酰胺(dmf),称量四氟硼酸亚硝(nobf4)100mg加入此离心管,取7.5ml分散有nayf4:yb
3+
/er
3+
@nayf4的环己烷溶液加入并搅拌0.5h,离心去除上清,将沉淀分散于5ml溶有100mg pei的dmf并搅拌24h,离心并水洗2次得到ucnps-pei,将其分散于20ml pbs溶液备用,纳米粒子的表面基团可以通过傅里叶红外吸收光谱(ftir)给出,如图3所示。
133.2、ucnps-pei加载ab制备ucnps-ab
134.(1)在离心管中加入200μl edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐),100μl nhs(n-羟基琥珀酰亚胺),56μl ab,搅拌2h,以活化ab。
135.(2)步骤(1)所得活化ab后的溶液中再加入浓度为20mmol/l的ucnps-pei 200μl,即白蛋白抗体与加载有聚乙烯亚胺的上转化纳米颗粒的质量比为7:500,共同孵育过夜。
136.(3)将步骤(2)所得溶液超声1min后,加入200μl bsa(0.3mg/ml),孵育0.5h,得到ucnps-ab。
137.收集所述pei、ucnps-pei、ucnps-ab的红外吸收光谱图,具体结果如图3所示,其中,2942cm-1
、2841cm-1
、1456cm-1
、1342cm-1
等吸收峰表明胺基的存在,从而证明pei已经接在
ucnps表面。另外,ab与pei表面的胺基通过脱水缩合生成共价酰胺键,1664cm-1
、1554cm-1
等吸收峰表明酰胺键的存在,从而证明抗体ab已经接在ucnps表面(ucnps-ab)。
138.3、ucnps-ab加载猝灭剂
139.(1)ucnps-ab加载rbha
140.a.取一只离心管,加入200μl edc(0.5mg/ml),100μl nhs(0.5mg/ml),200μl孟加拉红溴己酸(0.25mg/ml),搅拌2h,活化孟加拉红溴己酸。
141.b.将活化的孟加拉红溴己酸加入离心管a,孵育2h,于10000r/min转速下离心10min,用pbs洗涤沉淀1次后,超声1min,以获得复合纳米粒子ucnps-ab-rbha,将得到的ucnps-ab-rbha分散于100μl pbs溶液备用。
142.(2)ucnps-ab加载go
143.a.称量10mg go加入5ml水,冰浴超声2h,于10000r/min的转速下离心30min,取离心后的上清液存储备用;
144.b.取步骤a获得的go上清液300μl,与步骤2获得的1ml ucnps-ab混合搅拌2h,于10000r/min的转速下离心100min后去掉上清液,将得到的ucnps-ab-go分散于100μl pbs(ph为7.4,浓度为1mm)溶液备用。
145.将制备的ucnps-ab-rbha、ucnps-ab-go储存备用。
146.实施例3复合纳米粒子参数优化
147.在本实施例中,所用pbs溶液的ph值为7.4,浓度为1mm,按照实施例1或2所述的方法制备所述上转换纳米粒子、复合纳米粒子,发明人进一步对所述复合纳米粒子的参数进行优化,实验操作步骤如下:
148.1、复合纳米粒子猝灭剂筛选
149.(1)利用实施例1所述的方法制备所述上转换纳米粒子,按照实施例2所述方法制备所述ucnps-ab-rbha、ucnps-ab-go,利用两种纳米粒子检测不同浓度的白蛋白,以筛选出检测效果较好的复合纳米粒子。发明人将白蛋白的浓度设置为0,5.6,17.6,45.8,75.8,105.5,138,166.7,195.5,225.4,255.4,285.7,315,346.4ng/ml,分别向含有ucnps-ab-rbha、ucnps-ab-go的pbs溶液中加入上述不同浓度的白蛋白,将复合纳米粒子和白蛋白共同孵育1.5h。孵育完成后,使用980激光器照射不同样品(1w/cm2),收集不同白蛋白浓度条件下,用980nm近红外光激发ucnps-ab-rbha和ucnps-ab-go所获得的发射光谱,具体结果如图4所示,当白蛋白的浓度在0~300ng/ml范围内变动时,检测到ucnps-ab-rbha的荧光强度随白蛋白含量的升高呈线性增加,而ucnps-ab-go的荧光强度未呈现出较强的线形规律,因此,ucnps-ab-rbha检测剂可以在不同溶液中实现白蛋白的有效检测,且检测剂恢复后的荧光强度与白蛋白浓度呈现良好的线性关系。
150.(2)基于本实施例实验(1)的结果,发明人收集所述rbha的吸收光谱图,以及ucnps-pei、ucnps-ab-rbha的发射光谱图,具体结果如图5所示,其中,ucnps-pei的发射光谱与rbha的吸收光谱有较大区域的重叠,提高能量供体(ucnps-pei)和能量受体(rbha)的能量传递效率,有效猝灭ucnps-pei绿光区域的发射光。另外,相较于rbha,ucnps-ab-rbha的吸收谱产生红移是分子结构改变引起的。
151.2、复合纳米粒子中ab添加浓度优化
152.结合本实施例第1个实验的结果,发明人利用实施例1所述的方法制备所述上转换
纳米粒子,按照实施例2所述方法制备ucnps-ab-rbha,制备过程中发明人对ucnps-ab-rbha中ab的添加浓度进行优化,将不同浓度的ab与ucnps-pei进行混合,采用f7000光谱仪设备检测ucnps-ab的荧光强度。实验结果如图6所示,从图中可以看出ab的最佳添加浓度是56μg/ml。
153.3、复合纳米粒子中rbha的添加浓度优化
154.结合本实施例第1个实验的结果,发明人利用实施例1所述的方法制备所述上转换纳米粒子,按照实施例2所述方法制备ucnps-ab-rbha,制备过程中对检测剂ucnps-ab-rbha中rbha的添加浓度进行优化。每个样品加入200μl 0.3mg/ml的bsa封闭能量空隙,30min后加入不同浓度的rbha(0.976,1.953,3.906,7.8125,31.25,62.5,125,250ng/ml)与ucnps-ab进行混合,共同孵育2h,10000r/min
×
10min离心,水洗一次,去掉未反应的rbha,每个样品加入相同浓度的白蛋白,共同孵育1.5h,在980nm激光照射下,通过f7000光谱仪收集荧光信号。实验结果如图7所示,从图中可以看出,rbha的最佳添加浓度是250ng/ml,即rbha与ucnps-ab的摩尔比为1:16。
155.4、rbha与ucnps-ab的孵育时间优化
156.结合本实施例第1个实验的结果,发明人利用实施例1所述的方法制备所述上转换纳米粒子,按照实施例2所述方法制备ucnps-ab-rbha,制备过程中对rbha与ucnps-ab的孵育时间进行优化,将相同浓度的rbha与ucnps-ab进行孵育。取一只离心管,加入200μl edc(0.5mg/ml),100μl nhs(0.5mg/ml),200μl孟加拉红溴己酸(0.25mg/ml),搅拌2h,活化孟加拉红溴己酸。加入上述得到的ucnps-ab(356μl),搅拌2h,将不同样品孵育不同的时间(0,30,60,90,120,150,180,210min),10000r/min
×
10min离心,水洗一次,去掉未反应的rbha,再加入相同浓度的白蛋白,共同孵育1.5h,在980nm激光照射下,通过f7000光谱仪收集荧光信号。实验结果如图8所示,从图中可以看出,ucnps-ab与rbha的最佳孵育时间是210min。
157.5、检测时白蛋白与复合纳米粒子ucnps-ab-rbha的孵育时间优化
158.发明人对检测白蛋白时的白蛋白与复合纳米粒子共同孵育的时间进行了优化,将含有不同浓度白蛋白的pbs溶液(0,5.6,17.6,45.8,75.8,105.5,138,166.7,195.5,225.4,255.4,285.7,315,346.4ng/ml)与ucnps-ab-rbha进行孵育,孵育1.5h后,分别在30min内检测与白蛋白结合后获得的ucnps-ab-albumin-rbha的荧光强度。实验结果如图9所示,从图中可以发现ucnps-ab-rbha与白蛋白的最佳孵育时间是210min。
159.综合上述实验结果,使用rbha相比于使用go制备的复合纳米粒子在检测白蛋白时具有良好的线性关系,且复合纳米粒子中ab添加的最佳浓度是56μg/ml,rbha的最佳浓度是250ng/ml,ucnps-ab与rbha的最佳孵育时间是210min。
160.实施例4不同液体环境中白蛋白的检测
161.在离心管中加入200μl edc(0.5mg/ml),100μl nhs(0.5mg/ml),56μl ab,搅拌2h,以活化ab。加入200μl ucnps-pei(20mmol/l)搅拌过夜。所得溶液超声1min后,加入200μl bsa(0.3mg/ml),孵育0.5h,得到ucnps-ab。取一只离心管,加入200μl edc(0.5mg/ml),100μl nhs(0.5mg/ml),200μl孟加拉红溴己酸(0.25μg/ml),搅拌2h,活化孟加拉红溴己酸。每个样品加入200μl 0.3mg/ml的bsa封闭能量空隙,30min加入上述得到的ucnps-ab(256μl),搅拌2h,孵育210min,10000r/min
×
10min离心,水洗一次,去掉未反应的rbha,将得到的ucnps-ab-rbha分散于不同溶液,再加入相同浓度的白蛋白,共同孵育1.5h,在980nm激光照
射下,通过f7000光谱仪收集荧光信号。结果如图10所示,不同溶液中(pbs、fbs+dmem、生长因子+培养基)检测白蛋白浓度的发射光谱、荧光强度和荧光强度比的变化情况。实验结果表明,随时间的变化,包含白蛋白的pbs、fbs和dmem、adgs培养基溶液中检测剂结合的白蛋白数量均增多,检测剂的荧光强度均逐渐恢复,检测剂恢复后的荧光强度与白蛋白浓度呈现良好的线性关系,因此,该检测剂(复合纳米粒子)可以在不同溶液中实现白蛋白的有效检测。
162.实施例5活体细胞中白蛋白的检测
163.在本实施例中,用于活体检测的细胞为hepg2/hacat细胞,其中hepg2是人肝母细胞瘤细胞系,能够表达和分泌白蛋白,而hacat是人角质化永生细胞系,基本不表达和分泌白蛋白,用来作为对照。
164.实验操作步骤如下:
165.(1)将hepg2/hacat细胞接种于24孔板上,培养基为含有10-15%胎牛血清的dmem培养基,其细胞密度为105细胞/孔,在37℃、5%co2培养箱中培养过夜。
166.(2)待细胞贴壁后,向培养基中加入ucnps-ab-rbha(10μm)共同孵育12h(37℃、5%co2)。
167.(3)吸去培养基,并沿着24孔板边缘小心加入适量pbs,轻微晃动孔板,清洗细胞,再吸去pbs,重复清洗两次后,加入4%的多聚甲醛室温避光固定细胞20min,并通过4',6-二脒基-2-苯基吲哚(dapi)对细胞核进行染色。
168.(4)利用双光子显微镜检测dapi和ucnps-ab-rbha成像。
169.具体结果如图11所示,双光子显微镜照射下,hepg2和hacat细胞均有较强的细胞核dapi荧光发射,但由于只有hepg2够表达和分泌白蛋白,故只有hepg2组在980nm激发,560nm发射检测处有较强的荧光发射,表明检测剂可以用于活细胞特异性白蛋白检测。
170.实施例6类器官中的白蛋白检测
171.本实施例中,用于类器官中白蛋白检测的类器官为肝脏类器官,包括胆管类器官和肝实质类器官,其中实质细胞相比于胆管细胞会表达和分泌大量的白蛋白,利用这一点,胆管类器官可作为对照。实验操作步骤如下:
172.(1)肝脏胆管类器官的分离与培养参照文献【broutier,et al.(2016).culture and establishment of self-renewing human and mouse adult liver and pancreas 3d organoids and their genetic manipulation.nature protocols 11,1724-1743.】报道的方法,从野生型c57bl/6小鼠和人的肝脏组织中分离得到胆管类器官。
173.a.小鼠经安乐死后,立刻将其肝脏取出,至于4℃预冷的基础培养基中,基础培养基成分为:advanced dmem/f12培养基、1%青链霉素、1x glutamax和10mm hepes;
174.b.用手术剪将肝脏剪成0.5mm3的小块,将其转移到15ml离心管,加入10ml清洗培养基(成分为:dmem培养基、1%胎牛血清、1%青链霉素)反复吹打;
175.c.静置沉降,去除上清。再加入10ml清洗培养基,吹打,重复步骤2;
176.d.尽可能地去除多余地清洗培养基,加入事前37℃预热的消化培养基,针对小鼠的肝脏,其成分为清洗培养基添加胶原酶和离析酶ii,终浓度为0.125mg/ml,添加脱氧核糖核酸酶i,终浓度为0.1mg/ml。针对人的肝脏,消化培养基的成分为ebss基础培养基添加胶原酶d和脱氧核糖核酸酶i,终浓度分别为2.5mg/ml和0.1mg/ml,其中,消化在37℃培养箱进
行;
177.e.每隔半小时取出少量样本进行镜检,针对小鼠,如果出现大量的胆管结构,即可停止消化;针对人,如果肝脏组织大部分(》80%)都已被消化为单细胞,即可停止消化,否则继续;
178.f.消化结束后,将上清转移到一个新的15ml离心管中,加入洗涤培养基至15ml,100g-300g离心5min,弃去上清。
179.g.重复f步骤一次。
180.h.加入10ml基础培养基重悬,100g-200g离心5min,弃去上清。
181.i.重复步骤h一次。
182.j.将沉淀用适量的matrigel重悬,均匀地滴在24孔板中央,用枪头将包裹胆管地matrigel铺开,但是不要碰到孔壁,于37℃二氧化碳培养箱中静置10min。
183.k.每个孔内再加入胆管类器官生长培养基(adgs):advanced dmem/f12培养基中添加1xb27、1xn2、1xglutamax、1.25mm n-乙酰半胱氨酸、1%青链霉素、50ng/ml egf、100ng/ml fgf10、50ng/ml hgf、200ng/ml r-spondin1和10nm gastrin,将24孔板置于37℃二氧化碳培养箱中进行培养,每隔3-5天换一次液。即完成胆管类器官的分离与培养。
184.(2)肝实质类器官的分离和培养方法参照文献【hu,h.,et al.(2018).long-term expansion of functional mouse and human hepatocytes as 3d organoids.cell 175,1591-1606e1519.】报道的方法,从野生型c57bl/6小鼠和人的肝脏组织中分离得到肝实质类器官。
185.a.通过肝脏灌注的方式,将含有胶原酶的灌注液通过静脉灌入肝脏中,肝实质细胞在胶原酶的消化下,开始解离,此时将肝脏转移至含有5%胎牛血清的dmem中来回抖动,即可将消化下来的实质细胞抖入培养基中,再通过50g离心5min后,吸去上清,沉淀即纯净的肝实质细胞。
186.b.将肝实质细胞沉淀用matrigel重悬,均匀地滴在24孔板中央,用枪头将包裹胆管地matrigel铺开,但是不要碰到孔壁。37℃二氧化碳培养箱中静置10min。
187.c.每个孔加入肝实质类器官培养基(adgs):advanced dmem/f12培养基中添加1xb27、1xn2、1xglutamax、1.25mm n-乙酰半胱氨酸、1%青链霉素、10mm hepes、50ng/ml egf、3um chir99021、10nm gastrin、25ng/ml hgf、100ng/ml fgf10、2um a83-01、3mm尼克酰胺、10um y-27632、200ng/ml r-spondin1和100ng/ml tnf-α,置于37℃二氧化碳培养箱中进行培养。每隔3-5天换一次液。即完成肝实质类器官的分离与培养。
188.(3)在上述两种类器官的培养基中加入ucnps-ab-rbha(10μm)共同孵育12h(37℃、5%co2)。
189.(4)吸去培养基,并用pbs清洗两次后,加入适量的cell recovery solution(corning,cat:354253),4度摇床放置30min,目的是将matrigel消化,释放其中包裹的类器官,然后,再加入4%的多聚甲醛室温避光固定细胞20min,再通过4',6-二脒基-2-苯基吲哚(dapi)对细胞核进行染色。
190.(5)利用双光子显微镜检测dapi和ucnps-ab-rbha成像,如图12所示,双光子显微镜照射下,胆管类器官和肝实质类器官均有较强的细胞核dapi荧光发射(420nm发射),但由于只有肝实质类器官够更高效地表达和分泌白蛋白,故只有肝实质类器官组在980nm激发,
560nm发射检测处有较强的荧光发射,因此,实验结果表明检测剂可以用于类器官特异性白蛋白检测。
191.在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
192.尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1