一种胰腺癌循环肿瘤细胞检测试剂盒及其应用方法与流程
1.本发明属于循环肿瘤细胞检测领域,尤其涉及一种胰腺癌循环肿瘤细胞检测试剂盒及其应用方法。
背景技术:
2.肿瘤是一类严重威胁人类健康,具有高发病率和高死亡率的疾病。胰腺癌是一种恶性程度极高的消化系统肿瘤,由于早期无明显症状、疾病进展快及化疗有效率低,患者预后极差。
3.循环肿瘤细胞(circulating tumor cell,ctc)可对多种肿瘤细胞展开分析,可先于影像学诊断发现微小病灶,目前已成为多种肿瘤疾病进展浸润及不良预后判断的重要依据。循环肿瘤细胞在肿瘤早期诊断、个体化治疗/疗效评估及肿瘤转移机制研究等方面具有重要价值。然而由于其在人体循环系统中所占比例极低,循环肿瘤细胞的分离和鉴定成为临床应用的难点。循环肿瘤细胞的异质性使得传统的依赖上皮特异性抗原表达来鉴定ctc的方法应用受到限制,只能检测到epcam阳性的细胞,无法检测epcam阴性的细胞。流式细胞法(flow cytometry,fcm)是基于荧光标记的单克隆抗体与细胞表面的特定抗原结合的原理,通过流式细胞仪对细胞进行分析的方法。流式细胞分析法的检测速度快,可实现肿瘤细胞的定量检测,还可对同一个细胞做多参数分析。
4.微流控芯片是一种技术先进的ctcs分离方法,能够单独操作和处理细胞,并精确捕获混合物中的稀有细胞,能够高效地从血液中分离活的癌细胞。微流控芯片管道可依据细胞大小来设计,也可利用免疫磁珠连同抗体的特异性结合来分离ctcs,通过抗原抗体结合捕获的ctcs可使用胰蛋白酶将其释放。微流控芯片具有灵敏度高,成本低,设备微型等优势,且不破坏细胞形态,分离出的ctcs可用于后续的体外培养和细胞分析。
5.现有技术中,缺少能够检测胰腺癌循环肿瘤细胞的试剂盒,不利于胰腺癌早期诊断、病理分型、病程分期及疗效评估。
技术实现要素:
6.本发明的目的在于:提供一种胰腺癌循环肿瘤细胞检测试剂盒及其应用方法,可用于检测胰腺癌循环肿瘤细胞,具有较高的敏感性和特异性,捕获分离出的细胞保持完整性,可用于后续的细胞分析,便于胰腺癌早期诊断、病理分型、病程分期及疗效评估。
7.为了实现上述目的,一方面,本发明提供了一种胰腺癌循环肿瘤细胞检测试剂盒,包括:微流控芯片、生物素标记的抗体、抗体稀释液、样本稀释液、细胞固定液、细胞通透液和细胞荧光染色液,微流控芯片的结构片上有设置有纳米微阵列通道,微阵列通道上包被有链酶亲和素磁微粒。
8.作为上述技术方案的进一步描述:
9.生物素标记的抗体的组分包括含有生物素标记的鼠抗hla-g抗体、生物素标记的鼠抗ca19-9抗体和生物素标记的鼠抗ca125抗体。
10.作为上述技术方案的进一步描述:
11.抗体稀释液的组分包括tris-hcl缓冲液、牛血清白蛋白和叠氮钠。
12.作为上述技术方案的进一步描述:
13.样本稀释液为磷酸盐缓冲液。
14.作为上述技术方案的进一步描述:
15.细胞固定液为4%多聚甲醛液。
16.作为上述技术方案的进一步描述:
17.细胞通透液0.2%triton-x100。
18.作为上述技术方案的进一步描述:
19.细胞荧光染色液的组分包括含有荧光标记抗体alexa fluor 488荧光素标记的细胞角蛋白抗体、pe标记的抗人cd45抗体和核酸染料dapi。
20.另一方面,本发明还提供了一种胰腺癌循环肿瘤细胞检测试剂盒的应用方法,包括以下步骤:
21.s1、外周血单核细胞的分离
22.a)取样品10ml,放入50ml试管中,轻轻混匀;
23.b)将试管直立静置于室温或37℃温箱中,待红细胞自然沉降;
24.c)用毛细管吸取位于红细胞层上面的富含白细胞的细胞悬液,移入另一试管中;
25.d)加入无ca2+、mg2+hank’s液至离试管口3cm处,混匀,离心,弃上清,同法重复洗涤两次;
26.e)沉淀细胞用适量10%~20%灭活小牛血清的hank’s液重悬,细胞悬液作为处理后样本用于后续检测;
27.s2、捕获抗体的包被
28.a)采用样本稀释液清洗微流控芯片;
29.b)将生物素标记的抗体添加到pbs无菌缓冲液溶液中,混匀成抗体捕获工作液,用注射器将抗体捕获工作液注入到微流控芯片中,然后将微流控芯片置于湿盒中孵育;
30.c)用磷酸盐无菌缓冲液溶液清洗包被了捕获抗体的微流控芯片,除去残留在微流控芯片中的捕获抗体工作液;
31.d)封闭芯片;
32.s3、循环肿瘤细胞的捕获
33.a)用无菌样本稀释液清洗微流控芯片3次;
34.b)将上述步骤s1制备的细胞悬液用注射器注入包被完成的微流控芯片中,室温静置;
35.c)将细胞固定液用注射器注入微流控芯片,静置;
36.d)用无菌样本稀释液清洗微流控芯片;
37.s4、循环肿瘤细胞的免疫荧光染色
38.a)用无菌样本稀释液清洗微流控芯片;
39.b)将含有抗体标记的细胞荧光染色液用注射器注入微流控芯片,孵育;
40.c)用无菌样本稀释液清洗微流控芯片;
41.d)将核酸荧光染色剂注入微流控芯片,静置;
42.e)置于荧光倒置显微镜下观察。
43.综上所述,由于采用了上述技术方案,本发明的有益效果是:
44.1、本发明中,试剂盒中微流控芯片的微阵列通道上包被有链酶亲和素磁微粒,链霉亲和素是一种四聚体蛋白,可以连接更多的生物素化的分子,形成一种类似晶格的复合体,从而使反应信号放大,大大提高循环肿瘤细胞检测的灵敏度。
45.2、本发明中,试剂盒中,抗体稀释液由tris-hcl缓冲液、牛血清白蛋白和叠氮钠组成。牛血清白蛋白可以保持抗体的活性和稳定性,减少非特异性结合,降低非特异性的背景着色,提高循环肿瘤细胞检测实验时的特异性和灵敏度。
46.3、本发明中,微流控芯片配合生物素标记的鼠抗hla-g抗体、生物素标记的鼠抗ca19-9抗体和生物素标记的鼠抗ca125抗体以及1
×
pbs无菌缓冲液溶液配制成的抗体捕获工作液,使得捕获分离出的细胞保持完整性,可用于后续的细胞分析,便于胰腺癌早期诊断、病理分型、病程分期及疗效评估。
附图说明
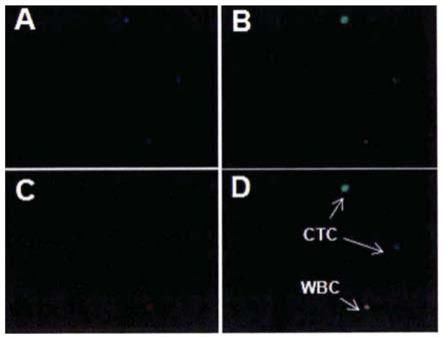
47.图1为显微镜下放大400倍的ctc细胞的荧光染色图。
48.a:dapi标记细胞核显蓝色影;b:ck18标记肿瘤细胞显绿色影;c:cd45标记白细胞,显红色影;d:显现dlpa(+)/ck18(+)/cd45(-)时,为肿瘤细胞。
具体实施方式
49.下面将更详细地描述本公开的示例性实施例。虽然显示了本公开的示例性实施例,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施例所限制。相反,提供这些实施例是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。
50.一方面,本发明提供了一种胰腺癌循环肿瘤细胞检测试剂盒,包括:微流控芯片、生物素标记的抗体、抗体稀释液、样本稀释液、细胞固定液、细胞通透液和细胞荧光染色液,微流控芯片的结构片上有设置有纳米微阵列通道,微阵列通道上包被有链酶亲和素磁微粒。
51.生物素-亲和素系统是一种具有高亲和力、灵敏度高、特异性强和稳定性好等优点的信号放大标记技术。由于微流控芯片的微阵列通道上包被有链酶亲和素磁微粒,链霉亲和素是由链霉菌分泌的一种蛋白质,是一种四聚体蛋白,可以和4个生物素分子亲密结合,可以连接更多的生物素化的分子,形成一种类似晶格的复合体,从而使反应信号放大,大大提高检测的灵敏度。
52.生物素标记的抗体是含有生物素标记的鼠抗hla-g抗体、生物素标记的鼠抗ca19-9抗体和生物素标记的鼠抗ca125抗体。人类白细胞抗原g(hla-g)是一种非典型的mhc-i类分子,具有七种蛋白异构体。hla-g作为一种免疫耐受分子,在体内能够和很多种的免疫活性细胞产生作用,从而达到减弱免疫应答的作用。生理条件下,hla-g仅表达在胎盘滋养层细胞、胸腺、角膜、指甲基质、胰腺、红细胞和内皮细胞的前体。病理条件下,hla-g可异常表达于肿瘤、病毒感染、自身免疫性疾病和单核细胞上。hla-g在大多数胰腺癌癌患者中表达,shla-g可以作为一个独立的预后因素,是一种有价值的预后指标。ca19-9是一类组成型表
达糖蛋白,在正常人和胰腺癌、胃癌等癌症患者血清中均能表达。但在正常人血清中的表达量普遍较低。ca19-9与胰腺癌相关性较高,可达到约70%,是胰腺癌中应用最广泛的一种血清学肿瘤标志物,常规用于协助诊断胰腺癌或评估其治疗效果。ca125是通过单克隆技术所证实的肿瘤相关抗原,本质是一种糖蛋白,存在于如腹膜、胸膜和心包膜等由体腔上皮衍生而来的组织中。ca125是胰腺癌、子宫内膜癌和卵巢癌的首选糖类抗原肿瘤标志物。当肠癌等其他癌症发生时其血清含量通常会上升。
53.抗体稀释液:由tris-hcl缓冲液、牛血清白蛋白和叠氮钠组成。牛血清白蛋白可以保持抗体的活性和稳定性,减少非特异性结合,降低非特异性的背景着色,提高实验的特异性和灵敏度。
54.样本稀释液为磷酸盐缓冲液。
55.细胞固定液为4%多聚甲醛液。
56.细胞通透液为0.2%triton-x100。
57.细胞荧光染色液:含有荧光标记抗体alexa fluor 488荧光素标记的细胞角蛋白抗体(alexa fluor 488-anti-ck18)、pe标记的抗人cd45抗体(pe-anti-cd45)和一种核酸染料dapi。
58.另一方面,本发明还提供了一种胰腺癌循环肿瘤细胞检测试剂盒的应用方法,具体检测步骤如下:
59.s1、外周血单核细胞的分离
60.1)取外周血10ml至加有抗凝剂50m离心管中,轻轻混匀;
61.2)将试管直立静置于室温或37℃温箱中30~60min,待红细胞自然沉降;
62.3)用毛细管吸取位于红细胞层上面的富含白细胞的细胞悬液,移入另一试管中;
63.4)加入无ca2+、mg2+hank’s液至离试管口3cm处,混匀,以水平离心机2000r/min离心10min,弃上清,同法在洗涤两次;
64.5)沉淀细胞用适量10%~20%灭活小牛血清的hank’s液重悬,制备成细胞悬液,作为处理后样本用于后续检测;
65.s2、捕获抗体的包被
66.1)采用200μl磷酸盐缓冲液清洗微流控芯片(芯片提前取出平衡至室温);
67.2)分别将生物素标记的鼠抗hla-g抗体、生物素标记的鼠抗ca19-9抗体和生物素标记的鼠抗ca125抗体添加到1
×
pbs无菌缓冲液溶液中,配制成5μg/ml浓度抗体捕获工作液。各取100μl混匀成混合抗体捕获工作液;
68.用注射器将100μl混合抗体捕获工作液注入到芯片中,然后将芯片置于湿盒中,4℃孵育过夜;在整个孵育过程中,确保所有芯片流道内始终覆盖着抗体捕获工作液;
69.3)用200μl的1
×
pbs无菌缓冲液溶液清洗包被了捕获抗体的芯片3次,除去残留在芯片中的捕获抗体工作液;
70.4)封闭芯片,用5%bsa溶液27℃封闭芯片2小时,芯片上捕获抗体的包被完成;
71.s3、循环肿瘤细胞的捕获
72.1)用无菌磷酸盐缓冲液清洗芯片3次;
73.2)将上述制备的细胞悬液用注射器注入包被完成的芯片中,室温静置30min;
74.3)用无菌磷酸盐缓冲液清洗芯片3次;
75.s4、循环肿瘤细胞的免疫荧光染色
76.1)用200μl 1
×
pbs无菌磷酸盐缓冲液清洗芯片3次;
77.2)将200μl 4%多聚甲醛液用注射器注入芯片,静置2小时,以固定捕获在芯片上的细胞;
78.3)用200μl 1
×
pbs无菌磷酸盐缓冲液清洗芯片3次;
79.4)将200μl 0.2%triton-x100用注射器注入芯片,透化细胞;
80.5)将200μlalexa fluor 488荧光素标记的细胞角蛋白抗体(alexa fluor488-anti-ck18)、pe标记的抗人cd45抗体(pe-anti-cd45)抗体标记的细胞荧光染色液用注射器注入芯片,孵育2小时;
81.7)用200μl 1
×
pbs无菌磷酸盐缓冲液清洗芯片3次;
82.8)将200μl dapi荧光染色剂用注射器注入芯片,静置15min;
83.9)置于荧光倒置显微镜下观察,记录荧光染色图像(参见附图1),并进行分析。
84.结果
85.用dapi、alexa fluor 488标记的抗细胞角蛋白(ck)、alexa fluor555标记的抗cd45进行三色免疫荧光染色,认定ctcs的阳性标准是dapi阳性、ck阳性、cd45阴性。而白细胞的阳性标准是dapi阳性,ck阴性和cd45阳性。实验结果显示:检测的肿瘤细胞染色结果为阳性,可以检测出肿瘤细胞。
86.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1