禽流感病毒感染与疫苗免疫鉴别诊断检测卡及制备方法
1.本发明属于生物检测技术领域,具体的说,涉及禽流感病毒感染与疫苗免疫鉴别诊断检测卡及制备方法。
背景技术:
2.禽流感(avian influenza,ai)是由正粘病毒科a型流感病毒引起的禽类高度接触性传染病,有16个ha亚型和10个na亚型,过去在民间称为“鸡瘟”,国际兽疫局将其定为甲类传染病,是养禽业毁灭性疾病之一,该病不仅不仅给全球养禽业造成了巨大的经济损失,而且能感染人类,给公共卫生安全造成了极大的威胁。
3.目前,有效控制禽流感的方法之一是疫苗接种,有效评价免疫效果的一个指标就是检测免疫后的抗体水平,但是野毒感染后期也会诱导抗体产生;另外,由于禽流感血清亚型众多,各亚型之间交叉保护很低,因此存在免疫禽群继续感染异型毒株的现象,给鉴别诊断该病是野毒感染还是疫苗免疫带来了很大困扰,因此,有效区分自然感染产生的抗体与免疫接种产生的抗体非常重要。
4.鸡群在感染禽流感病毒的早期细胞核内存在大量ns1蛋白,在感染的晚期,在胞浆中也会出现ns1蛋白,它可以刺激机体产生ns1非结构蛋白抗体,但在成熟的病毒颗粒中没有发现该蛋白的存在,野毒感染的鸡体内由于存在病毒的繁殖、复制,通常会出现大量ns1蛋白,从而诱导抗体产生。
5.而应用疫苗免疫后,在鸡体中则不会出现ns1蛋白抗体或出现极低含量的ns1蛋白抗体,所以ns1蛋白及其抗体可以作为禽流感病毒感染机体的一个重要标记。
6.目前,传统的血清学实验方法,如血凝和血抑实验(ha
‑
hi)、琼脂扩散实验(agp)只能检测免疫后的抗体水平,不能鉴别自然感染鸡群与免疫接种鸡群;虽然也有鉴别禽流感感染和疫苗免疫的酶联免疫吸附试验(elisa)方法的报道,但是elisa方法操作繁琐、耗时长、需要精密仪器设备、对操作人员要求较高,在实际应用中具有局限性。
7.免疫层析法中又以胶体金方法是最常见的,但是胶体金的烧制容易出现颗粒不均匀的现象,导致产品质量不稳定,均一性差。
技术实现要素:
8.本发明要解决的主要技术问题是提供一种禽流感病毒感染与疫苗免疫鉴别诊断检测卡及制备方法,该鉴别诊断检测卡能够区分禽流感病毒感染鸡群和疫苗免疫鸡群,并且能够解决传统的胶体金试纸条制备过程中胶体金的烧制容易出现颗粒不均匀的现象导致产品质量不稳定,均一性差的问题。
9.为解决上述技术问题,本发明提供如下技术方案:禽流感病毒感染与疫苗免疫鉴别诊断检测卡,包括外壳和配套使用的样品稀释液,外壳内装配有试纸条,试纸条包括pvc底板,pvc底板上黏贴有样品垫、标记垫、包被膜和吸水垫,其特征在于:标记垫为玻璃纤维素膜,包被有鼠抗鸡igg单克隆抗体与乳胶微球的
偶联标记物;包被膜为硝酸纤维素膜,包被膜上涂设有一条包被有纯化的禽流感ns1蛋白的检测线和一条包被有纯化的重组链球菌g蛋白的质控线。
10.以下是本发明对上述技术方案的进一步优化:样品稀释液包括基液,基液中加入有质量百分数为1%的蔗糖和0.05%的nan3,基液中还加入有体积百分数为0.3%的tween
‑
20;基液为pbs溶液,pbs溶液的浓度为0.01mol/l,pbs溶液的ph为7.2。
11.进一步优化:外壳上开设有观察窗和加样孔,试纸条装配在外壳内后,包被膜位于观察窗位置处、样品垫位于加样孔位置处,外壳上设置有标记:“c”和“t”,标记“c”与质控线相对应,标记“t”与检测线相对应。
12.本发明还公开了禽流感病毒感染与疫苗免疫鉴别诊断检测卡的制备方法,包括如下步骤:s1、乳胶微球的处理:乳胶微球清洗液中加入有质量百分数为0.1%的乳胶微球,在2~8℃条件下离心15分钟,离心速度为13000 r/min,弃上清,沉淀物中加入有与乳胶微球清洗液相同体积的清洗液重悬,重复清洗1次,悬浮后的乳胶微球溶液中,先加入浓度为20mg/ml的nhs,再加入浓度为20mg/ml的edc,nhs与悬浮后的乳胶微球溶液的体积比为1:20;edc与悬浮后的乳胶微球溶液的体积比为1:100;而后进行震荡15分钟,震荡速度为140~150 r/min,震荡完成后在2~8℃的条件下进行离心15分钟,离心速度为13000 r/min,弃上清,沉淀完成后加入原乳胶微球清洗液体积的乳胶微球保存液重悬,乳胶微球的平均直径为100nm;s2、蛋白标记:在处理好的乳胶微球中按乳胶微球质量的1/10加入鼠抗鸡igg单克隆抗体,并且在室温环境下进行震荡1小时,震荡速度为140~150 r/min,震荡完成后加入原乳胶微球清洗液1/10体积的封闭液,在室温环境下进行震荡30分钟,震荡速度为140~150 r/min;震荡完成后,在2~8℃的条件下进行离心15分钟,离心速度为13000 r/min,弃上清,沉淀加入原乳胶微球清洗液2倍体积的复溶液复溶;s3、标记垫的制备:标记垫为玻璃纤维素膜,将步骤s2中复溶后的蛋白溶液在玻璃纤维素膜上进行铺垫,而后在37℃的室温中干燥2小时,即得到标记垫。
13.以下是本发明对上述技术方案的进一步优化:该制备方法还包括:s4、包被膜的制备:选择硝酸纤维素膜作为包被膜,分别将纯化的ns1蛋白和重组链球菌g蛋白用划膜液稀释至浓度均为1mg/ml,获得纯化的ns1蛋白稀释液和重组链球菌g蛋白稀释液,纯化的ns1蛋白稀释液用于检测线的划线;重组链球菌g蛋白稀释液用于质控线的划线;采用三维划膜喷金仪以1μl/cm的浓度在硝酸纤维素膜上进行划线,而后在37℃的环境中干燥2小时获得包被膜。
14.进一步优化:该制备方法还包括:s5、样品稀释液制备:样品稀释液的配方包括:基液中加入有质量百分数为1%的蔗糖和0.05%的nan3,基液中还加入有体积百分数为0.3%的tween
‑
20;基液为pbs溶液,pbs溶液的浓度为0.01mol/l,pbs溶液的ph为7.2;s6、诊断检测卡的组装:将包被膜、标记垫、样品垫和吸水垫依次贴于pvc底板上,制得试纸条,将试纸条装入外壳中,获得禽流感病毒感染与疫苗免疫鉴别诊断检测卡;
s7、包装:将组装好的禽流感病毒感染与疫苗免疫鉴别诊断检测卡连同干燥剂装入铝箔袋中密封,贴签,而后将样品稀释液管放入外包装盒内。
15.进一步优化:乳胶微球清洗液的配方包括:ph值为6.1、浓度为25mmol/l的mes溶液,mes溶液中加入有体积百分数为0.05%的tween
‑
20。
16.进一步优化:乳胶微球保存液的配方为:ph值为6.1、浓度为25mmol/l的mes溶液,mes溶液中加入有质量百分数为0.05%的nan3。
17.进一步优化:封闭液的配方包括水,水中加入有质量百分数为1.0%的bsa;复溶液的配方包括:ph值为6.5、浓度为0.01mol/l的pbs缓冲液,pbs缓冲液中加入有质量百分数为:10%的蔗糖、1%的bsa、0.05%的peg 20000和0.05%的nan3,pbs缓冲液中还加入有体积百分数为0.5%的tween
‑
20。
18.进一步优化:划膜液的配方包括:ph值为7.2、浓度为0.01mol/l的pbs缓冲液。
19.本发明采用上述技术方案,具有如下有益效果:1、本发明具有成本低廉、灵敏度较高、方便快速及无需设备仪器以及不需要专业人员的特点。
20.2.可鉴别诊断禽流感病毒感染和疫苗免疫产生的抗体,具有良好的特异性和便捷性,能很好地鉴别禽流感感染鸡群。
21.3.本发明的禽流感病毒感染与疫苗免疫鉴别诊断检测卡在制备过程中首次采用乳胶微球代替胶体金标记鼠抗鸡igg单克隆抗体,能够使禽流感病毒感染与疫苗免疫鉴别诊断检测卡的制备工艺可重复性更好,产品更加稳定、适应性更强。
22.下面结合附图和实施例对本发明进一步说明。
附图说明
23.图1为本发明实施例1的总体结构示意图;图2为本发明实施例1中诊断检测卡的结构示意图;图3为本发明实施例1中诊断检测卡在使用时强阳性结果判定图;图4为本发明实施例1中诊断检测卡在使用时弱阳性结果判定图;图5为本发明实施例1中诊断检测卡在使用时阴性结果判定图;图6为本发明实施例1中诊断检测卡在使用时只有检测线显示的无效结果判定图;图7为本发明实施例1中诊断检测卡在使用时无效结果判定图;图8为本发明实施例2中不同标记ph值的检测结果;图9为本发明实施例3中不同蛋白标记量的检测结果;图10为本发明实施例4中不同封闭液配方的检测结果;图11为本发明实施例5中最佳复溶液的选择结果;图12为本发明实施例6中不同划膜液配方的检测结果;图13为本发明实施例7中敏感性的检测结果;图14为本发明实施例8中特异性检测结果;图15为本发明实施例9中对未免疫过禽流感疫苗而发生禽流感的30份血清的检测结果;图16为本发明实施例9中对免疫过禽流感疫苗的20份血清的检测结果。
24.图中:1
‑
样品垫;2
‑
pvc底板;3
‑
标记垫;4
‑
检测线;5
‑
质控线;6
‑
包被膜;7
‑
吸水垫;8
‑
外壳;81
‑
观察窗;82
‑
加样孔。
具体实施方式
25.实施例1:请参阅图1
‑
2,禽流感病毒感染与疫苗免疫鉴别诊断检测卡,包括外壳8和配套使用的样品稀释液,所述外壳8内装配有试纸条。
26.所述试纸条包括pvc底板2,所述pvc底板2上由pvc底板2的一侧向另一次依次黏贴由样品垫1、标记垫3、包被膜6和吸水垫7。
27.所述包被膜6为硝酸纤维素膜。
28.在本实施例中,所述包被膜6采用sartorius公司生产的型号为cn140的硝酸纤维素膜。
29.所述包被膜6上涂设有检测线4和质控线5,所述检测线4涂设在靠近标记垫3的位置处,所述质控线5涂设在靠近吸水垫7的位置处。
30.所述检测线4上包被有纯化的禽流感ns1蛋白,所述质控线5上包被有纯化的重组链球菌g蛋白。
31.所述标记垫3为玻璃纤维素膜,包被有鼠抗鸡igg单克隆抗体与乳胶微球的偶联标记物。
32.在本实施例中,所述标记垫3采用型号为8964的玻璃纤维素膜,由上海捷宁生物科技有限公司生产,可由市面上直接购买获得。
33.在本实施例中,禽流感ns1蛋白、重组链球菌g蛋白和鼠抗鸡igg单克隆抗体均由“洛阳佰奥通实验材料中心”生产的,且均能够在市面上购买的获得。
34.所述外壳8上靠近试纸条的包被膜6的位置处开设有观察窗81。
35.所述试纸条装配在外壳8内后,所述包被膜6位于观察窗81位置处。
36.所述外壳8上位于观察窗81的两侧分别设置有标记:“c”和“t”,所述标记“c”与质控线5相对应,所述标记“t”与检测线4相对应。
37.所述外壳8上靠近试纸条的样品垫1的位置处开设有加样孔82。
38.所述试纸条装配在外壳8内后,所述样品垫1位于加样孔82位置处。
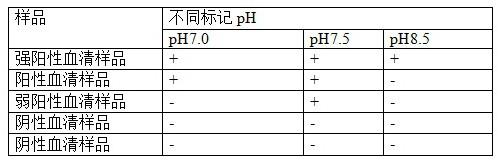
39.所述样品稀释液包括基液,基液中加入有质量百分数为1%的蔗糖和0.05%的nan3,基液中还加入有体积百分数为0.3%的tween
‑
20;所述基液为pbs溶液,所述pbs溶液的浓度为0.01mol/l,所述pbs溶液的ph为7.2。
40.本发明还公开了禽流感病毒感染与疫苗免疫鉴别诊断检测卡的制备方法,该制备方法包括如下步骤:s1、乳胶微球的处理:在乳胶微球清洗液中加入有质量百分数为0.1%的乳胶微球,在环境温度为2~8℃条件下进行离心工序,采用离心机进行离心,所述离心速度为13000 r/min,离心时间为15分钟,弃上清,沉淀物中加入有与乳胶微球清洗液相同体积的清洗液重悬,重复清洗1次。
41.在上述悬浮后的乳胶微球溶液中,先加入浓度为20mg/ml的nhs(n
‑
羟基丁二酰亚胺)溶液,再加入浓度为20mg/ml的edc(1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酸氢二亚胺盐酸盐)溶液,nhs与悬浮后的乳胶微球溶液的体积比为1:20;edc与悬浮后的乳胶微球溶液的体积
比为1:100。
42.而后在室温环境下进行震荡,所述震荡速度为140~150 r/min,振荡时间为15分钟。
43.震荡完成后在环境温度为2~8℃的条件下进行离心工序,采用离心机进行离心,所述离心速度为13000 r/min,离心时间为15分钟,弃上清,沉淀完成后加入原乳胶微球清洗液体积的乳胶微球保存液重悬。
44.所述步骤s1中,乳胶微球清洗液的配方包括:ph值为6.1、浓度为25mmol/l的mes溶液(2
‑
(n
‑
吗啡啉)乙磺酸溶液),mes溶液中加入有体积百分数为0.05%的tween
‑
20。
45.所述步骤s1中,乳胶微球保存液的配方为:ph值为6.1、浓度为25mmol/l的mes溶液,mes溶液中加入有质量百分数为0.05%的nan3。
46.所述步骤s1中,乳胶微球的平均直径为100nm。
47.s2、蛋白标记:在处理好的乳胶微球中按乳胶微球质量的1/10加入鼠抗鸡igg单克隆抗体,并且在室温环境下进行初次震荡,初次震荡速度为140~150 r/min,初次振荡时间为1小时,初次震荡完成后加入原乳胶微球清洗液1/10体积的封闭液,而后在室温环境下进行二次震荡,二次震荡速度为140~150 r/min,二次震荡速度为30分钟。
48.二次震荡完成后,在环境温度为2~8℃的条件下进行离心工序,采用离心机进行离心,所述离心速度为13000 r/min,离心时间为15分钟,弃上清,沉淀加入原乳胶微球清洗液2倍体积的复溶液复溶。
49.所述步骤s2中,乳胶微球与标记用的鼠抗鸡单克隆抗体的质量比为10:1。
50.所述步骤s2中,封闭液的配方包括水,水中加入有质量百分数为1.0%的bsa(牛血清白蛋白)。
51.所述步骤s2中,乳胶微球清洗液体积与封闭液的体积比为10:1。
52.所述步骤s2中,复溶液的配方包括:ph值为6.5、浓度为0.01mol/l的pbs缓冲液,pbs缓冲液中加入有质量百分数为:10%的蔗糖、1%的bsa、0.05%的peg 20000和0.05%的nan3,pbs缓冲液中还加入有体积百分数为0.5%的tween
‑
20。
53.所述步骤s2中,所述乳胶微球清洗液体积与复溶液的体积比为1:2。
54.s3、标记垫的制备:所述标记垫为玻璃纤维素膜8964,将步骤s2中复溶后的蛋白溶液在玻璃纤维素膜8964上进行铺垫,而后放置在37℃的室温中干燥2小时,即得到标记垫3,所述标记垫3密封于锡箔袋内,常温保存备用。
55.s4、包被膜的制备:选择硝酸纤维素膜作为包被膜6,分别将纯化的ns1蛋白和重组链球菌g蛋白用划膜液稀释,获得纯化的ns1蛋白稀释液和重组链球菌g蛋白稀释液,所述纯化的ns1蛋白稀释液和重组链球菌g蛋白稀释液的浓度均为1mg/ml。
56.所述纯化的ns1蛋白稀释液用于检测线4(t线)的划线;重组链球菌g蛋白稀释液用于质控线5(c线)的划线;采用三维划膜喷金仪依次将纯化的ns1蛋白稀释液和重组链球菌g蛋白稀释液以1μl/cm的浓度在硝酸纤维素膜上进行检测线4(t线)和质控线5(c线)的划线。
57.划线完成后进行烘干工序,所述烘干温度为37℃,所述时间为2小时,经烘干完成后获得包被膜6,将包被膜6密封于锡箔袋内,常温保存备用。
58.所述步骤s4中,三维划膜喷金仪的型号为hm3030。
59.所述步骤s4中,划膜液的配方包括:ph值为7.2、浓度为0.01mol/l的pbs缓冲液。
60.所述纯化的ns1蛋白稀释液用于划线检测线4,使检测线4上包被有纯化的禽流感ns1蛋白。
61.所述重组链球菌g蛋白稀释液用于划线质控线5,使质控线5上包被有纯化的重组链球菌g蛋白。
62.s5、样品稀释液制备:样品稀释液的配方包括基液,基液中加入有质量百分数为1%的蔗糖和0.05%的nan3,基液中还加入有体积百分数为0.3%的tween
‑
20。
63.所述基液为pbs溶液,所述pbs溶液的浓度为0.01mol/l,所述pbs溶液的ph为7.2。
64.所述稀释液制备完成后,将稀释液装入稀释液管中。
65.在本实施例中,所述样品稀释液的具体配方为:ph值为7.2、浓度为0.01mol/l的pbs溶液100ml,pbs溶液中加入1g的蔗糖、0.3ml的tween
‑
20和0.05g的 nan3。
66.s6、试纸条的组装:将包被膜6、标记垫3、样品垫1、吸水垫7依次贴于pvc底板2上,而后采用切条机进行切条,获得试纸条,将试纸条装入外壳8中,获得禽流感病毒感染与疫苗免疫鉴别诊断检测卡。
67.s7、包装:将组装好的禽流感病毒感染与疫苗免疫鉴别诊断检测卡连同干燥剂装入铝箔袋中密封,贴签,而后将样品稀释液管放入外包装盒内。
68.本发明还公开了禽流感病毒感染与疫苗免疫鉴别诊断检测卡的使用方法,该使用方法的具体步骤如下:(1)在鸡身上采取血清,将该血清装入一次性滴管中,采用一次性滴管向稀释液管中滴加2
‑
3滴血清,搅拌均匀后,取混合液进行检测。
69.所述步骤(1)中:样品若不能立即检测,应避光冷藏保存,超过24小时,应冷冻保存;样品再次检测前需恢复至室温。
70.(2)将未开封的禽流感病毒感染与疫苗免疫鉴别诊断检测卡和检测样品恢复至室温。
71.(3)将禽流感病毒感染与疫苗免疫鉴别诊断检测卡水平放置,用滴管向禽流感病毒感染与疫苗免疫鉴别诊断检测卡加样孔82缓慢逐滴加入4
‑
5滴不含气泡的检测液。
72.(5)加样品液后,红色的液体从靠近加样孔82的观察窗81边缘涌出,朝另一方向流动。
73.(6)5
‑
10分钟判断结果,10分钟后的结果仅作参考。
74.结果判断:如图3
‑
图7所示,阳性:质控线5显示红色色带,检测线4也显示红色色带,无论颜色深浅均判为阳性。
75.阴性:质控线5显示红色色带,检测线4不显示红色色带,判为阴性。
76.无效:质控线5不显示红色色带,无论检测线4是否显示红色色带,该禽流感病毒感染与疫苗免疫鉴别诊断检测卡均判为无效。
77.实施例2:在上述实施例1中,最佳蛋白标记ph值的确定:在乳胶微球的蛋白标记过程中,分别采用ph值为7.0、7.5和8.0的mes进行标记,比较不同ph值对禽流感病毒感染与疫苗免疫鉴别诊断检测卡特异性和敏感性的影响,从而确定最佳蛋白标记的ph值,实验结构如下表和图8所示。
78.下表为不同标记ph值的实验效果:
上表中,“+”表示阳性;
“‑”
表示阴性。
79.根据上表和图8可以看出,ph值为7.5时禽流感病毒感染与疫苗免疫鉴别诊断检测卡检测线敏感性较好,检测线显色较好,ph值为7.0和 ph值为8.0时敏感性较差,均有假阴性出现,因此根据实验结果选择标记ph值为7.5。
80.实施例3:在上述实施例1中,最佳蛋白标记量的选择:在乳胶微球的蛋白标记过程中,分别采用标记蛋白与乳胶微球质量比例为1:15、1:10、1:5的鼠抗鸡igg单克隆抗体进行标记,实验结构如下表和图9所示。
81.下表为不同蛋白标记量的实验效果:上表中,“+”表示阳性;
“‑”
表示阴性。
82.根据上表和图9可以看出,标记蛋白与乳胶微球质量比例为1:15时,敏感性较差,检测线显色较弱;1:10时敏感性和特异性均较好,1:5时禽流感病毒感染与疫苗免疫鉴别诊断检测卡显色效果较1:10时无明显变化,因此根据实验结果最终选择标记蛋白与乳胶微球质量比例为1:10。
83.实施例4:在上述实施例1中,最佳封闭液配方的选择:采用终浓度为0.5%、1.0%、1.5%bsa作为封闭液对标记蛋白后的乳胶微球进行封闭,实验结构如下表和图10所示。
84.下表为:不同封闭液配方的实验效果:
上表中,“+”表示阳性;
“‑”
表示阴性。
85.根据上表和图10可以看出,bsa终浓度为0.5%时,特异性较差,有假阳性出现;bsa终浓度为1%时敏感性和特异性均较好;bsa终浓度为1.5%时敏感性相对较差,检测线显色较弱,因此根据实验结果最终选择bsa终浓度为1.0%。
86.实施例5:在上述实施例1中,最佳复溶液的选择:采用不同复溶液进行复溶,复溶液配方如下表所示,根据不同复溶液配方对禽流感病毒感染与疫苗免疫鉴别诊断检测卡特异性和敏感性的影响,确定最佳复溶液配方。
87.下表为不同复溶液的配方:不同复溶液配方对禽流感病毒感染与疫苗免疫鉴别诊断检测卡特异性和敏感性的影响,实验结构如下表和图11所示。
88.下表为:不同复溶液的实验结果:上表中,“+”表示阳性;
“‑”
表示阴性。
89.根据上表和图11可以看出,从特异性方面来看,4组复溶液均无假阳性出现;从敏感性方面来看,复溶液2敏感性最高,检测线显色最好,所以,最终选用复溶液2,作为本产品的最终复溶液。
90.实施例6:包被膜的制备:选择硝酸纤维素膜作为包被膜6,分别将纯化的ns1蛋白和重组链球菌g蛋白用划膜液稀释至浓度均为1mg/ml ,分别用于检测线4(t线)和质控线5(c线)划线,采用xyz三维划膜喷金仪依次以1μl/cm的浓度在硝酸纤维素膜上进行检测线4(t线)和质控线5(c线)的划线,37℃烘干包被2小时,即得到包被膜6,包被膜6密封于锡箔袋内,常温保存备用。
91.(1)最佳划膜液配方的选择:采用不同的划膜液配方(如下表所示),将ns1蛋白稀释至1.0mg/ml,用于检测线4(t线)的划线,将重组链球菌g蛋白稀释至1.0mg/ml用于质控线(c线)的划线,根据不同划膜液配方对检测特异性和敏感性的影响,确定最佳划膜液配方。
92.下表为3种不同划膜液的配方:
不同划膜液配方对检测特异性和敏感性的影响,实验结构如下表和图12所示。
93.下表为:不同划膜液的实验结果:上表中:“+”表示阳性;
“‑”
表示阴性。
94.根据上表和图12可以看出,待选的3种缓冲体系中pbs缓冲体系敏感性相对于pbst缓冲液体系和tris缓冲液体系的敏感性和特异性均较好,其中,tris缓冲液体系敏感性较差,检测线显色较弱;pbst缓冲体系特异性较差,有假阳性出现,因此,最终选择的ph值为7.2的pbs(0.01mol/l)作为最佳划膜液配方。
95.实施例7:敏感性检测:对禽流感病毒血清样品依次进行:1:2、1:4、1:8...1:512倍稀释,而后采用本发明的禽流感病毒感染与疫苗免疫鉴别诊断检测卡进行检测,检测结构如下表和图13所示。
96.下表为:敏感性测定结果:上表中:“+”表示禽流感病毒抗体阳性,
“‑”
表示禽流感病毒抗体阴性。
97.据上表和图13可以看出,血清样品1:128倍稀释时检测结果均为阳性。
98.实施例8:特异性试验:采用本发明的禽流感病毒感染与疫苗免疫鉴别诊断检测卡对免疫禽流感的鸡血清(h9 vaccine)、传染性支气管炎病毒阳性血清(ibv)、传染性法氏囊病毒阳性血清(ibdv)、新城疫病毒阳性血清(ndv)、大肠杆菌培养液(e.coli)进行检测,检测结构如下表和图14所示。
99.下表为:特异性检测结果:
上表中:
“‑”
表示禽流感病毒抗体阴性。
100.跟据上表和图14可以看出,本发明的禽流感病毒感染与疫苗免疫鉴别诊断检测卡对:h9 vaccine、ibv、ibdv、ndv和e.coli的检测结构均为阴性,因此该禽流感病毒感染与疫苗免疫鉴别诊断检测卡能够满足特异性要求。
101.实施例9:批间试验:采用本发明的禽流感病毒感染与疫苗免疫鉴别诊断检测卡对未免疫过禽流感疫苗而发生禽流感的鸡场采集的30份血清(编号:s1~s30)和免疫过禽流感疫苗鸡场采集的20份血清(编号:v1~v20)进行检测,检测结构如下方的两个表格和图15
‑
16所示。
102.下表为:对未免疫过禽流感疫苗而发生禽流感的鸡场采集的30份血清的检测结果:上表中:+”表示禽流感抗体阳性。
103.下表为:对免疫过禽流感疫苗鸡场采集的20份血清的检测结果:
上表中:“+”表示禽流感抗体阳性,
“‑”
表示禽流感抗体阴性。
104.跟据上表和图14可以看出,未免疫过禽流感疫苗而发生禽流感的鸡场采集的30份血清检测结果均为阳性,即阳性检出率为100%(30/30),免疫过禽流感疫苗鸡场采集的20份血清,阳性检出率为20%(4/20)。
105.对于本领域的普通技术人员而言,根据本发明的教导,在不脱离本发明的原理与精神的情况下,对实施方式所进行的改变、修改、替换和变型仍落入本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1