一种快速检测血浆中甲状腺球蛋白浓度的方法与流程
1.本发明属于检测分析领域,具体涉及一种快速检测血浆中甲状腺球蛋白浓度的方法。
背景技术:
2.甲状腺球蛋白thyroglobulin(tg)是甲状腺滤泡上皮细胞分泌的大分子糖蛋白,分子量约为660000,人体中tg由2767个氨基酸残基组成,为同源二聚体。血清tg水平异常与甲状腺肿瘤、甲状腺组织炎症和损伤相关,因此临床检测tg浓度有重要的意义。tg检测方法有血凝法、放免法(ria)、免放法(ima),现在常用方法是发光法测定。
3.免疫发作为临床常用tg检测方法,有很大的缺点,有些病人血清中含有tg自身抗体-血清甲状腺球蛋白抗体(tgab),会干扰血清tg浓度测定。tgab对tg测定的干扰与血清tgab浓度不成正比,干扰的程度与性质和tgab的亲和力、特异性及血清容量有关。tgab阳性时,用ima法测定的tg值偏低,引起假阴性,掩盖甲状腺癌复发和转移的病人;用ria法测定tg值容易偏高,引起假阳性。
4.液相色谱串联质谱法(lc-ms/ms)定量大分子蛋白质,需要先将蛋白质酶解成多肽小分子,选择性的检测目标蛋白的特征性多肽,来替代目标蛋白浓度的检测方法,因此lc-ms/ms可有效克服tgab带来的干扰,精确检测tg浓度。tg在生理状态下的正常浓度值为5~40ng/ml,而血浆总蛋白浓度约为70mg/ml,tg占总蛋白浓度不足0.1%。由于血浆中存在大量的高丰度蛋白,如血清白蛋白和抗体igg占血浆总蛋白的85%以上,这些高丰度蛋白酶解后的肽段严重影响tg特征肽的检测,且由于血浆样品成分异常复杂,基质效应难以克服,因此直接酶解后检测仍然存在很大困难,需要对目标蛋白特征肽进行富集,去除干扰物再进行质谱检测。
5.胰蛋白酶可特异性的识别和酶解蛋白质的一级结构,即氨基酸残基序列中精氨酸(r)和赖氨酸(k)残基的c端,尤其是对r有更高的酶解效率,形成酶解后多肽产物。胰蛋白酶酶解前需要先让蛋白变性,破坏蛋白质的空间结构,比如三级结构和四级结构,使其成为线性的一级结构,利于胰蛋白酶识别和结合酶解位点,酶解更充分。通常需要先加变性剂如sds、强酸等,使蛋白变性,加还原剂打开蛋白质上半胱氨酸间的二硫键,再加烷基化试剂封闭半胱氨酸的巯基,防止再次形成二硫键,然后再加入适量胰蛋白酶,使蛋白质彻底酶解为多肽。
6.血清蛋白酶解后需要对肽段进行纯化,比如过固相萃取小柱,去除小分子盐、磷脂、多糖和寡核苷酸等,但是固相萃取小柱不能特性纯化目标多肽。抗体可特异性的识别目的抗原,抗多肽的特异性抗体可做为富集和纯化目标多肽的手段,由于多肽小分子通常不能产生免疫反应,需要将多肽小分子与载体蛋白如klh偶联制备半抗原,再免疫动物,才能产生抗体。磁微粒偶联抗体技术及其应用,因为自动化程度高在化学发光领域应用已经非常成熟,但是在lc-ms/ms尚缺乏使用案例。
7.因此建立基于抗体偶联磁微技术富集和纯化目标蛋白特征肽的lc/ms-ms方法显
得尤为重要和迫切,使得tg检测方法更精确和自动化,成为临床中重要检测手段。
技术实现要素:
8.为了解决上述问题,本发明提供了一种快速检测血浆中甲状腺球蛋白浓度的方法,本发明通过胰蛋白酶酶解血清总蛋白,得到含有甲状腺球蛋白特征性多肽的血清总蛋白胰蛋白酶酶解肽段混合物,抗甲状腺球蛋白特征肽抗体偶联磁微粒自动化富集纯化血清中的tg特征性多肽,利用超高效液相色谱串联质谱法快速测定血清中的tg浓度。
9.为了实现上述目的,本发明采用以下技术方案:
10.一种快速检测血浆中甲状腺球蛋白浓度的方法,包括以下步骤:
11.1)设计并合成tg特征性多肽lr12及lr12内标,将lr12与载体蛋白偶联制备半抗原,并得到抗lr12的多克隆抗体,抗lr12的多克隆抗体与磁微粒偶联得到可富集tg特征性多肽lr12的抗体偶联磁微粒;
12.2)建立分析lr12和lr12内标的液相色谱和质谱方法,得到甲状腺球蛋白标准曲线;
13.3)取血清样品,加入步骤1)得到的lr12内标,经变性,开键,烷基化酶解得到用于液相色谱串联质谱检测的酶解物;
14.4)通过步骤1)得到的抗体偶联磁微粒富集步骤3)得到的酶解物,进质谱仪进行分析;
15.5)步骤4)得到的分析数据通过标准曲线计算得到血清tg浓度。
16.作为本发明的一种优选方案,步骤1)中tg特征性多肽lr12如seq id no.1所示。
17.在本发明中,根据甲状腺球蛋白(tg)氨基酸序列,选择特征肽,要求:(1)不含有甲硫氨酸(m)和半胱氨酸(c),因为这两个氨基酸容易发生氧化,影响后续质谱鉴定;(2)选择精氨酸为c端、n端之前氨基酸为精氨酸的多肽,因为在后续蛋白质酶解用的是胰蛋白酶,可以高效且特异性的在蛋白质的精氨酸c端酶解,将蛋白质酶解成多肽;(3)经过uniprot数据库的peptide search进行序列比对,确认是否是tg的特征肽。最终选择的氨基酸序列为:亮氨酸—丙氨酸—丙氨酸—谷氨酰胺—丝氨酸—苏氨酸—亮氨酸—丝氨酸—苯丙氨酸—酪氨酸—谷氨酰胺—精氨酸,单字母缩写序列为:laaqstlsfyqr(缩写lr12)作为人tg的特征肽。化学合成lr12多肽,同时合成:亮氨酸—丙氨酸—丙氨酸—谷氨酰胺—丝氨酸—苏氨酸—亮氨酸—丝氨酸—苯丙氨酸—酪氨酸—谷氨酰胺—精氨酸(用6个碳13,4个氮15标记),单字母缩写序列为:laaqstlsfyqr(13c6,15n4)的稳定同位素多肽,作为lr12的内标肽段(简写lr12内标)。lr12与载体蛋白klh偶联制备半抗原,免疫兔子得到多克隆抗体。
18.作为本发明的一种优选方案,步骤1)中,所述lr12内标为使用同位素标记合成,其中同位素为碳13与氮15。
19.作为本发明的一种优选方案,步骤1)中,抗体偶联磁微粒的制备方法为:
20.1)抗体溶液预处理:使抗体保存液置换为pbs缓冲液;
21.2)磁珠预处理:取羧基磁微粒混合均匀,磁性分离去除上清液;加入去离子水,混合均匀,磁性分离去除上清液,再重复2次;加入pbs重悬磁微粒,磁性分离去除上清液,再重复2次;
22.3)抗体与磁微粒偶联:加入步骤2)得到的pbs重悬磁微粒,加入步骤1)得到的抗
体,室温旋转混合;加入碳化二亚胺溶液,补充pbs使体系到总体积为1000μl,室温涡旋偶联1~3hr,磁性分离去除上清液;加入淬灭缓冲液重悬磁微粒,涡旋混合,磁性分离去除上清液;加入pbs,混合重悬磁微粒,磁性分离去除上清液,再重复2次;并将抗体偶联磁微粒保存在10%甲醇90%水溶液中,使得抗体偶联磁微粒浓度达到1mg/ml。
23.作为本发明的一种优选方案,步骤2)中,甲状腺球蛋白标准曲线的浓度依次为5ng/ml,10ng/ml,25ng/ml,50ng/ml,75ng/ml与100ng/ml。
24.作为本发明的一种优选方案,步骤3)具体为:在血清样品或定标曲线样品中加入pbs配制的lr12内标,再加入变性剂,加入二硫苏糖醇60℃还原,打开蛋白质半胱氨酸间中的二硫键;恢复室温后加入碘乙酰胺避光室温处理,使还原后的半胱氨酸烷基化;加入胰蛋白酶酶解;加入10%甲酸,混匀,waters sepakc18小柱脱盐,80%甲醇洗脱,真空浓缩干燥,得到酶解物。
25.作为本发明的一种优选方案,步骤4)具体为:在步骤3)得到的酶解物中加入90%pbs-10%甲醇溶液充分溶解,加入抗体偶联磁微粒孵育,磁吸分离弃去液体;抗体偶联磁微加入pbs洗涤,磁吸分离弃去液体,再重复洗1次;抗体偶联磁微粒加80%甲醇洗脱,磁吸分离弃去抗体偶联磁微粒,取洗脱后的肽段上质谱仪分析。
26.作为本发明的一种优选方案,液相色谱的参数为:色谱柱:waters acquity uplc beh c18 100
×
2.1mm 1.7μm;流动相a:0.1%甲酸水溶液;流动性b:0.1%甲酸乙腈溶液;流速:0.5ml/min;柱温:45℃;进样:20μl。
27.作为本发明的一种优选方案,质谱参数为:质谱型号和扫描模式:i-class waters tqs,正离子模式;毛细管电压:0.8kv;脱溶剂温度:400℃;脱溶剂气:800l/hr;锥孔气:150l/hr;扫描模式:多反应监测。
28.与现有技术相比,本发明具有以下有益效果:
29.1)本发明设计和化学合成tg特征肽laaqstlsfyqr(缩写lr12)与血蓝蛋白(klh)偶联制备半抗原,免疫兔子得到抗lr12的多克隆抗体,同时合成laaqstlsfyqr(
13
c6,
15
n4)作为内标;
30.2)tg特征性多肽lr12与磁微偶联获得能富集lr12的抗体偶联磁微粒。
31.3)将血清总蛋白经过变性和酶解为多肽小分子化合物,同时加入lr12内标全程校正实验误差,利于lc-ms/ms检测。
32.4)通过抗体偶联磁微富集酶解后的血清总蛋白多肽中的lr12及其内标,通过waters tqs液相色谱串联质谱法检测lr12。
33.5)本发明的方法可避免tgab带来的影响,准确检测血清中的tg浓度;
34.6)样品前处理操作简便,结合自动处理仪器ims1000,可实现样品前处理自动化,实验周期短,一天内可完检测。
附图说明
35.图1是本发明甲状腺球蛋白(tg)定标曲线。
具体实施方式
36.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,
显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
37.实施例1
38.本实施例提供了快速检测血浆中甲状腺球蛋白浓度的方法,包括以下步骤:
39.1)设计并合成tg特征性多肽lr12及lr12内标,将lr12与载体蛋白偶联制备半抗原,并得到抗lr12的多克隆抗体,抗lr12的多克隆抗体与磁微粒偶联得到可富集tg特征性多肽lr12的抗体偶联磁微粒;其中,tg特征性多肽lr12如seq id no.1:laaqstlsfyqr,即亮氨酸—丙氨酸—丙氨酸—谷氨酰胺—丝氨酸—苏氨酸—亮氨酸—丝氨酸—苯丙氨酸—酪氨酸—谷氨酰胺—精氨酸;
40.并合成:亮氨酸—丙氨酸—丙氨酸—谷氨酰胺—丝氨酸—苏氨酸—亮氨酸—丝氨酸—苯丙氨酸—酪氨酸—谷氨酰胺—精氨酸(用6个碳13,4个氮15标记),单字母缩写序列为:laaqstlsfyqr(
13
c6,
15
n4),作为lr12内标;
41.2)建立分析lr12和lr12内标的液相色谱和质谱方法,得到甲状腺球蛋白标准曲线;
42.3)取血清样品,加入步骤1)得到的lr12内标,经变性,开键,烷基化酶解得到用于液相色谱串联质谱检测的酶解物;
43.4)通过步骤1)得到的抗体偶联磁微粒富集步骤3)得到的酶解物,进质谱仪进行分析;
44.5)步骤4)得到的分析数据通过标准曲线计算得到血清tg浓度。
45.步骤1)中,甲状腺球蛋白特征肽多克隆抗体偶联羧基磁微粒制备为:
46.1、抗体溶液预处理:使用30kd超滤管将1mg抗体于4℃,12000g离心10min超滤,加500μl pbs,12000g离心10min超滤,重复3次,使抗体保存液置换为pbs缓冲液。
47.2、磁珠预处理:取羧基磁微粒混合均匀,取1000μl(10mg)磁微粒加入到2ml ep管中,磁力架上磁性分离去除上清液。加入去离子水,混合均匀,磁性分离去除上清液,再重复2次。加入100μl pbs重悬磁微粒,磁性分离去除上清液,再重复2次。
48.3、抗体与磁微粒偶联:加入50μl pbs重悬磁微粒,加入上述处理好的1mg抗体(提前溶于pbs),室温旋转混合30min。加入10μl现配的10mg/ml碳化二亚胺溶液,补充pbs使体系到总体积为1000μl,室温涡旋偶联1~3hr,磁性分离去除上清液。加入100μl淬灭缓冲液(50mm tris-hcl,ph7.4)重悬磁微粒,涡旋混合30min,磁性分离去除上清液。加入1000μl pbs,混合重悬磁微粒,磁性分离去除上清液,再重复2次。并将抗体偶联磁微粒保存在10%甲醇90%水溶液中,使得抗体偶联磁微粒浓度达到1mg/ml。
49.甲状腺球蛋白定标曲线配制
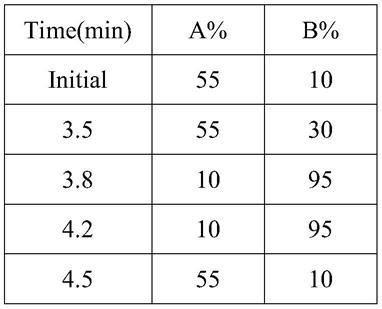
50.甲状腺球蛋白用pbs配制的5%bsa配置定标曲线,如表1所示,单位ng/ml,每管130μl封装,﹣80℃保存。
51.表1甲状腺球蛋白定标曲线浓度
52.名称标线1标线2标线3标线4标线5标线6甲状腺球蛋白510255075100
53.酶解
54.100μl血清样品或定标曲线样品、10μl pbs配制的200ng/ml lr12内标,再加100μl变性剂(8m尿素、2m硫脲、100mm碳酸氢铵),加入10mm二硫苏糖醇60℃还原10min,打开蛋白质半胱氨酸间中的二硫键。取出样品恢复室温后加入20mm碘乙酰胺避光室温处理10min,使还原后的半胱氨酸烷基化,防止半胱氨酸再次形成二硫键,影响胰蛋白酶酶解。加入200μl胰蛋白酶(6μg/ml,100mm碳酸氢铵溶解)4hr。加入40μl 10%甲酸,混匀,waters sepakc18小柱脱盐,80%甲醇洗脱,真空浓缩干燥。
55.人血浆中tg特征肽lr12富集
56.lr12和lr12内标富集通过杭州佰辰医学检验所有限公司ims1000自动化完成,减少因人为因素带来的实验误差。方法如下,取上述脱盐后的肽段加200μl 90%pbs 10%甲醇溶液充分溶解,加入30μl 1mg/ml的抗体偶联磁微粒于37℃孵育5min,磁吸分离弃去液体。抗体偶联磁微加入200μl pbs洗涤1min,磁吸分离弃去液体,再重复洗1次。抗体偶联磁微粒加100μl 80%甲醇洗脱,磁吸分离弃去抗体偶联磁微粒,取90μl洗脱后的肽段上waters tqs分析。
57.tg特征肽lr12试剂条结合ims-1000自动化操作流程
58.所用的试剂条为15孔的试剂条,其中:
59.孔1为加样孔,可加10~250μl血浆蛋白酶解后的多肽;
60.孔7为30μl 1mg/ml lr12抗体偶联磁微,用于上述酶解多肽中lr12的富集;
61.孔3、孔4、孔5为洗涤孔,每孔加200μl pbs,在抗体偶联磁微粒富集tg特征肽lr12后,用于洗涤非特异性吸附;
62.孔14为洗脱液,加150μl 80%甲醇,用于抗体偶联磁微粒上lr12的洗脱。
63.试剂条为单人份试剂条,结合杭州佰辰医学检验收有限公司的ims-1000,可自动化完成血浆蛋白酶解后多肽中甲状腺球蛋白特征肽lr12的富集。
64.操作步骤如下:试剂条中加入试剂后,孵育反应控温37℃,后续步骤ims-1000可自动化完成,ims-1000自带一次性专用吸头在孔1中吸取100μl酶解后的多肽,到孔7中吹打孵育10min;磁吸分离,将富集到lr12的抗体偶联磁微粒转移到孔3中进行洗涤,去除非特异性吸附,再依次用孔4和孔5洗涤;磁吸分离,将富集到lr12的抗体偶联磁微粒转移到孔14吸取100μl洗脱液,转移到孔15中,上下吹打混匀1min,将富集到lr12多肽从抗体偶联磁微粒上洗脱,磁吸分离,去除抗体偶联磁微粒;将洗脱后的lr12多肽转移到96孔板中,waters tqs质谱检测。
65.色谱参数
66.色谱柱:waters acquity uplc beh c18 100
×
2.1mm 1.7μm;流动相a:0.1%甲酸水溶液;流动性b:0.1%甲酸乙腈溶液;
67.液相色谱洗脱梯度见表2:
68.表2液相色谱洗脱梯度
[0069][0070][0071]
流速:0.5ml/min;柱温:45℃;进样:20μl。
[0072]
质谱参数
[0073]
质谱型号和扫描模式:i-class waters tqs,正离子模式;毛细管电压:0.8kv;脱溶剂温度:400℃;脱溶剂气:800l/hr;锥孔气:150l/hr;扫描模式:多反应监测(mrm),各化合物质谱参数见表3:
[0074]
表3甲状腺球蛋白特征肽多反应监测(mrm)质谱参数
[0075][0076]
加标回收
[0077]
选择实际病人血清作为回收实验基础样品,按照100μl低、中、高标准样品分别与900μl的基础样品混合,如表4所示,低、中和高浓度分别加入15ng/ml、50ng/ml和75ng/ml人tg蛋白。将上述“基础样品”和“实验样品”重复平行测定6次,记录实验结果并进行统计分析低、中、高3个浓度水平的加标回收情况,回收率=(检测值-基础样品值)/理论值
×
100%,85%<回收率<115%。
[0078]
表4加标回收配制表
[0079]
[0080]
精密度
[0081]
分别检测低、高2个浓度水平样品浓度,每天各进行3次重复,连续测5天,分别计算批内和批间精密度,要求批内和批间cv<15%。
[0082]
实施例2
[0083]
本实施例是实施例1的检测结果,其中,图1是甲状腺球蛋白(tg)定标曲线,表5是加标回收结果,表6是甲状腺球蛋白(tg)5天精密度的结果,具体如下:
[0084]
参见图1,定标曲线范围5~100ng/ml,r2=0.9995,符合要求(要求r2≥0.99)。
[0085]
表5加标回收结果
[0086][0087]
表6甲状腺球蛋白(tg)5天精密度
[0088][0089][0090]
由此可知,本发明的方法可避免tgab带来的影响,准确检测血清中的tg浓度,样品前处理操作简便,结合自动处理仪器ims1000,可实现样品前处理自动化,实验周期短,一天内可完检测。
[0091]
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1