一种检测谷氨酸脱羧酶抗体各亚型的试剂盒
1.本发明属于生物医药技术领域,具体涉及一种检测谷氨酸脱羧酶抗体各亚型的电化学发光法检测试剂盒。
背景技术:
2.1型糖尿病(t1dm)胰岛自身抗体包括胰岛素自身抗体(iaa)、谷氨酸脱羧酶抗体(gada)、酪氨酸磷酸酶抗体(ia2a)和锌转运体8自身抗体(znt8a),是目前t1dm胰岛β细胞自身免疫破坏的最可靠生物标志,对胰岛自身抗体进行检测有助于了解t1dm的自身免疫病程,并对t1dm患者的诊断、鉴别诊断,以及一般人群和患者一级亲属的风险预测有极大的价值。gada作为占比较高的胰岛自身抗体,在t1dm的鉴别诊断中具有特殊的地位,不仅可以揭示病人的免疫进程,还可能为病人的精准化治疗带来新的思路。
3.一直以来gada的检测都是总的抗体的检测,没有类型上的细分,但不同的抗体亚型具有不同的生物学意义,其免疫源性存在差异,因此对抗体进行进一步的细分,进行亚型的鉴定,对于疾病作用机理的研究、药物的开发具有重要意义。
技术实现要素:
4.本发明的目的是提供一种检测谷氨酸脱羧酶抗体各亚型的电化学发光法检测试剂盒,填补了分型上的空白。
5.为了实现上述目的,本发明采用以下技术方案:
6.一种检测谷氨酸脱羧酶抗体各亚型的试剂盒,包括以下试剂:谷氨酸脱羧酶抗原蛋白,sulfo-tag,生物素标记的抗ig各型的抗体和msd链霉亲和素平板。
7.进一步地,所述生物素标记的抗ig各亚型的抗体为生物素标记的抗igg1的二抗、生物素标记的抗igg2的二抗、生物素标记的抗igg3的二抗、生物素标记的抗igg4的二抗、生物素标记的抗iga的二抗、生物素标记的抗igd的二抗、生物素标记的抗igm的二抗、生物素标记的抗ige的二抗。
8.进一步地,所述试剂盒还包括阳性对照和阴性对照。
9.采用上述试剂盒检测胰岛素抗体亚型的方法,包括以下步骤:
10.步骤1,采用sulfo-tag标记谷氨酸脱羧酶抗原蛋白;
11.步骤2,将步骤1的标记抗原制成抗原缓冲液;
12.步骤3,将抗原缓冲液与待测血清混合,然后加入生物素标记的抗ig各亚型的抗体,混合后进行孵育;
13.步骤4,将步骤3的混合物置于msd链霉亲和素平板,通过msd电化学发光仪器检测发光计数,然后计算抗体指数。
14.本发明在已有ecl检测法的基础上,通过新的试剂的引入,以及原有试剂biotin标记抗原的去除,使得待测抗体与各试剂形成全新的四个蛋白质分子的聚合物,不仅可以有效联通电路,放大检测信号,还可以实现抗体亚型的精准分型。
附图说明
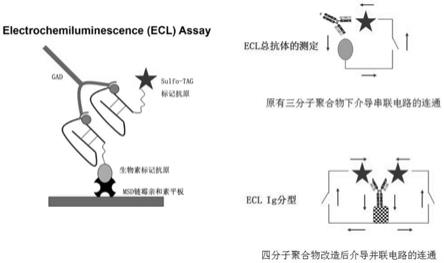
15.图1为本发明检测试剂盒的检测原理。
16.图2为ecl-gad抗体的正常人界值判定结果。
17.图3为ecl-gad抗体及rba检测gad抗体结果的roc曲线分析。
18.图4为ecl-gad抗体分型实验二抗浓度梯度实验结果。
19.图5为部分初诊糖尿病患者的ecl-gad抗体分型检测结果。
20.图6为对733名初诊糖尿病患者gad抗体分别进行的ecl及rba检测结果。
21.图7为对图6筛选出的ecl-gad阳性、rba-gad阴性的患者进行gad抗体分型结果。
具体实施方式
22.鉴于不同的抗体亚型的生物学意义,本发明在现有ecl的平台上建立了新的ecl-gad抗体检测方法,并与国际上检测谷氨酸脱羧酶抗体的金标准rba法进行了比对;同时通过核心步骤的改变建立了谷氨酸脱羧酶抗体各亚型,包括igg1、igg2、igg3、igg4、iga、igd、igm、ige的ecl分类检测方法,使谷氨酸脱羧酶抗体在方法学的检测上摆脱了同位素的限制,填补了分型上的空白。为临床难以分型的糖尿病患者提供了新的诊断参考。
23.如图1所示,常规的ecl抗体检测在于使待测抗体分子的两个轻链结合携带不同信号的抗原分子,形成包含三个蛋白质分子的聚合物,继而联通电路,获得检测信号;而本发明通过采用生物素标记的抗ig各亚型的抗体,使得待测抗体与各试剂形成了全新的四个蛋白质分子的聚合物,替换了原来的三个蛋白质分子的聚合物。新的四分子聚合物通过结构的全新改变介导了信号传导路径的改变,使检测信号得到了双倍的提升;同时实现了抗体亚型的精准分型,为临床诊疗带来了全新的提示。
24.下面结合附图和具体实施例对本发明作进一步详细说明,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件。
25.样本来源:gad阳性质控血清标本来自于发明人实验室现有的经过国际胰岛自身抗体标准化检测(iasp)国际室间认证的rba gad检测技术平台使用的强阳性混合样本,阴性质控血清标本取自于无糖尿病家族史的健康志愿者。糖尿病(dm)血清150例来自2020年iasp组织室间质评样本、733例初诊糖尿病血清来自临床收集的初次诊断为dm的病人。健康人155例来自招募人群[年龄(26.8
±
9.7)岁;男87例,女68例];糖耐量检测(ogtt)空腹及2h血糖正常,排除心、脑、肝、肾等慢性及内分泌疾病,无糖尿病家族病史及自身免疫疾病史。所有研究对象均签署知情同意。
[0026]
实施例1
[0027]
1.血清标本采集:
[0028]
所有健康对照者和糖尿病患者均采集禁食8h以上的空腹肘静脉血,分离血清后于-70℃冰箱中保存。
[0029]
2.ecl-gad检测:
[0030]
a.标记蛋白:gad抗原蛋白按摩尔比1∶20分别与3mmol/l nhs-peg4-biotin(thermo,a39259)和3mmol/l sulfo-tag(meso scale discovery,r91ao-2)混合,室
温避光孵育1h后经zeba柱(thermo,89890)纯化过滤收集于无菌离心管,即为标记后的gad-biotin和gad-sulfo-tag。
[0031]
b.抗原缓冲液准备:标记后gad-biotin和gad-sulfo-tag按800ng/ml,100ng/ml比例混合至含5%胎牛血清的1
×
磷酸盐缓冲液(phosphate buffered saline,pbs)中配成抗原缓冲液。
[0032]
c.血清与抗原缓冲液孵育:取新的96孔加样板中依次加入4μl血清/孔,双复孔,抗原缓冲液20μl/孔,16μl1
×
pbs/孔。以上加完后,离心1000rpm,1min;水平震荡rt 450rpm/min,2h;4℃过夜。
[0033]
d.次日,取30μl抗原缓冲液-待测血清复合物,转移至经3%blocker a(meso scale discovery,r93aa-1)隔夜封闭的msd链霉亲和素平板(mesoscale discovery,l15sa-1),于水平摇床450r/min室温振荡1h,含0.25%吐温20的1
×
pbs洗涤3次后拍干,加入150μl 2
×
read buffer(meso scale discovery,r92tc-1),通过msd电化学发光仪器(meso scale discovery,meso quickplex sq 120)检测发光计数。
[0034]
e.抗体指数(index)=(样本发光计数-阴参发光计数)/(阳参发光计数-阴参发光计数)。根据155例健康对照者ecl-gad指数的第99百分位点,确定阳性判断标准:ecl-gad指数≥0.01。
[0035]
3.ecl-gad各亚型的检测:
[0036]
a.抗原缓冲液准备:标记后gad-sulfo-tag按100ng/ml比例混合至含5%胎牛血清的1
×
pbs中配成抗原缓冲液。
[0037]
b.血清与抗原缓冲液孵育:新的96孔加样板中依次加入4μl血清,抗原缓冲液20μl/孔,离心1000rpm,1min;根据实验目的加入抗igg1、igg2、igg3、igg4、iga、igd、igm、ige的biotin标记的二抗(ab99775,invitrogen 05-3540,ab86252,ab99818,ab85864,ab224182,ab99745,ab99807)5μl/孔,浓度0.03125μg/μl,离心1000rpm,1min。水平震荡rt 450rpm/min,2h;4度过夜。
[0038]
c.次日,取30μl抗原缓冲液-待测血清复合物,转移至经3%blocker a隔夜封闭的msd链霉亲和素平板,于水平摇床450r/min室温振荡1h,含0.25%吐温20的1
×
pbs洗涤3次后拍干,加入150μl2
×
read buffer,通过msd电化学发光仪器检测发光计数,计算抗体指数,计算方法同上。
[0039]
4.rba-gad检测:
[0040]
参照发明人团队先前建立的方法,主要步骤是经试管内快速转录翻译的
35
s标记gad抗原蛋白与待测血清在4℃过夜孵育后,抗原抗体复合物被包被有蛋白a-琼脂糖(ge公司,17-5280-02)的96孔聚偏氟乙烯过滤平板所捕获,经过高通量洗涤后,采用液体闪烁液置于β-counter计数仪获取每分钟脉冲数(counts per minute,cpm)值,抗体指数(index)=(样本血清cpm-阴性质控cpm)/(阳性质控cpm-阴性质控cpm)。阳性判断标准:rba-gad指数≥0.042。
[0041]
所有数据均采用spass26软件进行统计,对所有计量资料符合正态分布的以用均数
±
标准差表示,组间比较采用t检验、组间率和构成比用卡方检验(χ2))、单因素方差分析、方差分析趋势性检验,两种方法的比较采用受试者工作特性(roc)曲线分析,并采用cohen
′
s kappa系数分析结果的一致性。p《0.05为差异具有统计学意义。
[0042]
实验结果:
[0043]
1.ecl-gad抗体的正常人界值判定
[0044]
取155例健康人血清进行ecl-gad抗体检测,计算抗体指数,取99%百分位点为界值,经计算阳性界值为0.01,阳性判断标准为≥0.01,如图2所示。
[0045]
2.ecl-gad抗体及rba检测gad抗体结果的一致性检验,roc曲线分析
[0046]
利用发明人实验室已有的经过iasp国际室间认证的rba-gad检测技术平台,对150例临床糖尿病患者血清中的gad抗体进行常规的rba检测。随后再用ecl检测,样本不变,一致性检验结果如下:
[0047]
ecl-gad和rba-gad抗体检测一致性比较(n=150)
[0048][0049]
经一致性检验,kappa=0.815,两种方法结果高度一致(kappa 0.81~1.00)。
[0050]
roc曲线分析结果如图3所示。ecl-gad抗体检测的敏感性83.9%(26/31),特异性96.7%(115/119),auc曲线下面积为0.904,p《0.0001,二者无显著性差异。
[0051]
3.ecl-gad抗体分型实验二抗浓度梯度实验
[0052]
取ecl-gad阳参进行抗体亚型检测,分别加入不同剂量的抗igg1、igg2、igg3、igg4、iga、igd、igm、ige的biotin标记的二抗。结果显示阳参为igg1阳性,发光计数与二抗添加量关系如图4所示。结果显示发光计数随着二抗添加量的减少先升高后降低,经过方差分析趋势性检验p《0.0001,趋势性极显著,在二抗浓度为0.03125μg/μl时发光计数达到最高,经信噪比(发光计数/阴参发光计数,s/n)分析结果见下表,s/n达26.70,为二抗添加最佳浓度剂量。
[0053][0054]
4.ecl-gad亚型在初诊糖尿病患者阳性患者中的分布
[0055]
对733名初诊糖尿病患者进行ecl-gad检测,其中136例ecl-gad阳性,对其进行igg1、igg2、igg3、igg4分型,阳性率分别为82.3%,5.15%,30.9%,2.9%,差异有统计学意义(χ2=263.3,p《0.0001),如图5所示。
[0056]
5.对ecl-gad阳性、rba-gad阴性的初诊糖尿病患者进行gad抗体分型
[0057]
对733名初诊糖尿病患者的gad进行ecl及rba检测,结果显示有一部分病人(图6中方块所示)rba结果为阴性,但ecl结果为阳性。
[0058]
收集以上ecl-gad阳性,rba-gad阴性这部分病人的临床信息,对于临床资料完善的18名病人发现仅根据这部分病人的临床表型无法准确将其归于1型或2型糖尿病。于是其进行了ecl抗体进一步iga、igm、igd、ige分型检测,18例患者中,13例为ecl-igm阳性,5例为ecl-igg阳性。结果如图7所示。
[0059]
本发明涉及的检测试剂盒,与传统的rba检测gad结果高度一致,通过对ecl核心步骤的改变,成功实现了gad抗体的分型。由于ecl法方法的特殊性,ecl-gad可以捕获全类型的抗体,分型中亦可捕获全类型的亚型。进一步的结果提示临床上rba-gad检测为阴性的难分型病人,有必要对其进一步行ecl检测及抗体分型,这利于识别有早期的自身免疫糖尿病病人,对后续的治疗决策十分重要。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1