板的评价方法和测试物的毒性评价方法与流程
本发明涉及板的评价方法和测试物的毒性评价方法。
背景技术:
1、在生物学安全性评价中,已知向试验物加入测试物并观察其变化。例如,在ames试验中,作为试验物,应用对氨基酸合成基因实施基因操作、改良为无法合成氨基酸的细胞。然后,在ames试验中,向上述细胞加入测试物后,在一定的条件培养。在由于测试物而细胞的氨基酸合成基因中产生突变时,细胞变得可以再次合成氨基酸。因而,通过确认细胞的增殖的有无来评价是否产生突变。此时,例如,如果应用由于细胞的增殖而颜色变化的指示剂,则可以用颜色的变化来评价细胞的增殖。因测试物的影响而细胞死亡时,存在产生异物的情形。因此,通过确认异物的有无,可以评价测试物对细胞的毒性。
2、近年来,为了试验物和测试物的量等的减少等,例如已知应用非专利文献1、非专利文献2和非专利文献3中公开的具有多个孔的板的ames试验。
3、现有技术文献
4、非专利文献
5、非专利文献1:fluckiger-isler s.,kamber m.,“direct comparison of theames microplate format(mpf)test in liquid medium with the stan dard ames pre-incubation assay on agar plates by use of equivocal to weakly positive testcompounds.”,mutation research/genetic toxicology and environmentalmutagenesis 747,p36-45,2012.
6、非专利文献2:sui h.,kawakami k.,sakurai n.,hara t.,nohmi t.,
7、“improvement and evaluation of high throughput fluctuation ames testusing 384-well plate with salmonella typhimurium ta100 and ta98.”,genes andenvironment 31(2),p47-55,2009.
8、非专利文献3:kamber m.,fluckiger-isler s.,engelhardt g.,jaeckh r.,zeiger e.,“comparison of the ames ii and traditional ames test re sponseswith respect to mutagenicity,strain specificities,need for metabo lism andcorrelation with rodent carcinogenicity”,mutagenesis 24(4),p359-366,2009.
技术实现思路
0、发明概述
1、发明要解决的课题
2、在应用如非专利文献1、非专利文献2和非专利文献3中公开的具有多个孔的板评价细胞毒性时,例如,即使应用相同条件的试验物和测试物,也存在由于板而评价变化的情形。例如,即使是因测试物的影响而细胞死亡并产生异物的条件,也存在由于板而异物消失的情形。该情形中,无法适当实施安全性评价。
3、因此,本发明的目的是提供:板的评价方法,其能够评价生物学安全性评价中使用的板的适当性;和测试物的毒性评价方法,其应用以上述评价方法评价的板。
4、用于解决课题的手段
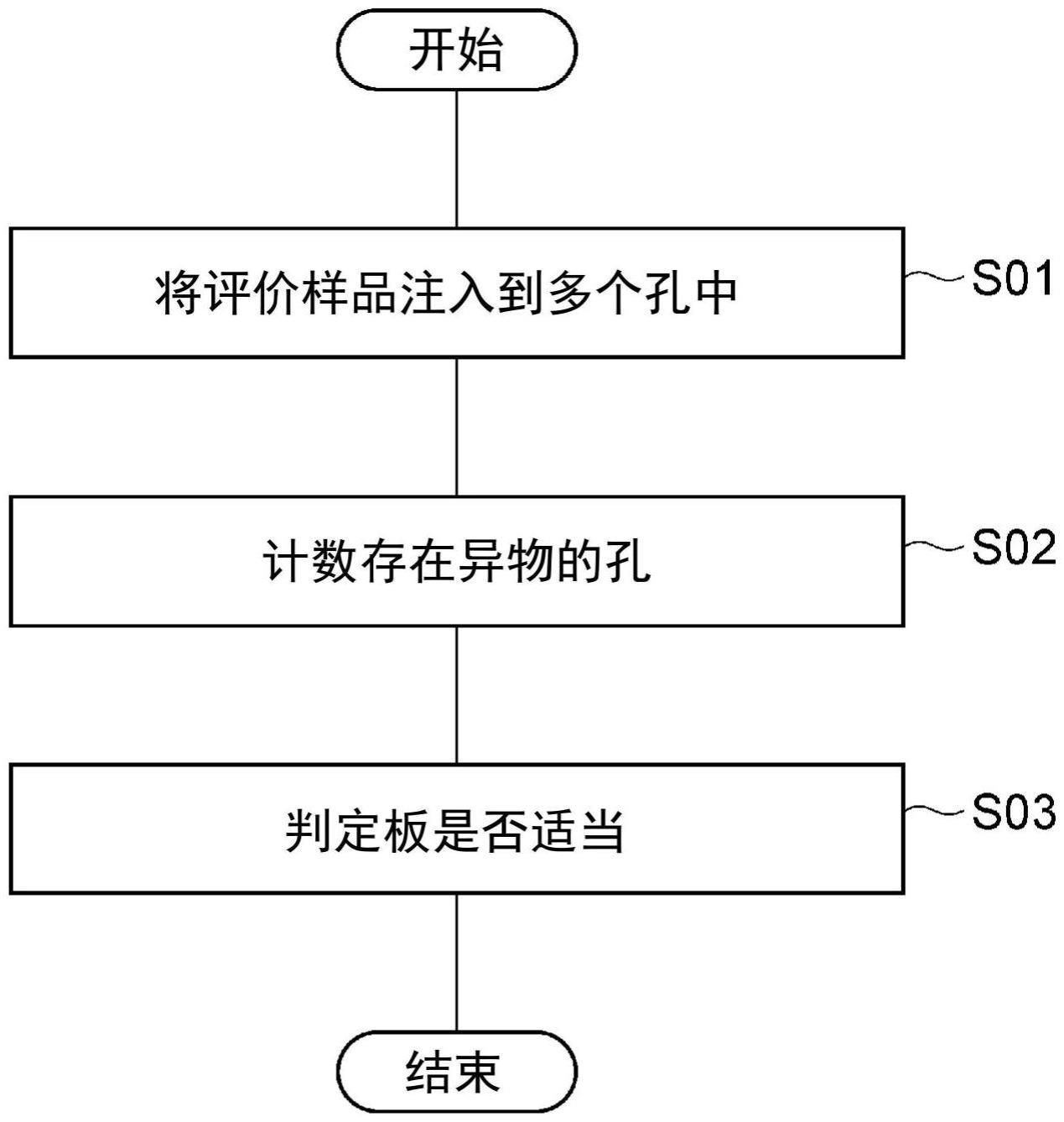
5、本发明的一方面涉及的板的评价方法是评价具备多个孔的板的方法,其具备:注入步骤,其中,将包含细胞和测试物的评价样品注入到上述多个孔中,上述评价样品预先调整为,由于上述测试物导致的上述细胞的死亡而产生异物;计数步骤,其中,在向上述多个孔注入上述评价样品后经过第1规定时间的第1计数时期,计数上述多个孔中具有上述异物的孔的数目;和判定步骤,其中,在上述多个孔中具有上述异物的孔的数目是1以上时,将上述板判定为适当,在具有上述异物的孔的数目是0时,将上述板判定为不适当。
6、在上述板的评价方法中,在向上述多个孔注入评价样品后经过上述第1规定时间的第1计数时期,计数孔内是否存在异物。通过向孔注入评价样品后经过第1规定时间,在假设为能够保持异物的板时,确保孔内确实存在异物。因此,通过在如上述的第1计数时期计数孔内是否存在异物,在上述板的评价方法中,可以评价板是否能够保持异物,即,其是不是适于生物学安全性评价试验的板。
7、上述第1计数时期可以是向上述多个孔注入上述评价样品后培养上述评价样品48小时后。在该情形中,在计数存在异物的孔的数目时,容易确保孔中存在异物的状态。
8、上述多个孔可以具有48个以上的孔。
9、在自上述第1计数时期起在一定温度保存上述板的同时经过第2规定时间的第2计数时期,计数上述多个孔中具有上述异物的孔的数目后,可以再度实施上述判定步骤。
10、即使对于在上述第1计数时期不评价安全性、在一定温度保存上述板一定时间后评价安全性的生物学安全性评价试验,在上述评价方法中,也可以评价是不是适当的板。
11、上述一定温度可以是10℃以下。
12、上述细胞可以是细菌。上述细胞可以是大肠杆菌(e.coli)或鼠伤寒沙门氏菌(s.typhimurium)。
13、上述评价样品是细胞和测试物被调整的样品,上述调整使得在向异物保持板所具有的多个孔注入上述评价样品后经过上述第1规定时间的上述第1计数时期,计数上述异物保持板所具有的多个孔中具有上述异物的孔的数目时,至少1个孔具有上述异物;上述异物保持板可以是具有玻璃板,和配置于上述玻璃板的表面上的由环烯烃共聚物形成的树脂层的板,其中,上述树脂层中形成有能够成为上述异物保持板所具有的多个孔的多个通孔,上述表面中从上述多个通孔露出的区域包被了纤连蛋白。
14、上述测试物可以是叔丁基对苯二酚(tert-butylhydroquinone)、1-癸醇(1-decanol)、2-乙氧基萘(2-ethoxynaphthalene)、4-(1,1,3,3-四甲基丁基)苯酚(4-(1,1,3,3-tetramethylbutyl)phenol)、二乙基硫代磷酰氯(diethyl chlorothiophos phate)、或4-氯苄基氯(4-chlorobenzyl chloride)。上述测试物也可以是浓度为62.5μg/ml以上的1-癸醇、或浓度为667μg/ml以上的叔丁基对苯二酚。
15、上述评价样品可以是例如,将大肠杆菌wp2uvra株用作上述细胞、将浓度为62.5μg/ml或125μg/ml的1-癸醇用作上述测试物的评价样品,或将鼠伤寒沙门氏菌ta100株作为上述细胞、将浓度为667μg/ml或2000μg/ml的1-癸醇用作上述测试物的评价样品。
16、本发明的一方面涉及的测试物的毒性评价方法,其包括向以上述板的评价方法判定为适当的上述板所具有的多个孔,注入包含含有细胞的试验物与测试物的评价对象,评价测试物的毒性的步骤。该情形中,可以正确评价测试物的毒性。
17、发明效果
18、根据本发明,可以提供:板的评价方法,其能够评价生物学安全性评价中使用的板的适当性;和测试物的毒性评价方法,其应用以上述评价方法评价的板。
- 还没有人留言评论。精彩留言会获得点赞!