使用定量相差显微镜分析组织样品
发明领域本发明属于生物医学研究和临床诊断领域。特别地,本发明涉及使用定量相差显微镜分析组织样品的方法以及相应的微流体系统和相应的装置。
背景技术:
0、背景
1、数字全息显微术使用成像光束和参考光束之间的干涉来获得由样品透射的光的相位和振幅信息,并且例如允许重建样品的定量相移图像,例如参见ep1524491a1和ep2357539a1。近年来,数字全息显微镜已经成功地用于生物医学应用,例如活细胞成像。细胞的相移图像可用于基于形态参数的分析和/或使用机器学习分类器可靠地鉴定细胞类型。与微流体系统相结合,例如,这允许进行高通量无标记血样分析,例如血细胞计数,参见例如us2019/0195774a1,促进检测疾病,例如疟疾、白血病和骨髓增生性肿瘤,例如参见m.ugele等人,adv.sci.1800761(2018)、wo2019/063548a1和m.ugele等人,proc.spie11060,optical methods for inspection,characterization,and imaging ofbiomaterials iv,110600v(2019)。
2、尽管数字全息显微镜可用于研究液体样品或包括二维或三维肿瘤模型在内的细胞培养物中的细胞,但它不适于研究较大的样品例如活检样品。对于许多疾病,例如胰腺癌,后者构成重要的诊断工具,对于这些疾病,组织样品可以例如通过超声内镜引导下的细针穿刺抽吸(eus-fna)活检来提取。通常通过各种细胞病理学和组织病理学技术分析这些样品以获得诊断。然而,这些分析是缓慢且昂贵的,而且在一些情况下,例如在高达25%的胰腺癌病例情况下,可能不会产生明确的结果。
技术实现思路
1、因此,本发明的一个目的是提供使用数字全息显微镜分析组织样品的快速且可靠的方法。
2、该目的通过使用权利要求1所述的定量相差显微镜,权利要求12所述的微流体系统和权利要求18所述的装置分析组织样品的方法来实现。在从属权利要求中详述了本发明的实施方案。
3、根据本发明的使用定量相差显微镜分析组织样品的方法包括在微流体系统的样品体积中提供组织样品,其中组织样品包括形成连续组织材料的多个生物细胞。将组织样品的至少一部分溶解成在样品体积中的载体流体中的单细胞和/或细胞聚集体。产生从微流体系统的样品体积到测量体积的载体流体流,并且利用定量相差显微镜获取测量体积中的单细胞和/或细胞聚集体的第一相移图像。
4、例如,组织样品可以是已经从患者中提取的活检样品,例如如下详述的。组织样品可以例如在每个方向上具有0.2mm至2mm的尺寸和/或0.01mm3至10mm2的体积,并且可以例如包含大约106至109个细胞。细胞形成连续的组织材料,其可以例如包含细胞和将细胞彼此连接以形成紧密连接的结构的细胞外基质。
5、组织样品可以例如通过将组织样品放置在微流体系统的样品体积中,例如通过样品体积的插入开口来提供。在一些实施方案中,组织样品可以在提取组织样品之后立即放置在样品体积中,例如通过将包含组织样品的活检针插入样品体积中以及从活检针释放组织样品。在一些实例中,提供组织样品可以包括在提供样品体积中的组织样品之前或之后冲洗组织样品例如以去除非组织细胞,例如血细胞。在将组织样品提供到样品体积中之后,可以例如通过用盖构件密封插入开口来封闭样品体积。
6、微流体系统例如可以是或包括具有衬底(substrate)的微流体芯片,在衬底中形成样品体积和测量体积,例如以及连接样品体积和测量体积的输送通道。在其它实例中,微流体系统可以包括多个元件,例如封闭样品体积的样品室,封闭测量体积的测量室以及将样品室连接到测量室的管或通道。在一些实例中,微流体系统可以是根据下面描述的本发明的实施方案之一的微流体系统。
7、随后,样品体积中的组织样品至少部分地溶解在载体流体中,从而从组织样品中分离多个单细胞和/或细胞聚集体。所述细胞聚集体可以例如是彼此粘附的细胞的小簇,例如包含2至20个细胞的簇,而单细胞不再粘附于来自组织样品的任何其他细胞。所述载体流体可以例如是水溶液,例如等渗溶液,并且可以在提供组织样品之前、同时或之后提供在样品体积中。所述载体流体可以包含用于组织样品中细胞的氧和/或细胞营养物。另外地或可选地,载体流体可以包括用于标记细胞的成像标志物,例如如下详述的。
8、在优选实施方案中,通过酶促消化来溶解组织样品。例如通过向载体流体中加入包括一种或多种酶的溶解流体或物质,所述载体流体可以例如包括用于组织样品的酶促消化的一种或多种酶,。所述溶解流体或物质可以在样品体积中提供载体流体之前或之后加入到载体流体中。在其它实例中,所述溶解流体或物质可以独立于载体流体而被提供在样品体积中,例如在提供载体流体之前。所述一种或多种酶可以包含一种或多种消化酶,其被配置成分解大分子,例如一种或多种蛋白酶。所述一种或多种酶可以例如包含一种或多种胶原酶,例如ii型胶原酶,和/或胰蛋白酶。
9、另外地或可选地,组织样品可以例如通过向组织样品施加超声来溶解。所述超声可以例如经由与微流体系统接触或机械耦合的超声波发生器(sonotrode)施加,特别是施加到样品体积的侧壁或用于插入开口的盖构件。另外地或可选地,所述超声可以例如由包括在微流体系统中的超声发射器产生。超声的频率可以例如为10khz至10mhz。
10、产生从微流体系统的样品体积到测量体积的载体流体流,以便将从组织样品分离的单细胞和/或细胞聚集体输送到测量体积。所述载体流体流可以在溶解组织样品时和/或之后产生,并且可以是连续流或脉冲流。所述脉冲流例如可以包括交替序列的周期,其中产生和保持载体流体流;以及停止流动的周期,例如以在将单细胞和/或细胞聚集体输送到测量体积之前进一步溶解组织样品。
11、使用定量相差显微镜获取测量体积中单细胞和/或细胞聚集体的第一相移图像。如本文所用,相移图像可以编码一个或多个波长的光的相移作为位置的函数,例如反射或传播通过样品的光的相移作为样品中位置的函数。所述第一相移图像可以例如量化沿着显微镜的光轴传播通过测量体积的光的相移。在一些实施方案中,所述方法可以包括获取多个相移图像,例如,如下详述的。在一个实例中,可以记录相移图像的连续视频流。
12、优选地,定量相差显微镜被配置成确定相移的绝对值。在其它实例中,显微镜可以仅被配置成以确定相移模量2π。例如,显微镜可以被配置成通过例如在探针或成像光束和参考光束之间光的干涉来获得相移。在优选实施方案中,所述显微镜是数字全息显微镜,例如,如下详述的。
13、通过在载体流体中将组织样品溶解成单细胞和/或细胞聚集体,根据本发明的方法以适于用定量相差显微镜,特别是数字全息显微镜进行分析的形式提供组织样品的成分,从而允许例如快速和可靠地确定组织样品中细胞的类型和/或形态。因为不需要另外的样品制备和/或分析步骤如染色或dna测序,所以这例如对于诊断疾病如胰腺癌可能是有利的。此外,与细胞学或组织病理学方法相比,可以获得更可靠和广泛的关于疾病状态的信息,例如关于组织样品的细胞组成或关于癌症的分化程度。此外,通过在用于显微成像的相同微流体系统内进行相应的步骤,所述方法可用于自动化高通量分析——与常规样品制备技术相反,所述常规样品制备技术例如已经用于如在f.baharom等人,j.vis.exp.(119),e55222(2017)的支气管内活检样品的流式细胞术分析,并且涉及多个装置中/之间的多个样品制备和转移步骤。此外,时间分辨测量可以如以下详述进行,这可以允许对组织样品进行空间解析分析。
14、在一些实施方案中,所述方法可以包括在溶解组织样品的同时在样品体积中移动组织样品。特别地,组织样品可以相对于与测量体积流体连通的样品体积的出口移动。以这种方式,源自组织样品的不同部分的细胞,例如组织样品的邻近出口的部分,可以被选择性地输送到测量体积,并用定量相差显微镜进行分析。在优选实施方案中,组织样品相对于样品体积中的载体流体的流动方向以一定角度移动,例如以45°至135°移动,在一个实例中垂直于样品体积中的载体流体的流动方向。例如,可以从输入通道经由样品体积到将样品体积连接到测量体积的输送通道产生载体流体流。所述组织样品可以相对于样品体积中的输入和输送通道的开口移动,使得组织样品的不同部分暴露于载体流体流。
15、例如,当组织样品相对于样品体积的出口处于第一位置时,可以获取测量体积中单细胞和/或细胞聚集体的第一相移图像。因此,至测量体积的载体流体流可以主要包含来自组织样品的一部分的细胞,所述组织样品的一部分邻近样品体积的出口和/或当组织样品处于第一位置时暴露于载体流体流。所述方法还可以包括:当组织样品相对于样品体积的出口处于不同位置时,获取测量体积中单细胞和/或细胞聚集体的另外相移图像。例如,当组织样品相对于样品体积出口处于第二位置时,获取测量体积中单细胞和/或细胞聚集体的第二相移图像,第二位置不同于第一位置。优选地,获取测量体积中单细胞和/或细胞聚集体的多个相移图像,其中对于每个相移图像,组织样品相对于样品体积的出口处于相应的位置,例如通过以预定的步骤顺序移动样品。由此,可以例如沿着组织样品的纵向范围进行组织样品沿着运动方向的空间解析分析。在一些实施方案中,可以在第一和第二相移图像之间冲洗样品体积和/或测量体积。
16、另外地或可选地,所述方法可以包括在组织样品处于相同位置时在不同时间点获取多个相移图像。例如,可以在溶解组织样品的同时在第一时间点获取第一相移图像,并且所述方法还包括在溶解组织样品的同时在第二时间点获取测量体积中单细胞和/或细胞聚集体的第三相移图像。当获取第一和第三相移图像时,组织样品可以处于相同的位置,例如处于第一位置,即组织样品可以在第一和第二时间点之间不移动。当组织样品在第一和第二时间点之间连续溶解时,在第一时间时包含在样品流体流中的细胞可以源自组织样品的外部部分或层,例如最初提供的组织样品的外表面,而在第二时间时包含在样品流体流中的细胞可以源自组织样品的内部部分或层,例如最初被组织样品的外表面覆盖的部分。这可以例如允许沿着组织样品的径向范围(例如从组织样品的外表面到组织样品的核心)对组织样品进行空间解析分析。在一些实施方案中,可以在第一和第三相移图像之间冲洗样品体积和/或测量体积。在一些实施方案中,获取测量体积中单细胞和/或细胞聚集体的多个相移图像,而在其间不移动组织样品,例如直到组织样品完全溶解。在一些实例中,所述方法还可以包括移动样品,并且当样品处于不同位置时获取一个或多个相移图像,例如如上所述的。在一个实例中,在溶解样品的同时所述样品在两个或更多个位置(例如第一和第二位置)之间重复移动。每当样品处于两个或更多个位置中的一个时,就可以获取相移图像。由此,可以获得沿着组织样品的纵向范围和径向范围的空间分辨信息。
17、在一些实施方案中,所述方法还可以包括在载体流体中提供一种或多种成像标志物,特别是一种或多种细胞类型特异性成像标志物,用于标记单细胞和/或细胞聚集体。例如,每个成像标志物可以被配置为选择性地结合一种或多种类型的细胞,并且可包含例如细胞类型特异性抗体。所述一种或多种成像标志物可以被配置成促进检测和/或鉴定相应的细胞。例如,可以提供包括用于相差显微术的标志物对象的成像标志物,其中标志物对象可以例如具有预定的尺寸和/或光学厚度,并且可以例如是金属簇。另外地或可选地,可以提供包括用于荧光显微术的标志物对象的成像标志物,其中标志物对象可以例如具有特征吸收和/或发射光谱,并且可以例如是荧光团。
18、在一些实施方案中,所述方法还可以包括对单细胞和/或细胞聚集体进行一个或多个光谱测量。特别地,所述方法可以包括例如在测量体积中对单细胞和/或细胞聚集体进行分子光谱分析。所述分子光谱分析可以包括记录单细胞和/或细胞聚集体的一个或多个光谱,例如在一个或多个波长范围内的吸收光谱和/或发射光谱。所述方法还可以包括确定一个或多个光谱中的特征,例如吸收和/或发射谱线,例如以检测特定分子的存在、不存在和/或浓度。进行分子光谱分析可以例如包括对单细胞和/或细胞聚集体进行拉曼光谱分析和/或多光子光谱分析。
19、在优选实施方案中,所述方法还包括由相移图像,特别是由第一相移图像确定一种或多种细胞的细胞类型。例如,这可以包括确定细胞的一个或多个形态学参数,以及基于所述一个或多个形态学参数,例如基于形态学参数的阈值和/或范围和/或针对形态学参数使用一个或多个基于神经网络的分类器来确定细胞类型。另外地或可选地,可以使用计算机视觉技术,例如用于相移图像的一个或多个基于神经网络的分类器,来确定一种或多种细胞的细胞类型。在一些实施方案中,可以使用细胞类型特异性成像标志物来确定一种或多种细胞的细胞类型,例如通过确定一种或多种细胞是否用成像标志物标记。
20、在一些实例中,所述方法可以包括测量体积中单细胞和/或细胞聚集体的流体动力学聚焦和/或粘弹性聚焦。例如,这可以允许在相对于显微镜的参考点处,例如在显微镜的焦平面内或邻近显微镜的焦平面处和/或处于或邻近显微镜的焦点处,精确地定位单细胞和/或细胞聚集体。所述流体动力学聚焦可以包括产生围绕测量体积中的载体流体流的一个或多个鞘流,特别是层状鞘流,例如以将载体流体流沿着一个或多个方向限制为小体积,例如在测量体积的中心处或在测量体积的侧壁附近。粘弹性聚焦可以例如通过提供粘弹性载体流体,例如包含聚合物例如聚乙二醇或透明质酸的载体流体来实现。粘弹性流体可以在单细胞和/或细胞聚集体上施加流体动力,从而引起垂直于流动方向的受控运动。优选地,将单细胞和/或细胞聚集体聚焦,使得单细胞和/或细胞聚集体在相同的平面内或沿着相同的路径传播,例如,使得单细胞和/或细胞聚集体的中心从各自的平面或路径移位小于10μm,在一些实例中小于5μm,在一个实例中小于2μm。
21、所述组织样品例如可以是活检样品,特别是针吸活检样品。活检样品例如可以直接从患者体内取出,例如通过诸如超声内镜引导下的细针穿刺抽吸(eus-fna)活检的切取活检,或者可以从先前从患者体内取出的组织中取出,例如通过切除活检或其它外科手术。例如,所述组织样品可以是已知的或疑似的癌症组织,特别是胰腺癌组织。
22、本发明还提供了使用根据本文所述的任何一个实施方案的方法用于分析组织样品的微流体系统,所述组织样品包括形成连续的组织材料的多个生物细胞。所述微流体系统包括被配置成通过插入开口接收组织样品的样品体积和与样品体积流体连通并且被配置成接收载体流体的输入端口。所述微流体系统还包括经由微流体输送通道与样品体积流体连通的测量体积和用于使用定量相差显微镜,特别是数字全息显微镜获取测量体积中的细胞的相移图像的检测窗口。
23、微流体系统例如可以是或包括具有衬底的微流体芯片,在所述衬底中形成样品体积、输入端口、输送通道、测量体积和/或检测窗口。所述衬底可以包括一个或多个层,每个层可以例如包括玻璃、塑料、金属或其组合或者由以上组成。特别地,所述衬底可以包括一个或多个层,所述层包括透明热塑性塑料,例如聚甲基丙烯酸甲酯(pmma)或由以上组成。在一些实例中,所述微流体系统可以包括多个分离的元件,例如,封闭样品体积的样品室和封闭测量体积的测量室,其中输送通道可以例如由将样品室连接到测量室的管形成。
24、样品体积可以由多个侧壁封闭,并且可以例如具有长方体或圆柱体形状。样品体积可以例如在每个方向上具有0.5mm至5mm的尺寸和/或0.2mm3至100mm2的体积。所述插入开口可以是侧壁之一中的开口,其中所述开口可以在相应侧壁的一部分上或在整个侧壁上延伸。优选地,所述微流体系统包括盖构件,所述盖构件被配置成放置在所述插入开口上或所述插入开口中,例如以封闭或密封所述样品体积。
25、输入端口可以例如布置在样品体积的侧壁中,并且可以包括通向样品体积的开口。在其它实例中,输入端口可经由输入通道(例如,微流体芯片中具有通向样品体积的开口的微流体通道)连接到样品体积。输入端口可以被配置成接收流体连接器,例如经由管将输入端口连接到流体供应系统。在一些实例中,输入端口还可以形成插入开口,或者可以布置在用于插入开口的盖构件中。
26、测量体积也可以由多个侧壁封闭,并且可以例如具有长方体或圆柱体形状。测量体积通过输送通道连接到样品体积,其中输送通道的横截面积足够大,使得单细胞和/或细胞聚集体可以通过输送通道,同时防止组织样品进入输送通道。输送通道的横截面积可以例如为500μm2至1mm2。在一些实例中,测量体积和输送通道可以是同一通道的节段(segment),例如将样品体积连接到微流体系统的输出端口或储存器的通道,即测量体积可以具有与输送通道相同的横截面面积。在其它实例中,测量体积可以具有与输送通道不同的横截面积,例如更大的横截面积。
27、检测窗口例如可以是测量体积的透明侧壁或其一部分,或者可以是布置在测量体积的侧壁中的透明窗口。优选地,优化用于相移测量的检测窗口。例如,检测窗口的透射波前误差可以小于λ/2,优选地小于λ/4,在一个实例中小于λ/8。检测窗口可以例如包括或透明热塑性塑料、硼硅酸盐玻璃和/或熔融石英或者由以上组成。所述微流体系统还可以包括用于照明测量体积中的细胞的照明窗口,其中照明窗口可以例如布置在测量体积的与检测窗口相对的一侧。所述照明窗口例如可以是面向检测窗口的测量体积的透明侧壁,或者可以是布置在面向检测窗口的侧壁中的透明窗口。优选地,照明窗口平行于检测窗口并且还被优化用于相移测量。
28、在优选实施方案中,微流体系统包括可移动元件,所述可移动元件被配置成在样品体积内移动以在样品体积内移动组织样品。所述可移动元件可以例如被配置成与组织样品接触,以便沿着样品体积推动或拉动组织样品。可移动元件可以被配置成沿着样品体积的一个或多个侧壁滑动,在一个实例中,沿着布置在相应侧壁上的导轨滑动。在优选实施方案中,可移动元件是包括盖构件的活塞,其被配置成密封插入开口并沿着样品体积滑动,以沿着样品体积移动组织样品。例如,所述盖构件可以是具有对应于样品体积的横截面的形状的板,其中在一些实例中,所述板可以包括沿着其边缘的密封元件。在另一个实例中,所述可移动元件可以布置在样品体积的侧壁中或者布置在用于插入开口的盖构件中,并且可以被配置成分别从侧壁和盖构件中延伸。例如,所述可移动元件可以是布置在侧壁或盖构件中的开口中的可移动杆。所述可移动元件可以被配置成机械地耦合到致动器,例如电动机、压电致动器或液压源。例如,所述可移动元件可以与诸如由电动机或液压源致动的杆的元件接触。
29、如上所述,微流体系统可以包括将输入端口与样品体积连接的输入通道。优选地,输入通道和输送通道的开口布置在样品体积的相对侧壁上并且沿着输入通道的流动方向彼此对准,例如使得从输入通道流向输送通道的流体沿着直的路径或基本上直的路径流过样品体积。例如,这可以促进产生通过样品体积的载体流体流,其被限制在样品体积的一部分,例如样品体积的在输入通道和输送通道的开口之间延伸的部分。在一个实例中,输入通道以及因此输入通道在其开口处的流动方向垂直于样品体积的侧壁,输入通道的开口布置在样品体积的侧壁上。所述输送通道的开口可直接与相对侧壁上的输入通道的开口相对布置,其中输送通道也可例如垂直于相应侧壁延伸。在另一个实例中,输入通道的流动方向可以相对于相应侧壁以一定角度延伸,并且相对侧壁上的输送通道的开口可以相对于输入通道的开口移位。
30、在优选实施方案中,微流体系统包括与测量体积流体连通的一个或多个鞘流通道。所述一个或多个鞘流通道可以被配置成产生一个或多个鞘流以流体动力学地聚焦测量体积中的载体流体。每个鞘流通道可以例如终止于测量体积或输送通道的侧壁中的相应开口处。鞘流通道中的流动方向可以相对于输送通道的流动方向成一定角度,例如以产生围绕测量体积中的载体流体流的鞘流。所述鞘流可以在一个或两个方向上限制载体流体流,例如限制到窄片,其可以例如具有5μm至20μm的厚度;或窄管或细丝,其可以例如在两个正交方向上具有5μm至20μm的厚度。
31、在一些实施方案中,微流体系统可以包括被配置成分选单细胞的细胞分选器。所述细胞分选器可以例如沿着输送通道或在测量体积中布置。优选地,所述细胞分选器沿着与测量体积流体连通的输出通道布置,并且例如将测量体积连接到微流体系统的一个或多个输出端口和/或一个或多个储存器。所述细胞分选器可以被配置成将单细胞选择性地引导到多个通道或出口中的一个。所述细胞分选器例如可以包括被配置成基于控制信号对细胞进行分选的主动式细胞分选器,所述控制信号例如可以由外部控制器提供;和/或被配置成基于细胞的电、磁和/或流体动力学特性对细胞进行分选的被动式细胞分选器。所述细胞分选器可以包括一个或多个电极,以产生用于分选细胞的电场,和/或一个或多个电感元件,以产生用于分选细胞的磁场。因此,所述控制信号例如可以是电控制信号,例如电压或电流。另外地或可选地,所述细胞分选器可以包括一个或多个光学元件和/或光源,以产生用于分选细胞的光学势,并且控制信号可以例如是光脉冲。在一些实例中,所述细胞分选器可以包括一个或多个微流体元件,例如阀和/或通道,例如以一定角度延伸并且特别是垂直于输出通道以产生偏转流的通道,或者包括用于流体动力细胞分选的一个或多个弯曲通道。
32、本发明还提供了使用根据本文所述的任何一个实施方案的方法用于分析组织样品的装置,所述组织样品包括形成连续组织材料的多个生物细胞。所述装置包括被配置成接收微流体系统的托架(mount),其中所述微流体系统包括被配置成接收组织样品的样品体积和与样品体积流体连通的测量体积。所述装置还包括定量相差显微镜和控制器,所述定量相差显微镜被配置成获取测量体积中的细胞的相移图像。所述控制器被配置成用于将组织样品的至少一部分溶解成在样品体积中的载体流体中的单细胞和/或细胞聚集体以及用于产生从样品体积到测量体积的载体流体流的控制工具。
33、所述托架可以被配置成将微流体系统保持在例如相对于显微镜的固定参考位置上。优选地,所述托架被配置成相对于显微镜定位微流体系统,例如沿着一个或多个方向移动微流体系统和/或围绕一个或多个轴倾斜微流体系统。在一些实例中,所述托架还可以包括一个或多个流体连接器,用于连接微流体系统的端口,例如微流体系统的输入端口和输出端口。例如,所述微流体系统可以是根据本文所述的本发明的一个实施方案的微流体系统。
34、所述定量相差显微镜被配置成获取相移图像,即将一个或多个波长的光的相移编码为位置的函数的图像。优选地,所述定量相差显微镜被配置成确定相移的绝对值。在其它实例中,显微镜可以仅被配置成确定相移模量2π。例如,所述显微镜可以被配置成通过例如在探针或成像光束和参考光束之间光的干涉来获得相移。所述显微镜可以被配置成获取一个或多个干涉图像,并且从一个或多个干涉图像重建相移图像。在一些实例中,所述显微镜还可以被配置成获取振幅或强度图像,其中强度图像可以编码光强度作为位置的函数,例如,反射或透射通过样品的光强度作为样品中位置的函数。在优选实施方案中,所述显微镜是数字全息显微镜,例如如下详述的。在其它实例中,所述显微镜可以是叠层显微镜(ptychographic microscope)。
35、控制器可以在硬件、软件或其组合中实现。所述控制器可以例如包括处理装置和存储器,所述存储器存储由处理装置执行的指令以提供本文所述的功能。所述控制器可以例如被配置成产生控制信号,例如数字和/或模拟控制信号,以控制用于溶解组织样品和用于产生载体流体流的工具。在一些实例中,控制器可以被配置成至少部分地根据本文所述的实施方案之一执行分析组织样品的方法。
36、用于溶解组织样品的工具可以例如至少部分地包括一个或多个微流体元件,例如阀和/或泵,其可以例如被配置成将溶解流体供应到样品体积和/或将溶解流体混合到载体流体,其中溶解流体可以例如包括用于酶促消化组织样品的一种或多种酶,例如如下详述的。所述控制器可以例如被配置成产生用于打开和关闭阀和/或用于开启和关闭泵的相应控制信号,例如以启动或停止溶解组织样品。另外地或可选地,用于溶解组织样品的工具可以例如至少部分地包括被配置成将超声施加到样品体积的超声源。所述控制器可以例如被配置成产生用于开启和关闭超声源的相应控制信号,例如以启动或停止溶解组织样品。
37、用于产生载体流体流的工具例如还可以包括一个或多个微流体元件,例如阀和/或泵,在一些实例中,所述微流体元件也可以用作溶解组织样品的工具,例如,如果载体流体包含溶解流体或溶解物质。所述控制器可以例如被配置成产生用于打开和关闭阀和/或用于开启和关闭泵的相应控制信号,例如以启动或停止载体流体流。
38、在一些实施方案中,所述装置包括超声源,所述超声源被配置成将超声施加到所述微流体系统的样品体积。控制器可以被配置成例如通过提供相应的控制信号来控制超声源,以通过向样品体积中的组织样品施加超声来溶解组织样品的至少一部分。所述超声源例如可以包括超声波发生器,所述超声波发生器被配置成与托架和/或微流体系统,特别是样品体积的侧壁用于样品体积的插入开口的盖构件接触或机械耦合。另外地或可选地,超声源可以例如包括整合到托架中的超声发射器。所述超声源可以例如被配置成产生频率为20khz至40khz的振动。
39、在优选实施方案中,所述装置包括微流体单元,所述微流体单元被配置成向微流体系统供应一种或多种流体。所述微流体单元可以包括用于储存流体的一个或多个储存器和/或一个或多个泵和/或一个或多个阀,其用于向微流体系统供应流体。所述微流体单元可以包括一个或多个输出端口,其被配置成连接到托架和/或微流体系统的相应输入端口。所述控制器可以配置成控制微流体单元以将流体供应到微流体系统。
40、所述微流体单元可以特别地被配置成向样品体积供应溶解流体,其中溶解流体包括用于组织样品的酶促消化的酶,例如,如上针对根据本发明的方法详述的。微流体单元可以包括用于储存溶解流体的储存器和泵和/或一个或多个阀,其用于将溶解流体供应到微流体系统。所述控制器可以被配置成例如通过提供相应的控制信号来控制微流体单元,以通过将溶解流体供应到样品体积来溶解组织样品的至少一部分。所述控制器可以例如被配置成控制微流体单元以将预定量的溶解流体供应到样品体积和/或以在预定量的时间内产生通过样品体积的溶解流体流。
41、优选地,所述微流体单元还被配置成产生从样品体积到测量体积的载体流体流,例如,响应控制器提供的相应控制信号。所述微流体单元可以例如包括用于储存载体流体的储存器和泵和/或一个或多个阀,其用于将载体流体供应到微流体系统。所述控制器可以被配置成控制微流体单元以调节载体流体的流量、流速和/或流动持续时间。在一些实例中,所述载体流体可对应于溶解流体或可包含溶解流体。所述控制器可以例如被配置成控制微流体单元以将溶解流体或溶解物质混合到载体流体中。
42、在一些实例中,所述微流体单元还被配置成向微流体系统供应鞘流体,用于在测量体积中产生一个或多个鞘流。所述微流体单元可以例如包括用于储存鞘流体的储存器和泵和/或一个或多个阀,其用于向微流体系统供应鞘流体。在一些实例中,所述鞘流体可以具有与载体流体相同的组成,并且可以例如储存在相同的储存器中。所述控制器可以被配置成控制微流体单元,以通过向微流体系统,例如向微流体系统的一个或多个鞘流通道供应鞘流体,来流体动力学地聚焦测量体积中的载体流体。所述控制器可以被配置成控制微流体单元以调节鞘流体的流量、流速和/或流动持续时间。
43、在优选实施方案中,所述装置还包括致动器,所述致动器被配置成在样品体积内移动可移动元件,其中控制器被配置成控制致动器以在样品体积内移动可移动元件,以便在样品体积内移动组织样品。所述致动器可以例如包括电动机、压电致动器和/或液压源,并且可以机械地耦合到可移动元件和/或可以被配置成机械地耦合到可移动元件。所述可移动元件可以包括在装置中或者可以是微流体系统的一部分,例如如上所述的。可移动元件例如可以是具有盖构件的活塞,其被配置成插入到样品体积中。例如,所述盖构件可以被配置成密封样品体积的开口,例如插入开口,并且例如在与样品体积的一个或多个侧壁接触时沿样品体积滑动。所述控制器可以被配置成控制致动器以沿着样品体积移动活塞,用于例如通过将活塞从插入开口推进到样品体积中来沿着样品体积移动组织样品。
44、在一些实例中,所述控制器被配置成从相移图像确定一种或多种细胞的细胞类型,例如,如上针对根据本发明的方法所述的。特别地,所述控制器可以被配置成确定细胞的一个或多个形态参数,并基于所述一个或多个形态参数来确定细胞类型。另外地或可选地,所述控制器可以被配置成使用用于分析相移图像的计算机视觉技术来确定细胞类型。
45、在一些实施方案中,所述微流体系统包括细胞分选器,其被配置成基于控制信号分选单细胞,例如如上所述的。所述控制器可以被配置成控制细胞分选器以例如通过产生相应的控制信号分选细胞。所述控制器可以例如被配置成向细胞分选器的一个或多个电极施加电压和/或向细胞分选器的一个或多个电感元件施加电流,例如以将细胞选择性地引导到多个通道或出口中的一个。另外地或可选地,所述控制器可以被配置成通过控制一个或多个光源来为细胞分选器中的细胞产生光学势和/或在细胞分选器中产生偏转流,例如在垂直于载体流体流的方向上。
46、优选地,所述控制器被配置成控制细胞分选器,以基于一种或多种细胞的所确定的细胞类型对从相移图像中确定细胞类型的一种或多种细胞进行分选。例如,所述控制器可以被配置成控制细胞分选器,以将一个或多个预定类型的细胞与其它类型的细胞分开。在一个实例中,所述控制器被配置成控制细胞分选器以将第一组细胞类型的细胞(例如第一类型的细胞)引导到第一通道,并将第一组细胞类型中不是一个类型的细胞引导到第二通道。在另一实例中,所述控制器被配置成控制细胞分选器以将第一组细胞类型的细胞引导到第一通道,将第二组细胞类型的细胞(例如第二类型的细胞)引导到第二通道,以及将既不是第一组细胞类型中的类型也不是第二组细胞类型中的类型的细胞引导到第三通道。
47、在优选实施方案中,所述定量相差显微镜是数字全息显微镜,其被配置成获取样品的相移图像以及振幅或强度图像。所述数字全息显微镜可以例如被配置成将样品的图像(例如透射通过样品的成像光束)与参考光束干涉,其中参考光束可以通过样品或者可以不通过样品。所述数字全息显微镜可以被配置成,例如通过重建透射穿过或反射样品的光的波前从一个或多个干涉图像中提取或重建相移和强度图像。所述数字全息显微镜可以是同轴数字全息显微镜,其中成像光束和参考光束在干涉时沿着相同的轴传播。优选地,所述数字全息显微镜是离轴数字全息显微镜,其中成像光束和参考光束在一个角度下干涉,并且可以被配置成从样品的单个干涉图像中提取相移图像。这种数字全息显微镜例如可以从ep1524491a1和ep2357539a1中获知。
48、在一些实例中,所述装置可以包括根据本文中描述的本发明的实施方案之一的一个或多个微流体系统。
49、根据本发明的方法、根据本发明所述的微流体系统和根据本发明所述的装置也可以适于与其它检测或测量技术一起使用,或者作为定量相差显微术的补充或者作为定量相差显微术的替代。例如,可以使用不同的显微术技术,例如亮场显微术,荧光显微术和/或超分辨率显微术。另外地或可选地,可以对测量体积中的单细胞和/或细胞聚集体进行任何其它类型的测量,例如另一光学测量或电测量,即,可以进行测量来代替在本公开内容的任何实施方案中获取相移图像或者除了在本公开内容的任何实施方案中获取相移图像之外还可以进行测量。
50、因此,本发明还提供了使用微流体系统分析组织样品的方法,所述方法包括:(1)在微流体系统的样品体积中提供组织样品,其中组织样品包括形成连续组织材料的多个生物细胞;(2)将所述组织样品的至少一部分溶解成在所述样品体积中的载体流体中的单细胞和/或细胞聚集体;(3)产生从微流体系统的样品体积到测量体积的载体流体流;以及(4)对测量体积中的单细胞和/或细胞聚集体进行第一次测量。上述编号仅仅是为了清楚,并不意味着所述方法的某种执行顺序。
51、在一些实施方案中,使用显微镜,例如亮场显微镜或荧光显微镜分析组织样品。因此,进行第一次测量可以包括或对应于用显微镜获取测量体积中的单细胞和/或细胞聚集体的第一显微图像。在一些实例中,所述方法可以包括获取多个显微图像,例如,如以上对于相移图像所描述的。
52、本发明还提供了用于使用根据前述实施方案的方法分析包含形成连续组织材料的多个生物细胞的组织样品的微流体系统,所述微流体系统包括:(1)样品体积,其被配置成通过插入开口接收所述组织样品;(2)输入端口,其与所述样品体积流体连通并且被配置成接收载体流体;(3)测量体积,其经由微流体输送通道与样品体积流体连通;以及(4)检测窗口,其用于获取测量体积中细胞的显微图像。
53、本发明还提供了用于使用根据前述实施方案的方法分析包含形成连续组织材料的多个生物细胞的组织样品的装置,所述装置包括:(1)托架,其被配置成接收微流体系统,所述微流体系统包括被配置成接收所述组织样品的样品体积和与所述样品体积流体连通的测量体积;以及(2)控制器,其被配置成用于将组织样品的至少一部分溶解成在样品体积中的载体流体中的单细胞和/或细胞聚集体以及用于产生从样品体积到测量体积的载体流体流的控制装置。换句话说,在一些实施方案中,根据本发明的装置可以不包括定量相差显微镜,而是可以例如包括不同的测量装置,例如不同类型的显微镜和/或电测量装置。在一些实施方案中,装置可以不包括任何测量装置,而是可以例如被配置成与诸如显微镜或电测量装置的测量装置一起使用。
54、附图列表
55、在下文中,参考附图给出了本发明及其示例性实施方案的详细描述。附图显示了以下的示意图。
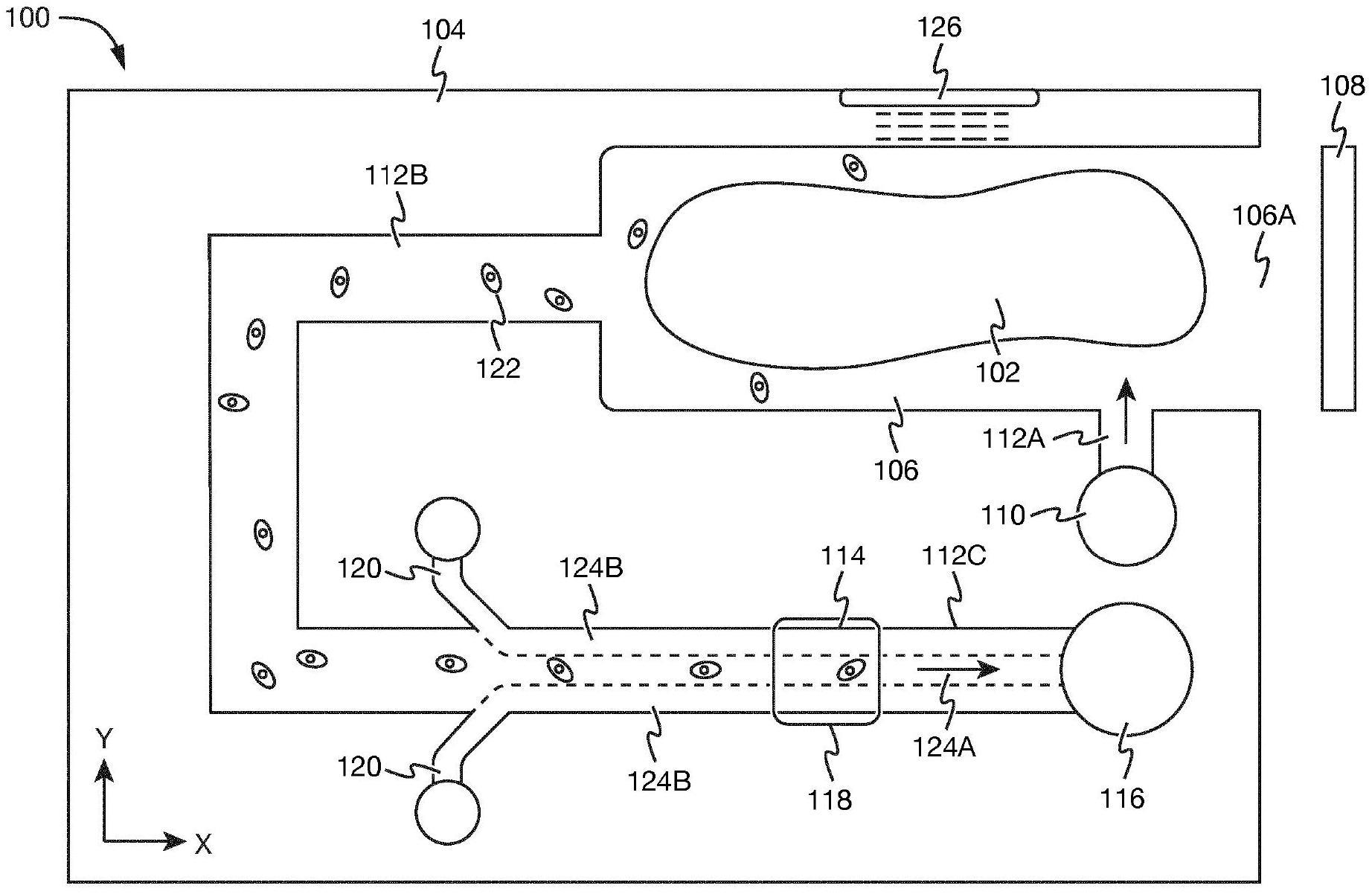
56、图1:根据本发明的示例性实施方案的用于分析组织样品的微流体系统;
57、图2:根据本发明的示例性实施方案的包括可移动元件和细胞分选器的微流体系统;
58、图3:根据本发明的示例性实施方案的用于分析组织样品的装置;
59、图4:根据本发明的示例性实施方案的图3装置的定量相差显微镜;以及
60、图5:根据本发明的示例性实施方案的使用定量相差显微镜分析组织样品的方法的流程图。
61、优选实施方案的描述
62、图1以俯视图示出了根据本发明的示例性实施方案的用于分析组织样品102的微流体系统100的示意图。所述组织样品102包括形成连续组织材料的多个生物细胞,其中细胞通过细胞外基质相互连接。组织样品102例如可以是先前已经从患者中提取的针吸活检样品。
63、微流体系统100包括具有衬底104的微流体芯片,衬底104例如可以包括一层或多层透明热塑性塑料,例如聚甲基丙烯酸甲酯(pmma),或者由以上组成。所述衬底104例如可以包括一个或多个结构化层,其中形成以下描述的结构中的一些或全部;以及一对覆盖层,其被夹在所述结构化层之间以密封其中的所述结构。
64、衬底104包围样品体积106,其被配置成通过插入开口106a接收组织样品102。所述插入开口106a可以例如被配置成接收包含组织样品102的活检针的尖端,以便从样品体积106中的活检针释放组织样品102。在图1的实例中,所述插入开口106a是布置在衬底104的侧面上的横向插入开口106a。在其它实例中,插入开口106a可例如布置在衬底104的顶面上,例如垂直于图1中的视角方向的表面。所述样品体积106可以例如具有1mm3至50mm3的体积。所述样品体积106可以例如具有长方体或圆柱体形状,沿着样品体积106的纵轴长度为2mm至5mm,其中纵轴可以例如与图1的x方向对准。样品体积106垂直于纵轴的宽度和高度或直径可以例如为0.5mm至2mm。微流体系统100还包括盖构件108,其被配置成可移除地放置在样品体积106的插入开口106a上,例如在将组织样品102放置在其中之后将样品体积106与微流体系统100的环境密封。
65、微流体系统100包括例如在如图1所示的衬底的顶面上的输入端口110,其经由输入通道112a与样品体积106流体连通。输入端口110被配置成接收流体,例如载体流体,其可以经由输入通道112a被供应到样品体积106。输入端口110例如被配置成接收流体连接器,例如连接到管的流体连接器,以将微流体系统100连接到流体源,例如微流体单元。
66、微流体系统100还包括测量体积114,其形成在衬底104中并且经由衬底104中的微流体输送通道112b与样品体积106流体连通。输送通道112b的横截面积显著小于样品体积106的横截面积,使得组织样品102不能进入输送通道112b。所述输送通道112b可以例如具有垂直于输送通道中的流动方向的500μm2至1mm2的横截面积,在一个实例中为0.001mm2至0.05mm2。在图1的实例中,测量体积114和输送通道112b是同一通道的相邻节段,即测量体积114具有与输送通道112b相同的横截面面积。在其它实例中,测量体积114可具有与输送通道112b不同的横截面积,例如比输送通道112b更大的横截面积。
67、测量体积114经由输出通道112c与微流体系统100的输出端口116流体连通,所述输出通道112c也可以是与图1的实例中的输送通道112b和测量体积114相同通道的节段。输出端口116布置在衬底104的顶面上,并且被配置成接收流体连接器,例如从微流体系统100提取流体。在其它实例中,微流体系统100可以另外地或可选地包括与测量体积114连接并且被配置成接收来自测量体积114的流体的储存器(未示出)。
68、在衬底104的顶面中,在测量体积114上方形成检测窗口118。检测窗口118适于使用定量相差显微镜通过检测窗口118获取相移图像。例如,检测窗口的透射波前误差可以小于λ/2,优选地小于λ/4,在一个实例中小于λ/8。检测窗口118例如可以是衬底104的覆盖层的一部分,或者可以布置在覆盖层中或覆盖层上。检测窗口118和/或覆盖层可以例如包括透明热塑性塑料、硼硅酸盐玻璃和/或熔融石英或者由以上组成。检测窗口118可以覆盖整个测量体积114或其一部分,并且可以例如具有2mm×2mm至25mm×25mm的尺寸。在一些实例中,微流体系统100还可以包括照明窗口(未示出),其布置在与检测窗口118相对的测量体积114的一侧上,例如布置在衬底114的底面中或底面上,例如如下面参考图4所详述的。所述照明窗口可以与检测窗口118相似或相同。
69、微流体系统100还包括与测量体积114流体连通的多个鞘流通道120。每个鞘流通道120将各自的端口与测量体积114前面的输送通道112b的一部分连接。每个鞘流通道120可以终止于布置在输送通道112b的侧壁中的出口,其中每个鞘流通道120以及因此相应的鞘流通道120中的流动方向相对于输送通道112b以及因此相应的输送通道112b中的流动方向以一定角度延伸。因此,可以在测量体积114中产生多个层状鞘流124b,用于如下详述的流体动力学聚焦。
70、微流体系统100例如可以用于使用下面参照图5描述的方法500,用定量相差显微镜分析组织样品102。简而言之,样品体积106中的组织样品102可以包埋在供给到样品体积106的载体流体中,并且可以例如通过包含在载体流体中的酶或者添加到载体流体中的溶解流体或物质至少部分地溶解成单细胞122和/或细胞聚集体(未示出),所述细胞聚集体包括彼此粘附的少量细胞。例如,通过经由输入端口110供应载体流体并经由输出端口116提取载体流体,可以产生从样品体积106到测量体积114的载体流体流124a。载体流体流124a可以将从组织样品102分离的单细胞122和/或细胞聚集体从样品体积106输送到测量体积114。可以向鞘流通道120中提供鞘流体,以产生鞘流124b,用于流体动力学地聚焦载体流体流124a。鞘流124b围绕载体流体流124a,并在垂直于载体流体流124a的流动方向的一个或两个方向上将载体流体流124a,例如,限制成延伸穿过显微镜焦点的平面或细丝。载体流体流124a可以例如被集中到20μm2至500μm2的横截面积,例如处于或邻近测量体积114的中心处或者邻近检测窗口118。
71、在图1的实例中,微流体系统100还包括超声发射器126,其被配置成将超声施加到样品体积106,特别是布置在其中的组织样品102。超声发射器126例如可以是或包括样品体积106的侧壁或其一部分,其被配置成将施加到微流体系统100,例如施加到衬底104的外表面的超声,传输到样品体积106的内部。超声发射器126的形状、厚度和/或材料可以适于增加进入样品体积106的透射效率。例如,超声发射器126的谐振频率可以适于施加到微流体系统100的超声的频率,并且可以例如为20khz至40khz。在其它实例中,超声发射器126可以另外地或可选地包括经配置以将施加到超声发射器126的电信号转换为超声的超声发射器。超声发射器例如可以包括一个或多个压电元件和/或一个或多个电容元件,其被配置成将交流(ac)电信号转换为超声波。
72、图2以俯视图描绘了根据本发明的另一个示例性实施方案的用于分析组织样品102的微流体系统200的示意图。微流体系统200类似于图1的微流体系统100,其中相应的元件使用与图1中相同的参考符号表示。特别地,微流体系统200也包括衬底104,在衬底104中形成被配置成接收组织样品102的样品体积106和测量体积114。样品体积106经由输入通道112a与衬底104的侧面上的输入端口110连接,并且经由输送通道112b与测量体积114连接。
73、微流体系统200的输入通道112a和输送通道112b彼此对准,使得输送通道112b的开口布置在与输入通道112a的开口相对并直接面对输入通道112a的开口的样品体积106的侧壁上。沿着输入通道112a流动的流体的流动路径延伸穿过样品体积106进入输送通道112b的开口,从而促进载体流体流124a的产生,所述载体流体流124a被限制在样品体积106的中心部分,并且因此例如仅围绕组织样品102的一部分流动。沿着输入通道112a流动的流体的流动路径可以例如垂直于样品体积106的侧壁延伸,在所述样品体积106上布置有输入和输送通道112a、112b的开口,如图2所示。
74、微流体系统200还包括可移动元件202,其被配置成在样品体积106内移动,用于移动样品体积106中的组织样品102,如图2中的双头箭头所示。以这种方式,组织样品102的不同部分可以暴露于载体流体流124a和/或将邻近样品体积106的出口定位到输送通道112b。在图2的实例中,可移动元件202是包括盖构件202a的活塞,其被配置成密封样品体积106的插入开口106a。盖构件202a被配置成沿着样品体积106滑动,以沿着样品体积106移动组织样品102。盖构件202a可以例如包括塑料,特别是热塑性塑料,或者由以上组成,并且可以包括沿着其边缘的密封构件(未示出),所述密封构件被配置成与样品体积106的侧壁接触,以在沿着样品体积106移动盖构件202a的同时提供紧密密封。活塞202还包括杆或轴,所述杆或轴连接到盖构件202a的背面并且被配置成机械地耦合到致动器(未示出),例如电动机或压电元件,用于沿着样品体积106移动活塞202。
75、微流体系统200还包括沿着输出通道112c布置的细胞分选器204,所述输出通道112c将测量体积114连接到衬底104的侧面上的一对输出端口116a、116b。细胞分选器204包括一个分叉或接合处,在所述分叉或接合处,输出通道112c分成一对通道,每个通道连接到输出端口116a、116b中相应的一个。在接合处和测量体积114之间,一对电极206被布置在输出通道112c的相对侧上的衬底之内或之上,例如在输出通道112c的相对侧壁上或邻近输出通道112c的相对侧壁。每个电极206电耦合到相应的电连接器上,所述电连接器例如可以连接到电压源,以便向电极206施加电压。施加到电极206的电压在输出通道112c上产生电场,输出通道112c根据施加的电压的信号,例如可以用于通过朝向在接合处分开的通道之一并且因此朝向输出端口116a、116b的电泳来使输出通道112c中的载体流体流124a中的细胞偏转。
76、图3以侧视图示意性地示出了根据本发明的示例性实施方案的用于分析组织样品102的装置300。所述装置300包括被配置成获取相移图像的定量相差显微镜400,这在图4中更详细地示出并在下面描述。装置300可以例如用于实现根据本文所述实施方案之一的分析组织样品的方法,例如下面参考图5描述的方法500。
77、所述装置300包括被配置成接收微流体系统304的托架302。所述微流体系统304包括被配置成接收组织样品102的样品体积106和与样品体积106流体连通的测量体积114。所述微流体系统304可以类似于上述微流体系统100、200中的一个,其中相应的元件使用与图1和2中相同的参考符号来表示。特别地,微流体系统304也包括输入端口110和输出端口116,输入端口110布置在微流体系统304的顶面上并与样品体积106流体连通,输出端口116布置在微流体系统304的侧面上并与测量体积114流体连通。托架302还可以被配置成接收其它微流体系统,特别是根据本文描述的本发明的一个实施方案的微流体系统,例如微流体系统100和/或微流体系统200。
78、托架302被配置成将微流体系统304保持在适当位置,例如防止微流体系统304至少沿着图3的z轴,优选地沿着所有三个轴相对于显微镜400的焦点运动。托架302可以例如包括用于将微流体系统304固定到托架302的一个或多个紧固件(未示出)。优选地,托架302被配置成例如通过沿着图3的x、y和/或z轴移动微流体系统304和/或通过围绕x、y和/或z轴倾斜微流体系统304来调节微流体系统304的位置和/或方向,其中y轴与图3中的视图方向对准。
79、装置300还包括控制器306,其被配置成用于将组织样品102的至少一部分溶解成微流体系统304的样品体积106中的载体流体中的单细胞(未示出)和/或细胞聚集体(未示出)的控制工具,以及用于产生从样品体积106到测量体积114的载体流体流124a的工具。控制器306可以在硬件、软件或其组合中实现,并且可以例如包括处理装置和存储指令的存储器,所述指令由处理装置执行以提供本文所述的功能。控制器306例如可以包括中央处理单元(cpu)、图形处理单元(gpu)、现场可编程门阵列(fpga)、专用集成电路(asic)和/或微控制器。优选地,控制器306被配置成至少部分地执行分析组织样品的方法500,例如步骤504至512中的一些或全部。
80、在图3的实例中,控制器306被配置成控制微流体单元308,所述微流体单元308可以是装置300的一部分或者可以作为独立单元提供。所述微流体单元308包括储存器308a,所述储存器308a配置成储存流体,例如载体流体和/或溶解流体;并连接到微流体系统304的输入端口110。所述微流体单元308还可以包括泵(未示出)和/或一个或多个阀(未示出),其用于将储存在储存器308a中的流体供应到输入端口110。控制器306可以被配置成产生用于泵和/或一个或多个致动器的控制信号,其被配置成打开和关闭所述阀,以便开始和停止流体向测量体积106的流动,例如产生从样品体积106到测量体积114的载体流体流和/或供应包含用于组织样品102的酶促消化的一种或多种酶的溶解流体。
81、在一些实施方案中,微流体单元308还可以被配置成向微流体系统304供应鞘流体以在测量体积中产生鞘流,例如如上文参考图1所述。微流体单元308可以例如包括用于储存鞘流体的另外的储存器(未示出)和泵(未示出)和/或一个或多个阀(未示出),其用于将鞘流体供应到微流体系统304的相应端口。在其它实例中,例如通过将储存器308a连接到微流体系统304的相应端口,储存在储存器308a中的载体流体也可以用作鞘流体。控制器306可以被配置成控制微流体单元308以通过向微流体系统304供应鞘流体来流体动力学地聚焦测量体积114中的载体流体。
82、控制器306还被配置成控制超声源310,所述超声源310可以是装置300的一部分或者可以作为独立单元提供。所述超声源310被配置成向样品体积106施加超声,并且例如可以包括具有一个或多个超声发射器的超声波发生器,所述超声波发生器被配置成与托架302和/或微流体系统304接触。在图3的实例中,超声源310被配置成以目标方式将超声施加到样品体积106,例如通过使超声波发生器与样品体积106的侧壁和/或微流体系统304的超声发射器(例如图1的微流体系统100的超声发射器126)接触。在其它实例中,超声源310可以被配置成,例如经由托架302将超声施加到整个微流体系统304。在一个实例中,超声源310或其组合,例如超声波发生器和/或一个或多个超声波发射器,可以整合到托架302中。
83、所述装置300还包括致动器312,其被配置成在样品体积106内移动可移动元件202,其中可移动元件202可以作为微流体系统304或装置300的一部分提供。可移动元件202例如可以是具有盖构件的活塞,其被配置成密封样品体积106的插入开口106a,并通过致动器312推进到样品体积106中,如图3所示,例如使得盖构件沿着样品体积106的侧壁滑动,同时密封样品体积106的相应部分。所述致动器312例如可以包括电动机(未示出),所述电动机被配置成机械地耦合到可移动元件202。所述电动机可以例如移动与可动元件202接触的杆或轴。在另一个实例中,致动器312可以包括压电致动器,所述压电致动器与可动元件202接触或机械地耦合到可动元件202。在又一个实例中,致动器312可包括液压压力源,其被配置成经由液压流体将正压或负压施加到可移动元件202以便移动可移动元件202。所述控制器306被配置成通过产生相应的控制信号来控制致动器312,以移动样品体积106内的可移动元件,特别是用于将组织样品102移动到样品体积106内的指定位置。
84、控制器306还可以被配置成提供其它功能,例如控制微流体系统304的托架302和/或元件,例如细胞分选器(未示出)和/或一个或多个阀。控制器306可以特别地被配置成控制定量相差显微镜400和/或获得并分析用定量相差显微镜400获取的相移图像,例如如下参考图4详述的。
85、图4描绘了根据本发明的示例性实施方案的图3的装置300的定量相差显微镜400的示意图。定量相差显微镜400是数字全息显微镜,其被配置成获取样品(特别是微流体系统304的测量体积114中的单细胞122和/或细胞聚集体)的相移图像以及振幅或强度图像。
86、数字全息显微镜400包括具有物镜404、全息成像系统406和成像透镜408的成像系统402。成像系统402被配置成例如通过微流体系统304的顶面中的检测窗口118将成像系统402的焦平面成像到镜头410上。所述镜头例如可以是ccd或cmos镜头。成像系统402的焦平面位于测量体积114内,优选地位于载体流体流124a流动所沿的平面内。显微镜400还包括用于照明测量体积114的照明源412和被配置成从镜头410获得图像的控制器414。所述控制器414还可以被配置成控制全息成像系统406、镜头410和/或照明源412。
87、物镜404例如可以是数值孔径大于0.4,在一些实例中,大于0.5的高na物镜。物镜404的景深可以小于10μm,优选地小于5μm,其中景深可以例如被定义为例如在1064nm的波长下由物镜404聚焦的激光束的最小瑞利长度。这可以允许精确地聚焦在测量体积114中的物体例如细胞上,例如在流体动力学聚焦的载体流体流124a中,并且可以提供足够的空间分辨率以解析细胞的形态特征。
88、全息成像系统406被配置成例如通过将成像光束与参考光束在镜头410上干涉来在镜头410上创建干涉图像。成像光束可以例如是穿过测量体积114并沿着穿过全息成像系统406的第一光路从成像系统402的焦平面传播到镜头410的光束。参考光束例如可以是沿着通过全息成像系统406的第二光路传播到镜头410的光束。在一些实例中,参考光束可以例如使用分束器或衍射光栅与成像光束分离,即,参考光束也可以已经穿过测量体积114并且可以沿着第二光路从成像系统402的焦平面传播到镜头410。在其它实例中,参考光束可以不穿过测量体积114,并且可以例如在测量体积114前面与成像光束中分离。
89、数字全息显微镜400可以是同轴数字全息显微镜,其中成像光束和参考光束在干涉时沿着同一轴传播,即以0°角度干涉。控制器414可以例如被配置成通过使用全息成像系统406改变参考光束和成像光束之间的相位偏移,从多个干涉图像中提取或重建相移图像以及样品的强度图像。优选地,显微镜400是离轴数字全息显微镜,其中成像光束和参考光束以一定角度干涉。在这种情况下,控制器414可以被配置成从单个干涉图像中提取或重建相移图像以及样品的强度图像。
90、照明源412被配置成例如通过微流体系统304的与检测窗口118相对的底面中的照明窗口来照明测量体积114。照明源412被配置成通过空间和/或时间相干光来照明测量体积114,其中照明光的相干长度可以例如大于显微镜400的视野,并且照明光的相干时间可以例如大于图像和参考光束之间的时间延迟,即使得可以在镜头410上观察到干涉图案。照明源412可以例如包括激光器或发光二极管,并且可以被配置成发射例如在500nm至1100nm波长的单色光。
91、控制器414可以在硬件、软件或其组合中实现。控制器414可以被配置成向另一个装置(例如装置300的控制器306)提供相移和强度图像。在一些实例中,控制器414或其一部分可以整合到控制器306中。除了重建相移和强度图像之外,控制器414还可以被配置成分析相移和/或强度图像。控制器414可以例如被配置成例如通过从相移和/或强度图像确定细胞的一个或多个形态参数并基于形态参数确定细胞类型来确定图像中的一种或多种细胞的细胞类型。控制器414可以被配置成使用计算机视觉技术分析相移和/或强度图像,并且可以例如被配置成使用基于神经网络的分类器从相移图像确定一种或多种细胞的细胞类型。
92、在一些实例中,显微镜400还可以被配置成使用其它成像技术,例如亮场显微镜、荧光显微镜和/或超分辨率显微镜,获取测量体积114中的单细胞122和/或细胞聚集体的图像,特别是强度图像。可选地,装置300还可以包括被配置成获取这种图像的第二显微镜(未示出)。
93、在一些实施方案中,装置300的控制器306经配置以基于所确定的一种或多种细胞的细胞类型来控制微流体系统304的细胞分选器,例如以将某一类型的细胞与载体流体流124a中的其它细胞选择性地分离。所述控制器306可以例如被配置成确定相应类型的细胞是否包含在相移图像中。所述控制器306可以被配置成例如基于细胞在相移图像中的位置和载体流体流124的流速来确定相应细胞在细胞分选器的到达时间。所述控制器306可以被配置成在到达时间向细胞分选器提供诸如电压的控制信号,例如使细胞偏转到多个通道中的一个。
94、图5示出了根据本发明的示例性实施方案的使用定量相差显微镜分析组织样品的方法500的流程图。例如,所述方法500可以用图3的装置300和图2的微流体系统200来实现,其在下文用作说明目的的实例。然而,这并不旨在以任何方式进行限制,并且所述方法500也可以使用具有定量相差显微镜的不同装置和/或使用不同的微流体系统来实现,例如图1的微流体系统100或图3的微流体系统304。此外,方法500不限于图5的流程图中所示的执行顺序。只要在技术上可行,方法500可以以任意顺序执行,并且其部分可以至少部分地同时执行。
95、在步骤502中,在微流体系统200的样品体积106中提供组织样品102。组织样品102包括形成连续组织材料的多个生物细胞,其中细胞通过细胞外基质相互连接。组织样品102例如可以是先前例如通过切开或切除活检从患者中提取的活检样品。优选地,组织样品是针吸活检样品,其可以直接从患者体内提取或者从已经从患者体内取出的更大的组织块中提取。组织样品102可以例如通过将包含组织样品102的活检针的尖端通过插入开口106a插入到样品体积106中并将组织样品102从活检针中释放而提供在样品体积106中。随后,可以通过将盖构件202a置于插入开口106a中来密封样品体积106。在一些实例中,步骤502可以包括在将组织样品102提供到样品体积106之前或之后冲洗组织样品102,例如以去除组织样品102中的血液。
96、在步骤504中,将组织样品102的至少一部分溶解成单细胞122和/或细胞聚集体,其中细胞聚集体例如可以是例如各自包含2至20个细胞的小簇。为此,例如通过输入端口110和/或插入开口106a将载体流体(例如等渗流体和/或缓冲溶液,例如磷酸盐缓冲盐水(pbs)或诸如达尔伯克改良伊格尔培养基(dulbecco’s modified eagle’smedium,dmem)的最低基本培养基)提供到样品体积106中。所述载体流体可以例如由控制器306使用微流体单元308提供。所述流体可以填充整个样品体积102并且可以完全包围组织样品102。
97、可以例如通过酶促消化来溶解组织样品102。为此,可以例如通过控制器306使用微流体单元308将溶解的流体供应到样品体积106。所述溶解流体包括用于组织样品102的酶促消化的一种或多种酶。所述一种或多种酶可以例如包含一种或多种胶原酶,如ii型胶原酶,和/或胰蛋白酶。在一些实例中,所述载体流体可以包括一种或多种酶,即也可以用作溶解流体,或者可以将溶解流体供应到储存器308a或将储存器308a连接到输入端口110的通道,以在将载体流体提供到样品体积106之前将溶解流体混合到载体流体中。组织样品102可以以预定量的时间暴露于一种或多种酶,例如5分钟至60分钟在一个实例中20分钟至40分钟。例如,可以基于组织样品102的尺寸、组织样品102中组织的类型和/或一种或多种酶来选择暴露时间。在一些实施方案中,在进行到步骤506之前,去除样品体积106中的一种或多种酶。在其它实例中,组织样品102可以在步骤506至512的一些或全部步骤期间连续暴露于一种或多种酶,例如直到组织样品102完全溶解。
98、在一些实例中,可以在不同的时间点将一种或多种酶供应到样品体积106和/或可以将组织样品102以不同的时间量暴露于一种或多种酶。例如,可以在第一时间点将第一种酶供应到样品体积106,并且可以在比第一时间点晚的第二时间点将第二种酶供应到样品体积106,其中第一种酶可以在供应第二种酶之前从样品体积106中去除或可以在供应第二种酶之前不从样品体积106中去除。另外地或可选地,组织样品可以以第一暴露时间暴露于第一种酶并且以不同于第一暴露时间的第二暴露时间暴露于第二种酶。例如,其中一种酶可以是ii型胶原酶,而另一种酶可以是胰蛋白酶,其中暴露于胰蛋白酶的时间可以比暴露于ii型胶原酶的时间短,例如以避免由于组织样品102长时间暴露于胰蛋白酶而损害细胞的表面蛋白。
99、另外地或可选地,组织样品102可以通过向组织样品施加超声,例如通过控制器306使用超声源310来溶解。所述超声的频率可以例如为10khz至10mhz,在一个实例中,为20khz至100khz,并且可以例如施加预定的时间量,例如30秒至60分钟。超声可以例如在预定的时间量期间连续地或作为脉冲序列施加。在一些实施方案中,组织样品102可以在步骤506至512的一些或全部步骤期间永久地或重复地暴露于超声,例如直到组织样品102完全溶解。例如,通过在上述酶促消化之前、期间和/或之后应用超声,超声的应用可以与酶促消化相结合。
100、在步骤506中,产生从样品体积106到测量体积114的载体流体流124a。控制器306可以例如控制微流体单元308的泵和/或一个或多个阀,以将载体流体从储存器308a供应到输入端口110,从而产生通过微流体系统200从输入端口110到输出端口116a、116b的载体流体流124a。载体流体流124a可以将从组织样品102分离的单细胞122和/或细胞聚集体从样品体积106输送到测量体积114。在一些实例中,载体流体流124a可以是连续流,例如,其在例如溶解组织样品102的同时保持预定时间量。在其它实例中,载体流体流124a可以是脉冲流。例如,所述脉冲流可以包括交替序列的周期,其中产生并维持载体流体流124a以将单细胞和/或细胞聚集体输送到测量体积114;以及载体流体流124a停止的周期,例如在将单细胞和/或细胞聚集体再次输送到测量体积114之前进一步溶解组织样品102。在一个实例中,载体流体流124a可以在停止1分钟至30分钟的时间段之前维持1秒至60秒的时间段。如上所述,载体流体也可以是或包括用于组织样品的酶促消化的溶解流体,即可以包括一种或多种酶。
101、在步骤508中,使用定量相差显微镜400获取测量体积114中的单细胞122和/或细胞聚集体的第一组相移图像。第一组相移图像例如可以是单个图像或者可以是多个图像。特别地,第一组相移图像可以是例如在15hz至240hz的重复率的图像的连续视频流,其可以在单细胞122和/或细胞聚集体通过载体流体流124a输送通过测量体积114的同时被记录。
102、随后,在步骤510中,组织样品102相对于与测量体积114流体连通的样品体积102的出口,例如相对于样品体积106的侧壁中的输送通道112b的开口移动。组织样品102可以例如从样品体积102中的第一位置(例如,在步骤506和/或508中的组织样品102的位置)移动到第二位置。为了移动组织样品102,具有可移动元件202a的活塞202可以从插入开口106a推进到样品体积106中,从而将组织样品102进一步推入到样品体积106中。组织样品102可以例如在第一和第二位置之间移动50μm至1mm。在一个实例中,组织样品102的前部可以邻近输送通道112b的开口,并且当组织样品102处于第一位置时,暴露于载体流体流124a。相应地,组织样品102的不同部分,例如邻近前部的部分,例如中心部分,可以邻近输送通道112b的开口,并且当组织样品102处于第二位置时,暴露于载体流体流124a。在将组织样品移动到第二位置之后,例如通过包含在载体流体中的酶、通过提供溶解流体和/或通过施加超声,可以继续组织样品的溶解。
103、在步骤512中,在组织样品102处于第二位置时,使用定量相差显微镜400获取测量体积114中的单细胞122和/或细胞聚集体的第二组相移图像。类似于第一组相移图像,第二组相移图像例如可以是单个图像或者可以是多个图像,特别是图像的连续视频流。
104、在一些实施方案中,可以连续地重复步骤510和512,例如顺序移动组织样品102经过样品体积106的出口。组织样品102可以例如以50μm至500μm的等距步骤顺序移动。通过将组织样品102的不同部分暴露于载体流体流124a,可以获得关于组织样品102的细胞组成的信息,将其沿着组织样品102的纵向方向(对应于组织样品102在样品体积106中移动的方向)空间解析。可以顺序移动组织样品102,直到组织样品102的端部邻近样品体积106的出口,在每个位置获取一组相移图像。
105、在一个实例中,组织样品102可以随后移动回第一位置,并且可以重复顺序扫描。由于组织样品102的溶解,组织样品102的外层可能已经被去除,从而暴露出组织样品102的内层。因此,所述载体流体流124a可以主要包含源自内层的单细胞122和/或细胞聚集体,其可以通过获取另一组相移图像来成像。这可以允许获得关于组织样品102的细胞组成的信息,将其沿着组织样品102的纵向方向以及在从组织样品102的外表面到组织样品102的核心的径向方向上空间解析。在一些实施方案中,可以在方法500的执行期间不移动组织样品102,但是可以在溶解组织样品102的同时在不同的时间点获取多组相移图像。
106、方法500还可以包括另外的步骤。方法500可以例如包括通过向鞘流通道120供应鞘流体,例如载体流体或具有与载体流体不同的组成的流体而产生鞘流124b,以便将载体流体流124b流体动力学地聚焦到例如显微镜400的焦平面或焦点。另外地或可选地,可以例如通过提供含有聚合物如聚乙二醇或透明质酸的粘弹性载体流体而粘弹性地聚焦载体流体流124a。
107、方法500还可以包括例如基于细胞的形态特征和/或使用机器学习分类器从相移图像确定一种或多种细胞的细胞类型。在一个实施方案中,细胞类型特异性成像标志物,例如附着于细胞类型特异性抗体的金属簇,可以提供给例如在载体流体中的样品体积106和/或测量体积114,并且可以使用成像标志物来确定细胞类型。
108、方法500还可以包括使用细胞分选器204对单细胞122和/或细胞聚集体进行分选,例如通过向电极206选择性地施加电压以使载体流体流124a中的一个或多个细胞122和/或细胞聚集体偏转到分别与输出端口116a和116b连接的通道中。例如,可以施加电压,使得第一细胞类型的单细胞122和/或细胞聚集体朝向输出端口116a偏转,而其它所有细胞122和/或细胞聚集体朝向输出端口116b偏转。
109、本文所公开的本发明的实施方案仅构成用于说明目的的具体实例。本发明可以以各种方式和许多不改变潜在的基本特性的修改来实现。因此,本发明仅通过所述的权利要求来限定。
110、参考符号列表
111、100-微流体系统
112、102-组织样品
113、104-衬底
114、106-样品体积
115、106a-插入开口
116、108-盖构件
117、110-输入端口
118、112a-输入通道
119、112b-输送通道
120、112c-输出通道
121、114-测量体积
122、116、116a、116b-输出端口
123、118-检测窗口
124、120-鞘流通道
125、122-单细胞
126、124a-载体流体流
127、124b-鞘流
128、126-超声发射器
129、200-微流体系统
130、202-可移动元件/活塞
131、202a-盖构件
132、204-细胞分选器
133、206-电极
134、300-装置
135、302-托架
136、304-微流体系统
137、306-控制器
138、308-微流控单元
139、308a-储存器
140、310-超声源
141、312-致动器
142、400-定量相差显微镜
143、402-成像系统
144、404-物镜
145、406-全息成像系统
146、408-成像透镜
147、410-镜头
148、412-照明源
149、500-分析组织样品的方法
150、502-提供组织样品的步骤
151、504-至少部分地溶解组织样品的步骤
152、506-产生载体流体流的步骤
153、508-获取第一组相移图像的步骤
154、510-在样品体积中移动组织样品的步骤
155、512-获取第二组相移图像的步骤
- 还没有人留言评论。精彩留言会获得点赞!