基于夹心ELISA的纳米等离子共振生物芯片以及快速定性定量检测目标物的方法与流程
基于夹心elisa的纳米等离子共振生物芯片以及快速定性定量检测目标物的方法
技术领域
1.本发明属于抗原的等离子共振定量检测技术领域,特别是基于夹心elisa的纳米等离子共振快速定性定量检测。
背景技术:
2.酶联免疫吸附测定(elisa)作为传统的夹心免疫测定法,检测速度快、费用低廉,在血清标志物检测分析中应用广泛,但这种检测方法的检测限度有限,检测过程相对繁琐耗时,酶标抗体不耐储存,酶催化反应条件相对苛刻。因而,开发一种信号稳定、高灵敏的,具有普遍性和易于实施的生物标志物检测策略在临床诊断和治疗监测中具有的重要意义。
3.纳米表面等离子共振技术(nanospr)是一项完全不同于等离子共振芯片技术(spr)和局部表面等离子体共振技术(lspr)的全新定性定量检测技术。表面等离子共振(spr)主要是建立在全反射模式上,利用衰减全反射棱镜耦合方法,实现激光激发表面等离子波,通过检测全反射角度的变化,引起消光光谱的移动,进而获取生化反应的信息。局部表面等离子体共振技术(lspr)则是当光线入射到由贵金属构成的纳米颗粒上,且入射光子频率与贵金属纳米颗粒或金属传导电子的整体振动频率相匹配时,纳米颗粒或金属会对光子能量产生很强的吸收作用,在光谱上出现一个强的共振吸收峰。
4.然而,纳米表面等离子体共振(nanospr)是通过入射光与金属纳米结构的共振耦合,利用表面等离子体共振的波长对于纳米结构周围介电环境的敏感性,实现对生化反应的检测。当吸附分子的折射率与周围环境的折射率存在差异时,吸附于基底表面的生物分子与目标分子的反应会改变基底表面的折射率,从而引起共振峰的变化,实现目标物质的检测。因此,纳米表面等离子体传感器的共振分析无需使用传统spr技术那样的复杂光学系统,与lspr在技术原理上也存在明显的差异。
5.现有技术中,例如中国专利申请cn110779905a提供了一种基于表面增强拉曼散射的金纳米标记的试纸条、制备方法及使用方法,该方法是在共轭垫上包被金纳米棒,在金纳米棒表面修饰有拉曼分子和牛血清白蛋白。拉曼分子作为拉曼报告分子,用于反馈在激发光下最大表面增强拉曼散射的信号。牛血清白蛋白(bsa)能增强金纳米棒的稳定性,防止金纳米棒彼此聚集,影响性能。上述试纸条通过包被鼠抗人甲胎蛋白检测抗体等肿瘤标志物检测抗体,从而实现抗原肿瘤标志物的拦截。
6.又例如中国专利申请cn101617229a提供了一种lspr的酶测定的方法,该方法是利用固定化酶与底物产生不溶性沉淀,这种沉淀在lspr表面聚集,引起表面反射光或透射光的变化;具体而言是在金包被表面固定用于检测目标物的第一捕获抗体,然后利用第一捕获抗体和第二捕获抗体与目标物结合,再加入酶底物氯化硝基蓝四氮唑(nbt)、5-溴-4-氯-3
′‑
吲哚基磷酸酯对甲苯胺盐(bcip)、3,3
′
,5,5
′‑
四甲基联苯胺(tmb)、4-氯-1-萘酚(4-cn)和3,3
′‑
二氨基联苯胺四盐酸盐(dab),使结合物形成不溶性沉淀,这种沉淀在进行检测时使得金颗粒的消光谱朝长波长的方向位移。
7.然而,上述这两种方法都存在检测灵敏度不高,检测光路系统复杂,检测通量低等不足。
技术实现要素:
8.针对以上现有技术的不足,本发明提供了基于夹心elisa的纳米等离子共振生物芯片,并利用该芯片快速定性定量检测目标物的方法。该方法选用特定尺寸结构的纳米等离子共振生物芯片(以下简称芯片),利用酶标二抗与tmb溶液反应产生的tmb离子,与生物芯片表面的贵金属(ag、au)发生刻蚀反应,从而导致吸收全光谱的光谱峰od值产生明显的下降,进而实现目标物的快速定性定量检测;本发明的检测方法的技术原理完全不同于上述现有技术。具体通过以下技术实现。
9.基于夹心elisa的纳米等离子共振生物芯片,包括基片和修饰在所述基片上的包被抗体;所述基片包括基底和从下至上依次镀在所述基底表面且厚度为1-20nm钛膜层、2-80nm银膜层和2-70nm金膜层,或者包括基底和从下至上依次镀在所述基底表面且厚度为1-20nm钛膜层、2-70nm银膜层,所述包被抗体用于与目标物特异结合;所述基底表面压印矩阵排列的纳米孔。。
10.上述nanospr生物芯片的基片,是采用目前公知的制备方法制备而成,即首先利用激光干涉光刻在硅晶圆纳米柱模具上制作纳米杯阵列,然后将紫外光固化聚合物溶液涂覆在清洁的硅晶圆纳米柱模具上,采用匀胶仪使表面的胶溶液均匀铺展,再将聚对苯二甲酸乙二醇酯(pet)薄板缓慢贴合于覆盖有紫外光固化聚合物的纳米柱模具上,使之于模具完全贴合,置于紫外线下进行固化处理;接着将pet薄板连同带有纳米杯阵列的紫外光固化聚合物从模具上剥离,即得到基底;最后在纳米杯阵列表面依次蒸镀钛膜、银膜、金膜,即得到nanospr生物芯片的基片。
11.如上所述,本发明提供的nanospr生物芯片的基片具有两种结构形式,即一种结构为基底+钛膜层(1-20nm)+银膜层(2-80nm)+金膜层(2-70nm),另一种结构为基底+钛膜层(1-20nm)+银膜层(2-70nm),使用这两种结构形式的基片制备的spr芯片,都能获得比较准确的定量检测结果,检测限较低。各类目标物标准品及其包被抗体均可以市场采购获得。
12.上述纳米等离子共振生物芯片(nanospr生物芯片)能够用于检测所有具有特异性抗体和二抗的抗原或化学物质(即目标物),例如可以广泛应用于肿瘤标志物(甲胎蛋白afp、前列腺特异抗原psa、癌胚抗原cea等)、动物疾病(非洲猪瘟病毒、禽流感病毒、猪瘟病毒抗体、猪禽流感、犬细小、犬瘟、猫瘟抗体等等)、食品中的小分子物质(抗生素类、毒素类、氟虫腈、黄曲霉素、额外添加物类等)的快速定性定量检测中。
13.优选地,所述基片包括基底和从下至上依次镀在所述基底表面且厚度为2-9nm钛膜层、5-30nm银膜层、2-10nm金膜层;进一步优选地,所述基片包括基底和从下至上依次镀在所述基底表面且厚度为2-5nm钛膜层、5-10nm银膜层、2-5nm金膜层。
14.优选地,所述基片包括基底和从下至上依次镀在所述基底表面且厚度为2-9nm钛膜层、5-30nm银膜层。进一步优选地,所述基片包括基底和从下至上依次镀在所述基底表面且厚度为2-5nm钛膜层、5-10nm银膜层。
15.一种权利要求基于夹心elisa的纳米等离子共振生物芯片的制备方法,包括以下步骤:
16.s1、制备、清洗所述基片,使用cbs缓冲液稀释包被抗体,获得包被抗体工作液,取包被抗体工作液包被所述基片,4-37℃孵育2-24h;
17.s2、用pbst缓冲液洗板、拍板,加入150μl封闭剂,25-37℃孵育30-120min;
18.s3、然后加入150μl保护剂,25-37℃孵育1-60min,烘干去除保护剂,制成所述纳米等离子共振生物芯片。
19.上述制备方法中,当选用的基片结构为上述的基底-钛膜层-银膜层-金膜层时,包被抗体一般用10mm的cbs缓冲液将afp包被抗体稀释至浓度2μg/ml,然后加入50μl包被抗体工作液;当选用的基片结构为上述的基底-钛膜层-银膜层时,包被抗体一般用10mm的cbs缓冲液将afp包被抗体稀释至浓度20μg/ml,然后加入1μl包被抗体工作液。
20.cbs缓冲液的原料组成为:碳酸钾8-12g、碳酸氢钠15-20g、防腐剂proclin3005-10ml、纯化水500ml。pbst缓冲液的原料组成为:十二水磷酸氢二钠20-30g、磷酸二氢钠2-5g、氯化钾1-3g、氯化钠60-80g、tween-20 5-10ml、防腐剂proclin3005-10ml、双蒸水10l。封闭剂是将牛血清白蛋白溶解于cbs溶液中配制而成的浓度10μg/ml的复合液。保护剂是将糖类(葡聚糖、葡萄糖、蔗糖、海藻糖中的一种)溶解于pbst溶液中配制而成的浓度10-200μg/ml的复合液。
21.一种芯片微孔板,集成了上述任意一种纳米等离子共振生物芯片。
22.一种快速定性定量检测目标物的检测试剂盒,含有上述任意一种纳米等离子共振生物芯片,或含有上述芯片微孔板。
23.更优选地,上述检测试剂盒还包括洗涤液、目标物标准品、目标物的检测抗体,所述检测抗体为酶标二抗,所述酶标二抗所用的酶是辣根过氧化物酶,酶底物为3,3',5,5'-四甲基联苯胺、4-氯-l-萘酚、3,3'-二氨基联苯胺四盐酸盐中至少一种。例如检测抗体可以是hrp标记的检测抗体等。
24.一种不以诊断和治疗为目的的快速定性定量检测目标物的方法,使用上述任意一种的纳米等离子共振生物芯片,或使用上述的芯片微孔板,或使用上述的检测试剂盒进行检测。不论是直接使用上述nanospr生物芯片,还是使用集成了nanospr生物芯片的芯片微孔板,或是装有上述nanospr生物芯片或芯片微孔板的试剂盒,其检测方法和原理都是相同的,都是先清洗读取初始值,然后加入浓度梯度的目标物标准品和tmb溶液,在芯片表面发生金属(ag、au)刻蚀反应,检测终点值,计算初始值和终点值差,然后绘制标准曲线,最后加入待测样品,记录终点值,根据标准曲线对应得出相应的浓度。
25.更优选地,上述快速定性定量检测目标物的方法具体包括以下步骤:
26.p1、用洗涤液清洗纳米等离子共振生物芯片之后再加入洗涤液,放入酶标仪中记录初始值,弃去残余的液体;
27.p2、在若干纳米等离子共振生物芯片中分别加入30-150μl的不同浓度梯度的目标物标准品,或加入稀释特定倍数后的待测样本,以及目标物的合适浓度的酶标检测抗体,振板反应,弃去微孔内液体;再用洗涤液清洗、拍板甩干;
28.p3、每个纳米等离子共振生物芯片对应加入25-100μl tmb溶液,振板反应10-20min后,放入酶标仪中记录终点值,以初始值减去终点值计算反应值,绘制不同浓度梯度的目标物标准品的反应值标准曲线;记录稀释后的待测样本终点值,对照标准曲线读取获得待测样本的浓度。
29.上述步骤p2中,tmb溶液购买于北京索莱宝科技有限公司。当选用的基片结构为上述的基底-钛膜层-银膜层-金膜层时,检测抗体的一般浓度为2pg/ml,用量50μl。当选用的基片结构为上述的基底-钛膜层-银膜层时,检测抗体的一般浓度为20pg/ml,用量50μl;或者浓度1ng/ml,用量1μl;或者浓度0.1ng/ml,用量1μl。即随着钛膜层和银膜层的厚度变化,检测抗体的量总体而言保持不变,可以随机调整检测抗体的浓度和用量。所用的包被抗体,以及芯片微孔板中所提到的cbs缓冲液、目标物的检测抗体、目标物的标准品、pbst缓冲液、保护剂、封闭剂均使用市面上常见可以购买到的试剂原料。
30.上述的纳米等离子共振生物芯片能够针对各种定性定量检测领域的目标物,在基片上包被相应的包被抗体或蛋白,用相应的酶标二抗和tmb溶液与之反应。现有的中国专利申请cn101617229a提供的技术手段,是基于lspr技术,利用固定的酶与酶底物发生反应形成不溶性沉淀,这种沉淀会对芯片的光谱产生影响,并且导致产生的消光谱朝长波长的方向发生位移,进而能够定性检测目标物是否存在;对金包被的纳米颗粒阵列的厚度没有特殊要求,5-1000nm都可以;并且该现有技术主要检测反射光谱。本发明则与上述现有技术明显不同,本发明的技术原理,是利用tmb离子在nanospr生物芯片表面对金属发生刻蚀反应,导致光谱峰减弱甚至消失,为了观测到这种光谱峰的变化和提高检测灵敏度,nanospr生物芯片上的金属层厚度必须非常薄;在检测时,先产生蓝色的tmb离子的峰,发生刻蚀反应后蓝色峰消失,同时芯片的吸收光谱峰od值也会明显下降;酶催化产生tmb离子的浓度越大,与芯片上贵金属的刻蚀反应越明显,进而导致芯片的吸收峰就会越低。因此,两者的技术原理明显不同,产生的技术效果也明显不同。
31.优选地,步骤p3中,在加入tmb溶液振板反应后,还加入了终止液,然后放入酶标仪中记录终点值。加入终止液后,能够一定程度提升检测精度,降低检测限。
32.与现有技术相比,本发明的有益之处在于:本发明提供了一种利用夹心elisa法与微孔等离子共振芯片法进行联用,采用一步式加样快速定量检测不同目标待测物的方法,采用本发明提供的nanospr芯片,能够显著提高目标待测物的检测灵敏度,降低检测限,极大简化了操作步骤,提高了检测效率。
附图说明
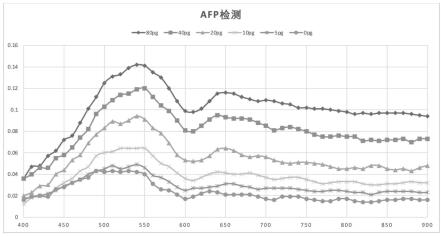
33.图1为实施例1的8个浓度梯度的甲胎蛋白的反应值全光谱图;
34.图2为实施例1的8个浓度梯度的甲胎蛋白的580nm处的od值柱状图;
35.图3为实施例1的甲胎蛋白的标准曲线示意图;
36.图4为实施例2的8个浓度梯度的前列腺特异抗原的反应值全光谱图;
37.图5为实施例2的8个浓度梯度的前列腺特异抗原的720nm处的od值柱状图;
38.图6为实施例2的前列腺特异抗原的标准曲线示意图;
39.图7为实施例3的8个浓度梯度的非洲猪瘟病毒的反应值全光谱图;
40.图8为实施例3的8个浓度梯度的非洲猪瘟病毒的720nm处的od值柱状图;
41.图9为实施例3的非洲猪瘟病毒的标准曲线示意图;
42.图10为实施例4的非洲猪瘟血清样本的标准曲线示意图;
43.图11为实施例4的非洲猪瘟血清样本的720nm处的od值柱状图;
44.图12为实施例5的8个浓度梯度的磺胺的反应值全光谱图;
45.图13为实施例5的8个浓度梯度的磺胺在双波长615nm和650nm的od值差值图;
46.图14为实施例5的磺胺的标准曲线示意图。
具体实施方式
47.下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动条件下所获得的所有其它实施例,都属于本发明保护的范围。
48.本发明提供的基于夹心elisa的纳米等离子快速定性定量检测目标物的方法,为了证明其对肿瘤标志物、动物疾病、食品小分子均具有非常高的检测效果,下面针对肿瘤标志物、动物疾病、食品小分子,分别各举1个或若干采用本发明的检测方法的实施例。肿瘤标志物以甲胎蛋白(简称afp)和前列腺特异抗原(简称psa)为代表的,动物疾病以非洲猪瘟病毒为代表,食品小分子以磺胺为代表。
49.甲胎蛋白(简称afp)是一种糖蛋白,在胎儿血液中具有较高浓度,但在成人血清中含量极低。甲胎蛋白与肝癌及多种肿瘤的发生发展密切相关,在多种肿瘤中均表现出较高浓度,可作为多种肿瘤的阳性检测指标。目前临床上主要作为原发性肝癌的血清标志物,用于原发性肝癌的诊断及疗效监测。
50.前列腺特异抗原(简称psa)只存在于人前列腺腺泡及导管上皮细胞胞浆中,不表达于其它细胞,前列腺炎、良性前列腺增生和前列腺癌均可导致总psa水平(游离、复合psa)升高。
51.以下实施例中所采用的基片均为量准(上海)医疗器械公司生产制得;甲胎蛋白、前列腺特异抗原的包被抗体、检测抗体(hrp修饰的二抗)采购自义翘神州公司;甲胎蛋白、前列腺特异抗原标准品采购自义翘神州公司。非洲猪瘟病毒的标准品(非洲猪瘟蛋白p54,cd2v蛋白)及其相应包被抗体、检测抗体(hrp修饰的二抗)采购自科前生物股份有限公司,磺胺的标准品及其相应包被抗体、检测抗体(hrp修饰的二抗)采购自广州优抗多生物技术有限公司。
52.cbs缓冲液的原料组成为:碳酸钾8-12g、碳酸氢钠15-20g、防腐剂proclin3005-10ml、纯化水500ml。
53.pbst缓冲液的原料组成为:十二水磷酸氢二钠20-30g、磷酸二氢钠2-5g、氯化钾1-3g、氯化钠60-80g、tween-20 5-10ml、防腐剂proclin300 5-10ml、双蒸水10l。
54.封闭剂是将牛血清白蛋白溶解于cbs溶液中配制而成的浓度10-100μg/ml的复合液。保护剂是将蔗糖溶解于pbst溶液中配制而成的浓度100-1000μg/ml的复合液。洗涤液选用pbst缓冲液。
55.实施例1
56.本实施例提供了一种用于检测甲胎蛋白(afp)的检测方法,在进行检测之前,将nanospr芯片集成到微孔板上,制成芯片微孔板,集成制作方法是:
①
在氧化硅片上光刻制作出12寸硅晶圆纳米孔模具;
②
通过纳米压印方法将12寸硅晶圆纳米模具上的纳米结构转印到高分子柔性材料基底(pet薄板基底)上形成反相的晶圆级纳米器件结构;
③
在其表面依次镀上5nm钛膜层、10nm银膜层、5nm金膜层,制成基片;
④
然后将基片采用粘贴的方式,集成到96孔微孔板的底部,制成芯片微孔板。
57.(1)清洗芯片微孔板的每个微孔中的基片,使用10mm cbs缓冲液稀释甲胎蛋白的包被抗体获得2μg/ml包被抗体工作液,以50μl/孔的用量用包被抗体工作液包被所述基片,4℃冰箱中孵育12h;
58.(2)用150μl pbst缓冲液洗板3次,拍干后加入150μl封闭剂,烘箱中37℃孵育60min;
59.(3)加入150μl保护剂,烘箱中37℃孵育30min,然后烘干去除保护剂使芯片表面干燥,制成所述spr芯片;
60.(4)每个微孔中用pbst缓冲液150μl清洗微孔板三次,再加入50μl pbst缓冲液,放入酶标仪中记录初始值,弃去微孔内的液体;
61.(5)再在每个微孔中加入50μl的8个浓度梯度(0、5、10、20、4000、80、pg/ml)的甲胎蛋白标准品,以及50μl浓度为2pg/ml的甲胎蛋白的检测抗体,700rpm转速振板反应45min,弃去微孔内液体;每个孔再用150μl pbst缓冲液清洗3次,拍板甩干;
62.(6)每个微孔中分别加入50μl tmb溶液,700rpm转速振板反应15min后,放入酶标仪中记录终点值,以初始值减去终点值计算反应值,甲胎蛋白的反应值全光谱图如图1所示,在580nm波长的od值如图2所示,绘制不同浓度梯度的反应值标准曲线,如图3所示,标准曲线方程式为:y=(a-d)/[1+(x/c)^b]+d,a=0.11769,b=-1.43939,c=29.52081,d=0.00043,r2=0.99968。
[0063]
实施例2
[0064]
本实施例提供了一种用于检测前列腺特异抗原(psa)的检测方法,在进行检测之前,将nanospr芯片集成到微孔板上,制成芯片微孔板,集成制作方法是:
①
在氧化硅片上光刻制作出12寸硅晶圆纳米孔模具;
②
通过纳米压印方法将12寸硅晶圆纳米模具上的纳米结构转印到高分子柔性材料基底(pet薄板基底)上形成反相的晶圆级纳米器件结构;
③
在其表面依次镀上10nm钛膜层、10nm银膜层、10nm金膜层,制成基片;
④
然后将基片采用粘贴的方式,集成到96孔微孔板的底部,制成芯片微孔板。
[0065]
(1)清洗芯片微孔板的每个微孔中的基片,使用10mm cbs缓冲液稀释前列腺特异抗原的包被抗体获得2μg/ml包被抗体工作液,以50μl/孔的用量用包被抗体工作液包被所述基片,4℃冰箱中孵育12h;
[0066]
(2)用150μl pbst缓冲液洗板3次,拍干后加入150μl封闭剂,烘箱中37℃孵育60min;
[0067]
(3)加入150μl保护剂,烘箱中37℃孵育30min,然后烘干去除保护剂使芯片表面干燥,制成所述spr芯片;
[0068]
(4)每个微孔中用pbst缓冲液150μl清洗微孔板三次,再加入50μl pbst缓冲液,放入酶标仪中记录初始值,弃去微孔内的液体;
[0069]
(5)再在每个微孔中加入50μl的8个浓度梯度(0、10、20、40、80、160、320、640pg/ml)的前列腺特异抗原标准品,以及50μl浓度为2pg/ml的前列腺特异抗原的检测抗体,700rpm转速振板反应45min,弃去微孔内液体;每个孔再用150μl pbst缓冲液清洗3次,拍板甩干;
[0070]
(6)每个微孔中分别加入50μl tmb溶液,700rpm转速振板反应15min后,放入酶标仪中记录终点值,以初始值减去终点值计算反应值,前列腺特异抗原的反应值全光谱图如
图4所示,在720nm波长的od值如图5所示,绘制不同浓度梯度的反应值标准曲线,如图6所示,标准曲线方程式为:y=(a-d)/[1+(x/c)^b]+d,a=0.49448,b=-0.89995,c=451.49116,d=-0.00511,r2=0.99712。
[0071]
实施例3
[0072]
本实施例提供了一种用于定性检测非洲猪瘟病毒抗体的检测方法,在进行检测之前,将nanospr芯片集成到微孔板上,制成芯片微孔板,集成制作方法是:
①
在氧化硅片上光刻制作出12寸硅晶圆纳米孔模具;
②
通过纳米压印方法将12寸硅晶圆纳米模具上的纳米结构转印到高分子柔性材料基底(pet薄板基底)上形成反相的晶圆级纳米器件结构;
③
在其表面依次镀上6nm钛膜层、8nm银膜层、6nm金膜层,制成基片;
④
然后将基片采用粘贴的方式,集成到96孔微孔板的底部,制成芯片微孔板。
[0073]
(1)清洗芯片微孔板的每个微孔中的基片,使用10mm cbs缓冲液稀释非洲猪瘟蛋白p54的包被抗体获得2μg/ml包被抗体工作液,以50μl/孔的用量用包被抗体工作液包被所述基片,4℃冰箱中孵育12h;
[0074]
(2)用150μl pbst缓冲液洗板3次,拍干后加入150μl封闭剂,烘箱中37℃孵育60min;
[0075]
(3)加入150μl保护剂,烘箱中37℃孵育30min,然后烘干去除保护剂使芯片表面干燥,制成所述spr芯片;
[0076]
(4)每个微孔中用pbst缓冲液150μl清洗微孔板三次,再加入50μl pbst缓冲液,放入酶标仪中记录初始值,弃去微孔内的液体;
[0077]
(5)再在每个微孔中加入50μl的8个阳性样本浓度梯度(1k、2k、4k、8k、16k倍)的非洲猪瘟抗体血清样本,以及50μl浓度为2pg/ml的非洲猪瘟蛋白p54的检测抗体,700rpm转速振板反应45min,弃去微孔内液体;每个孔再用150μlpbst缓冲液清洗3次,拍板甩干;
[0078]
(6)每个微孔中分别加入50μl tmb溶液,700rpm转速振板反应15min后,放入酶标仪中记录终点值,以初始值减去终点值计算反应值,非洲猪瘟抗体的反应值全光谱图如图7所示,在720nm波长的od值如图8所示,绘制不同样本稀释倍数与反应值拟合曲线,如图9所示,拟合曲线方程式为:y=(a-d)/[1+(x/c)^b]+d,a=0.37569,b=0.98332,c=1461.17596,d=0.01639,r2=0.99902。
[0079]
实施例4
[0080]
本实施例提供了一种用于定性检测非洲猪瘟病毒抗体的检测方法,方法与实施例3基本相同,本实施例选取29例非洲猪瘟血清样本进行测试(样本均已用elisa检测方法确定阴性和阳性),其中19例阴性样本,10例阳性样本,结果与elisa结果符合率100%。29例非洲猪瘟血清样本的全光谱图如图10所示,720nm波长的柱状图如图11。
[0081]
实施例5:
[0082]
本实施例提供了一种基于nanospr生物芯片,采用竞争法检测磺胺的方法。在进行检测之前,将nanospr芯片集成到微孔板上,制成芯片微孔板,集成制作方法是:
①
在氧化硅片上光刻制作出12寸硅晶圆纳米孔模具;
②
通过纳米压印方法将12寸硅晶圆纳米模具上的纳米结构转印到高分子柔性材料基底(pet薄板基底)上形成反相的晶圆级纳米器件结构;
③
在其表面依次镀上9nm钛膜层、30nm银膜层、50nm金膜层,制成基片;
④
然后将基片采用粘贴的方式,集成到96孔微孔板的底部,制成芯片微孔板。
[0083]
(1)清洗芯片微孔板的每个微孔中的基片,使用10mm cbs缓冲液稀释磺胺的抗原获得2μg/ml包被抗原蛋白工作液,以50μl/孔的用量用包被抗原蛋白工作液包被所述基片,4℃冰箱中孵育12h;
[0084]
(2)用150μl pbst缓冲液洗板3次,拍干后加入150μl封闭剂,烘箱中37℃孵育60min;
[0085]
(3)加入150μl保护剂,烘箱中37℃孵育30min,然后烘干去除保护剂使芯片表面干燥,制成所述spr芯片;
[0086]
(4)每个微孔中用pbst缓冲液150μl清洗微孔板三次,再加入50μl pbst缓冲液,放入酶标仪中记录初始值,弃去微孔内的液体;
[0087]
(5)再在每个微孔中加入50μl的8个浓度梯度(0、500、1000、2000、4000、8000、16000、32000pg/ml)的磺胺标准品,以及50μl浓度为2pg/ml的抗磺胺的检测抗体,700rpm转速振板反应45min,弃去微孔内液体;每个孔再用150μl pbst缓冲液清洗3次,拍板甩干;
[0088]
(6)每个微孔中分别加入50μl tmb溶液,700rpm转速振板反应15min后,放入酶标仪中记录终点值,以初始值减去终点值计算反应值,磺胺的反应值全光谱图如图12所示,在双波长615nm和650nm的od值差值图如图13所示,绘制不同浓度梯度的反应值标准曲线,如图14所示,标准曲线方程式为:y=(a-d)/[1+(x/c)^b]+d,a=0.57281,b=0.81894,c=963.49161,d=-0.01152,r2=0.99336。
[0089]
通过上述实施例可知,本发明提供的nanospr生物芯片以及利用该生物芯片的检测方法,对肿瘤标志物、动物疾病、食品小分子等各种不同种类的抗原均能够实现快速定性定量检测,且检测限低,具有非常高的灵敏度。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1