一种植物根系活性氧快速染色定位方法
1.本发明涉及一种植物根系活性氧快速染色定位方法。
背景技术:
2.植物体内活性氧代谢非常迅速,o
2-代谢时间以毫秒计算,代谢最慢的h2o2在体内存留的时间也不过数分钟。对植物组织进行活性氧的染色定位时需考虑其不稳定性,且温度越高、处理时间越长越不稳定,结果越不准确。
3.植物根系为圆柱形,不可能参考植物叶片的活性氧染色和透明的方法,必需经过切片后才能观察。传统的石蜡切片要经过固定、包埋、切片和染色等步骤,所需时间较长,熔蜡的温度较高,活性氧损失过多,不能用于活性氧定位的研究。
4.因此,对活性氧进行定位研究时必需选择快速、准确的方法。
技术实现要素:
5.为了解决现有技术中存在的问题,本发明提供了一种植物根系活性氧快速染色定位方法。本发明使用低温真空染色固定和冰冻切片方法,将活性氧切片完成的时间长度由原来的72h缩短到了12h之内,有效提高了工作效率,且能够极大保存活性氧的原始状态,提高研究准确性。本发明的方法可用于直径在3-8mm之间粗细植物根系的活性氧快速染色切片观察。
6.本发明提供一种植物根系活性氧快速染色定位方法,所述方法包括以下步骤:
7.(1)将植物根系固定到容器底部,添加待测活性氧对应的染色液没过样品,放入真空容器中,进行低温真空染色;
8.(2)丢弃染色液,加入固定液,放入真空容器中,进行低温真空固定;
9.(3)丢弃固定液,加入甘油水溶液,放入真空容器中,进行低温真空填充定形;
10.(4)将冷室及切片刀具预冷至-18℃到-21℃,将丢弃甘油水溶液的植物根系使用otc包埋剂进行包埋,调整固定台温度为-18℃至-19℃,进行切片;
11.(5)植物根系回温后封片。
12.作为优选,步骤(1)-步骤(3)中,所述染色液、固定液、甘油水溶液在使用前预冷至0-4℃。
13.作为进一步优选,步骤(1)-步骤(3)中,所述染色液、固定液、甘油水溶液在使用前预冷至同一温度。
14.作为进一步优选,步骤(1)-步骤(3)中,所述染色液、固定液、甘油水溶液在使用前预冷至0℃。
15.作为优选,步骤(1)-步骤(3)中,所述低温真空具体为:将真空容器预冷至0-4℃,使用时抽真空至真空度-0.05mpa以下。
16.作为优选,步骤(1)-步骤(3)中,所述低温真空具体为:将真空容器预冷至0℃。
17.作为优选,步骤(1)中,所述待测活性氧为o
2-和h2o2,所述o
2-的染色液为:用5mmol/
lph 7.6的3-(n-吗啉)丙烷磺酸钠缓冲液配制的2.5mmol/l的氯化硝基四氮唑蓝溶液;
18.所述h2o2的染色液为:向100mmol/lph 6.9的磷酸钾缓冲液中添加5units/ml辣根过氧化酶,混匀后用其配制成2.5mmol/l 3,3
’‑
二氨基联苯胺溶液。
19.作为优选,步骤(2)中,所述固定液为:将5体积份38%甲醛、5体积份冰乙酸、100体积份50%酒精混合配制而成。
20.作为优选,步骤(5)中,所述封片为使用中性树胶与二甲苯混合液进行封片,混合液中中性树胶与二甲苯的重量比为1:1。
21.本发明的有益效果如下:
22.1)从材料处理到切片观察的时间短,可在12h之内完成。原有的切片完成时间需要72h以上,节约了大量制作时间,实现了快速切片。
23.2)切片结果准确,从取样到切片完成,所有过程都可保持低温,减少了温度对活性氧代谢的影响,极大提高了切片的准确性。
24.3)本发明方法采用先真空染色,再冷冻切片的方法,保证组织不会收缩,保持原有的生活形态,保证了切片的真实可靠。
25.4)活性氧在植物体内一直存在,但是在胁迫处理、物理损伤和/或病原菌接种时,活性氧会集中爆发。本发明能够定位和半定量植物根系中的活性氧,大概评估植物根系中活性氧数量。
附图说明
26.附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
27.图1为枸杞根系接种尖孢镰刀菌8h后o
2-的组织化学染色。
28.图2为枸杞根系接种尖孢镰刀菌72h后h2o2的组织化学染色。
29.图3为应用现有技术方法,将枸杞根系针刺并接种尖孢镰刀菌72h后h2o2的组织化学染色。
具体实施方式
30.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均购自常规生化试剂公司。
31.一、试剂:
32.1、检测o
2-的染色液为:用5mmol/lph 7.6的3-(n-吗啉)丙烷磺酸钠缓冲液配制的2.5mmol/l的氯化硝基四氮唑蓝溶液。
33.2、检测h2o2的染色液为:向100mmol/lph 6.9的磷酸钾缓冲液中添加5units/ml辣根过氧化酶,混匀后用其配制成2.5mmol/l3,3
’‑
二氨基联苯胺溶液。
34.3、固定液:甲醛-冰乙酸-酒精(faa)固定液,将浓度38%甲醛5ml、冰乙酸5ml、50%酒精100ml混合配制而成。
35.二、本发明的一种植物根系活性氧快速染色定位方法步骤如下:
36.本发明的方法可用于直径在3-8mm之间粗细植物根系的活性氧快速染色切片观
察。
37.1、根系样品及处理
38.将直径在3-8mm之间粗细的植物根系剪切成适宜长度,迅速固定到离心管底部,以免后期处理时漂浮,影响染色固定效果。
39.所述适宜长度可以为0.8-1.2cm。
40.所述迅速固定到离心管底部具体是迅速使用重物或夹具将剪切后的植物根系固定到离心管底部。
41.2、根系样品染色
42.向步骤1所述离心管中添加预冷至0-4℃的检测相应活性氧(活性氧为o
2-或h2o2)的染色液没过样品,然后将离心管竖直置于预冷至0-4℃的真空罐或真空桶中,盖好真空罐或真空桶后,抽真空达到负压状态,并保持2-4h进行染色,具体染色时间长短视根系样品的粗细而定。
43.所述抽真空达到负压状态可以是将真空度调至-0.05mpa以下。
44.低温真空染色的目的是:可以确保在活性氧降解最少的条件下,加强染色液的渗透,增加染色效果,并且缩短染色时间。若仅采用低温染色,染色剂渗透率降低,染色效果差;若仅采用真空染色,会引起活性氧成分的降解或代谢,丧失切片的真实性。
45.3、根系样品固定
46.染色完成后迅速将离心管取出,丢弃染色液,使用缓冲液(检测o
2-为5mmol/l ph 7.63-(n-吗啉)丙烷磺酸钠缓冲液,检测h2o2为100mmol/lph 6.9的磷酸钾缓冲液)冲洗数次样品,洗净残留染色液后可开始固定。
47.离心管中加入预冷至0-4℃的固定液,将离心管竖直放入预冷至0-4℃的真空罐或真空桶中,盖好真空罐或真空桶后,抽真空达到负压状态,固定0.5-1h。
48.所述抽真空达到负压状态可以是将真空度调至-0.05mpa以下。
49.低温真空固定的目的是:可以确保在活性氧降解最少的条件下,加强固定效果,缩短固定时间。若仅采用低温固定剂渗透率降低,固定效果差;若仅采用真空固定,会引起活性氧成分的降解或代谢,丧失切片的真实性。
50.4、根系样品填充定形
51.随后丢弃固定液,加入预冷至0-4℃的体积百分比为15%的甘油水溶液,再次将离心管竖直放入预冷至0-4℃的真空罐或真空桶中,盖好真空罐或真空桶后,抽真空达到负压状态,填充定形1-3h,让材料组织间充满甘油,保证细胞形态。
52.所述抽真空达到负压状态可以是将真空度调至-0.05mpa以下。
53.低温真空填充定形的目的是:可以确保在活性氧降解最少的条件下,加强定形效果,缩短定形时间。若仅采用低温填充定形,填充剂渗透率降低,填充速度慢;若仅采用真空填充定形,活性氧成分受高温影响降解或代谢,丧失切片的真实性。
54.5、根系切片
55.将冷冻切片机冷室及切片用具预冷至-18℃到-21℃,将根系直立放置在样品托上,添加otc包埋剂进行包埋,完成后修整形状为楔形,调整角度使样品横切面与刀片垂直,调整固定台温度为-18℃至-19℃,设置切片的合理厚度,比如将切片的厚度设置为15-25μm,进行切片。温度过低会使植物样品变脆,切片易碎,过高则易卷,不宜展片。
56.6、切片封胶及观察
57.将切好的样品根段用毛笔蘸到载玻片上,取出后放置3-5min待样品回温完全粘到载玻片上,用中性树胶与二甲苯混合液进行封片,混合液中中性树胶与二甲苯的重量比为1:1,在显微镜下观察并拍照。
58.温度与真空度的改变会影响植物根系组织的收缩,故,上述步骤2-4中的预冷温度以及真空度最好能够保持一致,以最大程度降低植物根系组织的收缩。
59.实施例1
60.本发明的一种植物根系活性氧快速染色定位方法步骤如下:
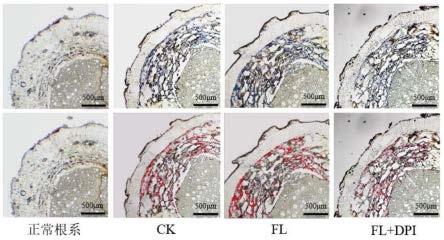
61.1、根系样品及处理
62.将直径为5mm的植物根系剪切到长短为1cm,迅速使用重物将根系固定到10ml离心管底部。
63.2、根系样品染色
64.将真空装置的真空罐预冷至0℃,其中放置预冷冰袋保持低温,而后将离心管竖直放入真空罐中。
65.添加预冷至0℃的检测o
2-的染色液没过样品。
66.盖好真空罐后,将真空度调至-0.05mpa,达到负压状态,并保持2h进行染色。
67.3、根系样品固定
68.染色完成后迅速将离心管取出,丢弃染色液,使用缓冲液(缓冲液为:5mmol/lph 7.63-(n-吗啉)丙烷磺酸钠缓冲液)冲洗数次样品,洗净残留染色液后可开始固定。
69.离心管中加入预冷至0℃的固定液,将离心管竖直放入预冷至0℃的真空罐中,盖好真空罐后,将真空度调至-0.05mpa,达到负压状态,固定1h。
70.4、根系样品填充定形
71.丢弃固定液后,再加入预冷至0℃的体积百分比为15%的甘油水溶液,再次将离心管竖直放入预冷至0℃的真空罐中,盖好真空罐后,将真空度调至-0.05mpa,达到负压状态,填充定形2h。
72.5、根系切片
73.切片前将冷室及切片用具预冷至-21℃。在冷室样品托中央放少量包埋胶,将根系直立放置在样品托上,周围用适量无气泡的otc包埋剂浸没组织,包埋剂及样品的总直径为样品直径的2倍,待包埋胶完全变白后将其修整为楔形,同时修薄刀片与样品间的包埋胶,修好后将冷台固定到切片机上,调整好样品与刀片的角度,使样品横切面与刀片垂直,将切片的厚度设置为25μm,样品固定台温度调整为-19℃,进行切片。
74.6、切片封胶及观察
75.选好样品根段后,用毛笔蘸到载玻片上,取出后放置短暂时间待样品回温完全粘到载玻片上,用中性树胶和二甲苯混合液进行封片,混合液中中性树胶与二甲苯的重量比为1:1,在显微镜下观察并拍照。
76.以枸杞根系为例进行上述植物根系活性氧o
2-的快速染色定位实验,具体实验为:
77.设定:正常根系组:未针刺,直接染色枸杞根系;ck组:针刺8h后染色枸杞根系;fl组:针刺后接种尖孢镰刀菌,在8h后再染色枸杞根系;fl+dpi组:针刺后接种氯化二亚苯基碘(dpi,活性氧抑制剂)和尖孢镰刀菌,在8h后再染色枸杞根系。上述各组所述染色均使用
本发明实施例1的方法。实验结果见图1。
78.图1为枸杞根系接种尖孢镰刀菌8h后o
2-的组织化学染色图片。上排为光学显微镜下拍得照片,o
2-被氯化硝基四氮唑蓝(nbt)染为蓝紫色;下排为通过image pro软件提取染色色彩后的图片,红线内为o
2-定位区域。其中,正常根系组:未针刺,直接染色枸杞根系;ck组:针刺8h后染色枸杞根系;fl组:针刺后接种尖孢镰刀菌,在8h后再染色枸杞根系;fl+dpi组:针刺后接种氯化二亚苯基碘(dpi,活性氧抑制剂)和尖孢镰刀菌,在8h后再染色枸杞根系。
79.在针刺或接种病原微生物活性氧会集中爆发。活性氧o
2-在本实施例中爆发时间是8h,不同处理不同物种,可能爆发的时间有差异。
80.在染色过程中,剪切时要把处理的目标位置,如针刺点或接种点放在中间位置,因为剪切位置受到物理损伤,也可以产生活性氧,染上颜色。
81.实施例2
82.本实施例与实施例1的不同之处在于:步骤2中,染色液为检测h2o2的染色液;步骤3中,缓冲液为:100mmol/lph 6.9的磷酸钾缓冲液。其余步骤均与实施例1相同。
83.以枸杞根系为例进行上述植物根系活性氧h2o2的快速染色定位实验,具体实验为:
84.设定:正常根系组:未针刺,直接染色枸杞根系;ck组:针刺72h后染色枸杞根系;fl组:针刺后接种尖孢镰刀菌,在72h后再染色枸杞根系;fl+dpi组:针刺后接种氯化二亚苯基碘(dpi,活性氧抑制剂)和尖孢镰刀菌,在72h后再染色枸杞根系。上述各组所述染色均使用本发明实施例2的方法。实验结果见图2。
85.图2为枸杞根系接种尖孢镰刀菌72h后h2o2的组织化学染色图片。上排为光学显微镜下拍得照片,h2o2被3,3
’‑
二氨基联苯胺(dab)染为红色;下排为通过image pro软件提取染色色彩后的图片,红线内为h2o2定位区域。其中,正常根系组:未针刺,直接染色枸杞根系;ck组:针刺72h后染色枸杞根系;fl组:针刺后接种尖孢镰刀菌,在72h后再染色枸杞根系;fl+dpi组:针刺后接种氯化二亚苯基碘(dpi,活性氧抑制剂)和尖孢镰刀菌,在72h后再染色枸杞根系。
86.活性氧h2o2在本实施例中爆发时间是72h,不同处理不同物种,可能爆发的时间有差异。
87.在染色过程中,剪切时要把处理的目标位置,如针刺点或接种点放在中间位置,因为剪切位置受到物理损伤,也可以产生活性氧,染上颜色。
88.实施例3
89.本发明的一种植物根系活性氧快速染色定位方法步骤如下:
90.1、根系样品及处理
91.将直径为8mm的植物根系剪切到长短为0.8cm,迅速使用夹具将根系固定到10ml离心管底部。
92.2、根系样品染色
93.将真空桶预冷至4℃,其中放置预冷冰袋保持低温,而后将离心管竖直放入真空桶中。
94.添加预冷至4℃的检测o
2-的染色液没过样品。
95.盖好真空桶后,将真空度调至-0.08mpa,达到负压状态,并保持4h进行染色。
96.3、根系样品固定
97.染色完成后迅速将离心管取出,丢弃染色液,使用缓冲液(缓冲液为:5mmol/lph 7.63-(n-吗啉)丙烷磺酸钠缓冲液)冲洗数次样品,洗净残留染色液后可开始固定。
98.离心管中加入预冷至4℃的固定液,将离心管竖直放入预冷至4℃的真空桶中,盖好真空桶后,将真空度调至-0.08mpa,达到负压状态,固定1h。
99.4、根系样品填充定形
100.丢弃固定液后,再加入预冷至4℃的体积百分比为15%的甘油水溶液,再次将离心管竖直放入预冷至4℃的真空桶中,盖好真空桶后,将真空度调至-0.08mpa,达到负压状态,填充定形3h。
101.5、根系切片
102.切片前将冷室及切片用具预冷至-20℃。在冷室样品托中央放少量包埋胶,将根系直立放置在样品托上,周围用适量无气泡的otc包埋剂浸没组织,包埋剂及样品的总直径为样品直径的2倍,待包埋胶完全变白后将其修整为楔形,同时修薄刀片与样品间的包埋胶,修好后将冷台固定到切片机上,调整好样品与刀片的角度,使样品横切面与刀片垂直,将切片的厚度设置为15μm,样品固定台温度调整为-19℃,进行切片。
103.6、切片封胶及观察
104.选好样品根段后,用毛笔蘸到载玻片上,取出后放置短暂时间待样品回温完全粘到载玻片上,用中性树胶和二甲苯混合液进行封片,混合液中中性树胶与二甲苯的重量比为1:1,在显微镜下观察并拍照。
105.实施例4
106.本发明的一种植物根系活性氧快速染色定位方法步骤如下:
107.1、根系样品及处理
108.将直径为3mm的植物根系剪切到长短为0.9cm,迅速使用夹具将根系固定到10ml离心管底部。
109.2、根系样品染色
110.将真空桶预冷至2℃,其中放置预冷冰袋保持低温,而后将离心管竖直放入真空桶中。
111.添加预冷至2℃的检测h2o2的染色液没过样品。
112.盖好真空桶后,将真空度调至-0.07mpa,达到负压状态,并保持3h进行染色。
113.3、根系样品固定
114.染色完成后迅速将离心管取出,丢弃染色液,使用缓冲液(缓冲液为:100mmol/lph6.9的磷酸钾缓冲液)冲洗数次样品,洗净残留染色液后可开始固定。
115.离心管中加入预冷至2℃的固定液,将离心管竖直放入预冷至2℃的真空桶中,盖好真空桶后,将真空度调至-0.07mpa,达到负压状态,固定0.5h。
116.4、根系样品填充定形
117.丢弃固定液后,再加入预冷至2℃的体积百分比为15%的甘油水溶液,再次将离心管竖直放入预冷至2℃的真空桶中,盖好真空桶后,将真空度调至-0.07mpa,达到负压状态,填充定形1h。
118.5、根系切片
119.切片前将冷室及切片用具预冷至-18℃。在冷室样品托中央放少量包埋胶,将根系直立放置在样品托上,周围用适量无气泡的otc包埋剂浸没组织,包埋剂及样品的总直径为样品直径的1.8倍,待包埋胶完全变白后将其修整为楔形,同时修薄刀片与样品间的包埋胶,修好后将冷台固定到切片机上,调整好样品与刀片的角度,使样品横切面与刀片垂直,将切片的厚度设置为20μm,样品固定台温度调整为-18℃,进行切片。
120.6、切片封胶及观察
121.选好样品根段后,用毛笔蘸到载玻片上,取出后放置短暂时间待样品回温完全粘到载玻片上,用中性树胶和二甲苯混合液进行封片,混合液中中性树胶与二甲苯的重量比为1:1,在显微镜下观察并拍照。
122.对比例1
123.现有技术方法:超氧阴离子染色:用本发明的检测o
2-的染色液浸没材料,在常温常压下培养48h后弃染液,若着色较慢可再培养24h。过氧化氢染色:用本发明的检测h2o2的染色液浸没材料,在常温常压下培养48h后弃染液,若着色较慢可再培养24h。染色后将洗净的材料,剪成1cm左右小段,放入本发明的固定液中在常温常压下固定3-12h,再放入15%的甘油液中在常温常压下浸泡12h,让材料在组织间充满,然后即可进行冷冻切片。其中,h2o2染色固定结果见图3。
124.图3为应用现有技术方法,将枸杞根系针刺并接种尖孢镰刀菌72h后,h2o2的组织化学染色。
125.由图3和图2的对比可以看出:应用现有技术的方法切片染色时间长,染色面积较小,组织分离比较严重,有比较严重的收缩。
126.最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1