一种金刚烷胺免疫磁珠及其制备方法与应用
1.本发明属于食品安全技术领域。更具体地,涉及一种金刚烷胺免疫磁珠及其制备方法与应用。
背景技术:
2.金刚烷胺(amantadine,ama)药物作为一种抗病毒药物,曾大量用于预防和治疗猪传染性胃肠炎和禽流感,是疾病治疗的常用药。在养殖过程中出现乱用、滥用、长期或超量使用的现象,会导致金刚烷胺药物在动物体内残留,最终进入人体,长期积累会出现耐药性、神经过敏等一系列副作用。因此,我国农业部在2005年发布的第560号公告明确规定,在兽医药品中禁止使用金刚烷胺等抗病毒药物。
3.目前,检测金刚烷胺的方法主要有仪器分析法和免疫分析法。鸡肉、鸭肉和饲料最常用的国标检测方法有高效液相色谱法、超高效液相色谱-串联质谱法(最低检测灵敏度为1ug/kg)。仪器分析方法虽然准确度高,但操作复杂、耗时长,费用高,难以满足对于大批量快速检测的要求。免疫分析法可以解决上述问题,但免疫分析法的灵敏度低、精密度差,往往都需要净化样品,如用液液萃取、固相萃取等方法净化,需要消耗大量有机溶剂。如中国专利申请公开了一种利用时间分辨荧光免疫分析技术对金刚烷胺进行检测,虽然其能检测金刚烷胺,但其精密度差、无法准确定量、操作复杂、成本较高,无法满足对金刚烷胺样品残留快速定量检测的需求。
技术实现要素:
4.本发明要解决的技术问题是克服现有缺乏富集金刚烷胺免疫磁珠缺陷和不足,提供一种金刚烷胺免疫磁珠,该磁珠可有效富集净化金刚烷胺,并能联合胶体金对金刚烷胺样品的残留进行快速定量检测,能大大降低金刚烷胺的检测限,且检测过程中操作简单、可以大大缩短前处理时间,成本低。
5.本发明的目的为提供一种金刚烷胺免疫磁珠的制备方法。
6.本发明的另一目的为提供一种金刚烷胺的检测方法。
7.本发明的另一目的为金刚烷胺免疫磁珠在检测金刚烷胺中的应用。
8.本发明的上述目通过以下技术方案实现:
9.一种金刚烷胺免疫磁珠,包括羧基化纳米磁珠、金刚烷胺多克隆抗体,所述金刚烷胺多克隆抗体包裹在羧基化纳米磁珠表面。
10.优选地,所述羧基化纳米磁珠包括羧基化四氧化三铁纳米磁珠、羧基化聚苯乙烯磁性微球。
11.优选地,所述羧基化纳米磁珠与金刚烷胺多克隆抗体的质量比为:(5~20)mg:(20~60)ug。
12.本发明进一步保护一种金刚烷胺免疫磁珠的制备方法,包括以下步骤:
13.将羧基化纳米磁珠洗涤后加入活化剂溶液,与金刚烷胺多克隆抗体混匀,于室温
孵育,洗涤,加入封闭液于室温孵育,即得;
14.所述孵育的体系ph为5.5~7.4。
15.优选地,所述活化剂溶液用ph=5.5~7.4的mes溶液配置。
16.优选地,金刚烷胺免疫磁珠的制备方法在加入封闭液于室温孵育还包括用含0.02%nan3和0.5%bsa的pbs缓冲液重悬,于4℃保存;
17.优选地,所述洗涤用缓冲液洗涤。
18.更优选地,所述缓冲液为pbs缓冲液、mes缓冲液或磷酸盐吐温缓冲液(pbst,含有0.05%吐温-20)。
19.优选地,所述活化剂包括1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)、n-羟基琥珀酰亚胺(nhs)。
20.优选地,所述活化的时间为20~50min。
21.优选地,所述活化剂溶液的浓度为5~20mg/ml。
22.优选地,所述封闭液为含0.5~2%牛血清白蛋白(bsa)的pbst溶液。
23.优选地,所述孵育的时间为0.5~6小时。
24.本发明进一步保护一种金刚烷胺的检测方法,包括如下步骤:
25.将样品前处理后,依次进行定性检测、定量检测;
26.所述样品前处理包括如下步骤:
27.将样品匀浆后加入提取溶剂提取,离心后取上清液,再加入所述金刚烷胺免疫磁珠捕捉2~3次、磁分离后加入洗脱试剂洗脱,磁分离得富集后净化的金刚烷胺。
28.优选地,所述样品包括猪肉、牛肉、鸡肉、鸭肉、鸽肉。
29.优选地,所述提取溶剂包括pbs缓冲液、纯水、盐酸。
30.优选地,所述富集的温度为20~40℃,时间为10~30min。
31.更优选地,所述富集的温度为25℃,时间为15min。
32.优选地,所述洗脱试剂包括氨化甲醇(含5~10%氨水的甲醇溶液),含8~15%甲醇的pbs缓冲液。
33.优选地,所述洗脱的温度为30~100℃,时间为2~10min。
34.更优选地,所述洗脱的温度为60~80℃,时间为2~8min。
35.优选地,所述方法的步骤包括:
36.将样品前处理后,加入到试剂盒的探针样品孔中,孵育,再将免疫层析试纸条的样品垫置于探针样品孔中进行显色反应,再用胶体金定量检测仪定量检测待测样品中金刚烷胺的浓度。
37.优选地,所述金刚烷胺的判断标准为:若t线和c线均显红色,两线显色程度相当,则判断为阴性结果,即样品中不含有金刚烷胺;
38.若t线不显色,c线显红色,则判断为强阳性结果,即样品中含有金刚烷胺;
39.若t线和c线均显红色,但t线显色程度浅于c线,则判断为弱阳性结果,即样品中含有一定量的金刚烷胺;
40.若c线不显红色,无论t线是否显红色,均表示实验结果无效。
41.优选地,所述金刚烷胺的定量检测方法为:
42.在金刚烷胺免疫磁珠富集净化后的金刚烷胺溶液中分别加入0、0.05、0.1、0.2、
0.4、0.5、0.8、1ng/ml的金刚烷胺药物配制成标准溶液,将判定为弱阳性或者强阳性结果的试纸条,通过免疫层析分析仪测出t/c值,再通过origin 2018软件绘制标准曲线,以药物浓度的对数值为x轴,以b/b0为y轴(b0为不添加药物时的t/c值,b为添加药物浓度的t/c值),拟合出标准曲线,再将待测浓度的y值代入拟合标准曲线中可以定量求出待测样本中金刚烷胺残留的浓度。
43.本发明进一步保护金刚烷胺免疫磁珠在检测金刚烷胺中的应用。
44.本发明具有以下有益效果:
45.本发明的免疫磁珠能特异性富集金刚烷胺,在短时间内迅速、有选择地将样品中的金刚烷胺富集与纯化;并且可以避免有机溶剂的大量使用,绿色环保;还能有效地减少样品中其他杂质的干扰,提高了检测的准确性和精准性;与胶体金结合检测金刚烷胺的过程中,检测的灵敏度高,精密性好,大大降低了最低检测限,且操作简便,成本低,可广泛应用于饲料、肉制品、动物组织中金刚烷胺的纯化、富集与分离,符合市场需求,对食品中金刚烷胺的安全检测和初筛具有重要的意义。
附图说明
46.图1为本发明检测金刚烷胺方法的流程示意图。
47.图2为胶体金试纸条判定方法示意图。
48.图3为用不同ph溶液配制活化剂制备得到的金刚烷胺免疫磁珠对金刚烷胺检测效果的影响。
49.图4为不同抗体用量制备得到的金刚烷胺免疫磁珠对金刚烷胺检测效果的影响。
50.图5为本发明检测金刚烷胺的标准曲线。
51.图6为本发明检测金刚烷胺的灵敏度检测结果。
52.图7为本发明检测金刚烷胺方法的准确度的显色结果。
具体实施方式
53.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
54.除非特别说明,以下实施例所用试剂和材料均为市购。
55.实施例1金刚烷胺免疫磁珠的制备
56.s1.取5mg羧基化四氧化三铁纳米磁珠放入离心管中,用0.05m ph=5.0的mes缓冲液(1ml)洗涤三次,磁分离后,加入活化剂10mg/mledc和nhs各200μl(edc和nhs用ph=5.5的mes溶液配置),混匀,于25℃下旋转活化30min得活化纳米磁珠;
57.s2.将活化纳米磁珠用1ml 0.01mol/l ph=7.4的pbs缓冲液洗涤三遍,加入10ug金刚烷胺多克隆抗体(浓度为2.5mg/ml)混匀,于25℃孵育4小时,制备成金刚烷胺抗体免疫磁珠;
58.s3.将金刚烷胺抗体免疫磁珠用1ml 0.01mo1/l的pbst缓冲液(含有0.05%吐温-20,ph=7.4)洗涤三次,用含1ml 1%bsa的pbst(0.01mol/l,ph=7.0)缓冲液于37℃孵育1小时,即得,置于1ml 0.05mpb缓冲液中在4℃下保存待用。
59.实施例2金刚烷胺免疫磁珠的制备
60.s1.取5mg羧基化四氧化三铁纳米磁珠放入离心管中,用0.05m ph=5.0的mes缓冲液(1ml)洗涤三次,磁分离后,加入活化剂10mg/mledc和nhs各200μl(edc和nhs用ph=6.0的mes溶液配置),混匀,于25℃下旋转活化30min得活化纳米磁珠;
61.s2.将活化纳米磁珠用1ml 0.01mol/l ph=7.4的pbs缓冲液洗涤三遍,加入10ug金刚烷胺多克隆抗体(浓度为2.5mg/ml)混匀,于25℃孵育4小时,制备成金刚烷胺抗体免疫磁珠;
62.s3.将金刚烷胺抗体免疫磁珠用1ml 0.01mo1/l的pbst缓冲液(含有0.05%tween-20,ph=7.4)洗涤三次,用含1ml 1%bsa的pbst(0.01mol/l,ph=7.0)缓冲液于37℃孵育1小时,即得,置于1ml 0.05mpb缓冲液中在4℃下保存待用。
63.实施例3金刚烷胺免疫磁珠的制备
64.s1.取5mg羧基化四氧化三铁纳米磁珠放入离心管中,用0.05m ph=5.0的mes缓冲液(1ml)洗涤三次,磁分离后,加入活化剂10mg/mledc和nhs各200μl(edc和nhs用ph=6.5的mes溶液配置),混匀,于25℃下旋转活化30min得活化纳米磁珠;
65.s2.将活化纳米磁珠用1ml 0.01mol/l ph=7.4的pbs缓冲液洗涤三遍,加入10ug金刚烷胺多克隆抗体(浓度为2.5mg/ml)混匀,于25℃孵育4小时,制备成金刚烷胺抗体免疫磁珠;
66.s3.将金刚烷胺抗体免疫磁珠用1ml 0.01mo1/l的pbst缓冲液(含有0.05%tween-20,ph=7.4)洗涤三次,用含1ml 1%bsa的pbst(0.01mol/l,ph=7.0)缓冲液于37℃孵育1小时,即得,置于1ml 0.05mpb缓冲液中在4℃下保存待用。
67.实施例4金刚烷胺免疫磁珠的制备
68.s1.取5mg羧基化四氧化三铁纳米磁珠放入离心管中,用0.05m ph=5.0的mes缓冲液(1ml)洗涤三次,磁分离后,加入活化剂10mg/mledc和nhs各200μl(edc和nhs用ph=7.0的mes溶液配置),混匀,于25℃下旋转活化30min得活化纳米磁珠;
69.s2.将活化纳米磁珠用1ml 0.01mol/l ph=7.4的pbs缓冲液洗涤三遍,加入10ug金刚烷胺多克隆抗体(浓度为2.5mg/ml)混匀,于25℃孵育4小时,制备成金刚烷胺抗体免疫磁珠;
70.s3.将金刚烷胺抗体免疫磁珠用1ml 0.01mo1/l的pbst缓冲液(含有0.05%tween-20,ph=7.4)洗涤三次,用含1ml 1%bsa的pbst(0.01mol/l,ph=7.0)缓冲液于37℃孵育1小时,即得,置于1ml 0.05mpb缓冲液中在4℃下保存待用。
71.实施例5金刚烷胺免疫磁珠的制备
72.s1.取5mg羧基化四氧化三铁纳米磁珠放入离心管中,用0.05m ph=5.0的mes缓冲液(1ml)洗涤三次,磁分离后,加入活化剂10mg/mledc和nhs各200μl(edc和nhs用ph=7.4的mes溶液配置),混匀,于25℃下旋转活化30min得活化纳米磁珠;
73.s2.将活化纳米磁珠用1ml 0.01mol/l ph=7.4的pbs缓冲液洗涤三遍,加入10ug金刚烷胺多克隆抗体(浓度为2.5mg/ml)混匀,于25℃孵育4小时,制备成金刚烷胺抗体免疫磁珠;
74.s3.将金刚烷胺抗体免疫磁珠用1ml 0.01mo1/l的pbst缓冲液(含有0.05%tween-20,ph=7.4)洗涤三次,用含1ml 1%bsa的pbst(0.01mol/l,ph=7.0)缓冲液于37℃孵育1
小时,即得,置于1ml 0.05mpb缓冲液中在4℃下保存待用。
75.实施例6金刚烷胺免疫磁珠的制备
76.s1.取5mg羧基化四氧化三铁纳米磁珠放入离心管中,用0.05m ph=5.0的mes缓冲液(1ml)洗涤三次,磁分离后,加入活化剂10mg/mledc和nhs各200μl(edc和nhs用ph=7.4的mes溶液配置),混匀,于25℃下旋转活化30min得活化纳米磁珠;
77.s2.将活化纳米磁珠用1ml 0.01mol/l ph=7.4的pbs缓冲液洗涤三遍,加入15ug金刚烷胺多克隆抗体(浓度为2.5mg/ml)混匀,于25℃孵育4小时,制备成金刚烷胺抗体免疫磁珠;
78.s3.将金刚烷胺抗体免疫磁珠用1ml 0.01mo1/l的pbst缓冲液(含有0.05%tween-20,ph=5.0)洗涤三次,用含1ml 1%bsa的pbst(0.01mol/l,ph=7.0)缓冲液于37℃孵育1小时,即得,置于1ml 0.05mpb缓冲液中在4℃下保存待用。
79.实施例7金刚烷胺免疫磁珠的制备
80.s1.取5mg羧基化四氧化三铁纳米磁珠放入离心管中,用0.05m ph=5.0的mes缓冲液(1ml)洗涤三次,磁分离后,加入活化剂10mg/mledc和nhs各200μl(edc和nhs用ph=7.4的mes溶液配置),混匀,于25℃下旋转活化30min得活化纳米磁珠;
81.s2.将活化纳米磁珠用1ml 0.01mol/l ph=7.4的pbs缓冲液洗涤三遍,加入20ug金刚烷胺多克隆抗体(浓度为2.5mg/ml)混匀,于25℃孵育4小时,制备成金刚烷胺抗体免疫磁珠;
82.s3.将金刚烷胺抗体免疫磁珠用1ml 0.01mo1/l的pbst缓冲液(含有0.05%tween-20,ph=7.4)洗涤三次,用含1ml 1%bsa的pbst(0.01mol/l,ph=7.0)缓冲液于37℃孵育1小时,即得,置于1ml 0.05mpb缓冲液中在4℃下保存待用。
83.对比例1金刚烷胺免疫磁珠的制备
84.s1.取5mg羧基化四氧化三铁纳米磁珠放入离心管中,用0.05m ph=5.0的mes缓冲液(1ml)洗涤三次,磁分离后,加入活化剂10mg/mledc和nhs各200μl(edc和nhs用ph=5.0的mes溶液配置),混匀,于25℃下旋转活化30min得活化纳米磁珠;
85.s2.将活化纳米磁珠用1ml 0.01mol/l ph=7.4的pbs缓冲液洗涤三遍,加入10ug金刚烷胺多克隆抗体(浓度为2.5mg/ml)混匀,于25℃孵育4小时,制备成金刚烷胺抗体免疫磁珠;
86.s3.将金刚烷胺抗体免疫磁珠用1ml 0.01mo1/l的pbst缓冲液(含有0.05%tween-20,ph=7.4)洗涤三次,用含1ml 1%bsa的pbst(0.01mol/l,ph=7.0)缓冲液于37℃孵育1小时,即得,置于1ml 0.05mpb缓冲液中在4℃下保存待用。
87.与实施例1相比,在步骤s1中,edc和nhs用ph=5.0的mes溶液配置。
88.对比例2金刚烷胺免疫磁珠的制备
89.s1.取5mg羧基化四氧化三铁纳米磁珠放入离心管中,用0.05m ph=5.0的mes缓冲液(1ml)洗涤三次,磁分离后,加入活化剂10mg/mledc和nhs各200μl(edc和nhs用ph=8.0的mes溶液配置),混匀,于25℃下旋转活化30min得活化纳米磁珠;
90.s2.将活化纳米磁珠用1ml 0.01mol/l ph=7.4的pbs缓冲液洗涤三遍,加入10ug金刚烷胺多克隆抗体(浓度为2.5mg/ml)混匀,于25℃孵育4小时,制备成金刚烷胺抗体免疫磁珠;
91.s3.将金刚烷胺抗体免疫磁珠用1ml 0.01mo1/l的pbst缓冲液(含有0.05%tween-20,ph=7.4)洗涤三次,用含1ml 1%bsa的pbst(0.01mol/l,ph=7.0)缓冲液于37℃孵育1小时,即得,置于1ml 0.05mpb缓冲液中在4℃下保存待用。
92.与实施例1相比,在步骤s1中,edc和nhs用ph=8.0的mes溶液配置。
93.对比例3金刚烷胺免疫磁珠的制备
94.s1.取5mg羧基化四氧化三铁纳米磁珠放入离心管中,用0.05m ph=5.0的mes缓冲液(1ml)洗涤三次,磁分离后,加入活化剂10mg/mledc和nhs各200μl(edc和nhs用ph=5.0的mes溶液配置),混匀,于25℃下旋转活化30min得活化纳米磁珠;
95.s2.将活化纳米磁珠用1ml 0.01mol/l ph=7.4的pbs缓冲液洗涤三遍,加入5ug金刚烷胺多克隆抗体(浓度为2.5mg/ml)混匀,于25℃孵育4小时,制备成金刚烷胺抗体免疫磁珠;
96.s3.将金刚烷胺抗体免疫磁珠用1ml 0.01mo1/l的pbst缓冲液(含有0.05%tween-20,ph=7.4)洗涤三次,用含1ml 1%bsa的pbst(0.01mol/l,ph=7.0)缓冲液于37℃孵育1小时,即得,置于1ml 0.05mpb缓冲液中在4℃下保存待用。
97.与实施例5相比,在步骤s2中,金刚烷胺多克隆抗体的添加量为5ug。
98.应用例1金刚烷胺的检测
99.待测样品的前处理:
100.s1.称取2g匀浆后的待测样品,加入4ml 0.01m pbs缓冲液,离心后取上清液,再分别加入200ul实施例1~7及对比例1~3制备得到的金刚烷胺免疫磁珠,旋转重悬,37℃下旋转捕获15min,磁分离,弃去上清液,在外磁场的作用下,用1ml 0.01m pbst清洗2~3次,混匀重悬,磁分离,弃去上清液得金刚烷胺免疫磁珠复合物;
101.s2.将各金刚烷胺免疫磁珠复合物加入10%甲醇溶液(用0.01mol/l的pbs缓冲液配置)中,进行洗脱,振荡混匀,在80℃下洗脱8min,磁分离,上清液即为富集净化后的金刚烷胺溶液。
102.金刚烷胺抗体-胶体金标记的探针样品孔的制备:
103.准备1个500ml烧杯,加入洗净的转子,分别装入200ml一级水,用锡箔纸封住瓶口,置于可加热的磁力搅拌器上温度调至最高加热,待水沸腾后,开始磁力搅拌,快速加入2ml 1%氯金酸溶液,待再次煮沸后分别加入18ml 1%柠檬酸三钠溶液,保持沸腾16min后停止加热,室温冷却,4℃冰箱中储存备用,即得胶体金溶液;
104.往干净的1.5ml离心管中加入1ml胶体金溶液,每管分别加入10ul的0.2mk2co3,涡旋混匀后振荡5min;加入10ul稀释成0.5mg/ml的抗体进行标记涡旋混匀后振荡反应5min,再加入10ul 10%bsa溶液进行封闭,涡旋混匀后振荡5min,在4℃、15000rpm下离心15min,弃去上清液,加入200ul 0.05mpb复溶液,振荡混匀得胶体金标记探针,4℃备用;
105.取10ul上述胶体金标记探针放入96孔酶标板上(市售),37℃孵育,烘干过夜,即得金刚烷胺抗体-胶体金标记的探针样品孔。
106.金刚烷胺的检测方法:
107.取100ul用实施例1~7及对比例1~3制备得到的金刚烷胺免疫磁珠富集净化后的金刚烷胺溶液加入到试剂盒的金刚烷胺抗体-胶体金标记的探针样品孔中孵育5min,再将免疫层析试纸条的样品垫置于金刚烷胺抗体-胶体金标记的探针样品孔中反应5min,通过t
线、c线显色判断检测结果;通过免疫层析读数仪读取各试纸条的t/c值,进行样品中金刚烷胺检测结果判定。
108.检测结果的判定方法:
109.1)若t线和c线均显红色,两线显色程度相当,则判断为阴性结果,即样品中不含有金刚烷胺药物;
110.2)若c线显红色,t线不显色,则判断为强阳性结果,即样品中含有金刚烷胺药物;
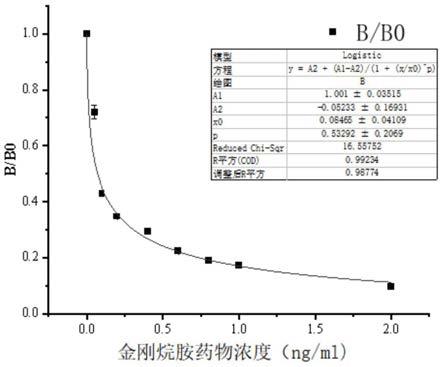
111.3)若t线和c线均显红色,但t线显色程度浅于c线,则判断为弱阳性结果,即样品中含有一定量的金刚烷胺药物;
112.4)若c线不显红色,无论t线是否显红色,均表示实验结果无效。
113.检测方法的流程示意图如图1所示。
114.检测结果判断示例图如图2所示。
115.检测结果:如图3所示:当用ph值为7.4的mes溶液配置活化剂溶液时,阴性样品的t线显色最深且阳性样品抑制完全,但当ph值继续增大时,抑制效果变差。因此在保证显色效果并兼顾灵敏度的情况下,选择ph值为7.4的mes溶液作为配置活化剂的溶液,此条件下阳性样品t线完全消除。
116.如图4所示,随着抗体用量的增加,阴性样品的t线逐渐变深;添加体积为10μg与15μg时,t线显色相近,从节省抗体用量的角度考虑,实验选择抗体用量为10μg。
117.应用例2金刚烷胺检测的灵敏性和特异性测试
118.标准曲线:
119.在实施例1制备得到的金刚烷胺免疫磁珠富集净化后的金刚烷胺溶液中分别加入0、0.05、0.1、0.2、0.4、0.5、0.8、1ng/ml的金刚烷胺药物配制成标准溶液,按上述金刚烷胺的检测方法进行检测,将判定为弱阳性或者强阳性结果的试纸条,通过免疫层析分析仪测出t/c值,再通过origin 2018软件绘制标准曲线,以药物浓度的对数值为x轴,以b/b0为y轴(b0为不添加药物时的t/c值,b为添加药物浓度的t/c值),拟合出标准曲线如图5所示:半数抑制浓度(ic50)为0.084ng/ml,线性范围为:0.006~1.14ng/ml。
120.特异性检测:
121.分别将100ul金刚烷胺、金刚乙胺、利巴韦林、诺氟沙星、盐酸吗啉胍、氟苯尼考、氯霉素溶液加入到试剂盒的金刚烷胺抗体-胶体金标记的探针样品孔中孵育5min,再将免疫层析试纸条的样品垫置于金刚烷胺抗体-胶体金标记的探针样品孔中反应5min,通过t线、c线显色判断检测结果;通过免疫层析读数仪读取各试纸条的t/c值,进行样品中金刚烷胺检测结果判定如表1所示:该试剂盒只对金刚烷胺有响应,对其他类似物药物的检测结果均呈阴性,具有高度特异性。
122.表1:试剂盒对药物检测的结果
[0123][0124][0125]
灵敏度检测:
[0126]
分别将浓度为0、0.05、0.1、0.2、0.4、0.5、0.8、1ug/kg金刚烷胺药物取100ul加入到试剂盒的金刚烷胺抗体-胶体金标记的探针样品孔中孵育3min,再将免疫层析试纸条的样品垫置于金刚烷胺抗体-胶体金标记的探针样品孔中反应5min,通过t线、c线显色判断检测结果;通过免疫层析读数仪读取各试纸条的t/c值,如图6所示:该试剂盒的灵敏度为0.5ug/kg(在0.5ug/kg处c线与t线均开始显色),最低检测限为0.005ng/ml(计算方法为:阴性空白样品检测的平均值0.002ng/m l+3
×
标准偏差0.001ng/m l
×
样品稀释倍数1),裸眼消线(cut-off)值分别0.4ng/ml,检测灵敏度高。
[0127]
应用例3金刚烷胺检测的准确度和精密度测试
[0128]
本发明金刚烷胺检测方法的准确度和精密度通过回收率和变异系数来反映。
[0129]
称取2g鸡肉和鸭肉分别放入0.5、1和2ng/ml金刚烷胺溶液中,每个浓度设置3个重复实验,按应用例1的前处理方法进行金刚烷胺的聚集和净化,在用金刚烷胺胶体金免疫检测试剂盒进行定性检测,重复试验3天,试纸条显色结果如图7所示:
[0130]
用胶体金定量检测仪检测样品中金刚烷胺的浓度,计算回收率和变异系数,标准差与平均数的比值称为变异系数,记为cv(%),回收率在60~110%范围内就符合定量方法学要求,变异系数数值越小(小于15%),说明数据越集中,数据越稳定,测试方法精密度越好。
[0131]
测试结果如表2所示:不论是鸡肉和鸭肉时,添加1ng/ml、2ng/ml金刚烷胺溶液的回收率均在72%以上,变异系数≤7.2,证明本发明金刚烷胺胶体金免疫检测试剂盒检测金刚烷胺的准确度高、精密度好。同时,用elisa试剂盒进行验证,对比证明上述结果可靠,可满足定量方法学要求。
[0132]
表2金刚烷胺检测的准确度和精密度结果
[0133]
[0134][0135]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1