低分子肝素生物制品免疫原性的体外检测方法
1.本发明涉及生物制品免疫原性检测技术领域,具体涉及低分子肝素生物制品免疫原性的体外检测方法。
技术背景
2.低分子量肝素(low-molecular-weight heparins,lmwhs)是以肝素(主要为猪肠黏膜来源)为原料采用不同的解聚方法制得的一系列复杂的寡糖混合物。肝素是临床广泛应用的抗凝血药物,主要通过抑制凝血因子fxa发挥抗凝作用。临床主要用于预防和治疗静脉血栓。尽管低分子肝素应用于临床取得了较好的临床效果,但同时也带来了一些不良反应,例如出血、过敏反应以及肝素诱导的血小板减少(heparin-induced thrombocytopenia,hit)。而lmwhs因其具有注射吸收好,半衰期长,生物利用度高,出血的副作用少等优点在临床上的应用不断扩大。
3.在临床使用中,肝素和lmwhs均存在发生hit的风险,临床表现为血小板减少和高凝状态,严重者可导致静脉、动脉血栓形成。产生这一风险的原理是低分子肝素进入人体后,与血小板趋化因子4(platelet factor 4,pf4)结合形成复合物,人体对这一复合物产生抗体,抗体与复合物结合引发不可逆的血小板聚集、减少或血栓形成。数据显示,经依诺肝素和肝素钠治疗的患者发生hit的风险分别为0.2%和2%~3%。尽管lmwhs的hit发生率相对较低,但潜在后果严重,同时由于lmwhs可以在门诊患者中使用,因此对lmwhs产品免疫原性风险的评估和管理非常重要。
4.由于国内lmwhs免疫原性研究起步晚,缺乏中国人群hit的临床资料,目前暂无具有提示意义的体外检测lmwhs免疫原性方法。国外文献报道常用的方法有两种:一种是采集hit患者血清进行lmwhs特异性抗体结合试验(heparin-induced platelet activation test,hipa),另一种是使用放射性方法检测血小板激活后五羟色胺释放量(14c-serotonin release assay,sra)。这两种方法因样品难以获得(hit患者的血样)和操作复杂(在放射性实验室完成试验操作)而难以构建。
5.hipa检测方法是将健康人血小板富集血浆与lmwhs和hit患者血清(含针对lmwhs-pf4复合物的抗体)孵育,lmwhs与血浆中的pf4、患者血清中的抗体结合形成抗原抗体复合物,并与血小板表面的fcγiia受体结合,诱导fcγiia介导的血小板活化,活化的血小板孵育液肉眼可见出现浑浊,则说明lmwhs具有免疫原性。
6.sra方法与hipa方法类似,将健康人血小板富集血浆与14c标记的五羟色胺孵育,使血小板充分吸收14c五羟色胺,随后加入lmwhs和hit患者血清,lmwhs与血浆中的pf4、患者血浆中的抗体结合形成抗原抗体复合物,并与血小板表面的fcγiia受体结合,诱导fcγiia介导的血小板活化而释放14c五羟色胺,通过检测放射元素量确定lmwhs是否具有免疫原性。
7.hipa和sra方法均需要获得hit确诊患者血清,在国内,获得此样本存在极大难度,一方面原因在于hit发病率较低(依诺肝素和肝素钠治疗的患者发生hit的风险分别为
0.2%和2%~3%),另一方面由于国内尚未建立完善的hit诊断标准,无法追踪患者信息。
技术实现要素:
8.本发明的目的是针对现有技术中需要大规模采集hit患者血清,操作性差的缺陷,提供了一种低分子肝素生物制品免疫原性的体外检测方法;此种体外检测方法的使用,可以使针对低分子肝素产品的体外免疫原性评估过程中不需采集hit患者血清,可操作性强,对比hipa和sra方法具有显著优势。
9.为实现上述目的,本发明采用了以下技术方案:
10.低分子肝素生物制品免疫原性的体外检测方法,是将外周血单核细胞与含有低分子肝素的复合物孵育后,采用流式细胞分析方法检测抗原递呈细胞上cd25的平均荧光强度,表征出树突状细胞的活化程度,并与阳性对照制品进行比对,即可测定所述低分子肝素生物制品的免疫原性。
11.树突细胞(dendritic cell,dc)因其表面具有星状多形性或树枝状突起而得名,此细胞是机体功能最强的专职抗原递呈细胞(antigen presenting cells,apc),它能高效地摄取、加工处理和递呈抗原,未成熟dc具有较强的迁移能力,成熟dc能有效激活初始t细胞,处于启动、调控、并维持免疫应答的中心环节。
12.树突细胞的活化程度,能够反映机体产生获得性免疫应答的强弱,因而树突细胞是否被激活可以来用评估机体在外源物刺激作用下,通过固有免疫或t细胞依赖的免疫反应而产生的免疫应答情况。流式细胞术能够准确确定多种细胞中被活化的树突状细胞的数量,通过流式细胞术确定树突细胞数量未增加的情况下,与阳性对照制品(即能够激活树突细胞)及阴性对照制品(包括无外源刺激对照、非复合物现有的低分子肝素产品对照、非复合物pf4对照)进行比对,就可以确定低分子肝素类产品是否具有免疫原性。
13.优选地,树突细胞包含在已经商业化的外周血单核细胞中;
14.优选地,树突细胞也可以包含在健康人全血中分离得到的外周血单核细胞中。
15.流式细胞术的工作原理是在细胞分子水平上通过单克隆抗体对单个细胞或其他生物粒子进行多参数、快速的定量分析。通过检测到的各细胞的平均荧光强度,依据荧光强度判定树突细胞的占比,从而能够有效表征树突细胞的活化程度。
16.本发明是通过检测ld-、cd3-、cd19-、cd14
+
、hla-dr
+
中cd25的平均荧光强度表征树突状细胞是否活化;“+
”“‑”
代表各指标的阳性和阴性判定。
17.进一步的,上述的低分子肝素生物制品免疫原性的体外检测方法,所述外周血单核细胞的细胞计数为2
×
10
6-4
×
106cells/ml。
18.外周血单个核细胞(peripheral blood mononuclear cell,pbmc)是外周血中具有单个核的细胞,包括淋巴细胞和单核细胞;外周血单核细胞可以为商业化的外周血单核细胞制品,也可以是通过健康人全血分离得到的外周血单核细胞制品,但其均需要达到细胞计数为2-4
×
106cells/ml的标准,高于或低于此标准,均会影响后续的流式细胞检测,也进而会影响树突细胞的表征,使得免疫原性的检测结果大大降低。
19.进一步的,上述的低分子肝素生物制品免疫原性的体外检测方法,所述含有低分子肝素的复合物为低分子肝素与肝素结合剂所形成的复合物。
20.低分子肝素是由普通肝素解聚制备而成的一类分子量较低的肝素的总称,其具有
注射吸收好、半衰期长、生物利用度髙、出血负作用少、无需实验室监测等优点,但低分子肝素也可能产生一些值得关注的不良反应,例如肝素诱导的血小板减少(heparin-induced thrombocytopenia,hit),这是由于低分子肝素与机体内存在的或经由低分子肝素给药后刺激产生的一种肝素结合剂相结合形成复合物,所形成的复合物能够激活机体免疫反应,从而产生上述不良反应;作为体外检测方法,本发明实际上是在体外模拟了此种结合形成复合物,以及复合物激活机体免疫反应的过程,以现有商业化的肝素结合剂与低分子肝素体外结合形成复合物,进而使复合物具备了相应的功能,通过体外环境反应模拟体内环境反应的过程,克服了现有技术中的缺陷。
21.进一步的,上述的低分子肝素生物制品免疫原性的体外检测方法,所述低分子肝素为猪肠黏膜来源的肝素解聚后得到的低分子肝素。
22.进一步的,上述的低分子肝素生物制品免疫原性的体外检测方法,所述低分子肝素的分子量为1500-6500da。
23.优选地,低分子肝素的分子量为3600-5000da或5600-6400da。
24.肝素解聚后产生的低分子肝素,通常居于上述分子量范围之内,未降解的肝素与复合物的结合能力大幅增强,导致hit的发生率显著增高。
25.进一步的,上述的低分子肝素产品免疫原性的体外检测方法,所述肝素结合剂是在体内存在的、血小板被激活后产生的或是直接在体外合成的、能够与所述低分子肝素特异性结合的血小板因子。
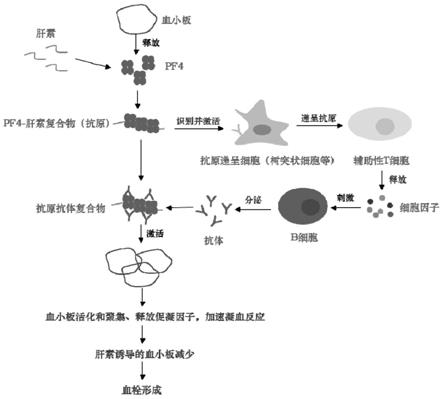
26.如图1所示,肝素结合剂,是由血小板产生或被激活状态下产生并释放出的一种血小板因子,这种血小板因子,同样可以通过体外重组合成获得,二者的作用效果基本相同,均是为了与低分子肝素特异性结合,形成一种类似于抗原的复合物,此种复合物能够有效的识别并激活抗原呈递细胞(树突细胞),从而实现抗原的呈递,而后抗原呈递后能够刺激辅助性t细胞释放细胞因子,此种细胞因子能够刺激b细胞分泌出相应的抗体,此抗体再与抗原复合物结合,得到了抗原抗体复合物,此种抗原抗体复合物的合成,最终导致了血小板释放促凝血因子、加速了凝血反应,凝血反应的加速,又导致了血小板减小,进而形成了血栓,这也就是肝素和低分子肝素在体内导致hit不良反应的基本原理。
27.进一步的,上述的低分子肝素生物制品免疫原性的体外检测方法,所述肝素结合剂为鱼精蛋白、溶菌酶和/或血小板因子4,优选为血小板因子4。
28.血小板第4因子(platlet factor 4,pf4)是由血小板α颗粒合成的一种特异蛋白质,是一种碱性多肽的四聚体。易结合并中和肝素,并易结合于血管内皮细胞表面的硫酸乙酰肝素上,以减慢凝血酶灭活过程,从而促进血栓形成。
29.进一步的,上述的低分子肝素生物制品免疫原性的体外检测方法,低分子肝素和肝素结合剂的配比按照摩尔比计为(0.5-10):(0.5-20)。
30.低分子肝素和肝素结合剂的配比可选择为2:1、1:1、0.5:1、1:2、1:0.5,优选为1:0.5。
31.肝素亲和剂优选为pf4,申请人为了得到低分子肝素和肝素亲和剂的最优配比,设计了大量的正交实验,最终通过实验发现,低分子肝素和pf4以摩尔比(0.125-4):0.5配比即可实现相应效果,而优选的配比,即低分子肝素和pf4以摩尔比1:0.5,具体应用中,浓度配比为低分子肝素:pf4为(0.2-0.7)iu/ml:(6.3-22.1)μg/ml,得到的pf4-肝素超大分子复
合物,其结合抗体并诱发hit(肝素诱发的血小板减少症)的能力最强。
32.进一步的,上述的低分子肝素生物制品免疫原性的体外检测方法,所述流式细胞分析方法是通过抗体区分出外周血单核细胞中的单核细胞和抗原呈递细胞,检测这些细胞上cd25的荧光强度,以此确定活化的树突细胞在细胞总量中的占比。
33.进一步的,上述的低分子肝素生物制品免疫原性的体外检测方法,所述流式细胞分析方法中,通过ld染液区分活/死细胞,通过cd3抗体区分t细胞,通过cd19抗体区分b细胞,通过cd14抗体区分单核细胞,通过hla-dr抗体区分抗原呈递细胞。
34.ld是7-氨基-放线菌素d(7-aad)活性染色液,是一种核酸染料,无法进入活细胞的质膜,但可以进入死亡细胞质膜而结合dna,通过在一定波长光源下发光而排除流式细胞分析中的无活性细胞。
35.cd3分子通过盐桥与t细胞抗原受体(t cell receptor,tcr)相连,参与t细胞的信号转导,主要用于标记胸腺细胞、t淋巴细胞。
36.cd19分子能够参与b细胞的增殖、分化、活化及抗体产生,促进bcr的信号转导,可视为b细胞的标志,帮助鉴定b细胞。
37.cd14分子,是一种存在于单核细胞、粒单系细胞等细胞表面的白细胞分化抗原,cd14通常被用作单核细胞的标志分子。
38.hla-dr是mhc-ii类分子,表达于b细胞、活化的t细胞、巨噬细胞等抗原提呈细胞(apc细胞)表面,是此类细胞的标志分子。
39.进一步的,上述的低分子肝素生物制品免疫原性的体外检测方法,所述阳性对照制品为脂多糖、toll样受体激动剂和/或(12-)十四酸佛波酯(-13-)乙酸盐。
40.进一步的,上述的低分子肝素生物制品免疫原性的体外检测方法,所述阳性对照制品为脂多糖lps和toll样受体激动剂r848的复合物,所述脂多糖lps的用量为80-120ng/ml,优选为100ng/ml;所述toll样受体激动剂r848的用量为8-12μg/ml,优选为10μg/ml;所述(12-)十四酸佛波酯(-13-)乙酸盐的用量为0.4-0.6μm,优选为0.5μm。
41.脂多糖lps,通过存在于宿主细胞的细胞膜表面的toll样受体4(toll-like receptor、tlr)(tlr4)实现其作用。
42.r848雷西莫特,toll样受体7和8的激动剂(tlr7/tlr8),诱导细胞因子如tnf-α,il-6和ifn-α的上调。
43.二者采用所述配比复合后,能够有效促进外周血单核细胞中树突细胞的活化,从而实现了免疫原性检测中阳性对照制剂的功能。
44.进一步的,上述的低分子肝素生物制品免疫原性的体外检测方法,所述体外检测方法具体包括以下步骤:s1.外周血单核细胞的活化:
45.在外周血单核细胞中加入含有低分子肝素的复合物,共同孵育24-48小时,优选为48小时,得孵育细胞;s2.流式细胞分析方法的准备:
46.1)将步骤s1得到的孵育细胞吹散并离心;
47.2)以pbs缓冲液重悬步骤1)得到的吹散细胞,离心后弃上清,取沉淀;
48.3)步骤2)得到沉淀加入含有fc封闭液和死活染液的facs缓冲液,重悬细胞后避光
孵育,得二次孵育细胞,facs缓冲液由按体积百分比计98%的pbs缓冲液和2%的胎牛血清fbs配制得到;
49.4)步骤3)得到的二次孵育细胞中,加入含有表面抗体的facs缓冲液,避光孵育,得三次孵育细胞;
50.5)步骤4)得到的三次孵育细胞中,加入facs缓冲液,离心后弃上清,取沉淀;
51.6)步骤5)得到的沉淀中,加入facs缓冲液,再次离心后弃上清,取沉淀;
52.7)步骤6)得到的沉淀中,加入facs缓冲液重悬细胞,再次离心弃上清取沉淀;
53.8)步骤7)得到的沉淀中,加入facs缓冲液重悬细胞,待采用流式细胞方法检测分析;s3.流式细胞检测分析:
54.采用多色流式细胞分析系统,以死活细胞染液区分出活/死细胞,用抗体区分出t淋巴细胞、b淋巴细胞、单核细胞、抗原呈递细胞apc,以荧光强度表征树突细胞的活化程度,并与阳性对照制品进行比对,即可测定所述低分子肝素生物制品的免疫原性。
55.步骤s2的步骤1)、2)、5)、6)、7)中,离心过程均优选为:4℃,500g,离心5min;
56.步骤3)中,孵育过程优选为:4℃,避光孵育15min;fc封闭液为1:50用facs或pbs稀释的封闭液;死活染料为1:1000用facs或pbs稀释的染液;
57.步骤4)中,孵育过程优选为:4℃,避光孵育30min;所述表面抗体为cd3(1μl/106个细胞)、cd19(1μl/106个细胞)、cd14(4μl/106个细胞)、hla-dr(4μl/106个细胞)和cd25(4μl/106个细胞)。
58.与现有技术相对比,本发明具有以下优点:
59.本发明提供的低分子肝素生物制品免疫原性的体外检测方法,克服了传统方法中,必须要获得hit确诊患者血清的缺陷,降低了树突细胞的活化程度判定的操作难度,也降低了体外评估低分子肝素免疫原性的操作难度,对比hipa和sra方法具有显著优势。
60.本发明提供的低分子肝素,能够大幅降低体内或体外的血小板聚集,降低血栓形成的概率,通过上述树突细胞的活化程度判定,再参照阳性对照,也证明了低分子肝素确实不具有免疫原性。
附图说明
61.图1显示为pf4-低分子肝素复合物(抗原制剂)对诱导血栓形成的原理图。
62.图2显示为实施例2中采用人全血为来源时,人全血加入分离液后的形态图示。
63.图3显示为实施例2中采用人全血为来源时,人全血加入分离液并离心后的分层效果图示;其中,从上至下分别为血清层、pbmc层、分离液层和血细胞层。
64.图4-图13分别显示为apc细胞(抗原呈递细胞)中cd25的阳性率显示图;
65.其中,图4为阴性对照,图5为阳性对照(lps+r848),图6为lmwh(待测药=千红812006029a),图7为pf4单独使用,图8为pf4+测试药复合物(待测药=千红811812047a),图9为pf4+测试药复合物(待测药=千红811910066a),图10为pf4+测试药复合物(待测药=千红812006029a),图11为pf4+参比制剂复合物(原研药=赛诺菲7s991),图12为pf4+参比制剂复合物(原研药=赛诺菲8s362),图13为pf4+参比制剂复合物(原研药=赛诺菲9s756)。
66.图14显示为实施例2中,apc细胞上(抗原呈递细胞)cd25表达的平均荧光强度,其
中,***p《0.001vs.阴性组;###p《0.001vs.阳性组。
67.图15显示为树突细胞激活试验技术用于树突细胞的活化程度判定(进而评估低分子肝素免疫原性)的技术流程示意图。
68.图16显示为不同低分子肝素与pf4摩尔比情况下复合物的sec色谱图;其中,(a)低分子肝素:pf4摩尔比=0.125:0.5;(b)低分子肝素:pf4摩尔比=0.5:0.5;(c)低分子肝素:pf4摩尔比=1:0.5;(d)低分子肝素:/pf4摩尔比=1.25:0.5;(e)低分子肝素:pf4摩尔比=1.5:0.5;(f)低分子肝素:pf4摩尔比=1.75:0.5;(g)低分子肝素:pf4摩尔比=2:0.5;(h)低分子肝素:pf4摩尔比=4:0.5;图中enox表示低分子肝素;ulc表示超大复合物;sc表示小复合物。
69.图17显示为实施例3中,apc细胞上(抗原呈递细胞)cd25表达的平均荧光强度,其中,***p《0.001vs.阴性组;###p《0.001vs.阳性组。
70.具体实施方式
71.为使本发明的目的、技术方案和优点更加清楚明了,下面对本发明进行进一步详细说明。但是应该理解,此处所描述仅仅用以解释本发明,并不用于限制本发明的范围。
72.除非另有定义,本文所使用的所有的技术术语和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同,本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在限制本发明。本文中所使用的试剂和仪器均商购可得,所涉及的表征手段均可参阅现有技术中的相关描述,本文中不再赘述。
73.为了进一步了解本发明,下面结合最佳实施例对本发明作进一步的详细说明。
74.名词(缩写)解释:
75.lmwhs——低分子肝素;
76.hit——肝素诱导的血小板减少;
77.pf4——血小板因子4;
78.hipa——采集hit患者血清进行lmwhs特异性抗体结合试验;
79.sra——放射性方法检测血小板激活后五羟色胺释放量;
80.fcγriia——主要在中性粒细胞、单核细胞、dc细胞、血小板表面表达的受体蛋白;
81.pbmc——外周血单核细胞;
82.pbs——pbs缓冲液;
83.fbs——胎牛血清;
84.x-vivo 15——淋巴细胞造血干细胞无血清培养基无血清培养基;
85.lps——脂多糖,通过存在于宿主细胞的细胞膜表面的toll样受体4(toll-like receptor、tlr)(tlr4)实现其作用;
86.r848——雷西莫特,toll样受体7和8的激动剂(tlr7/tlr8),诱导细胞因子如tnf-α,il-6和ifn-α的上调;
87.千红怡诺lmwh——已经商业化的低分子肝素产品;
88.千红怡那lmwh——已经商业化的低分子肝素产品;
89.赛诺菲克赛lmwh——原研药,赛诺菲公司已经商业化的低分子肝素产品;
90.aspen速碧林lmwh——原研药,aspen公司已经商业化的低分子肝素产品;
91.fc封闭液——fc阻断剂,商品化的fc block,阻断位于不同细胞上的fc受体,降低非特异性结合导致的背景信号;
92.facs缓冲液——由98%pbs缓冲液和2%胎牛血清fbs配制得到;
93.死活染液——live/dead染液(ld),用以区分死活细胞;
94.cd3——分化簇3,与tcr形成tcr-cd3复合体,共同参与t细胞对抗原的识别;
95.cd19——b细胞表达的cd分子(白细胞分化抗原),参与b细胞的增殖、分化、活化及抗体产生,为b细胞的标志,用于鉴定b细胞;
96.cd14——lps受体,存在于单核细胞、巨噬细胞等细胞表面的白细胞分化抗原;
97.hla-dr——mhc-ii类分子,表达于b细胞、活化的t细胞、巨噬细胞等抗原提呈细胞(apc细胞)表面b淋巴细胞、巨噬细胞、活化t淋巴细胞、活化nk淋巴细胞和人祖细胞上,用于标记此类细胞;
98.cd25——又称为白介素2受体α亚基(il2ra),检测il-2受体α的表达,在活化的t细胞、b细胞、dc细胞上表达会上调。
99.实施例1
100.低分子肝素生物制品免疫原性的体外检测方法,是将外周血单核细胞与含有低分子肝素的复合物孵育后,采用流式细胞分析方法检测抗原递呈细胞上cd25的平均荧光强度,表征出树突状细胞的活化程度,并与阳性对照制品进行比对,即可测定所述低分子肝素生物制品的免疫原性。
101.树突细胞(dendritic cell,dc)因其表面具有星状多形性或树枝状突起而得名,此细胞是机体功能最强的专职抗原递呈细胞(antigen presenting cells,apc),它能高效地摄取、加工处理和递呈抗原,未成熟dc具有较强的迁移能力,成熟dc能有效激活初始t细胞,处于启动、调控、并维持免疫应答的中心环节。
102.树突细胞的活化程度,能够反映机体产生获得性免疫应答的强弱,因而树突细胞是否被激活可以来用评估机体在外源物刺激作用下,通过固有免疫或t细胞依赖的免疫反应而产生的免疫应答情况。流式细胞术能够准确确定多种细胞中被活化的树突状细胞的数量,通过流式细胞术确定树突细胞数量未增加的情况下,与阳性对照制品(即能够激活树突细胞)及阴性对照制品(包括无外源刺激对照、非复合物现有的低分子肝素产品对照、非复合物pf4对照)进行比对,就可以确定低分子肝素类产品是否具有免疫原性。
103.优选地,树突细胞包含在已经商业化的外周血单核细胞中;
104.优选地,树突细胞也可以包含在健康人全血中分离得到的外周血单核细胞中。
105.流式细胞术的工作原理是在细胞分子水平上通过单克隆抗体对单个细胞或其他生物粒子进行多参数、快速的定量分析。通过检测到的各细胞的平均荧光强度,依据荧光强度判定树突细胞的占比,从而能够有效表征树突细胞的活化程度。
106.本发明是通过检测ld-、cd3-、cd19-、cd14
+
、hla-dr
+
中cd25的平均荧光强度表征树突状细胞是否活化;“+
”“‑”
代表各指标的阳性和阴性判定。
107.低分子肝素生物制品免疫原性的体外检测方法中,外周血单核细胞的细胞计数为2
×
106cells/ml-4
×
106cells/ml,优选为3
×
106cells/ml。
108.外周血单个核细胞(peripheral blood mononuclear cell,pbmc)是外周血中具有单个核的细胞,包括淋巴细胞和单核细胞;外周血单核细胞可以为商业化的外周血单核细胞制品,也可以是通过健康人全血分离得到的外周血单核细胞制品,但其均需要达到细胞计数为2-4
×
106cells/ml的标准,高于或低于此标准,均会影响后续的流式细胞检测,也进而会影响树突细胞的表征,使得免疫原性的检测结果大大降低。
109.含有低分子肝素的复合物为低分子肝素与肝素结合剂所形成的复合物。
110.低分子肝素是由普通肝素解聚制备而成的一类分子量较低的肝素的总称,其具有注射吸收好、半衰期长、生物利用度髙、出血负作用少、无需实验室监测等优点,但低分子肝素也可能产生一些值得关注的不良反应,例如肝素诱导的血小板减少(heparin-induced thrombocytopenia,hit),这是由于低分子肝素与机体内存在的或经由低分子肝素给药后刺激产生的一种肝素结合剂相结合形成复合物,所形成的复合物能够激活机体免疫反应,从而产生上述不良反应;作为体外检测方法,本发明实际上是在体外模拟了此种结合形成复合物,以及复合物激活机体免疫反应的过程,以现有商业化的肝素结合剂与低分子肝素体外结合形成复合物,进而使复合物具备了相应的功能,通过体外环境反应模拟体内环境反应的过程,克服了现有技术中的缺陷。
111.低分子肝素为猪肠黏膜来源的肝素解聚后得到的低分子肝素。
112.低分子肝素的分子量为1500-6500da。
113.可选地,低分子肝素的分子量为3600-5000da,5600-6400da。
114.肝素解聚后产生的低分子肝素,通常居于上述分子量范围之内,未降解的肝素与复合物的结合能力大幅增强,导致hit的发生率显著增高。
115.肝素结合剂是在体内存在的、或血小板被激活后产生的或是直接在体外合成的、能够与所述低分子肝素特异性结合的血小板因子。
116.如图1所示,肝素结合剂,是在肝素进入体内后,由血小板产生或被激活状态下产生并释放出的一种血小板因子,这种血小板因子,同样可以通过体外重组合成获得,二者的作用效果基本相同,均是为了与低分子肝素特异性结合,形成一种类似于抗原的复合物,此种复合物能够有效的识别并激活抗原呈递细胞(树突细胞),从而实现抗原的呈递,而后抗原呈递后能够刺激辅助性t细胞释放细胞因子,此种细胞因子能够刺激b细胞分泌出相应的抗体,此抗体再与抗原复合物结合,得到了抗原抗体复合物,此种抗原抗体复合物的合成,最终导致了血小板释放促凝血因子、加速了凝血反应,凝血反应的加速,又导致了血小板减小,进而形成了血栓,这也就是肝素和低分子肝素在体内导致hit不良反应的基本原理。
117.肝素结合剂为肝素结合剂为鱼精蛋白、溶菌酶和/或血小板因子4,优选为血小板因子4。
118.血小板第4因子(platlet factor 4,pf4)是由血小板α颗粒合成的一种特异蛋白质,是一种碱性多肽的四聚体。易结合并中和肝素,并易结合于血管内皮细胞表面的硫酸乙酰肝素上,以减慢凝血酶灭活过程,从而促进血栓形成。
119.低分子肝素和肝素结合剂的配比按照摩尔比计为(0.5-10):(0.5-20);
120.低分子肝素和肝素结合剂的配比可选择为2:1、1:1、0.5:1、1:2、1:0.5,优选为1:0.5。
121.肝素亲和剂优选为pf4,申请人为了得到低分子肝素和肝素亲和剂的最优配比,设
计了大量的正交实验,最终通过实验发现,低分子肝素和pf4以摩尔比(0.125-4):0.5配比即可实现相应效果,而优选的配比,即低分子肝素和pf4以摩尔比1:0.5,具体应用中,浓度配比为低分子肝素:pf4为(0.2-0.7)iu/ml:(6.3-22.1)μg/ml,得到的pf4-肝素超大分子复合物,其结合抗体并诱发hit(肝素诱发的血小板减少症)的能力最强。
122.流式细胞分析方法是过抗体区分出外周血单核细胞中的单核细胞和抗原呈递细胞,检测这些细胞上cd25的荧光强度,以此确定活化的树突细胞在细胞总量中的占比。
123.流式细胞分析方法中,通过ld染液区分活/死细胞,通过cd3抗体区分t细胞,通过cd19抗体区分b细胞,通过cd14抗体区分单核细胞,通过hla-dr抗体区分抗原呈递细胞。
124.ld是7-氨基-放线菌素d(7-aad)活性染色液,是一种核酸染料,无法进入活细胞的质膜,但可以进入死亡细胞质膜而结合dna,通过在一定波长光源下发光而排除流式细胞分析中的无活性细胞。
125.cd3分子通过盐桥与t细胞抗原受体(t cell receptor,tcr)相连,参与t细胞的信号转导,主要用于标记胸腺细胞、t淋巴细胞。
126.cd19分子能够参与b细胞的增殖、分化、活化及抗体产生,促进bcr的信号转导,可视为b细胞的标志,帮助鉴定b细胞。
127.cd14分子,是一种存在于单核细胞、粒单系细胞等细胞表面的白细胞分化抗原,cd14通常被用作单核细胞的标志分子。
128.hla-dr是mhc-ii类分子,表达于b细胞、活化的t细胞、巨噬细胞等抗原提呈细胞(apc细胞)表面,是此类细胞的标志分子。
129.阳性对照制品为脂多糖、toll样受体激动剂和/或(12-)十四酸佛波酯(-13-)乙酸盐。
130.阳性对照制品为脂多糖lps和toll样受体激动剂r848的复合物,脂多糖lps的用量为80-120ng/ml,优选为100ng/ml;toll样受体激动剂r848的用量为8-12μg/ml,优选为10μg/ml;(12-)十四酸佛波酯(-13-)乙酸盐的用量为0.4-0.6μm,优选为0.5μm。
131.脂多糖lps,通过存在于宿主细胞的细胞膜表面的toll样受体4(toll-like receptor、tlr)(tlr4)实现其作用。
132.r848雷西莫特,toll样受体7和8的激动剂(tlr7/tlr8),诱导细胞因子如tnf-α,il-6和ifn-α的上调。
133.二者采用所述配比复合后,能够有效促进外周血单核细胞中树突细胞的活化,从而实现了免疫原性检测中阳性对照制剂的功能。
134.低分子肝素生物制品免疫原性的体外检测方法,具体包括以下步骤:
135.s1.外周血单核细胞的活化:
136.在外周血单核细胞中加入含有低分子肝素的复合物,共同孵育24-48小时,优选为48小时,得孵育细胞;
137.s2.流式细胞分析方法的准备:
138.1)将步骤s1得到的孵育细胞吹散并离心;
139.2)以pbs缓冲液重悬步骤1)得到的吹散细胞,离心后弃上清,取沉淀;
140.3)步骤2)得到沉淀加入含有fc封闭液和死活染液的facs缓冲液,重悬细胞后避光孵育,得二次孵育细胞,facs缓冲液由按体积百分比计98%的pbs缓冲液和2%的胎牛血清
fbs配制得到;
141.4)步骤3)得到的二次孵育细胞中,加入含有表面抗体的facs缓冲液,避光孵育,得三次孵育细胞;
142.5)步骤4)得到的三次孵育细胞中,加入facs缓冲液,离心后弃上清,取沉淀;
143.6)步骤5)得到的沉淀中,加入facs缓冲液,再次离心后弃上清,取沉淀;
144.7)步骤6)得到的沉淀中,加入facs缓冲液重悬细胞,再次离心弃上清取沉淀;
145.8)步骤7)得到的沉淀中,加入facs缓冲液重悬细胞,待采用流式细胞方法检测分析;
146.s3.流式细胞检测分析:
147.采用多色流式细胞分析系统,以死活细胞染液区分出活/死细胞,用抗体区分出t淋巴细胞、b淋巴细胞、单核细胞、抗原呈递细胞apc,以荧光强度表征树突细胞的活化程度,并与阳性对照制品进行比对,即可测定所述低分子肝素生物制品的免疫原性。
148.步骤s2的步骤1)、2)、5)、6)、7)中,离心过程均优选为:4℃,500g,离心5min;
149.步骤3)中,孵育过程优选为:4℃,避光孵育15min;fc封闭液为1:50用facs或pbs稀释的封闭液;死活染料为1:1000用facs或pbs稀释的染液;
150.步骤4)中,孵育过程优选为:4℃,避光孵育30min;所述表面抗体为cd3(1μl/106个细胞)、cd19(1μl/106个细胞)、cd14(4μl/106个细胞)、hla-dr(4μl/106个细胞)和cd25(4μl/106个细胞)。
151.本技术将商业化的外周血单核细胞(peripheral blood mononuclear cells,pbmc),或采集健康人全血分离出的外周血单核细胞,与低分子肝素-pf4复合物孵育后,使用多色流式细胞分析系统,通过不同抗体区分出活/死细胞、t淋巴细胞、b淋巴细胞、单核细胞、抗原递呈细胞,检测ld-cd3-cd19-cd14+hla-dr+中cd25的平均荧光强度表征树突状细胞是否活化,并与阳性对照制品进行比对,即可测定所述低分子肝素生物制品的免疫原性。
152.上述树突细胞活化程度的判定方法,其应用可以延伸至多个方向、多个领域;例如,包括但不限于,以树突细胞活化程度的判定结果,结合阳性对照制品的比对结果,确定了新研发成功的低分子肝素药物制剂(千红)确实不具有免疫原性,且与原研药物制剂(赛诺菲)的免疫原性基本相同(甚至更低)。
153.实施例2:
154.1.pbmc的获得/提取:
155.a)、pbmc来源为购买:
156.pbmc为外周血单核细胞,其通常采用已经商业化的外周血单核细胞,本实施例中的3例样品分别采用:
157.a、购自上海雅吉生物科技有限公司的外周血单核细胞产品,货号:ys1106c;品牌:atcc来源;置于3
×
106cells/ml培养;
158.b、购自上海康朗生物科技有限公司的人外周血单个核细胞产品,货号:klh1104;品牌:康朗生物;置于3
×
106cells/ml培养;
159.c、购自上海元琦生物科技有限公司的pbmc人外周血单核细胞产品,货号:tx2106;品牌:atcc/dsmz/ecacc来源;置于3
×
106cells/ml培养。
160.b)、pbmc来源为自行分离提取:
161.pbmc也可采用从健康人全血中自行分离的方式获得,具体方法如下所示:
162.1)采集3例健康人全血;
163.2)保持无菌操作,取人外周血及hank's缓冲液(或pbs)以1:1的比例混合(3ml:3ml);然后取2支15ml离心管,分别加入3ml ficoll分离液,随后向其中加入hank's缓冲液与外周血的稀释液,约6ml;
164.3)管壁倾斜,将血液沿管壁轻轻缓慢加入,保证分离液和血样的分界清晰,不能将血液与淋巴细胞分离液相混,如图2所示;
165.4)将15ml离心管放置离心机中离心30min(400g,25℃),升降速率均为最低;
166.5)离心后如图3所示,可见分为四层,最上层黄色为稀释血清,紧邻最上层的第二层是目的层,为白色云雾状pbmc层,第三层为分离液层,最下层是血细胞,然后小心吸取pbmc层,放置于15ml管中;
167.6)加入适量x-vivo 15(无血清免疫细胞培养基)洗一次;如果沉淀中有较多红细胞,用红细胞裂解液5ml冰上处理5min后再离心一次;
168.7)x-vivo 15重悬计数,3
×
106cells/ml培养。
169.2.一种低分子肝素钠复合物对pbmc的活化:
170.在细胞(3
×
106/孔)中分别加入100ng/ml lps+10μg/ml r848(阳性对照)、12.6μg/ml pf4、(12.6μg/ml:0.4iu/ml的)pf4-低分子肝素复合物,孵育48h。具体试验分组如下表1所示:
171.其中,*:基于文献数据,此种低分子肝素在人体内的血药浓度范围为0.2~0.4iu/ml;
172.#:基于文献数据及药学研究结果,pf4-lmwh复合物按照摩尔比0.5:1配制;
173.测试样品复合物组ⅰ,针对人全血提取的pbmc;
174.测试样品复合物组ⅱ,针对商业购买来源的pbmc。
macromolecular complexes,ulc)时,其结合抗体并诱发hit的能力最强,因此,试验过程中选择获得最多ulc的低分子肝素和pf4配比开展研究。
193.基于本次实验结果可以得出以下结论:
194.1)温孵过程中,人单核和淋巴细胞群中的活细胞占比在93.47-96.13%之间,证明细胞活性未受各组受测试药物的影响,单核和淋巴细胞群中的活细胞比例(%)如下表3所示:
195.表3中,血样1-3组别显示为人全血提取的pbmc测试结果;
196.表3表3
197.针对商业购买来源的pbmc,同样进行与表3类似的pbmc测试,其结果与表3结果高度相似,说明本发明所提供的pbmc既可以来源于人全血提取,也可以来源于现有已商业化的pbmc。
198.2)lps和r848均为toll样受体(tlr)激动剂,能诱导树突状细胞成熟,因此lps+r848作为刺激树突状细胞等抗原递呈细胞的阳性对照。结果显示,相比未加药物的阴性对照,阳性药物可显著激活dc细胞,使膜表面的cd25表达上调,证明实验系统可靠(如图4-图13、图14,表4所示)。apc细胞上cd25表达的平均荧光强度如下表4所示:
199.表4中,血样1-3组别显示为人全血提取的pbmc测试结果;
200.表4表4
201.针对商业购买来源的pbmc,同样进行了与表4类似的pbmc测试,其结果与表4结果
高度相似,说明本发明所提供的pbmc既可以来源于人全血提取,也可以来源于现有已商业化的pbmc。
202.3)低分子肝素、pf4单体、低分子肝素-pf4复合物(千红怡诺和赛诺菲克赛参比制剂3个批次)对抗原递呈细胞上cd25表达均无显著诱导作用(相比阴性对照p》0.05,相比阳性对照p《0.0001)(如图4-图13、图14,表4所示)。
203.综上,使用人外周血pbmc温孵体系可评估pf4-低分子肝素复合物对树突状细胞的免疫激活作用。千红怡诺和赛诺菲克赛3个批次的低分子肝素-pf4复合物对树突状细胞无明显的免疫刺激作用,未见批次差异。千红怡诺与原研赛诺菲克赛低分子肝素的体外免疫原性是一致的。
204.有研究支持lmwhs与pf4形成超大型复合物(ultra-large complex,ulc)时,对比较小复合物(small complex,sc)诱导的免疫原性大,因此设计开展了采用sec-uv技术检测低分子肝素与pf4不同摩尔比条件下复合物形成情况,以此来确定体外流式实验下的最佳摩尔比。
205.结果如图16所示,结合图16,针对不同摩尔比情况下复合物的保留时间进行了验证,结果如下表5所示:
206.表5图16最大ulc保留时间(min)sc保留时间(min)a//b9.810/c9.868/d/15.580e/15.758f/15.736g/15.630h/15.537
207.结果显示低分子肝素:pf4在1:05时形成的ulc量最多,提示该配比下免疫原性最强。
208.实施例3:
209.实施例3与实施例2的区别在于使用不同低分子肝素产品进行了不同浓度配比的实验,pbmc的获得/提取和确定形成超大型复合物(ulc)的摩尔配比实验方法一致。
210.另一种低分子肝素复合物对pbmc的活化:
211.在细胞(3
×
106个/孔)中分别加入100ng/ml lps+10μg/ml r848(阳性对照)、19.5μg/ml pf4、(19.5μg/ml:0.66iu/ml的)pf4-低分子肝素复合物,孵育48h。具体试验分组如下表6所示:
212.表6
213.其中,*:此种低分子肝素在人体内的血药浓度值为0.66iu/ml;
214.#:基于药学研究结果,pf4-lmwh复合物按照摩尔比0.5:1配制时获得ulc比例最高;
215.测试样品复合物组ⅰ,针对人全血提取的pbmc;
216.测试样品复合物组ⅱ,针对商业购买来源的pbmc。
217.采用(12-)十四酸佛波酯(-13-)乙酸盐(pma)或将(12-)十四酸佛波酯(-13-)乙酸盐与lps/r848复配,同样可以做为本技术的阳性对照,无论是lps、r848还是pma,其均能够能诱导树突状细胞成熟,也均可以做为检测低分子肝素免疫原性的阳性标准。
218.3.流式检测、统计与分析方法:
219.同实施例2。
220.4.结论:
221.本技术应用人外周血pbmc温孵体系评估了pf4-lmwh复合物在体外对树突状细胞免疫刺激作用的差异,使用lps+r848作为阳性对照,评估实验体系的可靠性。
222.pf4-肝素复合物在激活树突状细胞的过程中,pf4-肝素复合物与抗体的结合对诱发hit至关重要。在体外,当pf4和肝素结合形成超大分子复合物(ultralarge macromolecular complexes,ulc)时,其结合抗体并诱发hit的能力最强,因此,试验过程中选择获得最多ulc的低分子肝素和pf4配比开展研究。
223.基于本次实验结果可以得出以下结论:
224.1)温孵过程中,人单核和淋巴细胞群中的活细胞占比在91.30-99.40%之间,证明细胞活性未受各组受测试药物的影响,单核和淋巴细胞群中的活细胞比例(%)如下表7所示:
225.表7
226.针对商业购买来源的pbmc,同样进行与表7类似的pbmc测试,其结果与表7结果高度相似,说明本发明所提供的pbmc既可以来源于人全血提取,也可以来源于现有已商业化的pbmc。
227.2)lps和r848均为toll样受体(tlr)激动剂,能诱导树突状细胞成熟,因此lps+r848作为刺激树突状细胞等抗原递呈细胞的阳性对照。结果显示,相比未加药物的阴性对照,阳性药物可显著激活dc细胞,使膜表面的cd25表达上调,证明实验系统可靠(图17,表8所示)。apc细胞上cd25表达的平均荧光强度如下表8所示:
228.表8
229.针对商业购买来源的pbmc,同样进行了与表8类似的pbmc测试,其结果与表8结果高度相似,说明本发明所提供的pbmc既可以来源于人全血提取,也可以来源于现有已商业化的pbmc。
230.3)低分子肝素、pf4单体、低分子肝素-pf4复合物(千红怡那和aspen速碧林参比制剂3个批次)对抗原递呈细胞上cd25表达均无显著诱导作用(相比阴性对照p》0.05,相比阳性对照p《0.0001)(如17,表8所示)。
综上,使用人外周血pbmc温孵体系可评估pf4-低分子肝素复合物对树突状细胞的免疫激活作用。千红怡那和aspen速碧林3个批次的低分子肝素-pf4复合物对树突状细胞无明显的免疫刺激作用,未见批次差异。千红怡那与原研aspen速碧林低分子肝素的体外免疫原性是一致的。
231.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1