一种检测沙门氏菌的适体生物传感器及其制备方法与应用
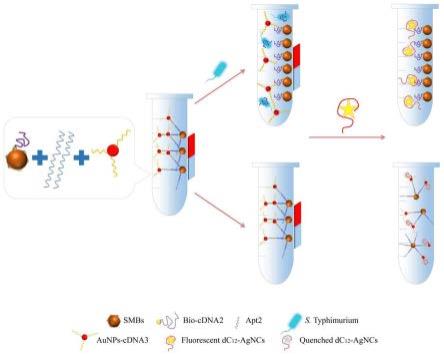
1.本发明涉及一种检测沙门氏菌的适体生物传感器及其制备方法与应用,属于食品安全技术领域。
背景技术:
2.食源性致病菌作为引起食物中毒和急性肠道疾病的主要原因之一,对全球食品尤其是乳制品安全造成了重大影响。
3.沙门氏菌(s.typhimurium)作为常见的食源性病原体之一,其污染可使人类患多种疾病,沙门氏菌会在潜伏12-72小时后引发腹泻、发热和腹痛等症状,严重时可导致脱水、休克、虚脱甚至败血症等。据统计,全世界每年约有1600万人感染沙门氏菌,其中约60万人死亡。沙门氏菌已经被who列为具有严重危害和中等危害的食物传播性病原菌。有研究表明,当沙门氏菌的污染量超过105cfu时即可引起健康人体感染。而对于老人、儿童等免疫力低下及易感人群而言,污染量仅为15-20cfu就可引起严重感染。因此,尽早预防和尽快检测沙门氏菌至关重要。
4.沙门氏菌属于肠杆菌科,是一种兼性厌氧的革兰氏阴性杆菌,其菌体呈两端钝圆的棒状,大小约为(2-5μm)
×
(0.7-1.5μm),其在培养基中菌落呈无色半透明圆形状,且表面光滑、边缘平整。沙门氏菌的生长温度范围较广(10℃-42℃),当温度超过20℃时即能大量繁殖,其中37℃为其最适生长温度。沙门氏菌的环境适应性较强,虽然6.8-7.8是沙门氏菌的最适ph,但其在4.5-9.5的ph范围内也可生长,并且在低水活度的条件下(水活度aw《0.2)仍可长期生存。此外,因为沙门氏菌的培养无需丰富的营养,所以即使是在普通培养基上其也能生长。
5.抗体存在制备和储存困难等问题,且还可能与不同抗原出现交叉反应。核酸适配体作为一种稳定特异的识别元件,不仅能够特异性识别目标物质,而且还易于多种分子偶联,并与多种信号传导模式相容。因此,开发一种基于核酸适配体的生物传感器对实现快速、灵敏地检测食源性致病菌有着重要意义。
6.目前,对沙门氏菌的检测方法主要有传统培养法、分子生物学方法以及免疫学方法,如聚合酶链式扩增反应(pcr)、环介导等温扩增技术(lamp)、酶联免疫吸附法(elisa)和免疫磁珠分离法(ims)等。传统培养法检测容易受到食品基质的干扰、周期长且操作过程繁琐,无法满足对于致病菌快速、简单和灵敏检测的要求,因此迫切需要一种操作简单、快速和准确的检测技术。分子生物学方法,例如主流的pcr技术,虽然相对于传统培养方法,pcr技术很大程度的缩短了检测的时间,并且能够实现高灵敏度的检测,然而却需要复杂的核酸提取程序,而且由于死细胞也具有dna,因此可能会高估活细胞的数量。与pcr方法相比,lamp减少了对高度复杂设备的需求,并且成本低,反应时间短。但lamp由于灵敏度过高,可能在环境中产生气溶胶而无法消除,导致结果出现假阳性结果,而且仍然需要核酸提取操作。免疫学方法易环境因素影响、检测成本高、抗体亲和力低等缺点也限制了其应用。免疫学方法存在的问题限制了elisa、ims等技术的应用。但是,ims的磁分离特性具有减少预富
集时间、降低食品基质干扰等优点。因此,迫切需要将ims技术与其他检测技术的联合应用以开发一种简单、经济、快速、灵敏的致病菌检测分析系统。
7.荧光适体传感器是最常见的光学检测方法,主要是基于与目标物结合后荧光信号的产生或猝灭,通过检测荧光强度的信号变化进行分析。由于该方法具有高灵敏度、高检测效率以及操作简单等特性,已被广泛应用于食源性致病菌的检测中。常用的有机荧光染料具有光稳定性差、低吸收、宽发射和光漂白特性等缺点。量子点材料相比于有机荧光染料具有很多优点,但是大多含有重金属,其生物毒性限制了其应用与发展。因此,开发出一种具有更稳定光学特性及低毒的荧光标记物对于应用荧光适体传感器检测食源性致病菌是十分有必要的。
技术实现要素:
8.为了解决利用传统微生物学方法、分子生物学方法以及免疫学方法检测沙门氏菌中存在的问题,本发明提供了一种快速检测沙门氏菌的适体生物传感器,包括由smbs-cdna2复合物、适配体apt2和aunps-cdna3探针建立的夹心结构smbs-apt2-aunps,和被用作荧光信号的以dna为模板合成的银纳米簇dna-agncs;所述smbs-cdna2复合物由链霉亲和素磁珠与生物素修饰的核酸链cdna2连接,cdna2的核苷酸序列如seq id no.1所示;所述aunps-cdna3探针由aunps溶液与巯基修饰的cdna3制备而成,cdna3的核苷酸序列如seq id no.2;所述适配体apt2的核苷酸序列如seq id no.3所示;所述dna模板的核苷酸序列如seq id no.4所示;
9.在没有沙门氏菌的情况下,smbs-apt2-aunps系统保持完整性,当加入dna-agncs时,系统中的aunps与agncs发生荧光共振能量转移以猝灭agncs的荧光;在有沙门氏菌的情况下,在上清液中悬浮的aunps-cdna3探针和结合apt2的沙门氏菌通过磁分离被去除,从而导致荧光不被猝灭。
10.本发明还提供了上述适体生物传感器的制备方法,包括如下步骤:
11.(1)制备smbs-cdna2复合物:smbs经1
×
b&w缓冲液洗涤后,重悬于2
×
b&w缓冲液中,加入等体积的cdna2溶液孵育,去除上清,经1
×
b&w缓冲液洗涤后,重悬于pbs溶液中,得到smbs-cdna2复合物;
12.(2)制备aunps-cdna3探针:将巯基修饰的cdna3与aunps溶液混合,孵育后加入磷酸缓冲液a,再次进行孵育,分多次缓慢加入含有2mol/l nacl的磷酸缓冲液b进行老化,直至溶液中nacl浓度达到0.01mol/l~2mol/l,离心后用去离子水重悬获得aunp-cdna3探针;
13.(3)制备smbs-apt2-aunps系统及合成dna-agncs:将apt2、smbs-cdna2复合物和aunps-cdna3探针在pbs溶液中混合并进行孵育,磁分离去除上清,再用pbs溶液洗涤三次获得smbs-apt2-aunps系统;向含有dna模板的pb溶液中加入agno3溶液,于黑暗中进行孵育,加入nabh4剧烈震荡,使用前避光稳定,以使用的dna浓度即为制备的dna-agncs的浓度。
14.进一步地限定,步骤(1)所述smbs的用量为0.1-5mg,2
×
b&w缓冲液的用量为20-500μl,pbs溶液的用量为20-500μl,所述cdna2的浓度为0.5-5μmol/l;所述孵育温度为25-45℃,孵育时间为30-120min;所述最终得到的smbs-cdna2复合物的终浓度为1-20μg/μl。
15.优选地,所述smbs的用量为1mg,2
×
b&w缓冲液的用量为200μl,pbs溶液的用量为200μl,所述cdna2的浓度为2μmol/l;所述孵育温度为37℃,孵育时间为60min;所述最终得
到的smbs-cdna2复合物的终浓度为5μg/μl。
16.进一步地限定,步骤(2)是将1~20μl浓度为10~500μmol/l的巯基修饰的cdna3与1ml的aunps溶液混合,于30℃~70℃孵育5~24h,加入50-500μl磷酸缓冲液a,于30℃~70℃孵育0.1-2h,分多次缓慢加入含有2mol/l nacl的磷酸缓冲液b进行老化,直至溶液中nacl浓度达到0.01-2mol/l,离心后,用50-500μl去离子水重悬获得aunp-cdna3探针。
17.进一步地限定,磷酸缓冲液a的制备:称取1.56g nah2po4·
2h2o,3.58g na2hpo4·
12h2o,0.1g sds,充分溶解于蒸馏水中,调节ph至7.6,随后定容至100ml,即得到0.1mol/l的磷酸缓冲液a。
18.进一步地限定,磷酸缓冲液b的制备:称取10ml 0.1m磷酸缓冲液a,加入11.7g nacl,用蒸馏水定容至100ml,即得到0.01mol/l的磷酸缓冲液b。
19.优选地,步骤(2)所述巯基修饰的cdna3的体积为8μl,浓度为100μmol/l;所述磷酸缓冲液a的添加量为100μl,加入磷酸缓冲液a前的孵育温度为50℃,孵育时间为12h;加入磷酸缓冲液a后的孵育温度为50℃,孵育时间为1h;所述老化结束的时间为nacl浓度达到0.2mol/l;所述去离子水的用量为200μl。
20.进一步地限定,所述步骤(3)是将1~10nmol/l apt2,1~100μg smbs-cdna2复合物和5~50μl aunps-cdna3探针在100μl pbs溶液中混合,并在25~45℃条件下孵育60~180min,然后通过磁分离去除上清液,再用pbs溶液洗涤三次制得smbs-apt2-aunps系统;向含有0.5~5nmol dna模板的浓度为0.002~0.2mol/l,ph为6.4~8的50~200μl pb溶液中加入1~20μl浓度为0.002~10mmol/l的agno3溶液,并在黑暗中于0~25℃孵育5~50min,将0.5~20μl浓度为0.1~10mmol/l的nabh4快速加入到混合物中,剧烈震荡1分钟,使用前,将混合物溶液于0~25℃避光稳定5~24h,以使用的dna浓度即为制备的dna-agncs的浓度。
21.本发明还提供了一种利用上述适体生物传感器检测沙门氏菌的方法,包括如下步骤:
22.s1、将smbs-apt2-aunps系统加入到样品中,并在25℃~45℃条件下,孵育60~180min;
23.s2、磁分离以弃去上清液,并重悬于30μl-200μl蒸馏水中;
24.s3、将5μl~100μl浓度为0.1μmol/l~5μmol/l的dna-agncs添加到溶液中并孵育2min~30min;
25.s4、通过多功能酶标仪检测dna-agncs的荧光光谱,激发波长为550nm~600nm,以2nm的间隔扫描601~750nm的发射光谱。
26.进一步地限定,s1所述的样品的体积为20-800μl,孵育温度为37℃,孵育时间为120min;s2所述蒸馏水的体积为80μl;s3所述dna-agncs的体积为20μl,浓度为1.5μmol/l,孵育时间为10min;s4所述激发波长为576nm。
27.本发明还提供了上述适体生物传感器在实时检测食品或食品加工过程中沙门氏菌污染中的应用。
28.本发明的有益效果:
29.本发明的原理在于,smbs-cdna2复合物、适配体apt2和aunps-cdna3探针建立的夹心结构smbs-apt2-aunps荧光猝灭系统能够在没有沙门氏菌的情况下保持完整性,系统中的aunps与agncs发生荧光共振能量转移(fret)以猝灭agncs的荧光;在有沙门氏菌的情况
下,沙门氏菌与作为连接桥梁的apt2结合,smbs-apt2-aunps系统被破坏,在上清液中悬浮的aunps-cdna3探针和结合apt2的沙门氏菌通过磁分离被去除,从而导致荧光不被猝灭,进而实现对沙门氏菌的简单、快速、灵敏的检测。
30.1)利用本发明公开方法制备的适体生物传感器,检测速度快、检测灵敏度高、检测成本低,可有效实现对沙门氏菌的快速检测;
31.2)本发明基于dna-agncs构建荧光适体生物传感器,解决现有荧光信号分子由于光稳定性差和具毒性导致的检测性能低的问题;
32.3)本方法的“三明治”结构不仅可以减少了核酸提取过程,而且能够有效减少食品基质的干扰,极大提高检测的速度和灵敏度;
33.4)本方法不需要昂贵的仪器和特殊的加热设备,更适用于资源受限的现场检测场景;
34.5)利用本发明建立的方法可用于实时检测食品及食品加工过程中沙门氏菌,尤其是对乳制品中的沙门氏菌污染。
附图说明
35.图1为该发明的原理图;
36.图2为aunps-cdna3探针制备过程中nacl终浓度的优化结果图,图中1-4的nacl终浓度分别为0.1mol/l、0.2mol/l、0.3mol/l和0.4mol/l;
37.图3为apt2浓度的优化结果图;
38.图4为smbs-cdna2复合物添加量的优化结果图;
39.图5为aunps-cdna3探针添加量的优化结果图;
40.图6为apt2、smbs-cdna2、和aunps-cdna3的孵育时间的优化结果图;
41.图7为pb溶液ph的优化结果图;
42.图8为dna/ag
+
摩尔浓度比的优化结果图;
43.图9为nabh4/ag
+
摩尔浓度比的优化结果图;
44.图10为smbs-apt2-aunps系统与沙门氏菌的孵育时间的优化结果图;
45.图11为对适体生物传感器检测沙门氏菌的灵敏度的考察结果;
46.图12为适体生物传感器检测沙门氏菌的线性关系图;
47.图13为对适体生物传感器检测沙门氏菌的特异性的考察结果图;
48.图14为利用适体生物传感器检测人工污染牛奶的灵敏度考察结果图;
49.图15为适体生物传感器检测人工污染牛奶中的沙门氏菌的线性关系图。
具体实施方式
50.下面结合具体实施例及附图对本发明做出进一步说明,但本发明不受实施例的限制。
51.以下实施例所用的材料、试剂、仪器和方法,未经特殊说明,均为本领域常规的材料、试剂、仪器和方法,均可通过商业渠道获得,所用菌株均来源于东北农业大学乳品重点实验室。
52.实施例1:适体生物传感器的制备方法
53.本发明适体生物传感器的原理图见图1。
54.cdna2的核苷酸序列如seq id no.1所示:5
’‑
ctgtcataatgtcaagtcc-3’;
55.cdna3的核苷酸序列如seq id no.2所示:5
’‑
gtcgggtgacgccgccata-3’;
56.适配体apt2的核苷酸序列如seq id no.3所示:5
’‑
tatggcggcgtcacccgacggggacttgacattatgacag-3’;
57.dna模板的核苷酸序列如seq id no.4所示:5
’‑
agtggaaaaacccccccccccc-3’。
58.(1)smbs-cdna2复合物的制备:
59.将1mg smbs用1
×
b&w缓冲液洗涤3次,然后重悬于200μl 2
×
b&w缓冲液中。随后,加入等体积的2μmol/l cdna2溶液,然后在37℃下振荡孵育60min。去除上清后,将smbs-cdna2复合物用1
×
b&w缓冲液洗涤3次,最终重悬于200μl pbs溶液中。以磁珠浓度作为复合物浓度,即终浓度为5μg/μl。最后,将制备的smbs-cdna2复合物于4℃保存备用。
60.(2)aunps-cdna3探针的制备:
61.将8μl浓度为100μmol/l的巯基修饰的cdna3与1ml aunps溶液进行混合,然后在50℃条件下孵育12h。随后,向混合液中加入100μl磷酸缓冲液a,使其继续在50℃下孵育1h后,在此之后,分多次缓慢加入含有2mol/l nacl的磷酸缓冲液b进行老化,直至溶液中nacl浓度达到0.2mol/l。将溶液在4℃下,12000
×
g离心20min,以除去过量的未结合的用cdna3。最后,200μl去离子水进行重悬获得aunp-cdna3探针,在使用之前4℃避光处理。
62.aunps-cdna3探针制备过程中nacl浓度的优化:
63.采用nacl终浓度分别为0.1mol/l、0.2mol/l、0.3mol/l和0.4mol/l,并按照步骤(2)进行操作,结果如图2所示。
64.结果表明,随着nacl浓度的增加,制备的aunps-cdna3探针溶液的颜色逐渐加深,当nacl终浓度为0.3mol/l时,颜色变为深紫红色,说明此时的盐浓度过高导致部分aunps发生聚集,从而引起颜色变化。当终浓度达到0.4mol/l时,aunps溶液出现沉淀。因此,本研究选择0.2mol/l为最优nacl终浓度。
65.(3)smbs-apt2-aunps系统的制备:
66.将2.5nmol/l apt2,40μg smbs-cdna2复合物和20μl aunps-cdna3探针在100μl pbs溶液中混合,然后在37℃条件下孵育120min来制备荧光猝灭系统。磁分离去除上清液后,用pbs溶液洗涤三次,得到smbs-apt2-aunps系统。
67.①
apt2浓度的优化:
68.选择apt2终浓度分别为1.5nmol/l、2.5nmol/l、3.5nmol/l和4.5nmol/l,按照步骤(3)进行实验。通过多功能酶标仪检测dna-agncs的荧光光谱(激发波长为576nm,以2nm的间隔扫描601~750nm的发射光谱)。优化结果如图3所示,f0和f分别代表鼠伤寒沙门氏菌添加之前和之后在643nm呈现出峰值的荧光强度。结果表明,随着apt2终浓度的增加,荧光比值(1-f0/f)逐渐增加,在2.5nmol/l时达到最大值,然后下降(p《0.05),因此最终确定apt2终浓度2.5nmol/l为最优浓度。
69.②
smbs-cdna2复合物添加量的优化:
70.选择smbs-cdna2复合物添加量分别为20μg、30μg、40μg和50μg,按照步骤(3)进行实验。通过多功能酶标仪检测dna-agncs的荧光光谱(激发波长为576nm,以2nm的间隔扫描601~750nm的发射光谱)。优化结果如图4所示,f0和f分别代表鼠伤寒沙门氏菌添加之前和
之后在643nm呈现出峰值的荧光强度。结果表明,荧光比值(1-f0/f)随着smbs-cdna2添加量从20μg增加到30μg而增加(p《0.05),并在30μg后无明显变化,然后在50μg时下降(p》0.05),因此最终确定40μg为smbs-cdna2复合物的最优添加量。
71.③
aunps-cdna3探针添加量的优化:
72.选择aunps-cdna3探针添加量分别为5μl、10μl、15μl和20μl,按照步骤(3)进行实验。通过多功能酶标仪检测dna-agncs的荧光光谱(激发波长为576nm,以2nm的间隔扫描601~750nm的发射光谱)。优化结果如图5所示,f0和f分别代表鼠伤寒沙门氏菌添加之前和之后在643nm呈现出峰值的荧光强度。结果表明,荧光比值(1-f0/f)随着aunps-cdna3探针的添加量从5μl增加到15μl而增加(p《0.05),然后在20μl时保持不变(p》0.05),因此最终确定15μl为aunps-cdna3探针的最优添加量。
73.④
smbs-cdna2、apt2和aunps-cdna3孵育时间的优化:
74.选择smbs-apt2-aunps系统孵育时间分别为30min、60min、90min和120min,按照步骤(3)进行实验。通过多功能酶标仪检测dna-agncs的荧光光谱(激发波长为576nm,以2nm的间隔扫描601~750nm的发射光谱)。优化结果如图6所示,f0和f分别代表鼠伤寒沙门氏菌添加之前和之后在643nm呈现出峰值的荧光强度。当反应达到一定时间后,荧光比值(1-f0/f)不发生明显变化时,将此时间确定为较好,因此确定最优孵化时间为90min。
75.(4)dna-agncs的合成:
76.向含有1.5nmol dna的89μl浓度为0.02mol/l、ph为7.4的pb溶液中加入6μl浓度为1.5mmol/l的agno3,然后在黑暗中于4℃孵育20min。随后,将5μl浓度为1.5mmol/l的nabh4快速加入到混合物中,然后剧烈震荡1min。使用前,将混合物溶液于4℃避光稳定12小时,以使用的dna浓度即可作为制备的dna-agncs的浓度。
77.①
pb溶液ph的优化:
78.选择pb溶液的ph分别为6.2、6.6、7和7.4,按照步骤(4)进行实验。通过多功能酶标仪检测dna-agncs的荧光光谱(激发波长为576nm,以2nm的间隔扫描601~750nm的发射光谱)。优化结果如图7所示,当ph从6.2增加到7时,生成的dna-agncs荧光强度也逐渐增大,而当ph从7增加到7.4时,荧光强度减小,因此确定pb溶液的最优ph为7。
79.②
dna/ag
+
摩尔浓度比的优化:
80.选择dna/ag
+
摩尔浓度比分别为1:2、1:4、1:6和1:8,按照步骤(4)进行实验。通过多功能酶标仪检测dna-agncs的荧光光谱(激发波长为576nm,以2nm的间隔扫描601~750nm的发射光谱)。优化结果如图8所示,当dna/ag+摩尔浓度比从1:2到1:6时,生成的dna-agncs荧光强度逐渐增大。而当摩尔浓度比从1:6到1:8时,荧光强度减小。因此确定最优的dna/ag
+
摩尔浓度比为1:6。
81.③
nabh4/ag
+
摩尔浓度比的选择
82.选择nabh4/ag
+
摩尔浓度比分别为1:3、2:3、5:6和1:1,按照步骤(4)进行实验。通过多功能酶标仪检测dna-agncs的荧光光谱(激发波长为576nm,以2nm的间隔扫描601~750nm的发射光谱)。优化结果如图9所示,当dna/ag
+
摩尔浓度比从1:3到5:6时,生成的dna-agncs荧光强度逐渐增大,而当摩尔浓度比从5:6到1:1时,荧光强度没有明显变化。因此确定最优的nabh4/ag
+
摩尔浓度比为5:6。
83.综上可知,最佳反应条件:dna:nabh4:ag
+
=1:5:6。
84.实施例2:利用适体生物传感器检测沙门氏菌的方法
85.(一)利用适体生物传感器检测沙门氏菌的方法
86.(1)菌株的活化与培养
87.以鼠伤寒沙门氏菌atcc 14028作为实验的标准菌株,将该菌按照2%的接种量接种于lb培养基中,37℃、200r/min条件下培养12h后三区划线于lb平板上,37℃培养12-16h后长出单菌落,挑单菌落接种于lb培养基中进行二次活化,用于后续实验。
88.(2)加入目标菌进行检测
89.实施例1中获得的smbs-apt2-aunps系统与200μl鼠伤寒沙门氏菌atcc 14028在37℃孵育120min。弃去上清液,并重悬于80μl蒸馏水中。随后,将20μl 1.5μmol/l dna-agncs添加到溶液中并孵育10min,通过多功能酶标仪检测dna-agncs的荧光光谱(激发波长为576nm,以2nm的间隔扫描601~750nm的发射光谱)。
90.smbs-apt2-aunps系统与沙门氏菌孵育时间的优化:
91.选择smbs-apt2-aunps系统与沙门氏菌孵育时间分别为30min、60min、90min和120min,按照上述目标菌检测方法进行实验。通过多功能酶标仪检测dna-agncs的荧光光谱(激发波长为576nm,以2nm的间隔扫描601~750nm的发射光谱)。f0和f分别代表鼠伤寒沙门氏菌添加之前和之后在643nm呈现出峰值的荧光强度。当反应达到一定时间后,荧光比值(1-f0/f)不发生明显变化时,将此时间确定为最佳。因此由图10可知,最佳孵育时间为60min。
92.(二)荧光生物传感器灵敏度的考察
93.取1ml处于对数培养后期的沙门氏菌atcc 14028于1.5ml已灭菌的离心管中,5000
×
g离心5分钟收集菌体。使用等体积pbs洗涤并梯度稀释菌体,经平板涂布确定菌数范围为3.7
×
100到3.7
×
108cfu/ml。在最佳条件下,按照(一)中(2)的步骤对每个稀释度的菌液进行检测。每组试验重复三次。考察结果如图11所示,随着鼠伤寒沙门氏菌浓度从3.7
×
102增加到3.7
×
108cfu/ml时,荧光光谱逐渐上升,荧光强度增加。
94.(三)荧光生物传感器检测沙门氏菌的线性关系
95.按照(二)中灵敏度考察的步骤进行处理和检测,结果如图12所示,f0和f分别代表鼠伤寒沙门氏菌添加之前和之后在643nm呈现出峰值的荧光强度,荧光比值(1-f0/f)与鼠伤寒沙门氏菌在3.7
×
102至3.7
×
105cfu/ml范围内的浓度对数呈线性关系。线性回归方程为y=0.1120x+0.0307,相关系数为r2=0.9858。根据计算,检出限为98cfu/ml(lod=3n/s,其中n为空白样品的标准偏差,s为标准曲线的斜率)。
96.(四)荧光生物传感器特异性的考察
97.将12种常见的食源性致病菌和鼠伤寒沙门氏菌(菌株信息见表1)分别接种至lb液体培养基中,过夜培养至菌液浓度为107cfu/ml,通过所构建的适体生物传感器进行特异性试验分析。取1ml新鲜培养的鼠伤寒沙门氏菌菌液于1.5ml已灭菌的离心管中,5000
×
g离心5min收集菌体,并重悬于等体积pbs溶液中。试验菌株浓度约为105cfu/ml。此外,已灭菌的lb肉汤培养基作为阴性对照。每个菌株设定三个平行试验。考察结果如图13所示,12种常见的食源性致病菌的荧光比值(1-f0/f)远低于鼠伤寒沙门氏菌,并与阴性对照组相似。,因此本发明所述适体生物传感器具有特异性。
98.表1 12种常见的食源性致病菌和鼠伤寒沙门氏菌的菌株信息
[0099][0100]
实施例3:利用适体生物传感器检测人工污染牛奶样品中的沙门氏菌的方法
[0101]
(1)人工污染牛奶:
[0102]
本试验部分使用的样品是在超市中购买的商用牛奶,经《gb 47894-2016食品安全国家标准食品微生物学检验沙门氏菌检验》检验不含有沙门氏菌。将鼠伤寒沙门氏菌atcc 14028的菌液进行梯度稀释,每个稀释梯度分别取1ml加入到24ml牛奶样品中,使样品中的菌液终浓度范围为7.6
×
101到7.6
×
107cfu/ml。
[0103]
(2)人工污染牛奶的预处理:
[0104]
取1ml人工污染牛奶样品,通过8000
×
g离心5min(4℃)去除牛奶中的蛋白质和脂肪,经pbs溶液重复洗涤三次后再重悬于等体积的pbs溶液中。
[0105]
(3)考察利用适体生物传感器检测人工污染牛奶的灵敏度:
[0106]
将纯培养后的鼠伤寒沙门氏菌菌悬液梯度稀释后添加到牛奶样品中,在最佳条件下按照实施例2(2)的步骤进行分析,每个试验重复三次。考察结果如图14所示。
[0107]
结果表明,荧光发射光谱随着人工污染奶样中鼠伤寒沙门氏菌浓度的增加(7.6
×
101至7.6
×
107cfu/ml)而升高。根据计算,人工污染奶样中的检出限为3.4
×
102cfu/ml。
[0108]
(4)人工污染牛奶检测的线性关系:
[0109]
向牛奶样品中加入已知浓度的鼠伤寒沙门氏菌atcc 14028,按照上述(3)的方法进行处理和分析,并根据上述基于实际样品检测建立的菌浓度和荧光信号间的数学公式计算出相应的菌落数,将结果进一步与平板涂布结果比对,计算该荧光适体传感器在牛奶加标样品中鼠伤寒沙门氏菌的回收率。以上试验重复三次测试。结果如图15所示。
[0110]
结果表明,荧光比值(1-f0/f)与鼠伤寒沙门氏菌浓度范围为7.6
×
103至7.6
×
106cfu/ml的对数之间存在良好的线性关系(r2=0.9754)。线性回归方程为y=0.1105x
–
0.1277,其中y是荧光比值(1-f0/f),x是鼠伤寒沙门氏菌的对数浓度。
[0111]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明精神和范围内,都可以做各种的改动与修饰,因此,本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1