SCD1在制备肝癌患者预后诊断试剂或药物筛选中的应用
scd1在制备肝癌患者预后诊断试剂或药物筛选中的应用
技术领域
1.本发明涉及肝癌预后技术领域,尤其涉及scd1在制备肝癌患者预后诊断试剂或药物筛选中的应用。
背景技术:
2.2020年全球恶性肿瘤流行病学资料表明,肝癌新发人数位于第六位,死亡人数位于第三位,是一种难以治疗的恶性肿瘤。原发性肝癌具有发病率高、预后差、死亡率高的特点。由于原发性肝癌早期没有典型的临床症状多数患者在确诊时已进入中晚期,仅有不到20%的患者能采用外科手术切除治疗。肝移植术是肝癌治疗的二线治疗方案, 但是手术治疗后,肝癌的复发率高,侵袭性强,术后需要采用肝动脉化疗、射频消融治疗、放疗等方式进一步缩小残留肿瘤,减少复发或转移。对于无法手术治疗的肝癌患者,常用的非手术治疗方式包括肝动脉栓塞化疗(tace)、射频治疗、微波消融、无水乙醇注射pei)、高频率超声聚焦消融(hfu)、中药治疗、免疫治疗等,其中teca是无法手术切除的肝癌患者治疗的首选方案,但是单独应用患者的预后并不够理想,需要综合其他治疗方法进行治疗。
3.硬酯酰辅酶a去饱和酶1(stearoyl-coa desaturase 1,scd1)是将脂肪酰基δ9键去饱和催化饱和脂肪酸c16:0、c18:0生成单不饱和脂肪酸c16:1、c18:1的重要限速酶。scd1主要分布在肝脏,对体内三酰甘油、胆固醇酯、磷脂和蜡酯等的合成起关键作用。王宏伟等研究显示,下调scd1表达可抑制人肝癌细胞株hepg2的增殖,并促进其凋亡 (王宏伟,李莉,杨志立,等.小分子干扰rna下调硬脂酰辅酶a去饱和酶-1对肝癌hepg2细胞增殖及凋亡的影响[j].新乡医学院学报,2015,032(001):1-3,7.)。苏改改等研究显示,脂代谢相关基因 scd1与血管生成相关,scd1是抑制血管生成和肿瘤发展的潜在靶点 (苏改改,刘红丽,孙永健,等.脂代谢相关基因pparγ2和scd1与血管内皮生长因子vegf在肝细胞癌组织的蛋白表达相关性及临床意义[j].河南师范大学学报(自然科学版),2020,v.48;no.211(02):106-110.)。现有研究对scd1的研究主要集中其脂质代谢作用以及抑制其在癌细胞中高表达进而获得一定的肿瘤控制作用。
[0004]
由于肝癌患者出院后,难以实现对患者体内肿瘤的长期有效监控,使得肿瘤初期复发或进展难以及时发现并给与干预,目前临床也缺乏快速有效的肝癌预后检测手段,耽误早期干预时机,不利于肝癌患者预后生存。
技术实现要素:
[0005]
为了解决肝癌预后较差的问题,本发明提供了一种新的肝癌预后标志物scd1,通过检测scd1表达水平可有效预测肝癌患者预后情况,有助于肝癌患者预后随访和辅助治疗方案的制定。此外,本发明还发现肝癌细胞基质硬度提高促进肝癌细胞的侵袭和转移,降低scd1表达水平可有效降低肝癌细胞的侵袭和转移能力,可以作为肝癌预后预防或治疗的药物潜在靶点。
[0006]
为了实现上述发明目的,本发明提供了scd1在制备肝癌患者预后诊断试剂或预后
药物筛选中的应用。
[0007]
本发明还提供了一种肝癌预后预测试剂盒,包括scd1表达水平的检测试剂。
[0008]
优选的,所述肝癌患者预后的诊断试剂盒的诊断项目包括:诊断肝癌患者预后肝癌细胞侵袭能力、诊断肝癌患者预后肝癌细胞转移能力、肝癌患者无瘤生存率和肝癌患者总生存率中的一种或多种。
[0009]
优选的,所述诊断试剂盒的诊断对象包括肝基质细胞硬度高于 1.6kpa的肝癌患者。
[0010]
优选的,所述检测scd1表达水平的试剂包括scd1免疫组化检测试剂、rt-qpcr或western blot。
[0011]
本发明还提供了降低scd1表达水平的试剂在制备预防或治疗肝癌患者预后的药物中的应用。
[0012]
优选的,所述降低scd1表达水平的试剂包括scd1抑制剂、scd1 表达基因抑制剂和scd1前体物质表达水平抑制剂中的一种或多种。
[0013]
与现有技术相比,本发明的有益效果:
[0014]
1、本发明发现scd1是一种新的肝癌细胞基质硬度响应蛋白,可作为肝癌预后预防或治疗药物筛选靶标。
[0015]
采用高、低硬度的聚丙烯酰胺凝胶模拟基质硬度,体外培养肝癌细胞并进行脂质组学分析。发现在高基质硬度培养条件下,肝癌细胞中大多数脂质类别中的单不饱和脂肪酸/饱和脂肪酸(mufa/sfa)的比率增加;在这些脂质中,含有c18:1不饱和脂肪酸的膜磷脂占优势, c16:1脂肪酰链的有增加趋势;同时,肝癌细胞mhcc97h中含有c18:0 的磷脂或huh7肝癌细胞中含有c16:0的磷脂显著降低。这些表明scd1 是肝癌细胞基质硬度响应蛋白,重编程肝癌细胞脂质代谢。进一步,通过western blot确认随着基质硬度增加,scd1表达发生相应变化。在高、低不同基质硬度培养条件下,改变scd1表达/活性,引起肝癌细胞脂质成分改变,膜流动性和体外侵袭能力的改变。敲除scd1后可抑制肝癌细胞的侵袭和转移能力。
[0016]
更进一步的,基于scd1对因肝脏基质细胞硬度所致的肝癌细胞侵袭、转移能力增加,可以利用降低scd1表达水平的试剂制备相关预防或治疗药物。
[0017]
第二方面,本发明发现scd1作为肝癌患者预后预测指标的潜在临床应用价值。
[0018]
人肝癌组织标本中,scd1表达与肝癌患者术后无瘤生存率和总生存率相关,表明scd1能预测肝癌患者预后,有利于患者随访和辅助治疗方案制定。本发明意外发现肝脏基质细胞硬度与肝癌患者预后生存率有显著相关性,scd1表达水平与肝脏基质细胞硬度呈正相关,进而试验验证显示,人肝癌组织样本中,scd1表达量与肝癌患者术后无瘤生存率和总生存率相关,表明通过scd1的表达水平可预测肝癌患者的预后情况,可作为肝癌患者预后情况预测的标志物。
附图说明
[0019]
图1为实施例1中基质硬度检测结果图;
[0020]
图2为实施例1中scd1蛋白在不同硬度基质胶的表达结果图;
[0021]
图3为实施例1中肝癌细胞系在不同基质硬度下的细胞体外侵袭能力检测结果图;
[0022]
图4为敲低scd1或scd1抑制剂cay10566抑制高硬度基质诱导的细胞侵袭能力检测结果图;
[0023]
图5为不同scd1表达水平下肝癌细胞体外侵袭能力检测结果图;
[0024]
图6为不同scd1表达水平下肝癌细胞细胞膜流动性检测结果图;
[0025]
图7为不同scd1表达水平下肝癌细胞原位成瘤能力检测结果图;
[0026]
图8为肝癌组织高表达scd1的患者无瘤生存率及总生存率结果图。
具体实施方式
[0027]
在本发明中,“肝癌”包括源于肝细胞本身的肝细胞癌和其他组织传播到肝脏的转移性肝癌,优选的,“肝癌”指肝细胞癌。
[0028]
在本发明中,所述“预后”指关于医学发展(例如,长期存活可能性、无疾病存活率等)的预期,包括积极预后或消极预后,所述消极预后包括疾病进展如复发,肿瘤生长、转移和耐药死亡率,并且积极预后包括疾病缓解如无疾病状态,疾病改善如肿瘤消退或稳定。
[0029]
在本发明中,“scd1”或“硬酯酰辅酶a去饱和酶1”包括scd1 的天然序列多肽、多肽变体及天然序列多肽/多肽变体的片段。本发明所述scd1可以是多种来源的,如人源或其他动物来源分离,或通过重组等合成方法制备得到的scd1多肽。本发明所述“scd1天然序列多肽”包括从自然界分离的scd1多糖具有相同氨基酸序列的多肽。本发明所述“scd1多肽变体”包括与scd1天然序列多肽具有至少80%氨基酸序列同一性的scd1多肽,包括在scd1天然序列多肽的n端或 c端增加或减少一个或多个氨基酸残基。通常,scd1多肽变体具有与 scd1天然序列多肽会具有至少约80%氨基酸序列同一性,或者至少约81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、或99%氨基酸序列同一性。任选地,与天然scd1多肽序列相比,scd1变体多肽会具有不超过1处保守氨基酸替代,或者与天然scd1多肽序列相比不超过2、3、4、5、6、7、8、9、或10处保守氨基酸替代。
[0030]
本发明提供了scd1在制备肝癌患者预后诊断试剂或预后药物筛选中的应用。
[0031]
通过检测sdc1在体内的表达水平,可实现对肝癌患者预后情况的预测。为此,本发明提供了一种肝癌预后预测试剂盒,包括scd1 表达水平的检测试剂;所述肝癌患者预后的诊断试剂盒的诊断项目包括但不限于诊断肝癌患者预后肝癌细胞侵袭能力、诊断肝癌患者预后肝癌细胞转移能力、肝癌患者无瘤生存率和肝癌患者总生存率中的一种或多种。在本发明中,所述诊断试剂盒的诊断对象包括肝基质细胞硬度高于1.6kpa的肝癌患者。
[0032]
在本发明中,所述检测scd1表达水平的试剂包括各类能够获得 scd1表达水平的试剂,包括对scd1自身表达水平检测的试剂,也包括对scd1反应产物生成量或前体物质消耗量等间接检测的试剂。所述检测scd1表达水平的试剂可以是scd1免疫组化检测试剂、rt-qpcr 或western blot。在本发明中,所述肝癌预后预测试剂盒还可以包括作为标准品的scd1。本发明所述的试剂盒中可以包括一种或多种检测scd1表达水平的试剂。在本发明中,当scd1表达水平结果越高,患者预后风险越高,需要密切随访跟踪肝癌细胞的复发和进展情况。在本发明的一个具体实施方案中,所述肝癌预后预测试剂盒包括scd1 免疫组化检测试剂,对肝癌细胞中的scd1表达水平检测并与癌旁细胞比较,则染色结果超过“++”的患者判断为肝癌预后高风险患者,需要密切跟踪随访,必要情况下增加辅助治疗以获得较好疗
效,延长患者的生存期。
[0033]
本发明发现,肝脏基质细胞硬度增加可诱导肝癌细胞脂代谢重编程,进而增强肝癌细胞的细胞膜流动相,促进肝癌细胞体外侵袭能力与体内转移能力,导致肝癌患者预后复发、恶化等情形,严重影响肝癌患者预后生存率。本发明进一步发现,肝脏基质细胞硬度增加促使scd1过量表达,通过降低scd1表达水平可有效抑制这一途径导致的肝癌细胞转移和侵袭能力。可作为筛选预防或治疗肝癌预后复发药物的潜在靶点。
[0034]
本发明还提供了降低scd1表达水平的试剂在制备预防或治疗肝癌患者预后的药物中的应用。本发明优选的,所述降低scd1表达水平的试剂包括scd1抑制剂、scd1表达基因抑制剂和scd1前体物质表达水平抑制剂中的一种或多种。降低scd1表达水平的试剂可以是本领域已知的scd1抑制剂,如cay10566、a939572、cvt11127、mf438、 t376451、bz36、abbott#7n等。
[0035]
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0036]
实施例1基质细胞硬度与肝癌细胞侵袭和转移能力的关系
[0037]
通过建立高、低不同基质硬度培养环境,体内裸鼠皮下瘤及原位移植瘤模型,利用脂质组学、western blot及免疫组化染色等分子生物学技术,发现基质硬度促进肝癌细胞中的scd1蛋白表达增加,使肝癌细胞内脂质代谢重编程,单不饱和酰基链比例增加,体外细胞侵袭性和体内转移能力增加。具体实验过程包括:
[0038]
1)脂质组学检测:
[0039]
采用高、低硬度的聚丙烯酰胺凝胶模拟基质硬度,将肝癌细胞 mhcc97h和huh7分别接种在基质硬度为1.6kpa(低基质硬度)、 25.6kpa(高基质硬度)的基质胶上,培养3天后,收集细胞,重悬离心,按照改良bligh and dyer方法(bligh eg,dyer wj.a rapidmethod of total lipid extraction and purification.can jbiochem physiol.1959;37(8):911-7.)提取细胞脂质。配置质控组样本,密封避光暂时保存在4℃下,在多反应监测模式下,将所有样品进行液相色谱质谱分析,用multiquant
tm
软件对数据进行处理,并用每对峰面积作进一步定量。用simca软件处理脂质组学数据。通过归一化细胞数和总信号强度计算相对信号强度。检测结果如图1 所示。
[0040]
2)western blot方法分析scd1蛋白在不同硬度基质胶的表达。
[0041]
分别在硬度梯度为1.6kpa,3.2kpa,6.4kpa和25.6kpa的基质胶上培养mhcc97h和plc/prf/5细胞,培养后分别提取其总蛋白,使用ripa裂解液(包含蛋白酶抑制剂及磷酸酶抑制剂)置于冰上裂解 30分钟,离心15分钟,取上清总蛋白,bca法定量蛋白浓度。电泳时采用10%分离胶,每孔上样20μg蛋白,电泳完成后转至pvdf膜上,然后快速封闭10分钟,一抗4℃孵育过夜。tbst洗3次,每次 10分钟,二抗室温孵育1小时,tbst洗3次,每次5分钟后显影。结果如图2所示。
[0042]
3)细胞体外侵袭性分析:
[0043]
肝癌细胞系mhcc97h、huh7、plc/prf/5、hep3b分别接种在基质硬度为1.6kpa(低基质硬度)、25.6kpa(高基质硬度)的基质胶上, 10天后显微镜下拍照观察并分析细胞离散度代表细胞体外侵袭能力,并做定量分析。结果如图3所示。
[0044]
4)细胞膜流动性定量:
[0045]
(1)肝癌细胞mhcc97h、huh7、plc/prf/5和hep3b接种在基质硬度为1.6kpa(低基质硬度)、25.6kpa(高基质硬度)的基质胶上,培养2天后,加入无血清培养基配置的含有5μm laurdan溶液,37℃避光孵育4小时,pbs洗涤后固定封片。使用共聚焦显微镜在405nm 波长激发光,400nm-460nm波长发射光范围观察并拍照有序相;在 405nm波长激发光,470nm-530nm波长发射光范围观察并拍照无序相。最后使用image j软件合成图像并计算gp值比较细胞膜流动性。结果如图4所示。
[0046]
(2)构建慢病毒:设计、构建scd1敲低慢病毒及对照慢病毒,得到scd1敲低慢病毒shscd1和对照慢病毒shcontrol。
[0047]
(3)测定目标细胞系moi(multiplicity of infection)并感染病毒:待细胞贴壁并生长24小时后,按照不同细胞系不同moi及病毒滴度计算所需病毒量,去除上清液,换用1ml含有病毒的完全培养基,密切观察细胞生长状况,若细胞形态明显变圆,可提前换液;否则待细胞生长12小时后,弃去上清(含病毒培养基),换成2ml(含有4μg/ml嘌呤霉素)完全培养基筛选感染成功的细胞。48小时后可提取rna及蛋白,分别通过rt-pcr及western blot验证感染效率并加入嘌呤霉素维持稳定表达细胞株,得到scd1稳定敲低肝癌细胞株mhcc97h和plc/prf/5。
[0048]
(4)将scd1稳定敲低肝癌细胞株mhcc97h和plc/prf/5分别接种在基质硬度为1.6kpa(低基质硬度)、25.6kpa(高基质硬度)的基质胶上,培养后通过测定细胞间分散距离测定离散度并比较敲低 scd1后的离散度。结果如图4所示。
[0049]
(5)将肝癌细胞系mhcc97h和plc/prf/5分布接种在基质硬度为1.6kpa(低基质硬度)、25.6kpa(高基质硬度)的基质胶上,过夜后对照组添加dmso,实验组分别加用scd1药理学抑制剂cay10566, 4天后观察通过显微镜拍摄细胞形态及测定细胞离散度。结果如图4 所示。
[0050]
5)scd1表达水平对肝癌细胞体外侵袭能力的影响
[0051]
将肝癌细胞系mhcc97h和plc/prf/5分布接种在基质硬度为 1.6kpa(低基质硬度)、25.6kpa(高基质硬度)的基质胶上,过夜后外源性添加单不饱和脂肪酸油酸(oleic acid,oa),4天后通过显微镜拍摄细胞形态及测定细胞离散度。结果如图5所示。
[0052]
6)scd1表达水平对肝癌细胞细胞膜流动性的影响
[0053]
将野生型及scd1稳定敲低肝癌细胞株mhcc97h和plc/prf/5分别接种在基质硬度为1.6kpa(低基质硬度)、25.6kpa(高基质硬度) 的基质胶上,培养2天后,加入无血清培养基配置的含有5μm laurdan 溶液,37℃避光孵育4小时,pbs洗涤后固定封片。使用共聚焦显微镜在405nm波长激发光,400nm-460nm波长发射光范围观察并拍照有序相;在405nm波长激发光,470nm-530nm波长发射光范围观察并拍照无序相。最后使用image j软件合成图像并计算gp值比较细胞膜流动性。肝癌细胞系mhcc97h和plc/prf/5在25.6kpa上, gp值减小,膜流动性增加。敲低scd1后,gp值增大,膜流动性下降。外源性添加单不饱和脂肪酸oa后,gp值减小,膜流动性增加。结果如图6所示。
[0054]
7)scd1表达水平对肝癌细胞原位成瘤能力的影响
[0055]
(1)皮下瘤动物模型:mhcc97h肝癌细胞使用胰酶(含0.25%edta) 从培养皿上消化下来制成单细胞悬液,使用一次性无菌注射器将单细胞悬液注射在balb/c裸鼠(雄性,4~6周龄,体重18~20g)的左侧腋窝处。定期测量接种部位肿瘤的长度和宽度,监测肿瘤的
生长情况。肿瘤体积计算公式为:v(mm3)=a(mm)
×
b(mm)2/2,其中v代表体积, a代表最大直径,b代表最小直径。实验结束后获取的肿瘤组织置于 4%多聚甲醛中固定。检测结果如图6所示。
[0056]
(2)肝原位移植瘤动物模型:mhcc97h肝癌细胞接种在裸鼠皮下形成瘤块后,将皮下肿瘤切成等体积的小块(1
×1×
1mm3),原位移植到10只裸鼠的肝脏中,n=5/组。随后,饲养6周后,同时取肝脏和肺组织,he切片染色评估肺转移情况。检测结果如图7所示。
[0057]
实验结果:
[0058]
1)脂质组学检测
[0059]
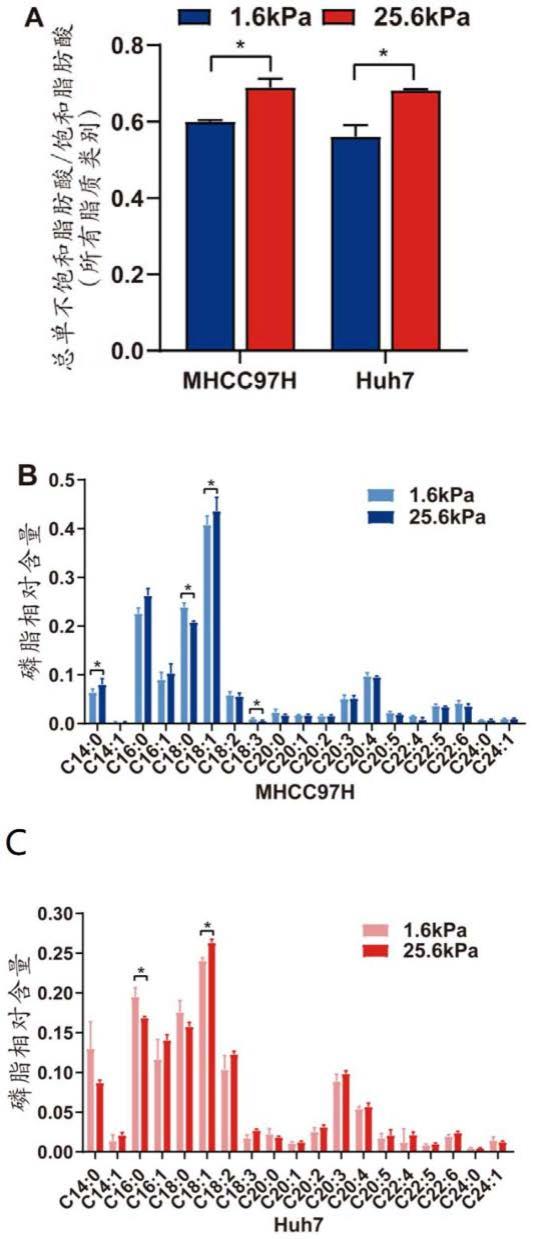
如图1所示,图1a是不同肝癌细胞在高、低基质硬度条件下的总脂质中单不饱和酰基链与饱和酰基链之比,由图1a可以看出,高基质硬度导致了肝癌细胞单不饱和酰基链与饱和酰基链之比显著提高(p<0.5);图1b、图1c是两种肝癌分别在高、低基质硬度条件下的甘油磷脂的各项含量比例,由图1b、图1c可以看出,高基质硬度促进了甘油磷脂中c18:1的含量比例显著增加(p<0.5)。
[0060]
由图1可得,高基质硬度调控肝癌细胞脂代谢重编程,脂质单不饱和酰基链比例增加。
[0061]
2)western blot方法分析scd1蛋白在不同硬度基质胶的表达
[0062]
如图2所示,其中图2a、图2b显示了高基质硬度(25.6kpa) 和低基质硬度(1.6kpa)条件下不同肝癌细胞的体外侵袭能力对比,可以看出,高基质硬度下的肝癌细胞体外侵袭能力有显著提升(p< 0.001);图2c、图2d显示了不同基质硬度下不同肝癌细胞中的scd1 蛋白表达水平,可以看出,两个图均显示了scd1蛋白含量随基质硬度梯度增加而显著增加(p<0.001)。
[0063]
由图2可得,高基质硬度上调肝癌细胞scd1蛋白表达,促进细胞体外侵袭能力。
[0064]
3)细胞体外侵袭性分析:
[0065]
如图3所示,其中图3a为不同肝癌细胞在高、低基质硬度下的细胞膜流动情况,图3b为不同肝癌细胞在高、低基质硬度下的细胞膜流动性统计分布图,由图3a、图3b可以看出,基质硬度提高促进了细胞膜广义极化(generalized polarization,gp)值下调,进而使得肝癌细胞膜流动性增加。
[0066]
4)细胞膜流动性定量
[0067]
如图4所示,图4a为成功构建的scd1稳定敲低肝癌细胞株 mhcc97h和plc/prf/5检测结果,其中shscd1#1、shscd1#2、shscd1#3 为重复测量结果。图4b为scd1稳定敲低肝癌细胞株mhcc97h和 plc/prf/5的离散度测定结果,经对比可以看出,高基质硬度 (25.6kpa)的肝癌细胞株离散度更高,即体外侵袭能力更强,这与前述实验结果保持一致;同时,高基质硬度条件下,敲低scd1后的肝癌细胞株与对照组相比离散度显著降低(p<0.001)。图4c为加入 scd1药理学抑制剂cay10566后的离散度检测结果,与对照组相比,高基质硬度的肝癌细胞离散度有显著降低(p<0.01)。
[0068]
由图4可得,敲低scd1或scd1抑制剂cay10566抑制高硬度基质诱导的细胞侵袭能力。
[0069]
5)scd1表达水平对肝癌细胞体外侵袭能力的影响
[0070]
由图5可知,肝癌细胞系mhcc97h和plc/prf/5在25.6kpa基质硬度上,细胞离散度
增加,侵袭能力增加。敲低scd1后,细胞离散度下降,侵袭能力下降。外源性补充scd1产物单不饱和脂肪酸油酸 oa后,敲低scd1的肝癌细胞在高基质硬度(25.6kpa)和低基质硬度(1.6kpa)条件下离散度均有显著提高(p<0.001)。表明scd1表达水平与肝癌细胞的侵袭能力呈显著正相关。
[0071]
6)scd1表达水平对肝癌细胞细胞膜流动性的影响
[0072]
由图6可知,肝癌细胞系mhcc97h和plc/prf/5在25.6kpa基质硬度上,gp值减小,膜流动性增加。敲低scd1后,gp值增大,膜流动性下降。外源性添加单不饱和脂肪酸油酸oa后,gp值减小,膜流动性增加。外源性补充油酸逆转scd1敲低肝癌细胞细胞膜流动性下降,上调肝癌细胞在1.6kpa低基质硬度胶上细胞膜流动性。
[0073]
7)scd1表达水平对肝癌细胞原位成瘤能力的影响
[0074]
如图7所示,其中图7a为小鼠皮下瘤体积增长折线图图,与对照组相比,scd1敲低组的皮下瘤增长速度显著降低(p<0.01)。图 7b为小鼠皮下瘤重量图,敲低scd1组皮下瘤重量低于对照组(p< 0.01)。图7c为小鼠原位瘤图,与对照组相比,scd1敲低组原位成瘤能力下降(p<0.01)。图7d为小鼠原位瘤肺转移图,与对照组相比,scd1敲低后肺转移数量下降(p<0.01)。
[0075]
由图7可得,scd1敲低组皮下瘤体积小,重量轻,原位成瘤能力差,肺转移少,即表明降低scd1表达水平能够显著抑制肝癌肿瘤的侵袭与转移。
[0076]
综上所述,可以得出以下结论:
[0077]
1、肝脏基质细胞硬度的提高可促进肝癌细胞体外侵袭与体内转移能力。
[0078]
2、肝脏基质细胞硬度与scd1表达水平呈正相关。
[0079]
3、scd1表达水平与肝癌细胞体外侵袭与体内转移能力呈正相关,抑制scd1表达水平可有效降低因肝脏基质细胞硬度提高引起的肝癌细胞体外侵袭与体内转移能力提高。
[0080]
4、scd1可作为肝癌细胞预后诊断的标志物,或作为预防或治疗肝脏基质细胞高硬度所致肝癌预后复发等情况的药物筛选靶点,进而具有抑制scd1表达水平功能的药物对其进行预防或治疗。
[0081]
实施例2 scd1在临床标本中的表达情况及预后意义
[0082]
收集110例肝癌患者的手术切除标本或活检肝癌组织,通过免疫组化法对肝癌细胞中的scd1进行染色检测,根据染色情况分成scd1 低表达组和高表达组患者,通过kaplan-meier生存分析比较两组患者的无瘤生存率和总生存率。结果如图8所示。
[0083]
scd1染色评分标准:0为无表达,1+为非常弱的表达,2+在》75%的肿瘤细胞中为中度表达,3+为在》75%的肿瘤细胞中有强表达。0和 1+归为scd1低表达患者;2+和3+归为scd1高表达患者。
[0084]
如图8所示,图8a为肝癌患者癌组织和癌旁组织scd1蛋白 western blot图,可以看出,与癌旁组织相比,肝癌组织中scd1蛋白表达增加。图8b为组织芯片中scd1免疫组化染色典型图。图8c 为生存曲线图,可以看出,scd1低表达组中无复发生存率及总生存率高于scd1高表达组。因此,由图8可以看出,肝癌组织高表达scd1 的患者无瘤生存率及总生存率明显降低。
[0085]
进而可以应用免疫组化试剂检测肝癌细胞的scd1表达情况,对于scd1高表达的肝癌患者,需要加强警惕,密切随访跟踪肿瘤有无复发和进展,增加辅助治疗以获得较好的疗
效,使患者有较长的生存期。
[0086]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1