一种联合检测pH和ATP的荧光生物传感器
一种联合检测ph和atp的荧光生物传感器
技术领域
1.本发明属于生物检测技术领域,具体涉及一种联合检测ph和atp的荧光生物传感器。
背景技术:
2.在自然界中,完整的凋亡细胞释放三磷酸腺苷(atp)作为一种信号分子,以立即触发吞噬清除,即使是在细胞凋亡的早期阶段。鉴于药物诱导的细胞凋亡是目前一种常见的癌症治疗方法,与传统方法相比,监测癌细胞表面的atp流出可以提供一种评估药物刺激和治疗效果的策略。
3.肿瘤微环境是异常细胞-细胞相互作用和内稳态破坏的特征。在这种状态下,肿瘤细胞优先利用糖酵解而不是氧化磷酸化作为能量释放的主要手段,这种效应被称为厌氧糖酵解。导致细胞外环境中乳酸负荷的增加约十倍,h
+
离子扩散转运到细胞间质。所以肿瘤细胞代谢改变引起的肿瘤微环境为酸性。
4.目前,检测atp的方法有电化学法、表面增强拉曼散射法等,检测ph的方法主要是化学比色法,但它们都存在耗时、仪器昂贵、操作复杂或不能检测痕量物质等缺点并且少见基于两种物质ph和atp水平变化联合检测的方法。因此,通过联合检测环境中的ph和atp,为评价药物诱导的细胞凋亡和治疗效果提供了一种敏感的方法,对疾病治疗及进程具有重要意义。
技术实现要素:
5.针对现有技术中的问题,本发明提供一种联合检测ph和atp的荧光生物传感器,检测限低、特异性好。
6.为实现上述目的,本发明采用如下技术方案。
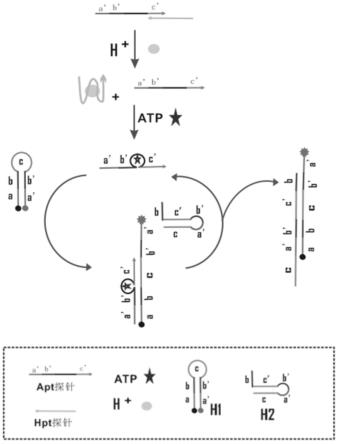
7.一种联合检测ph和atp的荧光生物传感器,包括:核苷酸序列如seq id no: 1-4所示的apt链、hpt链、发夹h1、发夹h2;所述发夹h1的5’端修饰了荧光报告基团,3’端修饰荧光猝灭基团。
8.优选地,所述生物传感器还包括缓冲溶液。
9.一种包含上述荧光生物传感器的检测ph和atp的试剂盒。
10.优选地,所述试剂盒还包括不同ph样品和atp标准样品。
11.一种采用上述生物传感器或者试剂盒检测ph和atp的方法,包括以下步骤:(1)apt链、hpt链变性、复性杂交获得apt-hpt复合探针;(2)将apt-hpt复合探针、发夹h1、发夹h2、待测样品或标准溶液在缓冲溶液中混合,30℃下孵育,然后进行荧光检测。
12.优选地,上述方法中还包括制作h
+
或atp标准曲线和计算待测样品中目标物浓度的步骤。
13.本发明的检测原理如图1所示:
如图1所示,该生物传感器用到以下序列:apt:5
’‑
aactggtatgattcaaaacctgggggagtattgcggaggaaggttttatacaaggaagggaa-3’hpt:5
’‑
ccttccctttctctttctctttcccttccttgtat-3’h1:5
’‑
[fam]aactggtatgatttcttcccttccttgtatgaaatcataccagtt[bhq]-3’h2:5
’‑
ttcccttccttgtataactggtatgatttcatacaaggaagggaagaaatcat-3’;其中,apt链中包含a’序列、b’序列、atp适配体及c’序列,hpt链中包含与apt链中c’序列杂交互补的部分和对ph响应的序列,apt链和hpt链杂交形成apt-hpt复合探针;在h
+
微环境中,hpt探针对h
+
响应,形成i-motif四联体,使apt-hpt复合探针中释放出apt链;游离的apt链在atp存在的情况下,atp适配体部分与atp结合,拉近apt链中两端的a’b’c’序列,作为后续打开发夹h1的toehold(a’b’c’序列)。apt链a’b’c’序列与发夹h1 3’端的abc序列互补结合,打开发夹h1,使h1两端原本靠近的荧光淬灭基团远离,荧光恢复,用于后续荧光仪检测;打开后的发夹h1暴露出b’序列。发夹h2的b序列作为toehold与发夹h1的b’序列互补结合,进而h2的c’b’a’序列与h1的cba序列结合,发生链置换置换下来apt链中的a’b’c’序列,参与下一次循环信号放大。
[0014]
本发明具有以下优点:本发明的传感器,利用核酸适配体和杂交链式反应,起到了信号放大的作用,提高了检测的灵敏度。利用atp与适配体的特异性识别和杂交链式反应循环toehold链,实现了对双目标物的高特异性联合检测;该传感器的反应条件温和,反应速度快;检测原理的主要过程是在均相中实现的,提高了反应速度,降低了操作的复杂程度,实现了目标物的快速,简单,灵敏的检测;该传感器的制备方法简单,性质稳定,重复性好,适用于样品中的目标物的检测和生物传感器产业化的实际应用。
[0015]
本发明基于核酸适配体的特异性识别,atp与适配体结合后,拉近toehold(a’b’c’序列),进行杂交链式反应(hcr),使发夹两端靠近的荧光基团和淬灭基团远离,构建了光学生物传感器。该传感器具有检测速度快,检测限低,特异性高等优点,最重要的是,该发明实现了一种方法对双目标物的联合检测,可以弥补现有检测方法的缺陷与不足,实现对快速、准确的定量检测。
附图说明
[0016]
图1为本生物传感器的原理图;图2为发卡h1浓度优化;图3为ph的工作曲线;图4为atp的工作曲线。
具体实施方式
[0017]
下面结合实施例和附图对本发明做进一步说明,但本发明不受下述实施例的限制。
[0018]
实施例1发卡h1浓度的筛选(1)根据seqidno:1-4所示的序列合成apt链、hpt链、发夹h1、发夹h2;并且进行以下修饰:发夹h1的5
‘
端修饰了荧光报告基团fam,3’端修饰荧光猝灭基团bhq;(2)按照以下步骤构建复合探针:将2
µ
lapt(100
µ
m)和2
µ
lhpt(100
µ
m)加入含6
µ
l灭菌水的离心管中,振荡30s,95℃保持5min然后冷却至室温,形成apt-hpt探针后,于4℃储存备用;(3)配制含50mmtris-hcl,10mmmgcl2,10mm(nh4)2so4,4mmdtt,ph7.5的10
×
buffer溶液;将9
µ
lapt-hpt探针(20
µ
m)5.5
µ
l灭菌水、5
µ
l10
×
buffer溶液、3
µ
l发夹h1(浓度为0
µ
m、200nm、400nm、600nm、800nm、1
µ
m、1.2
µ
m、1.4
µ
m)、3
µ
l发夹h2(100
µ
m)、3
µ
l含h
+
溶液(20mm)、1.5
µ
latp(100mm)加入灭菌离心管中,震荡30s,在30℃下孵育90min;(4)将反应后的溶液(30
µ
l)稀释至100
µ
l,设置激发波长为485nm,并在520nm处检测荧光信号变化;结果见图2,从图中可以看出,随着发夹h1浓度的增加,实验得到的荧光强度不断增强,在发夹h1的浓度达到0.8
µ
m之后,荧光强度基本不变,说明最适的发夹h1浓度是0.8
µ
m。
[0019]
实施例2生物传感器对ph的检测按照实施例1种的方式进行检测,不同在于,步骤(3)中,发夹h1浓度是0.8
µ
m,h
+
的浓度为0mm、200
µ
m、500
µ
m、1mm、2mm、3mm、4mm、5mm;步骤(4)中,荧光检测在500-650nm扫描荧光信号变化,并记录520nm处荧光信号;结果见图3,从图中可以看出,检测到的荧光信号随着目标物h
+
浓度在0
µ
m-5mm区间内增大而增大,拟合曲线:i=632.86+318.546lgc(mm)(其中c代表了h
+
的浓度,r2=0.991)。在200
µ
m的浓度基础上继续向更低的浓度检测,经检测当浓度低于1.5
µ
m时,ph浓度的对数与荧光强度大小恰好不再符合拟合曲线规律,即图中的荧光强度最低值。因此,可得到该方法检测ph的下限为1.5
µ
m。
[0020]
实施例3生物传感器对atp的检测按照实施例1种的方式进行检测,不同在于,步骤(3)中,发夹h1浓度是0.8
µ
m,atp的浓度为0
µ
m、100
µ
m、200
µ
m、500
µ
m、1mm、3mm;步骤(4)中,荧光检测在500-650nm扫描荧光信号变化,并记录520nm处荧光信号;结果见图4,从图中可以看出,检测到的荧光信号随着目标物atp浓度在0
µ
m-3mm区间内增大而增大,拟合曲线:i=632.27+317.46lgc(mm)(其中c代表了atp的浓度,r2=0.985)。在100
µ
m的浓度基础上继续向更低的浓度检测,经检测当浓度低于0.8
µ
m时,atp浓度的对数与荧光强度大小恰好不再符合拟合曲线规律,即图中的荧光强度最低值。因此,可得到该方法检测atp的下限为0.8
µ
m。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1