一种荧光免疫检测高血压多联试剂卡及其制备方法和应用与流程
1.本技术涉及免疫层析检测技术领域领域,具体而言,涉及一种荧光免疫检测高血压多联试剂卡及其制备方法和应用。
背景技术:
2.高血压也称血压升高,是血液在血管中流动时对血管壁造成的压力持续高于正常的现象。高血压是临床常见且多发慢性疾病,也是引起心脑血管疾病的主要危险因素,因此及早诊断与有效治疗对控制血压、减少并发症具有重要意义。
3.目前,高血压六项检测是鉴别诊断高血患者的常用方法,六项主要包括醛固酮(ald)、肾素(renin)、皮质醇(cortisol)、促肾上腺皮质激素(acth)、血管紧张素i(angⅰ)和血管紧张素ⅱ(angⅱ)。这些指标可以作为临床医生评估病人高血压起因的依据,根据相应的血压调节机制,指导医生选择适合病人的药物。
4.目前市面上的一些荧光免疫检测高血压试剂卡多是单试剂卡,一次只能检测一种指标,多种指标分批检测检测耗时长。
技术实现要素:
5.本技术的目的在于提供一种荧光免疫检测高血压多联试剂卡,该多联试剂卡可一次性检测多种指标,耗时短,操作简单,携带方便,同时可得到高血压相关指标的定量浓度。
6.本技术的另一目的在于提供一种荧光免疫检测高血压多联试剂卡的制备方法。
7.本技术解决其技术问题是采用以下技术方案来实现的。
8.一方面,本技术实施例提供一种荧光免疫检测高血压多联试剂卡,其包括:外壳、和多个检测不同指标的检测卡,多个检测卡分隔设置在外壳内;检测卡包括顺次搭接在底板上的滤血垫、喷金垫、硝酸纤维素膜和吸水垫;喷金垫喷涂有荧光微球复合物溶液,荧光微球复合物溶液包括荧光微球,以及偶联在荧光微球上的链霉亲和素和抗体a;硝酸纤维素膜设有一条质控线和至少一条检测线,检测线包被有待测指标的抗原b或与抗体a处于不同表位的抗体b,质控线固定有生物素化-bsa。
9.另一方面,本技术实施例提供一种荧光免疫检测高血压多联试剂卡的制备方法,其包括:
10.s1,荧光微球复合物溶液的制备:
11.s11,将1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐溶液(edc)和n-羟基琥珀酰亚胺溶液(nhs)加入到羧基荧光微球中进行活化,活化后离心,收集沉淀,用磷酸盐缓冲液重悬,得到活化后的荧光微球分散液;
12.s12,将链霉亲和素(sa)和抗体a和分别加入到步骤s1所得的活化后的羧基荧光微球分散液中进行偶联反应,离心后取沉淀物,得到偶联链霉亲和素和抗体a的荧光微球;
13.s13,向步骤s12所得的偶联链霉亲和素和抗体a的荧光微球中加入牛血清白蛋白,封闭未偶联抗体的活化羧基位点,封闭后离心,取沉淀,加入抗体保存液,得到荧光微球复
合物溶液;
14.s2,喷金垫制备:将步骤s13制得的荧光微球复合物溶液喷涂在喷金垫上,干燥;
15.s3,划膜:将抗体b或抗原b稀释至工作浓度后划在检测线上,将生物素化-bsa稀释至工作浓度后划在质控线上;
16.s4,滤血垫制备:使用滤血垫处理液浸泡滤血膜;
17.s5,检测卡组装:将滤血垫、喷金垫、硝酸纤维素膜和吸水垫依次粘贴于底板上,裁剪后装入外壳,得到检测卡。
18.相对于现有技术,本技术的实施例至少具有如下优点或有益效果:
19.1.本技术基于荧光免疫层析法,同时结合生物素-链霉亲和素标记技术,提供了一种高灵敏度待测抗原检测卡及其制备方法。生物素-链霉亲和素系统具有高特异性、高灵敏度、高稳定性的特点,使各种示踪免疫分析的特异性和灵敏度进一步提高。
20.2.本技术的荧光免疫检测高血压多联试剂卡携带方便,操作简单,易于掌握,无需专业人员操作,并且检测成本低。
21.3.本技术提供的一种荧光免疫检测高血压多联试剂卡可一次性检测高血压六项指标,耗时短,15min内即可获得检测结果,并获得各项指标的定量浓度,为高血压的临床诊断提供数据支持。
22.4.本技术通过在硝酸纤维素膜上设置至少一条检测线的方法,有些为2条检测线,在检测低浓度的样品时,可以更多的捕捉到目标抗原,提高检测灵敏度,使得检测结果更加精确。
附图说明
23.为了更清楚地说明本技术实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本技术的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
24.图1为本技术实施例1中一种荧光免疫检测高血压多联试剂卡的加样面;
25.图2为本技术实施例1中一种荧光免疫检测高血压多联试剂卡的结果观测面;
26.图3为实验例1中血管紧张素ⅰ的标准曲线;
27.图4为实验例3中皮质醇的标准曲线;
28.图5为实验例4中促肾上皮质腺素的标准曲线;
29.图6为实验例5中肾素的标准曲线;
30.图7为实验例6中醛固醇的标准曲线。
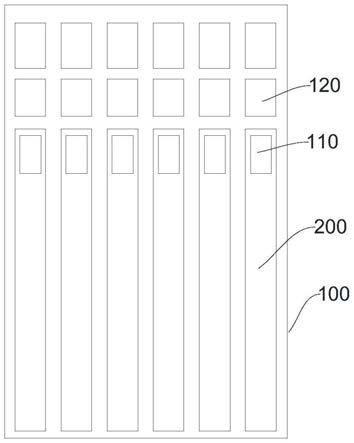
31.图标:100-外壳,110-加样区,120-混合槽,140-二维码,200-检测卡,210-标记区。
具体实施方式
32.为使本技术实施例的目的、技术方案和优点更加清楚,下面将对本技术实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
33.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将参考具体实施例来详细说明本技术。
34.一方面,本技术实施例提供一种荧光免疫检测高血压多联试剂卡,其包括:外壳、和多个检测不同指标的检测卡,多个检测卡分隔设置在外壳内;检测卡包括顺次搭接在底板上的滤血垫、喷金垫、硝酸纤维素膜和吸水垫;喷金垫喷涂荧光微球复合物溶液,荧光微球复合物溶液包括荧光微球,以及偶联在荧光微球上的链霉亲和素和抗体a;硝酸纤维素膜设有一条质控线和至少一条检测线,检测线包被有待测指标的抗原b或与抗体a处于不同表位的抗体b,质控线固定有生物素化-bsa。本技术的多联试剂卡可一次性检测多种指标,耗时短,操作简单,携带方便,同时可得到高血压相关指标的定量浓度。
35.需要说明的是,在本技术的一些实施例中,荧光微球复合物溶液可以采用鼠源抗体a偶联荧光微球,质控线处包被兔抗鼠igg;荧光微球复合物溶液采用igy偶联荧光微球,质控线处包被抗igy抗体;荧光微球复合物溶液采用dnp抗体偶联微球,质控线处包被bsa-dnp。以上几种方式同样可以达到检测目的。
36.多条t线能够尽可能的捕捉待测物,提高捕捉效率,提高灵敏度,也有利于标准曲线的拟合,在检测浓度较低的产品时尤为适用。
37.在本技术的一些实施例中,滤血垫设有加样区。滤血垫与加样区连通,方便加样。
38.在本技术的一些实施例中,外壳设有多个用于混合样品的混合槽,外壳设有用于标记不同检测指标的标记区。不同指标所用的抗体或抗原不同,为了避免混淆出现错误,在外壳上设置颜色标记或文字标记,方便实验人员识别和加样。
39.在本技术的一些实施例中,还包括层析缓冲液,层析缓冲液还包括以下组分:0.4-0.6%吐温20、0.1-0.5%proclin300、0.5-0.8%酪蛋白和磷酸缓冲液(pb)溶液,层析缓冲液的ph=6.0-8.0。
40.一种荧光免疫检测高血压多联试剂卡的制备方法,其包括以下步骤:s1,荧光微球复合物溶液的制备:
41.s11,将1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐溶液和n-羟基琥珀酰亚胺溶液加入到荧光微球中进行活化,活化后离心,收集沉淀,用磷酸盐缓冲液重悬,得到活化后的荧光微球分散液;
42.s12,将链霉亲和素和抗体a分别加入到步骤s1所得的活化后的荧光微球分散液中进行偶联反应,离心后取沉淀物,得到偶联链霉亲和素和抗体a的荧光微球;
43.s13,向步骤s12所得的偶联链霉亲和素和抗体a的荧光微球中加入牛血清白蛋白,封闭未偶联抗体的活化羧基位点,封闭后离心,取沉淀,加入抗体保存液,得到荧光微球复合物溶液;
44.s2,喷金垫制备:将步骤s13制得的荧光微球复合物溶液喷涂在喷金垫上,干燥;
45.s3,划膜:将抗体b或抗原b稀释至工作浓度后划在检测线上,将生物素化-bsa稀释至工作浓度后划在质控线上;
46.s4,滤血垫制备:使用滤血垫处理液浸泡滤血膜;
47.s5,检测卡组装:将滤血垫、喷金垫、硝酸纤维素膜和吸水垫依次粘贴于底板上,裁剪后装入外壳,得到检测卡。
48.该多联卡携带方便,重复性好、稳定性高且经济实用。
49.在本技术的一些实施例中,步骤s12中,荧光微球与抗体a的质量比为1000:3-1000:60,荧光微球与链霉亲和素的质量比为1000:2-1000:5。抗体a末端含有氨基可与荧光微球表面的羧基形成共价键,荧光微球与抗体a的质量比为1000:3-1000:60,可尽可能地提高荧光微球与抗体的偶联率及灵敏度。荧光微球与链霉亲和素的质量比为1000:2-1000:5,可尽可能提高荧光微球与抗体的偶联率。
50.在本技术的一些实施例中,步骤s2中荧光微球标记的抗体a的喷涂量为2-3μl/cm。喷涂量过大会造成浪费,喷涂量过小会增大因仪器精度等导致的系统误差,故综合将荧光微球结合物溶液喷涂的量控制在2-3μl/cm,既能保证尽快干燥又能尽可能减小系数误差,又能减少浪费。
51.在本技术的一些实施例中,步骤s3中,每条检测线上抗体b或抗原b的包被量为0.03-1μg/cm,质控线上生物素化-bsa的包被量为1-5μl/cm。
52.在本技术的一些实施例中,步骤s4中,滤血垫处理液包括以下组分:0.6%tris-base,0.1%edta na2·
2h2o,1%bsa,5%海藻糖,2.5%0.01m pbs,0.8%吐温20。滤血垫能过滤血液样本中的血细胞等,其能在不影响样本层析的情况下很好的对全血样本进行分离。
53.作为一个总的申请构思,本技术还提供一种荧光免疫检测高血压多联试剂卡在高血压诊断中的应用。该方法操作简单,耗时短,可一次性得到多个检测指标的定量浓度,可为医生的临床诊断提供支持。
54.以下结合实施例对本技术的特征和性能作进一步的详细描述。
55.实施例1
56.本实施例提供一种荧光免疫检测高血压多联试剂卡及其制备方法和应用。
57.一种荧光免疫检测高血压多联试剂卡,其包括:外壳100、和6个检测不同指标的检测卡200,6个检测卡200分隔设置在外壳100内;检测卡200包括顺次搭接在底板上的滤血垫、喷金垫、硝酸纤维素膜和吸水垫;喷金垫喷涂荧光微球复合物溶液,荧光微球复合物溶液包括荧光微球,以及偶联在荧光微球上的链霉亲和素和抗体a;硝酸纤维素膜设有质控线和检测线,检测线包被有待测指标的抗原b或与抗体a处于不同表位的抗体b,质控线固定有生物素化-bsa。
58.本实施例检测6项高血压指标,分别为:血管紧张素ⅰ(angⅰ)、血管紧张素ⅱ(angⅱ)、皮质醇(cor)、促肾上腺皮质激素(acth)、肾素(ren)和醛固酮(ads)。
59.在本实施例中,滤血垫设有加样区110。滤血垫与加样区110连通,方便加样。
60.在本实施例中,外壳100设有两个用于混合样品的混合槽120。把样品和层析缓冲液加入混合槽120即可将其混匀,操作简单。外壳100设有用于标记不同检测指标的标记区210。不同指标所用的抗体或抗原不同,为了避免混淆出现错误,在外壳100上设置颜色标记或文字标记,方便实验人员识别和加样。
61.在本实施例中,外壳100上设有二维码140,通过扫描二维码可得到各项指标的标准曲线信息,根据标准曲线可计算各项指标的浓度,实现定量检测。需要说明的是,为了减小批内差异,不同批次的多联试剂卡的标准曲线不同,每制作一批多联试剂卡均需要制作六个指标的标准曲线。
62.本实施例提供一种荧光免疫检测高血压多联试剂卡的制备方法,包括以下步骤:
63.s1荧光微球结合复合物溶液的制备
64.荧光微球活化:将100μl荧光微球原液和900μl 0.1m mes(ph6.0),混匀超声5min,14400rpm离心12min弃上清;加1ml 0.1m mes(ph6.0),超声5min,离心弃上清;加500μl 0.1m mes(ph6.0)超声分散5min,加edc、nhs各1mg,60rpm旋转混匀1h(室温),离心去上清;加1ml hepes缓冲液,超声5min,离心去上清,重复一次。
65.抗体与荧光微球结合物羧基偶联:加500μl hepes缓冲液,超声5min,先加sa混匀,再加抗体a混匀,60rpm旋转过夜(4℃);离心,向沉淀中加500μl封闭液,超声混匀,封闭液封闭微球多余羧基;60rpm旋转混匀2h(室温),离心去上清,向沉淀物中加1ml hepes缓冲液离心去上清,按5:1加保存液,得到荧光微球结合复合物溶液。
66.s2喷金垫的制备:
67.喷金垫处理液(100ml)的配制:称量1gbsa、6g蔗糖、1gpvp-k30加入超纯水中溶解,再量取1ml吐温20加入混合液中,搅拌均匀,定容至100ml;将喷金垫放在干净的托盘中,倒入处理液,于水平摇床震荡浸泡30min;将处理完成的喷金垫置于37℃生化培养箱中干燥24h,回收备用。
68.将得到的荧光微球复合物溶液使用三维平面点膜喷金仪的喷金功能,设置参数,将荧光微球复合物喷在处理好的喷金垫上;将喷好荧光微球复合物的喷金垫放置在37℃的生化培养箱中烘烤24小时。将烤好的已喷金垫子装在铝箔袋中,加上干燥剂,放在4℃冰箱备用。
69.s3划膜:
70.使用三维平面点膜喷金仪的划膜功能,将抗体b或抗原b稀释后划在检测线上,将生物素化-bsa稀释后划在质控线上;将划好的膜条放在37℃生化培养箱中烤24h;将膜条收起,用铝箔袋装好,加入干燥剂,封口后再放置60℃生化培养箱中烤72h;拿出烤好的膜条,放在4℃冰箱备用。
71.s4滤血垫制备:
72.滤血垫处理液的配制(100ml):0.6g tris-base,0.1g edta na2
·
2h2o,1gbsa,0.5g酪蛋白,5g海藻糖,2.5ml 0.01m pbs,0.8ml吐温20。
73.加入适量纯化水溶解,定容至100ml,再用稀盐酸或氢氧化钠调整ph至8.5,混匀。将一张滤血膜放在干净的托盘中,倒入滤血垫处理液,浸没滤血膜,于水平摇床震荡浸泡30min,取出滤血膜,将处理完成的滤血膜置于37度生化培养箱中干燥24h,干燥完成后回收滤血膜备用。
74.s5检测卡200组装:将滤血垫、喷金垫、硝酸纤维素膜和吸水垫依次粘贴于底板上,裁剪后得到检测卡200。将多个检测卡200装入外壳100,得到多联试剂卡。
75.层析缓冲液的制备(100ml):向玻璃容器中加入0.5ml吐温20,0.1ml proclin300,0.7g酪蛋白,再加入0.2mm pb溶液搅拌溶解。用稀盐酸或氢氧化钠将ph调节为6.0。
76.封闭液配方(500μl):125μl 20%bsa,375μl hepes缓冲液。
77.保存液配方:10%海藻糖,0.5%bsa,0.8%吐温20,0.1%proclin 300,10mm hepes补齐。
78.使用时,先向混合槽120中将150ul层析缓冲液中加入,再加入50ul样品,混合均匀后取75ul混合物加入到加样区110,层析15min后将多联卡插入荧光免疫分析仪中,荧光免
疫分析仪自动扫描色带并检测t线和c线上的复合物发出荧光的强度,用两个色带荧光强度的比值计算所测物质的含量。
79.本技术的实施例中,所有指标的检测卡200的制作方法都是一致的。但由于需要检测六项高血压指标(angⅰ、angⅱ、cor、acth、ren和ads),在操作过程中,荧光微球偶联的抗体的种类和抗体加入的量,荧光微球偶联的sa的量,在喷金垫喷涂抗体的量,t线包被的抗体或抗原种类以及包被的量,t线的条数以及c线包被生物素化-bsa的量各有不同,具体见表1。
80.表1实施例1中六项指标的检测卡差异
[0081][0082][0083]
本实施例的原理为夹心法和竞争法。当t线包被的是抗体时,为夹心法。荧光微球上包裹着与t线配对的抗体a及以及与c线配对的sa,在荧光微球与样本混合时,荧光微球上的检测抗体a与待测指标的抗原结合形成抗体a-抗原复合物,在硝酸纤维素膜条上层析时,与t线上的抗体b形成抗体a-抗原-抗体b的夹心复合物,其他未与抗原结合的游离荧光微球通过t线,荧光微球上的sa与c线上的生物素化-bsa结合,形成sa-生物素化bsa复合物,即剩余的荧光微球会被c线捕捉。将试剂卡插入分析仪中,分析仪自动扫描两条色带并检测检测区t线和质控区c线上的复合物发出荧光的强度,用两个色带荧光强度的比值计算所测物质的含量。待测物浓度越高,t峰越高,t/c值越大。
[0084]
当t线包被的是抗原时,为竞争法。荧光微球上包裹的抗体能与待检测抗原相配对,硝酸纤维素膜t线上包裹着与待检测抗原相似的抗原复合物。当荧光微球与待检测物混合时,荧光微球上的抗体与待检测抗原相结合形成抗体-抗原复合物,在通过硝酸纤维素膜上t线时,已形成复合物的荧光微球不能被t线捕捉而通过t线后被c线捕捉,未能与待测物形成复合物的荧光微球抗体与t线上的抗原复合物结合,被t线捕捉。此时样本中待测物浓度越高,t线上能结合的荧光微球越少,t线峰值越低,t/c越小,使用c/t值与理论浓度拟合
曲线。
[0085]
实施例2
[0086]
本实施例与实施例1基本相同,区别点在于层析缓冲液的制备(100ml):向玻璃容器中加入0.4ml吐温20,0.5ml proclin300,0.6g酪蛋白,再加入0.2mm pb溶液搅拌溶解。用稀盐酸或氢氧化钠将ph调节为6.5。
[0087]
实施例3
[0088]
本实施例与实施例1基本相同,区别点在于层析缓冲液的制备:向玻璃容器中加入0.6ml吐温20,0.2ml proclin300,0.8g酪蛋白,再加入0.2mm pb溶液搅拌溶解。用稀盐酸或氢氧化钠将ph调节为8.0。
[0089]
实施例4
[0090]
本实施例与实施例1基本相同,区别点如表2。
[0091]
表2实施例4中六项指标的检测卡差异
[0092][0093][0094]
实验例1
[0095]
本实验例为血管紧张素i的梯度实验。采用实施例1中制得的多联试剂卡中血管紧张素i的检测卡进行实验。用抗原稀释液将血管紧张素i的抗原稀释至以下浓度:0.5ng/ml、5ng/ml、10ng/ml、15ng/ml、20ng/ml、25ng/ml。所采用的抗原稀释液ph为7.5,以配置100ml的抗原稀释液为例,其具体成分见表3。将上述样品分别加入检测卡,层析15min后插入荧光免疫分析仪,结果如表4。
[0096]
表3 100ml抗原稀释液组分
[0097]
药品浓度称取质量nah2po4·
2h2o25mm0.0642g
na2hpo4·
12h2o25mm0.7518gnacl0.3m1.755gd-mannitol10mm1.8217gchaps0.60%0.6gproclin3000.10%0.1g
[0098]
表4血管紧张素i梯度实验结果
[0099][0100][0101]
根据表4的结果可拟合出血管紧张素i的标准曲线,如图3所示,标准曲线方程为y=-6.0734x2+47.703x-54.708,r2=0.9647,线性关系较好,满足相关要求。
[0102]
实验例2
[0103]
本实验例为血管紧张素ⅱ的梯度实验。采用实施例1中制得的多联试剂卡中血管紧张素ⅱ的检测卡进行实验。用抗原稀释液将血管紧张素ⅱ的抗原稀释至以下浓度:0ng/ml、0.5ng/ml、5ng/ml、10ng/ml、15ng/ml、20ng/ml、25ng/ml。所采用的抗原稀释液ph为7.5,以配置100ml的抗原稀释液为例,其具体成分见表3。将上述样品分别加入检测卡,层析15min后插入荧光免疫分析仪,结果如表5。
[0104]
表5血管紧张素ⅱ梯度实验结果
[0105][0106]
t1代表第一条t线高度,t2代表第二条t线高度,t代表总t高度,c代表c峰高度,t/c代表t峰高度/c峰高度,峰高代表荧光强度。由表5可知,同一浓度的各测定值间重复性较好。
[0107]
实验例3
[0108]
本实验例为皮质醇的梯度实验。采用实施例1中制得的多联试剂卡中皮质醇的检测卡进行实验。用抗原稀释液将皮质醇的抗原稀释至以下浓度:0ng/ml、5ng/ml、20ng/ml、60ng/ml、100ng/ml、200ng/ml、600ng/ml。所采用的抗原稀释液ph为7.5,以配置100ml的抗原稀释液为例,其具体成分见表3。将上述样品分别加入检测卡,层析15min后插入荧光免疫分析仪,结果如表6。
[0109]
表6皮质醇梯度实验结果
[0110][0111]
根据表6的结果可拟合出皮质醇的标准曲线,如图4所示,标准曲线方程为y=0.151x2+437.15x-193.13,r2=0.9943,线性关系较好,满足相关要求。
[0112]
实验例4
[0113]
本实验例为促肾上腺皮质激素的梯度实验。采用实施例1中制得的多联试剂卡中促肾上腺皮质激素的检测卡进行实验。用抗原稀释液将肾上腺皮质激素的抗原稀释至以下
浓度:0ng/ml、2.5ng/ml、25ng/ml、50ng/ml、100ng/ml、250ng/ml、500ng/ml、1000ng/ml、2000ng/ml。所采用的抗原稀释液ph为7.5,以配置100ml的抗原稀释液为例,其具体成分见表3。将上述样品分别加入检测卡,层析15min后插入荧光免疫分析仪,结果如表7。
[0114]
表7促肾上腺皮质激素梯度实验结果
[0115]
[0116][0117]
根据表7的结果可拟合出皮质醇的标准曲线,如图5所示,标准曲线方程为y=108.78x2+995.84x-14.291,r2=0.9988,线性关系较好,满足相关要求。
[0118]
实验例5
[0119]
本实验例为肾素的梯度实验。采用实施例1中制得的多联试剂卡中肾素的检测卡进行实验。用抗原稀释液将肾素的抗原稀释至以下浓度:0ng/ml、0.039ng/ml、0.078ng/ml、0.156ng/ml、0.313ng/ml、0.625ng/ml、1.25ng/ml、2.5ng/ml、5ng/ml。所采用的抗原稀释液ph为6.5,以配置100ml的抗原稀释液为例,其具体成分见表3。将上述样品分别加入检测卡,层析15min后插入荧光免疫分析仪,结果如图6,其标准曲线方程为y=0.1275x2+2.4214x-0.219,r2=0.9968,线性关系较好,满足相关要求。
[0120]
实验例6
[0121]
本实验例为醛固醇的梯度实验。采用实施例1中制得的多联试剂卡中醛固醇的检测卡进行实验。采用抗原稀释液将醛固醇的抗原稀释至以下浓度:15ng/ml、50ng/ml、100ng/ml、150ng/ml、200ng/ml、300ng/ml、500ng/ml、750ng/ml、1000ng/ml、1500ng/ml、2000ng/ml。所采用的抗原稀释液ph为7.5,以配置100ml的抗原稀释液为例,其具体成分见表3。将上述样品分别加入检测卡,层析15min后插入荧光免疫分析仪,结果如图7。
[0122]
根据实验结果,其标准曲线方程为y=-1236.1x2+5646.9x-2911.4,r2=0.9861,线性关系较好,满足相关要求。
[0123]
以上所描述的实施例是本技术一部分实施例,而不是全部的实施例。本技术的实施例的详细描述并非旨在限制要求保护的本技术的范围,而是仅仅表示本技术的选定实施例。基于本技术中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1