Au@Pd核壳八面体纳米酶双信号放大SPR检测探针制备方法与流程
au@pd核壳八面体纳米酶双信号放大spr检测探针制备方法
技术领域
1.本发明属于免疫学领域和电化学分析技术领域,更具体地说,本发明涉及一种au@pd核壳八面体纳米酶双信号放大表面等离子共振(spr)检测探针的制备方法。
背景技术:
2.表面等离子体共振传感是基于表面等离子体共振这一光学现象发展的。liedberg等人于1983年发现金属表面附近的质量累积会影响金属与电介质交界面的折射率,而spr信号对折射率变化很敏感,首次开发了表面等离子体共振传感器研究结合反应。spr传感器为研究分子结合提供了一种快速、实时、高选择性和高灵敏性的测定方法。spr可在分子水平上分析生物及药物分子之间的相互作用,如:蛋白质、dna、脂质到小分子、噬菌体及病毒等,spr传感器都可以研究其相互作用而应用于临床医学、药物筛选、食品安全及环境检测领域。spr传感器电化学分析技术和免疫检测技术相结合,因制作简单、损耗小及高选择性和实时性等优点而备受关注。
3.夹心免疫分析是利用抗体与待测抗原发生特异性结合时,根据待测物浓度对spr信号变化的影响关系实现免疫检测。相对于传统的修饰基底以增大spr信号的方法,本发明的方法可进行二次信号放大近而提高检测灵敏度。
4.用于增大spr信号的材料有聚合物和纳米材料。目前,应用于spr传感器的纳米材料包括磁性纳米材料、碳纳米材料和贵金属纳米材料。其中,贵金属纳米材料中金、钯纳米粒子具有优异的光学及电学性质,通过与spr金膜之间的电磁耦合的综合作用导致较大的spr信号变化。由于核壳纳米材料的特殊结构,具有现出优异的高比表面积、良好的生物相容性、稳定的光学性质。纳米模拟酶融合了化学催化剂与生物催化剂的独特优势。与天然酶相比,纳米酶具有低成本,高稳定性,高耐受性,可长期储存,易于大规模生产及活性可调控等优势。相比单金属,具有核壳结构的双金属具有更优良的模拟酶催化性能,而被用于生物传感,疾病诊断治疗方面。本发明将ag和pd复合后得到au@pd核壳八面体纳米酶,基于该复合纳米材料的优良性能,可以很好的应用在生物传感器领域,尚未有au@pd核壳八面体纳米酶用于表面等离子免疫传感领域的报道。苯胺在催化过氧化氢的作用下可以生成聚苯胺,可以二次信号放大以提高灵敏度。
技术实现要素:
5.为了克服上述缺陷,本发明提供一种au@pd核壳八面体纳米酶双信号放大表面等离子体共振(spr)检测探针的制备,其基本思路为:先合成au@pd核壳八面体纳米酶,利用pd与氨基的牢固结合的特点直接将二级抗体(ab2)固定于其表面得到双信号放大探针(au@pd-ab2),通过在表面等离子体共振分析仪的芯片表面修饰金黄色葡萄糖球菌蛋白以固定一级抗体(ab1),用牛血清蛋白封闭再结合抗原,进一步结合探针,spr信号放大,再通入苯胺和h2o2的混合溶液,利用纳米酶在spr芯片表面催化苯胺的聚合反应达到二次信号放大目的。利用spr信号变化与抗原浓度之间的线性关系,可用于高灵敏的spr免疫传感器检测蛋
白质分子。
6.合成au@pd核壳八面体纳米酶:
7.在烧杯中加入氯金酸溶液、氯钯酸钾溶液和超纯水超声混合后,接着加入十六烷基三甲基氯化铵溶液,混合均匀得到混合溶液(摩尔比为:氯金酸:氯钯酸钾:十六烷基三甲基氯化铵=4:12:3)。将混合溶液转入反应釜中,接着将反应釜放入鼓风干燥箱中,设置温度为90℃,反应48h。待反应结束冷却至室温,离心洗涤收集得到au@pd核壳八面体,并再次分散于超纯水中备用。au@pd核壳八面体平均粒径为60nm。
8.具体采用如下的技术方案:
9.一种au@pd核壳八面体纳米酶双信号放大spr检测探针制备方法,以氯金酸为金源,氯钯酸钾为钯源,超纯水作为溶剂,以十六烷基三甲基氯化铵为还原剂和稳定剂,采用一步水热法合成au@pd核壳八面体纳米酶,利用au@pd核壳八面体纳米酶固定二级抗体ab2制得spr检测探针。
10.具体包括以下步骤:
11.(1)将au@pd核壳八面体纳米酶超声分散于磷酸缓冲溶液pbs中,加入二级抗体ab2,低温下搅拌,再通过低温高速离心,继续分散于pbs中,低温储藏;
12.(2)将h2o2、氨水和超纯水的混合溶液煮至微沸,将表面等离子共振spr芯片放入浸泡,接着用超纯水和乙醇交替冲洗spr芯片,再用氮气吹干;
13.(3)将步骤(2)中处理好的芯片装入表面等离子体共振检测池中;将pbs通入检测池以平稳基线;
14.(4)在步骤(3)基线平稳后,注入金黄色葡萄球菌蛋白spa溶液,待信号平稳,注入pbs冲洗至spr信号稳定;
15.(5)在步骤(4)中spr信号稳定后注入一级抗体ab1与spa反应,待信号平稳,再通入pbs冲洗至spr信号稳定;
16.(6)在步骤(5)中spr信号稳定后注入牛血清蛋白溶液进行封闭,待信号平稳,再通入pbs冲洗至spr信号稳定;
17.(7)在步骤(6)中spr信号稳定后注入抗原与一级抗体ab1反应,待信号平稳,再通入pbs冲洗至spr信号稳定;
18.(8)在步骤(7)中spr信号稳定后注入au@pd-ab2与抗原反应,待信号平稳,再通入pbs冲洗至spr信号稳定;
19.(9)在步骤(8)中spr信号稳定后注入苯胺和h2o2的混合溶液,待信号平稳,再通入pbs冲洗至spr信号稳定。
20.优选的,步骤(1)中,所述au@pd核壳八面体纳米酶的浓度为0.5-2mg/ml,二级抗体ab2的浓度为1mg/ml;所述低温为4℃,离心转速及时间为10000r/min和30min。
21.优选的,步骤(2)中,所述h2o2、氨水和超纯水的混合溶液的混合体积比为1:1:5。
22.优选的,步骤(3)~步骤(9)中,所述磷酸盐缓冲溶液的浓度为0.01m;步骤(4)中,所述spa的浓度为100μg/ml。
23.优选的,步骤(5)中,所述ab1浓度为100μg/ml;步骤(6)中,所述牛血清蛋白溶液浓度为200μg/ml。
24.优选的,步骤(7)中,所述抗原浓度为0.005~1μg/ml。
25.优选的,步骤(8)中,所述au@pd-ab2浓度为10μg/ml。
26.优选的,步骤(9)中,所述苯胺和h2o2的混合溶液中苯胺的浓度为30mm,h2o2的浓度为5mm。
27.优选的,步骤(2)~(9)中,通入流速为5μl/min,温育时间为30min。
28.本发明至少包括以下有益效果:
29.(1)本发明使用的材料为au@pd核壳八面体纳米酶,一方面au@pd核壳八面体纳米酶具有高比表面积和优异的光学及电学性质等优点,且pd可与氨基牢固结合直接能固定ab2,简化操作,避免抗体失活的问题。au@pd核壳八面体能通过与spr金膜之间的电磁耦合的综合作用促进较大的spr信号增大。au@pd核壳八面体粒径为60nm,本发明合成的au@pd核壳八面体界面具有大的比表面积,良好的生物相容性,表现出优异的光学性能。
30.(2)另外,au@pd核壳八面体具有优异的模拟酶性质,在模拟酶催化过氧化氢的作用下可以催化苯胺生成聚苯胺,可以二次信号放大以提高灵敏度,本发明可实时且灵敏检测。
31.本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
32.图1为本发明探针制备和免疫分析示意图;
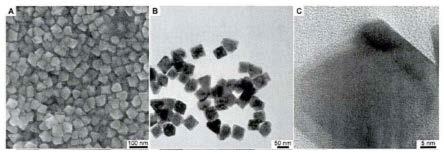
33.图2为本发明制备au@pd核壳八面体的扫描电镜图和透射电镜图;
34.图3为本发明基于au@pd核壳八面体纳米酶信号放大的表面等离子体共振免疫传感器的可行性研究图;
35.图4为本发明检测higg标准样品的线性曲线。
具体实施方式
36.以下将参照附图,通过实施例方式详细地描述本发明的技术方案。在此需要说明的是,对于这些实施例方式的说明用于帮助理解本发明,但并不构成对本发明的限定。
37.本文中术语“和/或”,仅仅是一种描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,单独存在b,同时存在a和b三种情况,本文中术语“/和”是描述另一种关联对象关系,表示可以存在两种关系,例如,a/和b,可以表示:单独存在a,单独存在a和b两种情况,另外,本文中字符“/”,一般表示前后关联对象是一种“或”关系。
38.合成au@pd核壳八面体纳米酶:
39.在烧杯中加入80μl氯金酸溶液(10wt%)、240μl氯钯酸钾溶液(10wt%)和超纯4ml水超声混合后,接着加入15ml十六烷基三甲基氯化铵溶液(50mm),混合均匀得到混合溶液。将混合溶液转入反应釜中,接着将反应釜放入鼓风干燥箱中,设置温度为90℃,反应48h。待反应结束冷却至室温,离心洗涤收集得到au@pd核壳八面体,并再次分散于超纯水中备用。au@pd核壳八面体平均粒径为60nm。
40.由图2a(扫描电镜图)可清晰看出au@pd核壳八面体呈八面体结构且尺寸均一,图2b为透射电镜图,由图可看出au@pd核壳八面体粒径约为60nm,图2c为透射电镜放大图,可
从图中看出该八面体为核壳结构,壳层厚度为5nm。综合上述,可证明成功制备了au@pd核壳八面体。
41.au@pd核壳八面体纳米酶双信号放大spr检测探针制备方法,具体包括以下步骤:
42.(1)将2.5mg au@pd核壳八面体超声分散于5ml磷酸缓冲溶液(pbs)中,超声30min加入50μl goat anti-higg(ab2),4℃低温下搅拌,再通过低温高速离心,继续分散于10ml pbs中,低温储藏;
43.(2)将spr芯片放入沸腾的h2o2,氨水和超纯水的混合溶液中浸泡,接着用超纯水和乙醇交替冲洗,再用氮气将芯片吹干;
44.(3)将处理好的芯片装入表面等离子体共振检测池中;将0.01m pbs通入检测池以平稳基线;
45.(4)在基线平稳后,注入100μg/ml金黄色葡萄球菌蛋白(spa)溶液,待信号平稳,注入磷酸盐缓冲溶液冲洗至spr信号稳定;
46.(5)在spr信号稳定后注入100μg/mlrabbit anti-higg与spa反应,待信号平稳,再通入磷酸盐缓冲溶液冲洗至spr信号稳定;
47.(6)在spr信号稳定后注入200μg/ml牛血清蛋白溶液进行封闭,待信号平稳,再通入磷酸盐缓冲溶液冲洗至spr信号稳定;
48.(7)在spr信号稳定后注入100μg/ml higg与rabbit anti-higg反应,待信号平稳,再通入磷酸盐缓冲溶液冲洗至spr信号稳定;
49.(8)在spr信号稳定后注入10μg/ml au@pd-ab2与higg反应,待信号平稳,再通入磷酸盐缓冲溶液冲洗至spr信号稳定;
50.(9)在spr信号稳定后注入苯胺(30mm)和h2o2(5mm)的混合溶液,待信号平稳,再通入磷酸盐缓冲溶液冲洗至spr信号稳定。
51.本发明使用的材料为au@pd核壳八面体纳米酶,一方面au@pd核壳八面体纳米酶具有高比表面积和优异的光学及电学性质等优点,且pd可与氨基牢固结合直接能固定ab2,简化操作,避免抗体失活的问题。au@pd核壳八面体能通过与spr金膜之间的电磁耦合的综合作用促进较大的spr信号增大。au@pd核壳八面体粒径为60nm,本发明合成的au@pd核壳八面体界面具有大的比表面积,良好的生物相容性,表现出优异的光学性能。
52.另外,au@pd核壳八面体具有优异的模拟酶性质,在模拟酶催化过氧化氢的作用下可以催化苯胺生成聚苯胺,可以二次信号放大以提高灵敏度,本发明可实时且灵敏检测。
53.图3为本发明基于au@pd核壳八面体纳米酶信号放大的表面等离子体共振免疫传感器的可行性研究图。由图可以清晰看出,图3中,曲线a为存在1μg/ml higg,通入au@pd-ab2与higg结合后,spr角度偏移值为0.1127度,进一步通入苯胺进行信号放大,spr角度偏移值为0.4536度;相比之下,曲线b为存在1μg/ml higg,通入au@pd-ab2,未通入苯胺进行信号放大的spr角度偏移值为0.1017度,相比而言,曲线a产生的偏移是曲线b的4.5倍。曲线c为存在1μg/ml higg,以ab2代替au@pd-ab2,苯胺进行信号放大,spr角度偏移值仅为0.0313度;曲线d为以0.01m pbs代替1μg/ml higg,进一步通入au@pd-ab2和苯胺进行信号放大,spr角度偏移值仅为0.0432度偏移。综合以上数据,可以证明所制备的基于au@pd核壳八面体纳米酶信号放大的表面等离子体共振免疫传感器检测higg是可行的。
54.如图4为检测higg标准样品的线性曲线。图4为本发明检测higg标准样品的线性曲
线。由图可以清晰看出spr信号随higg浓度增大而增大。图4a为基于au@pd核壳八面体纳米酶信号放大的表面等离子体共振免疫传感器检测0.005μg/ml,0.05μg/ml,0.1μg/ml,0.5μg/ml,0.8μg/ml,1.0μg/ml higg标准样品的传感图,图4b为相应的线性曲线,由图可以清晰看出检测线性范围为0.005-1μg/ml。线性方程为
△
θ(mdeg)=371.5996c
higg
(μg/ml)+57.5034,其中
△
θ为spr角度偏移量,c为higg浓度。由上可知,基于au@pd核壳八面体纳米酶信号放大的表面等离子体共振免疫传感器检测higg灵敏度高,检测限低。
55.为考察该传感器的实际应用的可靠性,进行了人血清实际样品的检测,并对未经处理的实际血清样本进行加标回收分析。回收率范围为96.3%-106.5%,说明该传感器在实际血清样本中可以准确检测higg如表1所示:
56.表1.higg实际样品的测定
[0057][0058][0059]
本发明一种au@pd核壳八面体纳米酶双信号放大spr检测探针制备方法,涉及表面等离子体共振免疫传感器领域。首先,本发明以氯金酸为金源,氯钯酸钾为钯源,超纯水作为溶剂,以十六烷基三甲基氯化铵为还原剂和稳定剂,采用一步水热法合成了au@pd核壳八面体纳米酶。所制备的au@pd核壳八面体纳米酶为八面体核壳结构,尺寸均一且粒径约60nm,au为核层,pd为壳层。利用pd与氨基的牢固结合,可以直接将二级抗体(ab2)固定于其表面得到au@pd核壳纳米酶纳米酶双信号放大探针(au@pd-ab2)。本发明所合成的au@pd核壳八面体纳米酶核壳结构使其具有大的比表面积,能够结合更多的ab2,au@pd优异的光学性能和催化性能促进spr信号放大。通过在spr的芯片表面修饰金黄色葡萄糖球菌蛋白以固定一级抗体,用牛血清蛋白封闭再结合检测抗原,进一步结合au@pd-ab2,再通入苯胺和h2o2的混合溶液。au@pd核壳八面体具有优异的类过氧化物酶模拟酶催化活性质,可在spr芯片表面催化h2o2氧化苯胺反应生成聚苯胺,形成二次spr信号放大。基于au@pd核壳八面体纳米酶双信号放大探针的表面等离子体共振免疫传感器,在磷酸缓冲溶液体系中,可快速简便地实现对蛋白分子的高灵敏度检测。本发明具有操作简单,试剂消耗少、检测限低和灵敏度高等优点。
[0060]
本发明利用au@pd核壳八面体纳米酶固定二级抗体(ab2)制得spr检测探针,当spr检测探针捕获待检测抗原分子后,具有过氧化物酶模拟酶性质的au@pd核壳八面体纳米酶,可在spr芯片表面催化苯胺聚合生成聚苯胺,从而形成二次spr信号放大,可用于高灵敏的spr免疫传感器检测疾病标志物等生物分子。
[0061]
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1