一种检测血红蛋白类氧载体中碳酸酐酶的酶活性的方法与流程
1.本发明涉及血红蛋白类氧载体技术领域,具体涉及检测血红蛋白类氧载体中碳酸酐酶的酶活性的方法。
背景技术:
2.血红蛋白类氧载体(hemoglobin-based oxygen carriers,hbocs)是一种新兴的具有携氧功能的血液代用品,具有可长时间保存、无需配型、便于运输、感染风险低等优点,但其表现出良好治疗效果的同时也存在氧化应激、影响血管收缩、产生肾毒性损伤等毒副作用。有研究将血红蛋白与超氧化物歧化酶(sod)、过氧化氢酶(cat)和碳酸酐酶(ca)复合来制备polyhb-sod-cat-ca,以解决上述问题。为进一步优化此类hbocs产品的性能,对以上三种酶进行酶活性测定很有必要。其中碳酸酐酶(ca)广泛存在哺乳动物的组织中并参与机体多种生命活动,其作用主要使催化二氧化碳转化为碳酸、控制生物流体(如血液)的酸度。常见的ca的酶活测定方法有测压法、比色法、电极法和酯酶测定法等,但测压法操作繁琐,且测定误差较大,比色法使用的指示剂往往对酶的活性会存在影响,测定结果不够准确,电极法对设备要求较高,且测得的酶活的线性响应范围较小,酯酶测定法只能测定具有酯酶活性的碳酸酐酶的酶活。
3.因此,亟需一种操作简单、对设备要求低、测定结果准确且适用生物样品的碳酸酐酶的酶活性检测方法。
技术实现要素:
4.本发明的目的是提供一种操作简单、对设备要求低、适用生物样品的碳酸酐酶的酶活性检测方法,本发明的方法测定过程中酶活性不受生物样本和指示剂的影响,准确度高。
5.为达此目的,本发明采用以下技术方案:
6.一种检测血红蛋白类氧载体中碳酸酐酶的酶活性的方法,包括以下步骤:
7.(1)向n个酶活性已知但不同的碳酸酐酶标准品中加入缓冲溶液、反应底物和酸碱指示剂,得到反应液n,建立反应液n的吸光度与反应时间的关系曲线,得到反应速率k,建立碳酸酐酶标准品的酶活性与反应速率k的标准工作曲线;
8.其中,所述反应底物包含二氧化碳;
9.(2)向待测样品中加入步骤(1)中的缓冲溶液、反应底物和酸碱指示剂,得到反应液n0,建立反应液n0的吸光度与反应时间的关系曲线,得到反应速率k0;
10.(3)根据反应速率k0和标准工作曲线,得到待测样品中碳酸酐酶的酶活性。
11.根据本发明的一些实施方式,所述步骤(1)中待测样品为牛血或血红蛋白类氧载体原液稀释液。
12.根据本发明的一些实施方式,所述步骤(1)中缓冲溶液为tris-hcl缓冲溶液。
13.根据本发明的优选实施方式,所述步骤(1)中反应底物为二氧化碳饱和溶液。
14.根据本发明的优选实施方式,所述步骤(1)中酸碱指示剂为溴百里酚蓝。
15.根据本发明的优选实施方式,在25℃水浴下,向溴百里酚蓝水溶液中通入co2气体,得到含溴百里酚蓝的co2饱和溶液。
16.根据本发明的一些实施方式,所述步骤(1)中缓冲溶液的ph为6.50-8.30,优选为7.60-8.30。
17.根据本发明的一些实施方式,所述步骤(1)中缓冲溶液的浓度为0.01mol/l-0.03mol/l,优选为0.015-0.025mol/l。
18.根据本发明的一些实施方式,所述步骤(1)中酸碱指示剂的浓度为0.01g/l-0.03g/l,优选为0.012g/l-0.02g/l。
19.根据本发明的一些实施方式,所述步骤(1)和步骤(2)中使用紫外-可见光分光光度计在速率模式下测量吸光度值。
20.根据本发明的一些实施方式,所述步骤(1)和步骤(2)中在同一波长下测量吸光度值。
21.根据本发明的一些实施方式,所述吸光度的测量波长为570nm-650nm,优选为600nm-630nm,更优选为610nm-630nm,最优选为617nm。
22.根据本发明的一些实施方式,所述步骤(1)中n为不小于3的正整数,优选为5-10之间的正整数,例如5,6,7,8,9或10。
23.根据本发明的一些实施方式,所述步骤(1)中碳酸酐酶标准品的酶活性为0u/ml-200u/ml,优选为0u/ml-100u/ml,例如碳酸酐酶标准品的酶活性为100u/ml、75u/ml、50u/ml、25u/ml、12.5u/ml、0u/ml。
24.根据本发明的一些实施方式,所述步骤(2)中,待测样品为使用ph为7.35-7.45的磷酸钾盐缓冲溶液稀释40-60倍后的牛血。
25.根据本发明的一些实施方式,所述步骤(2)中,待测样品为使用ph为7.35-7.45的磷酸钾盐缓冲溶液稀释15-30倍后的血红蛋白类氧载体原液。
26.根据本发明的一些实施方式,所述步骤(1)中以反应时间t(s)为横坐标,吸光度值a为纵坐标作图,所得直线的斜率为反应速率k。
27.根据本发明的一些实施方式,所述步骤(2)中以反应时间t(s)为横坐标,吸光度值a为纵坐标作图,所得直线的斜率为反应速率k0。
28.根据本发明的一些实施方式,所述步骤(1)中以反应速率为横坐标,ca标准品的酶活性为纵坐标作图,建立碳酸酐酶标准品的酶活性与反应速率k的标准工作曲线。
29.根据本发明的一些实施方式,所述步骤(2)中选取反应时间为0s-16s,优选为2s-6s处的吸光度值作图。
30.与现有技术相比,本发明具有如下优点:本发明选择特定的酸碱指示剂和特定ph的缓冲溶液,使ca催化二氧化碳水合反应的反应速率与其在某一波长处的吸光度值变化成呈线性关系,并通过建立ca酶活性的标准工作曲线,实现对血红蛋白类氧载体中ca酶活性的准确测定,且操作简单、对设备要求低、测定过程中酶活性不受生物样本和指示剂的影响。
附图说明
31.图1为实施例2中进行全波长扫描的光谱图。
32.图2为实施例3中建立的ca酶的酶活性标准工作曲线图。
具体实施方式
33.为使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步的详细说明。此处所描述的具体实施例仅用于解释本发明,并不用于构成对本发明的任何限制。
34.除非另有定义,否则本发明使用的所有技术术语和科技术语都具有如在本发明所属领域中通常使用的相同含义。
35.实施例1:血红蛋白类氧载体中ca酶活性的测定
36.配置缓冲溶液a(0.05m磷酸钾盐缓冲液,ph为7.40):称取1.7g磷酸二氢钾,用超纯水溶解并定容到250ml,备用。称取5.7g磷酸氢二钾,用超纯水溶解并定容到500ml,备用。在500ml磷酸氢二钾溶液里缓慢加入磷酸二氢钾溶液,边搅拌边监测ph,当ph达到7.40,停止加入磷酸二氢钾溶液,过0.45μm微孔过滤膜,即可。
37.配置缓冲溶液b(0.02m tris-hcl含0.015g/l溴百里酚蓝,ph为8.25):精密称取tris-hcl 3.1528g,溴百里酚蓝15mg,用超纯水溶解并定容到1000ml,得到0.02m tris-hcl含0.015g/l溴百里酚蓝,备用。精密称取tris-base 2.4228g,溴百里酚蓝15mg用超纯水溶解并定容到1000ml,得到0.02m tris-base含0.015g/l溴百里酚蓝,备用。在500ml 0.02m tris-base含0.015g/l溴百里酚蓝溶液中,缓慢加入0.02m tris-hcl含0.015g/l溴百里酚蓝溶液,边搅拌边监测ph,当ph达到8.25时,停止加入。
38.配置co2饱和溶液含0.015g/l溴百里酚蓝:精密称取15mg溴百里酚蓝,用超纯水溶解并定容到1000ml。取400ml定容后的溴百里酚蓝水溶液,在25℃水浴条件下,通co2气体2小时,溶液保持温度24℃,ph为3.90。
39.配置ca酶标准品:精密称取ca酶标准品适量,用缓冲溶液a配成酶活性3000u/ml的储备液,吸取储备液稀释成100u/ml、75u/ml、50u/ml、25u/ml、12.5u/ml、0u/ml系列浓度。
40.配置待测样品:吸取牛血或者hbocs液适量,用缓冲溶液a稀释n倍,牛血按40-60倍稀释,hbocs液按15-30倍稀释,得到待测样品。
41.(1)建立标准工作曲线
42.a.ca标准品调0(空白):以2.1ml缓冲液b和1.4ml超纯水为空白对照;
43.b.向10ul酶活性为100u/ml、75u/ml、50u/ml、25u/ml、12.5u/ml、0u/mlca酶标准品中加入2.1ml缓冲液b,取1.4ml co2溶液饱和溶液含0.015g/l溴百里酚蓝,加入比色皿同时点击检测,并迅速盖上检测池盖;速率模式下检测波长617nm,带宽2nm,间隔时间0.5s,总时长16s;
44.c.重复步骤b,逐一检测ca酶标准品;
45.d.以检测时间t(s)为横坐标,吸光度值a为纵坐标,选取反应时间为2
–
6s的吸光度值数据作图,所得直线的斜率为ca酶标准品催化co2水合反应的反应速率k;
46.e.以反应速率k为横坐标,ca标准品的酶活性u
标
为纵坐标作图,得到ca酶活性的标准工作曲线。
47.(2)测定样品原液中碳酸酐酶的酶活性
48.a.待测样品调0(空白):以2.1ml 0.02m tris-hcl和1.4ml超纯水为空白对照;
49.b.向10ul待测样品中,加入2.1ml缓冲液b,取1.4ml co2溶液,加入比色皿同时点击检测,并迅速盖上检测池盖;速率模式下检测波长617nm,带宽2nm,间隔时间0.5s,总时长16s;
50.c.以检测时间t(s)为横坐标,吸光度值a为纵坐标,选取反应时间为2
–
6s的吸光度值数据作图,所得直线的斜率为待测样品催化co2水合反应的反应速率k0;
51.d.根据反应速率k0和标准工作曲线,得出待测样品的碳酸酐酶酶活性u0;
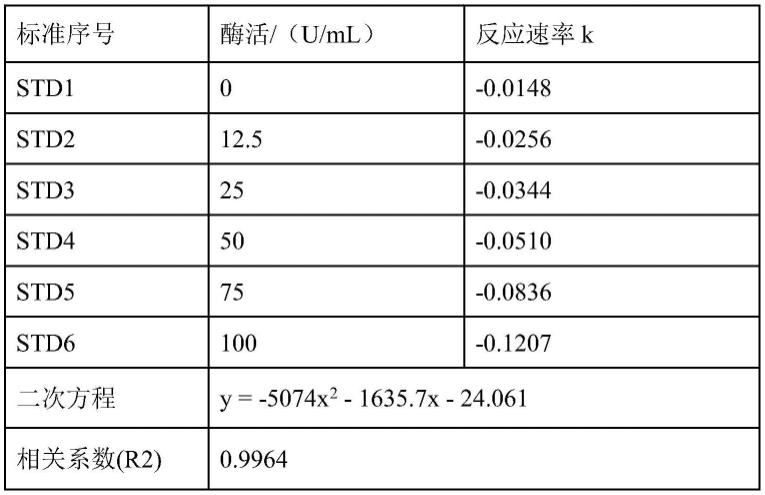
52.e.按如下公式得出样品原液中碳酸酐酶的酶活性:
53.u=u0×
n054.式中:u代表样品原液中碳酸酐酶的酶活性,单位为u/ml;
55.u0代表待测样品中碳酸酐酶的酶活性,单位为u/ml;
56.n0代表样品原液稀释倍数。
57.实施例2:对血红蛋白类氧载体中ca酶活性的测定方法进行专属性确认
58.在4.5ml比色皿中加入2.1ml 0.02m tris-hcl缓冲液(ph8.30、ph6.30),加入1.4ml未通co2气体的溴百里酚蓝水溶液;对照空白为2.1ml不含溴百里酚蓝的0.02m tris-hcl缓冲液,加1.4ml超纯水;在300-700nm进行全波长扫描,得到扫描光谱图(见图1)。
59.从扫描光谱图可以看出,tris-hcl缓冲液因ph值差异,在617nm处的吸光度有较大差异,符合我们的检测原理要求,可以作为该方法的检测波长。
60.实施例3:对血红蛋白类氧载体中ca酶活性的测定方法进行线性范围余相关系数确认
61.(1)试验数据
62.试验数据如表1所示:
63.表1
[0064][0065]
标准工作曲线图见图2。
[0066]
(2)试验结论
[0067]
ca酶标准溶液酶活在0、12.5、25、50、75、100u/ml范围时,其二次方程是y=-5074x2-1635.7x-24.061,相关系数(r2)=0.9964,具有良好的线性关系,满足方法学线性和范围的确认要求:6个系列浓度,相关系数r2≥0.99。
[0068]
实施例4:对血红蛋白类氧载体中ca酶活性的测定方法进行精密度试验(重复性和中间精密度)
[0069]
(1)试验方法
[0070]
不同分析员、不同日期分别制备6份样品,按实施例1中测定样品中的含量,计算其rsd(%)。
[0071]
(2)试验数据
[0072][0073][0074]
(3)试验结论
[0075]
人员1的6个样重复性rsd是10.1%,人员2的6个样重复性rsd是10.5%,在不同时间、不同人员操作的检测结果的中间精密度是6.4%,满足方法学精密度的确认要求:重复性:rsd≤11%;中间精密度(不同人员同一仪器):rsd≤10%。实施例5:对血红蛋白类氧载体中ca酶活性的测定方法进行回收率试验
[0076]
(1)试验方法
[0077]
加标样品的处理:按照表2对样品原液、ca酶标准品进行稀释。
[0078]
表2
[0079][0080]
(2)试验数据
[0081]
得到的实验数据如表3所示。
[0082]
表3
[0083][0084][0085]
测得:加入浓度=加标样酶活-样品酶活
[0086]
回收率(%)=测得加入酶活/实际加标酶活*100%
[0087]
(3)试验结论
[0088]
3个不同梯度的回收率分别是98.4%、95.1%和115.5%,满足方法学回收率的确认要求:80-120%,用该方法检测ca酶活性,具有一定的准确性。
[0089]
对比例1:使用ph计法检测血红蛋白类氧载体中ca酶活性的精密度试验(重复性和中间精密度)
[0090]
(1)试验方法
[0091]
不同分析员、不同日期分别制备6份样品,按实施例1测定样品中的含量,计算其rsd(%)。
[0092]
(2)试验数据
[0093][0094][0095]
(3)试验结论
[0096]
人员1的6个样重复性rsd是11.14%,人员2的6个样重复性rsd是8.11%,在不同时间、不同人员操作的检测结果的中间精密度是21.6%,其重复性、中间精密度不如本发明的方法。
[0097]
综上,通过对本发明碳酸酐酶(ca)活性检测方法的专属性、线性和范围、重复性、中间精密度及回收率各方法参数进行确认,确认结果均能满足方法学确认的标准要求,该方法可用于碳酸酐酶(ca)的活性检测。
[0098]
本发明的技术方案不限于上述具体实施例的限制,凡是根据本发明的技术方案做出的技术变形,均落入本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1