一种检测人体内四氢生物蝶呤的方法与流程
1.本发明涉及医药技术领域,特别涉及一种检测人体内四氢生物蝶呤的方法。
背景技术:
2.四氢生物蝶呤(bh4)是苯丙氨酸羟化酶的辅酶,在酶促反应中作为电子载体起还原剂的作用。其氧化型为二氢生物蝶呤,后者在二氢生物蝶呤还原酶催化下以nadph为供氢体还原再生成为四氢生物蝶呤。四氢生物蝶呤不足或催化四氢生物蝶呤再生的还原酶缺陷,是苯丙氨酸羟化反应受阻、出现苯酮尿症的原因之一。其化学名称2-氨基-6-[(1r,2s)-1,2-二羟丙基]-5,6,7,8-四氢-4(1h)-蝶啶酮,分子式:c9h
15
n5o3,分子量:241.25,其化学结构式为:
[0003][0004]
bh4在很多领域都有应用,具体为:
[0005]
1、bh4与糖尿病
[0006]
糖尿病中,bh4水平的下降与血管内皮功能障碍有着密切联系。bh4被氧化和内皮型no合酶(enos)脱偶联所导致的no合成减少是血管内皮功能障碍的重要原因,同时enos脱偶联导致超氧化物的产生会加剧bh4的氧化,bh4、no和磷脂酰肌醇激酶/蛋白激酶(pi3k/akt)通路以及一些其他的分子共同作用导致,并已发现包括直接给药诱导激活外界刺激等许多方法能够缓解内皮功能紊乱。
[0007]
2.bh4与心肌保护
[0008]
bh4在心肌保护方面扮演重要角色。在发生心脏负荷过重时,线粒体功能障碍诱导心肌细胞凋亡,并最终导致心肌肥厚和功能障碍。bh4可通过抑制nos脱偶联,促进no的合成,与激活的胞内(bpi3k/akt)通路共同影响对心肌起保护作用的环磷酸鸟苷/蛋白激酶g(cgmp/pkg)通路,抑制心肌的缺血再灌注损伤在离体实验中,使用bh4可以缓解心脏骤停所带来的心肌缺血再灌注损伤,而使用抗坏血酸和n-乙酰半胱氨酸维持bh4水平和bh4/(二氢生物蝶呤)bh2比率,也可起到缓解心肌缺血再灌注损伤的作用。
[0009]
3.bh4与肺动脉高压
[0010]
肺动脉高压(ph)是一种以肺动脉肺静脉和肺毛细血管血压一同升高,并导致呼吸短促晕厥等症状的严重疾病,并伴有心力衰竭和运动耐受力下降。研究发现bh4与肺动脉高压有着密切关系,bh4的氧化和消耗,会使enos的活性剂量依赖性地降低,同时在bh4水平较低时,血光紧张素ii(angii)可以降低二氢叶酸还原酶(dhfr)的表达促进鸟苷三磷酸环化水解酶(gtpch)的降解,导致肺动脉高压的发生。这说明,bh4缺乏与肺动脉高压有着联系。这说明bh4可以抑制肺动脉高压的发生近期研究显示enos脱偶联和还原型辅酶ⅱ(nadph)氧化酶的活性增加导致no生物利用度下降,受损血管的修复再生能力减弱,在给予墨蝶呤
后可以改善该种情况;提示bh4的减少所导致的no生成减少和血管内皮功能的障碍是肺动脉高压发生的途径之一,并且在补充bh4后可以缓解该情况。
[0011]
4、bh4与高胆固醇血症
[0012]
enos产生的no是一种抗血栓形成和抗动脉粥样硬化的分子。在高胆固醇血症发生时,nadph氧化酶介导的氧化应激导致bh4的氧化,enos功能障碍和活性降低,并导致血管no的生物利用度的降低,最终参与诱导动脉粥样硬化形成。通过bh4直接给药的方法,都发现给予bh4可以维持nos的偶联状态,降低氧化应激,保护血管内皮的功能,减缓动脉粥样硬化的发展。
[0013]
5.bh4与生物节律性
[0014]
研究显示bh4以及gtpch在体内的表达水平也存在着节律性当节律基因,如bmal1和per2失活时,小鼠的血管内皮细胞功能将会受到明显抑制,引起o2的累积和血管正常舒张功能的减弱,主要原因可能是bh4昼夜节律性失调和表达水平紊乱而导致enos的脱偶联同时,研究发现,环氧酶非选择性抑制剂吲哚美辛可以一定程度上缓解bmal1基因失活导致的血管内皮细胞功能抑制,但是对于per2基因失活所引起的血管内皮细胞功能抑制没有缓解效果,原理目前尚不清楚。
[0015]
6.bh4与高苯丙氨酸血症(新生儿筛查)
[0016]
四氢生物蝶呤(bh4)缺乏症(bh4d)是高苯丙氨酸血症的一种亚型,是一种常染色体隐性遗传性疾病,与苯丙酮尿症(pku)同属于高苯丙氨酸血症(hpa),是一种人类的罕见遗传代谢病之一。bh4在合成或代谢途径中,某种酶的缺陷导致氨基酸代谢障碍,影响脑内神经递质的合成,患儿出现严重的神经损害症状体症和智能障碍。主要会对人的神经系统造成损害,导致患儿出现智力低下、癫痫等症状。临床预后极差,多在早期夭折,故曾称为“恶性pku”。全世界bh4d的平均发病率在1/10600左右,约占高苯丙氨酸血症的1%~2%,有明显的种族和区域性差异。在中国每年约2000万新生儿中可能患bh4缺乏症的为100~200人。因此bh4检测在新生儿筛查中具有极其重要的作用。
[0017]
由于bh4属于内源性物质,同时在一般情况下极易被氧化为二氢生物蝶呤和生物蝶呤,在准确检测bh4具有很大的挑战。目前查找各方面专利,暂时无bh4生物样品检测的方法,设计一个简单,快速,准确的定量方法,在人类疾病发现和治疗具有很大的社会价值。
技术实现要素:
[0018]
本发明的目的是提供一种检测人体内四氢生物蝶呤的方法,解决上述现有技术问题中的一个或者多个。
[0019]
本发明提供的一种检测人体内四氢生物蝶呤的方法,血浆样品经预处理后经过高效液相色谱-串联质谱检测其浓度,包括以下步骤:
[0020]
s1、血浆样品预处理:采用一步有机溶剂加抗氧化剂萃取法;
[0021]
s2、试样测定:将测试样品注入高效液相色谱-串联质谱仪中,检测样品中bh4和内标bh4-13
c 15
n3的色谱峰,并据此计算所述血浆样品中的bh4浓度。
[0022]
在某些实施方案中,步骤s1具体包括:
[0023]
a1、以k2edta为抗凝剂,配制样品后,取适量于96深孔板中,添加第一溶液至每一样品并混匀;
[0024]
a2、继续添加0.2ng/μl内标标准溶液至每一样品并混匀,空白及残留样品添加第
一溶液并混匀;
[0025]
a3、继续添加第二溶液于96深孔板中并涡旋混匀;
[0026]
a4、继续添加meoh于96深孔板中并涡旋混合1分钟以沉淀样品中的蛋白质;
[0027]
a5、在4℃下,将a4得到的样品以3000rpm的转速离心10min,取上清液转移至装有第三溶液的96深孔板中并涡旋混匀;在4℃下,继续以3000rpm的转速离心5min。
[0028]
在某些实施方案中,所述第一溶液的制备方法为:将0.1m的hcl溶于体积比为50:50的meoh和h2o的混合溶液中,得到溶液a,将体积分数为5%的vc溶于溶液a中,从而得到所述第一溶液;所述第二溶液的制备方法为:将0.02m的hcl溶于体积比为50:50的meoh和h2o的混合溶液中,得到溶液b,将体积分数为5%的vc溶于溶液b中,从而得到所述第二溶液;所述第三溶液的制备方法为:将h2o溶于1mch3coonh4中,并控制两者之间的体积比为100/0.1,从而得到所述第三溶液。
[0029]
在某些实施方案中,高效液相色谱的测定条件为:
[0030]
色谱柱:evo c185μm,柱规格为4.6
×
100mm;
[0031]
色谱柱温:30℃;
[0032]
流动相a:h2o/1m hcoonh4=100/0.1(v/v);
[0033]
流动相b:acn;
[0034]
洗液:acn/meoh=50/50(v/v);
[0035]
自动进样器温度为4℃;
[0036]
等度洗脱,流速为0.6000ml/min,进样量为15μl,分析时间为3.00min。
[0037]
在某些实施方案中,bh4质谱测定条件为:
[0038]
离子源采用电喷雾离子源,喷雾电压为2800v,雾化温度为650℃,喷雾气压力为85psi,辅助加热气压力为85psi,气帘气压力为20psi,碰撞气压力为high,去簇电压分别为20ev的bh4;
[0039]
碰撞室入口电压分别为10ev的bh4;
[0040]
碰撞电压分别为26ev的bh4;
[0041]
碰撞室出口电压分别为10ev的bh4;
[0042]
正离子方式检测;
[0043]
扫描方式为多重反应检测;
[0044]
bh4用于定量分析的离子对为:m/z242.3
→
m/z166.1。
[0045]
在某些实施方案中,bh4-13
c 15
n3质谱测定条件为:
[0046]
离子源采用电喷雾离子源,喷雾电压为2800v,雾化温度为650℃,喷雾气压力为85psi,辅助加热气压力为85psi,气帘气压力为20psi,碰撞气压力为high,去簇电压分别为20ev的bh4;
[0047]
碰撞室入口电压分别为10ev的bh4-13
c 15
n3;
[0048]
碰撞电压分别为26ev的bh4-13
c 15
n3;
[0049]
碰撞室出口电压分别为10ev的bh4-13
c 15
n3;
[0050]
正离子方式检测;
[0051]
扫描方式为多重反应检测;
[0052]
bh4-13
c 15
n3用于定量分析的离子对为:m/z246.1
→
m/z170.2。
[0053]
在某些实施方案中,等度洗脱的程序为:
[0054]
总时间(min)流动相a(%)流动相b(%)0.0093.07.03.0093.07.0
[0055]
在某些实施方案中,步骤s2中,采用内标法,以bh4与内标bh4-13c15
n3的峰面积比值代入标准曲线方程计算所述血浆样品中的bh4的浓度。
[0056]
在某些实施方案中,所述标准曲线方程的建立包括以下步骤:
[0057]
取190μl空白血浆8份置于1.5ml离心管中,以储备液的形式添加10μl浓度分别为1.00ng/ml、2.00ng/ml、5.00ng/ml、10.0ng/ml、50.0ng/ml、100ng/ml、200ng/ml、300ng/ml的bh4溶液至标样1、标样2、标样3、标样4、标样5、标样6、标样7、标样8中,分别取标样1、标样2、标样3、标样4、标样5、标样6、标样7、标样8、零浓度样本50μl于96深孔板中,添加5μl的第一溶液,再添加5μl的0.2ng/μl内标标准溶液,然后添加25μl的第二溶液于96深孔板中并涡旋混匀;添加500μl meoh于96深孔板中并涡旋混合1分钟以沉淀样品中的蛋白质;于4℃,以3000rpm离心10分钟,取150μl上清液转移至装有800μl第三溶液的96深孔板中并涡旋混匀,于4℃,3000rpm,离心5分钟后作为测试样品待检测。
[0058]
在某些实施方案中,分别取15μl标准样品注入高效液相色谱-串联质谱仪中,检测样品中bh4及bh4-13
c 15
n3的色谱峰,并据此得到标准曲线,以用于计算所述血浆中的bh4的浓度。
[0059]
与现有技术相比,本发明具有以下优点:
[0060]
(1)预处理方法简便,通过一步有机溶剂加抗氧化剂萃取,适用于常规测定;
[0061]
(2)专属性强:在本实验所采用的色谱条件下,bh4保留时间为1.872min左右,,内标bh4-13
c 15
n3保留时间为1.869min左右。bh4及bh4-13
c 15
n3的峰型良好,无杂峰干扰测定,基线平稳;
[0062]
(3)灵敏度高:血浆最低定量限为1.00ng/ml,能准确测定血浆中bh4的浓度,灵敏度高,特异性强;
[0063]
(4)本发明方法快速、准确、灵敏度高、操作简便,为bh4的血药浓度测定提供依据。本方法的血浆标准曲线线性范围为1.00-300ng/ml,批内和批间精密度rsd均在15%之内。
附图说明
[0064]
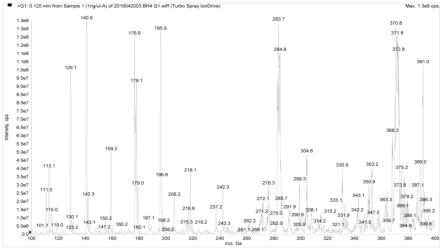
图1为分析物bh4和内标bh4-13
c 15
n3离子扫描图(1.a为分析物bh4 q1扫描图,1.b为分析物bh4 q3扫描图,1.c为内标bh4-13
c 15n3 q1扫描图,1.d为内标bh4-13
c 15n3 q3扫描图);
[0065]
图2为hplc-ms/ms法测得的bh4在人血浆中的标准曲线;
[0066]
图3为人空白血浆的hplc-ms/ms图;
[0067]
图4为人空白血浆加入bh4的hplc-ms/ms图。
具体实施方式
[0068]
下面通过实施方式对本发明进行进一步详细的说明。
[0069]
实施例1实验材料与分析设备
[0070]
bh4(分析物):clearsynth inspiring research
[0071]
bh4-13
c 15
n3(内标):clearsynth inspiring research
[0072]
使用试剂见下表1:
[0073]
表1试剂明细
[0074][0075][0076]
注:亦可使用相同级别或更高级别的试剂
[0077]
使用分析设备见下表2:
[0078]
表2使用设备明细
[0079]
组件种类制造商binary pump(二元泵)ad pumpshimadzudegasser(脱气器)degassershimadzucolumn oven(恒温柱箱)ad column ovenshimadzuautosampler(自动取样器)ac autosamplershimadzusample rack(样本架)rack changershimadzumass spectrometer(质谱仪)triple quad 6500+sciexdata processor(数据处理器)analyst(software)sciex
[0080]
相同的lc-ms/ms系统亦可被使用。
[0081]
实施例2测定条件
[0082]
1、液相色谱条件
[0083]
色谱柱:evo c185μm,柱规格为4.6
×
100mm;色谱柱温:30℃;流动相a:h2o/1m hcoonh4=100/0.1;流动相b:acn;洗液:acn/meoh的体积比为50/50;自动进样器温度为4℃;等度洗脱,流速为0.6000ml/min,进样量为15μl,分析时间为3.00min;
[0084]
表3等度洗脱程序
[0085]
总时间(min)流动相a(%)流动相b(%)0.0093.07.03.0093.07.0
[0086]
2、质谱条件
[0087]
bh4条件为:
[0088]
离子源采用电喷雾离子源,喷雾电压为2800v,雾化温度为650℃,喷雾气压力为85psi,辅助加热气压力为85psi,气帘气压力为20psi,碰撞气压力为high,去簇电压分别为20ev的bh4;碰撞室入口电压分别为10ev的bh4;碰撞电压分别为26ev的bh4;碰撞室出口电压分别为10ev的bh4;正离子方式检测;扫描方式为多重反应检测;
[0089]
bh4用于定量分析的离子对为:m/z242.3
→
m/z166.1;
[0090]
bh4-13
c 15
n3条件为:
[0091]
离子源采用电喷雾离子源,喷雾电压为2800v,雾化温度为650℃,喷雾气压力为85psi,辅助加热气压力为85psi,气帘气压力为20psi,碰撞气压力为high,去簇电压分别为20ev的bh4;碰撞室入口电压分别为10ev的bh4-13
c 15
n3;碰撞电压分别为26ev的bh4-13
c 15
n3;碰撞室出口电压分别为10ev的bh4-13
c 15
n3;正离子方式检测;扫描方式为多重反应检测;
[0092]
bh4-13
c 15
n3用于定量分析的离子对为:m/z246.1
→
m/z170.2。
[0093]
实施例3试验过程
[0094]
1、bh4标准溶液的配制
[0095]
bh4标准溶液的配制:精密称取bh4(分析物)2.00mg,加入5%vc in(0.1m hcl in meoh/h2o=50/50(w/v))溶解至0.100mg/ml,5%vc in(0.1m hcl in meoh/h2o=50/50(w/v))依次稀释配制bh4标准溶液,具体稀释浓度见下表4:
[0096]
表4 bh4标准溶液配制浓度
[0097]
来源溶液(ng/ml)来源溶液体积(μl)溶剂体积(μl)最终浓度(ng/ml)100000a12018806000100000a8019204000100000a4019602000100000a20198010002000200180020020001001900100200040196040.0200020198020.0100000a10019005000100000a601940300050002401760600500024197660.050008199220.0
[0098]
a:直接从bh4制备而成
[0099]
bh4标准溶液于不使用时储存于棕色玻璃容器及冰箱(-20℃)保存,体积可视需要依比例增加或减少。
[0100]
2、bh4-13
c 15
n3内标标准溶液的配制
[0101]
bh4-13
c 15
n3内标标准溶液的配制:精密称取bh4-13
c 15
n3(内标)1.00mg,加入5%vc in(0.1m hcl in meoh/h2o=50/50(w/v))溶解至0.050mg/ml,5%vc in(0.1m hcl in meoh/h2o=50/50(w/v))依次稀释配制bh4-13
c 15
n3标准溶液,具体稀释浓度见下表5:
[0102]
表5 bh4-13
c 15
n3标准溶液配制浓度
[0103]
来源溶液(ng/μl)来源溶液体积(μl)最终体积(ml)最终浓度(ng/μl)50b4001000.2c[0104]
b:直接从bh4-13
c 15
n3(内标)制备而成
[0105]
c:用于样本制备步骤
[0106]
3、线性试验
[0107]
将空白血浆于室温环境放入水浴解冻;转移190μl的空白血浆10份至96深孔板中(每一个标准曲线样本、空白样本-00及零浓度样本-0),依下表6所列,分别精密加入不同浓度的bh4标准溶液10μl或稀释溶液配制每一个样本并混匀,配成不同浓度的含药血浆,按“血浆样品预处理”操作。以峰面积比y对血药浓度x作回归计算,结果见图2和表7及表8。以y对血药浓度x做回归计算,得回归方程y=0.0571x+0.00316,相关系数(r)为0.9996,拟合度(r2)为0.9992。权重系数w=1/x2,按该方法测得的bh4的血药浓度的最低定量限为:1.00ng/ml。
[0108]
表6 bh4标准曲线配制浓度
[0109][0110][0111]
a:分析物的稀释溶液:5%vc in(0.1m hcl in meoh/h2o=50/50(w/v))
[0112]
表7 hplc-ms/ms法测得的bh4在人血浆中的标准曲线(n=14)
[0113]
检测批次编号斜率截距rlloquloq拟合方程10.05580.001740.99981.013302.876y=0.0558x+0.0017420.05560.002110.99980.995309.607y=0.0556x+0.0021130.0560.001270.99961.004306.105y=0.056x+0.0012740.0567-0.00230.99971.002301.075y=0.0567x-0.002350.05720.002570.99991.003308.395y=0.0572x+0.0025760.05490.002530.99980.993303.575y=0.0549x+0.0025370.05730.004750.99971.013311.002y=0.0573x+0.0047580.05910.00180.99931.021315.440y=0.0591x+0.001890.05710.004020.99931.005316.233y=0.0571x+0.00402100.0570.006150.99971.011308.171y=0.057x+0.00615110.05720.001160.99981.008306.530y=0.0572x+0.00116120.05850.002080.99941.006313.713y=0.0585x+0.00208130.05610.01190.99931.023306.813y=0.0561x+0.0119140.06060.004520.99890.959293.360y=0.0606x+0.00452
平均值0.05710.003160.99961.004307.350nasd0.00150.003220.00030.0156.057na%cv2.6101.90.01.52.0nan1414141414na
[0114]
表8:标准曲线的回算浓度
[0115]
[0116][0117]
4、准确度和精密度
[0118]
将空白血浆于室温环境解冻;转移适当体积的空白血浆至适当的容器并添加bh4标准溶液制备5种不同浓度的含药血浆质控样品(lloq qc、lqc、gmqc、mqc、hqc)及一条随行标准曲线,按“血浆样品预处理”操作,质控样品制备如下表7所示。每天做一批及一条随行标准曲线,连续做3天,共3批,第一批、第三批分别做6份样品,第二批做14个样品,计算bh4和内标bh4-13
c 15
n3的峰面积比,代入当天的标准曲线中求得实测浓度,由实测浓度计算批内于批间精密度,实测浓度与理论浓度的比值即为准确度,结果见表10。bh4血浆样品批间、批内精密度、准确度在15%以内符合要求。
[0119]
表9质控样品配制浓度
[0120][0121]
依每一分析批所需,分装足够的体积至已标示的样本瓶中并储存于理论温度-20℃。体积可视需要依比例增加或减少。
[0122]
表10 hplc-ms/ms法测定血浆中bh4的批内、批间精度和准确度
[0123]
[0124][0125]
5、干扰性
[0126]
使用6个不同来源(每个来源一个)的空白血浆样品和3个不同来源(每个来源1个)的空白溶血血浆样品,将9个不同来源的空白血浆样品于同一分析批依样本制备步骤制备及分析,来评价不同空白血浆对bh4分析物及内标bh4-13
c 15
n3的干扰。
[0127]
将一个混合基质中的零浓度样品(0)(只添加内标不添加分析物)和一个在混合基质中只添加uloq不添加内标的样品(uloq without is)依样本制备步骤制备及分析,分别评价内标对分析物的干扰和分析物对内标的干扰。
[0128]
9个不同来源的空白血浆样本制备分析后,在符合bh4保留时间处的干扰峰响应均低于该分析批的标准曲线中定量下限样本的bh4响应的20.0%,结果见表11。结果表明该分
析方法对bh4的分析具有专属性。
[0129]
9个不同来源空白血浆样本制备分析后,在符合内标保留时间处的干扰峰响应均低于该分析批的标准曲线中定量下限样本的内标响应的5.0%,结果见表12。结果表明该分析方法对内标的分析具有选择性。
[0130]
零浓度样品(0)制备分析后,在符合bh4保留时间处的干扰峰响应均低于该分析批的标准曲线中定量下限样品的bh4响应的20.0%,结果见表13。结果表明在分析过程中内标对bh4的干扰可忽略。
[0131]
uloq without is制备分析后,在符合内标保留时间处的干扰峰响应均低于该分析批的标准曲线中定量下限样品的bh4-13c 15n3响应的5.0%,结果见表14。结果表明在分析过程中沙丙蝶呤对bh4-13c 15n3的干扰可忽略。
[0132]
表11 9个不同来源空白血浆对bh4分析物的干扰性数据对比表
[0133][0134][0135]
表12 9个不同来源空白血浆对内标的干扰性数据对比表
[0136][0137]
表13内标对分析物的干扰性数据对比表
[0138][0139]
表14分析物对内标的干扰性数据对比表
[0140][0141]
从表11和表12中可以看出,不同人体的空白血浆对bh4的检测结果没有造成干扰;从表13可以看出内标对分析物的检测结果没有造成干扰;从表14可以看出分析物对内标的检测结果没有造成干扰。因此,该方法可以用于检测不同人体血浆中的bh4浓度。
[0142]
6、回收率
[0143]
将使用混合血浆配制的lqc、mqc和hqc来计算分析物的回收率。对于lqc、mqc和hqc的各3个平行样品和9个db进行提取。db提取后加入分析物和内标,使它们在提取后加入的db提取物中的浓度与提取的lqc、mqc和hqc样品相同。通过比较来自于qc的分析物和内标的峰面积与db提取后加入的分析物和内标的平均峰面积来计算提取回收率。从表15中可以看出,在分析物的每个浓度水平,分析物峰面积的%cv和总体%cv均在15.0%以内,回收率为99.1%,表明使用该前处理方法bh4的提取回收率高。从表16中可以看出,内标的全部提取样品的响应值%cv和全部未提取样品的响应值%cv均在15%以内,内标的平均提取回收率为92.3。表明使用该前处理方法bh4-13
c 15
n3的提取回收率高。
[0144]
表15 bh4分析物的提取回收率
[0145][0146]
表16内标的提取回收率
[0147][0148]
7、基质效应
[0149]
7.1空白基质效应
[0150]
处理来自至少6个不同来源的空白基质样品。在提取db后加入分析物,确保它们在处理后db中的浓度(每个浓度每个来源1个样品)与处理后的lqc、mqc和hqc样品浓度相同;准备包含分析物的溶液,使最终浓度与处理后的lqc、mqc和hqc样品浓度相同,每个浓度6个平行,结果见表17,分析物峰面积比%cv均在15%以内,表明不存在空白基质效应问题。
[0151]
表17 bh4分析物的空白基质效应
[0152][0153][0154]
7.2溶血基质效应
[0155]
为考察溶血基质中的基质效应,配制一份在溶血基质中lqc和hqc,每个浓度5个平行,结果见表18,分析物峰面积比%cv均在15%以内,表明不存在溶血基质效应问题。
[0156]
表18 bh4分析物的溶血基质效应
[0157][0158]
7.2高脂基质效应
[0159]
为考察高脂基质中的基质效应,配制一份在高脂基质中lqc和hqc,每个浓度5个平行,结果见表19,分析物峰面积比%cv均在15%以内,表明不存在高脂基质效应问题。
[0160]
表19 bh4分析物的高脂基质效应
[0161][0162]
综上所述:本发明提供了一种预处理方法简便的血浆中bh4浓度的测定方法,采用一步有机溶剂加抗氧化剂萃取法,适用于常规测定;同时,在本实验所采用的色谱条件下,bh4保留时间为1.872min左右,内标bh4-13
c 15
n3保留时间在1.869min左右,bh4和内标bh4-13
c 15
n3峰形良好,无杂峰干扰测定,基线平稳;本方法具有较高的特异性,能准确测定血浆中bh4的浓度,灵敏度较高,血浆最低定量限为1.00ng/ml;同时,本发明方法快速、准确、灵敏度高、操作简便,为bh4的血药浓度测定提供依据。本方法的血浆标准曲线线性范围1.00-300ng/ml,批内和批间精密度rsd在
±
15%以内,分析物提取回收率高且不存在基质效应。
[0163]
以上表述仅为本发明的优选方式,应当指出,对本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些也应视为发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1