一种基于酶解法进行多肽药物样品中杂质定量分析的方法与流程
1.本技术涉及一种基于酶解法进行多肽药物样品中杂质定量分析的方法,属于多肽药物分析技术领域。
背景技术:
2.多肽由于其结构的复杂性,其合成过程中需要控制的杂质非常多,包括非对映异构体、插入肽、缺失肽、断裂肽等。常规的杂质分析方法有液相、质谱分析等,也有基于多肽水解、衍生后测定多肽中氨基酸手性的gc-ms和lc-ms方法。液相分析对于长肽合成中一些消旋杂质和缺失杂质的分离会很困难,质谱对于多肽的手性杂质无法分析,而多肽中氨基酸的手性分析涉及到水解、衍生,过程较为复杂,且处理过程也会产生消旋,定量限一般在0.1%左右,其准确性对于操作的要求也非常高。
技术实现要素:
3.根据本技术的一个方面,提供一种基于酶解法进行多肽药物样品中杂质定量分析的方法。所述方法将多肽药物样品酶解成短肽再进行分析,难度大大降低,可以检测样品中杂质的准确含量,为多肽合成的工艺控制提供有力保障。
4.一种基于酶解法进行多肽药物样品中杂质定量分析的方法,其特征在于,所述方法包括以下步骤:
5.用蛋白酶将多肽药物样品酶解得到酶解产物,采用液相色谱法对酶解产物进行目标杂质含量测定。
6.可选地,所述多肽药物样品中的主成分选自生长抑素、索马鲁肽中的任一种;
7.所述目标杂质选自插入肽杂质di-gly
2-生长抑素、消旋杂质d-ala
26-索马鲁肽中的任一种。
8.可选地,所述蛋白酶选自胰蛋白酶、glu-c蛋白酶、v8蛋白酶中的任一种;
9.优选地,所述将多肽药物样品酶解为将多肽药物样品酶解至杂质片段含有2~15个氨基酸,杂质片段对应的主成分片段含有2~15个氨基酸。
10.可选地,当主成分为生长抑素,目标杂质为插入肽杂质di-gly
2-生长抑素时,所述将多肽药物样品酶解为将多肽药物样品酶解至杂质片段如式i所示,杂质片段对应的主成分片段如式ii所示;
[0011][0012][0013]
可选地,当主成分为索马鲁肽,目标杂质为消旋杂质d-ala
26-索马鲁肽时,所述将多肽药物样品酶解为将多肽药物样品酶解至杂质片段如式iii所示,杂质片段对应的主成
分片段如式iv所示;
[0014]
ile
23-ala
24-trp
25-leu
26-val
27-arg
28
ꢀꢀꢀ
式iii;
[0015]
ile
23-dala
24-trp
25-leu
26-val
27-arg
28
ꢀꢀꢀ
式iv。
[0016]
可选地,所述方法包括以下步骤:
[0017]
(s1)将多肽药物样品溶液和蛋白酶溶液混合,放置,得到酶解产物;
[0018]
(s2)将酶解产物进行hplc分离、检测,获得色谱图,根据所述色谱图得到所述杂质的含量。
[0019]
可选地,(s1)中,所述多肽药物样品溶液的浓度为0.1~5mg/ml;
[0020]
所述蛋白酶溶液的浓度为0.1~5mg/ml;
[0021]
所述多肽药物样品溶液和蛋白酶溶液的体积比为100:1~10。
[0022]
可选地,所述多肽药物样品溶液的浓度和所述蛋白酶溶液的浓度独立地为0.1、0.5、1、3、5mg/ml中的任意一个值或任意两个值之间的范围值。
[0023]
可选地,所述多肽药物样品溶液和蛋白酶溶液的体积比为100:1、100:2.5、100:5、100:7、100:10中的任意一个值或任意两个值之间的范围值。
[0024]
可选地,(s1)中,所述放置的温度为27~47℃。
[0025]
可选地,所述放置的温度为27~47℃为27、33、37、40、45、47℃中的任意一个值或任意两个值之间的范围值。
[0026]
可选地,(s1)中,所述放置的时间为0.5~24h。
[0027]
可选地,所述放置的时间为0.5、1、4、8、10、15、20h中的任意一个值或任意两个值之间的范围值。
[0028]
可选地,(s2)中,hplc分离的色谱柱选自c18柱中的任一种。
[0029]
可选地,(s2)中,当主成分为生长抑素,目标杂质为插入肽杂质di-gly
2-生长抑素时,hplc分离的条件包括:
[0030]
流速0.2~2ml/min,
[0031]
柱温25~45℃;
[0032]
流动相a为0.02~0.05mol/l na2hpo4水溶液,流动相b为乙腈;
[0033]
分离的洗脱程序为:
[0034]
第0~2分钟中,流动相中流动相a的体积占比为95%,和流动相b的体积占比为5%;
[0035]
第2~52分钟中,流动相中流动相a的体积占比由95%变化至85%,和流动相b的体积占比由5%变化至15%;
[0036]
第52~62分钟中,流动相中流动相a的体积占比由85%变化至60%,和流动相b的体积占比由15%变化至40%;
[0037]
第62~63分钟中,流动相中流动相a的体积占比由60%变化至95%,和流动相b的体积占比由40%变化至5%;
[0038]
第63~72分钟中,流动相中流动相a的体积占比为95%,和流动相b的体积占比为5%;
[0039]
可选地,(s2)中,当主成分为索马鲁肽,目标杂质为消旋杂质d-ala
26-索马鲁肽时,hplc分离的条件包括:
[0040]
流速0.2~2ml/min,
[0041]
柱温25~45℃;
[0042]
流动相a为0.02%~0.2%tfa水溶液,流动相b为0.02%~0.2%tfa的乙腈溶液;
[0043]
分离的洗脱程序为:
[0044]
第0~60分钟中,流动相中流动相a的体积占比由90%变化至10%,和流动相b的体积占比由10%变化至90%;
[0045]
第60~61分钟中,流动相中流动相a的体积占比由10%变化至90%,和流动相b的体积占比由90%变化至10%;
[0046]
第61~70分钟中,流动相中流动相a的体积占比为90%,和流动相b的体积占比为10%。
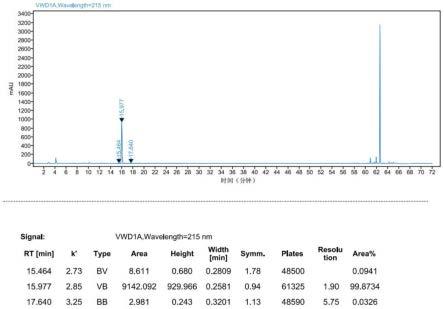
[0047]
作为一种实施方案,本发明提供一种基于酶解法进行多肽药物中杂质定量分析的方法,具体地,该检测方法是采用液相色谱法对酶解后的多肽片段进行目标杂质含量测定,对酶解后的片段进行目标杂质分析,方法开发简单,检测效率高,灵敏度高,检测准确度和重复性好。
[0048]
多肽(特别是长肽)在合成过程中常产生普通方法下很难分离的杂质,可以根据多肽的序列,采用特异性的酶(例如胰蛋白酶、glu-c蛋白酶、v8蛋白酶等)将长肽酶解成短的片段,再进行主成分片段与杂质片段的分离,可应用于多肽的杂质定量分析,检测限可达到0.02%。
[0049]
一种多肽中目标杂质定量分析的方法,其特征在于,将结构复杂的多肽酶解成相对简单的肽段,经过普通液相方法即可对目标杂质进行定量分析。
[0050]
本发明的目的是提供一种多肽中杂质分析的方法,以解决现有技术的不足。
[0051]
本技术要解决的技术问题为:针对常规方法下很难分离、定量的多肽杂质,将其酶解成短的片段肽,降低杂质分析方法的开发难度。
[0052]
为解决上述技术问题,本技术提供的技术方案:
[0053]
一种多肽中目标杂质定量分析的方法,将结构复杂的多肽酶解成相对简单的肽段,经过普通液相分析方法对目标杂质进行定量分析。包括如下步骤:
[0054]
步骤1、根据多肽序列,采用特定的蛋白酶将多肽和多肽杂质酶解成合适的片段肽;
[0055]
步骤2、通过对比多肽和多肽杂质酶解后的色谱图差异,确定目标肽段;如有必要可以对酶解后的片段进行质谱分析,确认目标杂质所在的片段肽;
[0056]
步骤3、合成目标片段肽(包括原序列以及杂质序列);
[0057]
步骤4、若需要,再进行简单的方法优化,使原序列的片段肽和杂质序列的片段肽能够较好地分离;
[0058]
步骤5、将多肽中杂质加标后酶解,进行检测方法准确度的确认;
[0059]
步骤6、采用杂质外标法(或面积归一化法)对目标杂质进行定量分析。
[0060]
可选地,步骤1中蛋白酶为胰蛋白酶、glu-c蛋白酶等,溶剂为20mmol/l的磷酸氢二钠缓冲液,并用磷酸调ph为8.15。
[0061]
可选地,步骤2酶解后的溶液取上清液,用c18除盐枪头将肽除盐,即可进行质谱分析。
[0062]
可选地,步骤4所采用的方法为反相高效液相色谱,色谱柱采用常用的c18柱即可。
[0063]
本技术提供了一种新的多肽杂质分析方法。某些多肽杂质在常规方法下很难与主成分进行分离,将其酶解成短肽再进行分析的难度大大降低,可以检测产品中该杂质的准确含量,为多肽合成的工艺控制提供有力保障。
[0064]
本技术能产生的有益效果包括:
[0065]
本技术所提供的基于酶解法进行多肽药物样品中杂质定量分析的方法,通过对多肽药物样品进行酶解处理,可以解决有效常规分析方法中多肽杂质难以与主成分分离的问题,从而可以简单、有效地对多肽杂质进行定量分析。
附图说明
[0066]
图1是生长抑素酶解后的色谱图;
[0067]
图2是插入肽杂质di-gly
2-生长抑素酶解后的色谱图;
[0068]
图3是生长抑素肽段质谱图(分子量932.6);
[0069]
图4是生长抑素肽段质谱图(分子量989.6);
[0070]
图5是生长抑素两个理论肽段结构图;
[0071]
图6是生长抑素样品酶解后的色谱图(含分离度);
[0072]
图7是生长抑素未采用酶解法前最佳色谱条件下的色谱图;
[0073]
图8是di-gly
2-生长抑素未采用酶解法前最佳色谱条件下的色谱;
[0074]
图9是索马鲁肽酶解后的色谱图;
[0075]
图10是消旋杂质d-ala
26-索马鲁肽酶解后的色谱图;
[0076]
图11是索马鲁肽酶解后的质谱图;
[0077]
图12是两个目标片段肽对照品分离色谱图;
[0078]
图13是索马鲁肽酶解后两个目标片段肽分离色谱图(含分离度);
[0079]
图14是消旋杂质d-ala
26-索马鲁肽定量限色谱图;
[0080]
图15是消旋杂质d-ala
26-索马鲁肽线性关系图;
[0081]
图16是索马鲁肽样品酶解后色谱图;
[0082]
图17是未采用酶解法前d-ala
26-索马鲁肽分离的色谱图(酸性流动相);
[0083]
图18是未采用酶解法前d-ala
26-索马鲁肽分离的色谱图(碱性流动相)。
具体实施方式
[0084]
下面结合实施例详述本技术,但本技术并不局限于这些实施例。
[0085]
如无特别说明,本技术的实施例中的原料均通过商业途径购买。
[0086]
实施例1
[0087]
一种分析生长抑素(序列如下)中插入肽杂质di-gly
2-生长抑素的方法,包括如下步骤:
[0088][0089]
步骤1、移取1mg/ml生长抑素溶液(取生长抑素适量,用50mmol的碳酸氢铵溶液稀释制成1mg/ml的溶液)1500μl置西林瓶中,移取胰蛋白酶溶液(取胰蛋白酶适量,用50mmol的碳酸氢铵溶液稀释制成1mg/ml的溶液)75μl加入(即,生长抑素溶液和胰蛋白酶溶液的体
积比为100:5),混匀,37℃条件下放置4小时,加入10%三氟乙酸30μl终止反应,4000转离心10min,取上清液待测。插入肽杂质di-gly
2-生长抑素同法配制。
[0090]
步骤2、通过高效液相色谱仪采用反相色谱法对其进行分析。使用安捷伦1260高效液相色谱仪紫外检测器,波长设为215nm,色谱柱选用agilent eclipe xdb-c18 4.6*250mm,5μm,流动相a为0.1%tfa水溶液,流动相b为0.1%tfa的乙腈溶液。按下表1进行梯度洗脱,流速1ml/min,柱温35℃,进样体积20μl。
[0091]
表1
[0092]
时间(分钟)流动相a%流动相b%09552955325953395540955
[0093]
生长抑素酶解后的图谱如图1所示;插入肽杂质di-gly
2-生长抑素酶解后的图谱如图2所示。
[0094]
酶解产物主要检测到两个片段,对比发现,生长抑素图中保留时间9.236分钟的峰与插入肽杂质di-gly
2-生长抑素图中保留时间9.188分钟的峰存在差异,初步判定这两个有差异的片段为目标肽段,且在该色谱条件下已经可以进行分离。
[0095]
使用安捷伦1290-6460qqq高效液相色谱-串联质谱仪对其进行分析,离子源为esi,选择正离子模式,流动相为0.1%甲酸-乙腈=1∶1。经分析,这两个肽段的分子量分别为932.6和989.6(见图3和图4)。与两个理论片段肽(见图5)的分子量一致。
[0096]
步骤3、定向合成上述两个片段肽,进行定位确认。
[0097]
步骤4、在步骤2中的tfa体系条件下,两个目标肽段虽然已经能够分离,但未达到基线分离,对于杂质的定量仍有一定的困难。因此,进行了简单的方法优化,确定方法如下:使用安捷伦1260高效液相色谱仪紫外检测器,波长设为215nm,色谱柱选用ymc-pack ods-aq c18 4.6*250mm,3μm,流动相a为0.05mol/l na2hpo4水溶液(ph6.5),流动相b为乙腈。按下表2进行梯度洗脱,流速1ml/min,柱温40℃,进样体积20μl。
[0098]
表2
[0099]
时间(分钟)流动相a%流动相b%095529555285156260406395572955
[0100]
步骤5、通过多肽中杂质加标进行方法准确度的确认(未开展);
[0101]
步骤6、采用上述方法对生长抑素样品进行分析,按照步骤1中的方法对生长抑素样品进行酶切,按照步骤4对酶切后的产物进行分离,采用面积归一化法对目标杂质进行定量分析。
[0102]
在该色谱条件下,生长抑素样品在酶解后可以检测到插入肽杂质di-gly
2-生长抑素,含量为0.09%,分离度达到1.9,实现基线分离(见图6),可以实现杂质的定量分析。
[0103]
对比例1
[0104]
在未对生长抑素进行酶解前,尝试在多种色谱条件下(反相液相色谱各种体系、离子交换色谱等)分离插入肽杂质di-gly
2-生长抑素,均未找到合适的方法。在最佳色谱条件下,两者的保留时间均为38.2分钟,未能分析,生长抑素图谱如图7所示,插入肽杂质di-gly
2-生长抑素图谱如图8所示。最佳色谱条件如下所示:
[0105]
安捷伦1260高效液相色谱仪紫外检测器,波长设为215nm,色谱柱选用welchaq-c18,4.6
×
250mm,3μm,流动相a为50mmol/l的磷酸氢二钠溶液(称取无水磷酸氢二钠7.098g,加水1000ml,加磷酸调节ph值至6.5),流动相b为乙腈。按下表3进行梯度洗脱,流速1ml/min,柱温40℃,样品浓度2μg/ml,进样体积30μl。
[0106]
表3
[0107][0108][0109]
实施例2
[0110]
一种分析索马鲁肽中消旋杂质d-ala
26-索马鲁肽的方法,包括如下步骤:
[0111]
步骤1、移取1mg/ml索马鲁肽溶液(取索马鲁肽适量,用50mmol的碳酸氢铵溶液稀释制成1mg/ml的溶液)3000μl置于西林瓶中,移取胰蛋白酶溶液(取胰蛋白酶适量,用50mmol的碳酸氢铵溶液稀释制成1mg/ml的溶液)75μl加入(即,索马鲁肽溶液和胰蛋白酶溶液的体积比为100:2.5),混匀,37℃条件下放置1小时,加入10%三氟乙酸60μl终止反应,4000转离心10min,取上清液待测。消旋杂质d-ala
26-索马鲁肽同法配制。
[0112]
步骤2、通过高效液相色谱仪采用反相色谱法对其进行分析。使用安捷伦1260高效液相色谱仪紫外检测器,波长设为215nm,色谱柱选用waters cortecs c18 4.6*150mm 2.7μm,流动相a为0.05%tfa水溶液,流动相b为0.05%tfa的乙腈溶液。按下表4进行梯度洗脱,流速1ml/min,柱温35℃,进样体积20μl。
[0113]
表4
[0114]
时间(分钟)流动相a%流动相b%09010601090619010709010
[0115]
索马鲁肽酶解后的图谱如图9所示。
[0116]
消旋杂质d-ala
26-索马鲁肽酶解后的图谱如图10所示。
[0117]
酶解产物检测到多个片段肽。通过液质联用仪对其进行分析。使用安捷伦1290-6460qqq高效液相色谱-串联质谱仪对其进行分析,离子源为esi,选择正离子模式,流动相为0.1%甲酸-乙腈=1∶1,对酶解得到的主要肽段进行质谱分析,发现保留时间11.324分钟的色谱峰包含了目标肽段ile
23-ala
24-trp
25-leu
26-val
27-arg
28
(如seq id no:1所示),分子量706.8da(见图11)。
[0118]
步骤3、定向合成两个目标片段肽ile
23-ala
24-trp
25-leu
26-val
27-arg
28
和ile
23-dala
24-trp
25-leu
26-val
27-arg
28
,进行定位确认,确认了保留时间11.116分钟的色谱峰为目标肽段ile
23-ala
24-trp
25-leu
26-val
27-arg
28
,12.620分钟的色谱峰为目标肽段ile
23-dala
24-trp
25-leu
26-val
27-arg
28
,且在原色谱条件下已能较好分离(见图12)。
[0119]
步骤4、在目前色谱条件下,索马鲁肽和消旋杂质d-ala
26-索马鲁肽酶解后的两个目标肽段已能很好地分离,分离度达到12.79,实现基线分离(详见图13),可以实现杂质的定量分析。
[0120]
步骤5、对酶解法测定索马鲁肽中消旋杂质d-ala
26-索马鲁肽的方法进行验证,验证内容如下:
[0121]
1、定量限
[0122]
定量限浓度下(相对于样品浓度的0.013%)信噪比为25(见图14),且定量限溶液连续6次进样,目标峰峰面积的rsd不大于10.0%,符合要求,详细数据见下表5。
[0123]
表5
[0124][0125]
2、线性与范围
[0126]
线性通过覆盖6个杂质限度浓度水平(20%,50%,80%,100%,150%,200%)的线性回归方程来考察,按最小二乘法计算线性回归方程,结果如表6所示,相关系数(r)不小于0.990,截距比限度响应值不大于10.0%;响应因子的rsd不大于10.0%,符合要求。
[0127]
表6
[0128][0129]
线性关系图如图15所示。
[0130]
3、准确度
[0131]
准确度用回收率说明:加入已知量的杂质对照品(50%至150%范围内的三个浓度水平,每个浓度水平测定2次),结果如表7所示,杂质在各浓度水平下的回收率应在80.0%~120.0%范围内,rsd不大于10.0%,符合要求。
[0132]
表7
[0133]
[0134][0135]
步骤6、采用上述方法对索马鲁肽样品进行分析:按照步骤1中的方法对索马鲁肽样品进行酶切,按照步骤2对酶切后的产物进行分离,采用面积归一化法对目标杂质进行定量分析,待测样品中未检测到目标杂质,详见图16。
[0136]
对比例2
[0137]
在未对索马鲁肽进行酶解前,尝试在多种色谱条件(包括反相各种体系、离子交换色谱等)下分离消旋杂质d-ala
26-索马鲁肽,均未找到合适的方法。在碱性流动相体系条件下索马鲁肽加1%目标杂质的图谱见图17,在酸性流动相体系条件下索马鲁肽加1%目标杂质的图谱见图18。
[0138]
碱性流动相体系色谱条件:
[0139]
使用安捷伦1260高效液相色谱仪紫外检测器,波长设为215nm,色谱柱选用waters xbridge peptide beh c18 4.6*150mm 3.5μm,流动相a为50mm碳酸氢铵缓冲盐(ph10.0),流动相b为乙腈。按下表8进行梯度洗脱,流速1ml/min,柱温35℃,样品浓度1mg/ml,进样体积20μl。
[0140]
表8
[0141][0142][0143]
酸性流动相体系色谱条件:
[0144]
使用安捷伦1260高效液相色谱仪紫外检测器,波长设为215nm,色谱柱选用waters cortecs c18 4.6*150mm 2.7μm,流动相a为1.0%磷酸三乙胺缓冲盐(ph约3.5),流动相b为乙腈。按下表9进行梯度洗脱,流速1ml/min,柱温35℃,样品浓度为1mg/ml,进样体积20μl。
[0145]
表9
[0146]
时间(分钟)流动相a%流动相b%06436485842522080582080596436706436
[0147]
以上所述,仅是本技术的几个实施例,并非对本技术做任何形式的限制,虽然本技术以较佳实施例揭示如上,然而并非用以限制本技术,任何熟悉本专业的技术人员,在不脱离本技术技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1