一种检测酶活性的纳米试剂盒耦合电喷雾电离质谱的装置、检测方法及其应用
1.本技术涉及单细胞检测分析领域,具体涉及一种耦合电喷雾电离质谱的纳米试剂盒、检测方法及应用。
背景技术:
2.血管紧张素转换酶2(ace2)是一种i型整合膜蛋白,可作为羧肽酶将血管紧张素ii水解为血管紧张素。血管紧张素转换酶2(ace2)不仅是一种酶,而且是严重急性呼吸综合征冠状病毒2(sars-cov-2)细胞膜上的功能性受体。众所周知,ace2在高血压、心功能、心功能和糖尿病中起重要作用。
3.目前的研究表明,ace2是sars-cov-2的特异性受体,介导病毒进入宿主细胞。因此,对ace2的全面研究,包括其催化活性,对于充分了解其生理作用非常重要。目前已经开发了许多方法来确定细胞群中的ace2活性,但是,在单细胞水平上的测量仍然具有挑战性。考虑到细胞异质性在了解ace2作用中的重要性,需要建立一个稳健的策略来测量ace2在单个活细胞中的活性。
4.目前,基于探针的光学方法在单个活细胞中分析酶活性中很流行。尽管这种策略是稳定的,但识别酶的特异性探针的设计和合成是复杂且耗时的。此前,现有技术也有基于纳米试剂盒的检测策略,用于测量单个活细胞中的酶活性。在已公开的方法中,将携带试剂盒成分的纳米移液管插入活细胞中。将这些成分以电化学方式泵入细胞,与目标酶反应生成过氧化氢的产物和副产物。通过使用纳米微毛细管管孔口处的环形电极电化学检测过氧化氢,确定了一个细胞中目标酶的活性。这种方法可以通过选择合适的试剂盒来适应多种酶的测量,但是,需要过氧化氢的副产物,这限制了这种基于纳米试剂盒的分析的应用。
技术实现要素:
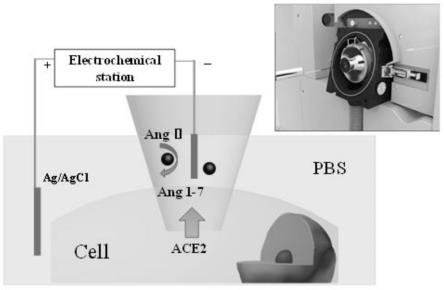
5.为解决上述技术问题,本技术提供一种检测酶活性的纳米试剂盒耦合电喷雾电离质谱的装置,所述装置包括纳米试剂盒、电化学工作站、操作系统和电喷雾电离质谱,其中,
6.所述纳米试剂盒包括:微毛细管和试剂,其中,所述试剂为待测酶的底物和金属盐溶液,所述微毛细管用于容纳所述试剂;
7.所述电化学工作站包括ag/agcl电极、银丝和数据采集系统,其中,所述 ag/agcl电极作为参比电极,所述银丝置于所述微毛细管中,连接所述微毛细管中的所述酶的底物与所述电化学工作站,所述银丝、试剂、ag/agcl电极和数据采集系统构成完整的回路,所述数据采集系统用于记录电化学测试结果;
8.所述操作系统包括显微镜、显微操作器和膜片钳放大器,其中,
9.所述显微镜用于定位细胞,装有底物的所述微毛细管通过膜片钳的电极夹持器被固定到显微操作器的机械臂上,显微操作器用于操作微毛细管的尖端移入到待测单细胞的上方并插入所述待测单细胞,所述电化学工作站用于施加电负压从细胞中电化学抽取细胞
质,使所述酶与所述酶解底物接触发生反应,反应后,所述微毛细吸管置于所述电喷雾电离质谱入口,所述电喷雾电离质谱,用于记录微毛细管内底物和产物的质谱信号,根据所述采集的质谱信号计算得到所述待检测酶的活性。
10.在一实施例中,所述微毛细管通过p-2000激光拉拔器由硼硅酸盐玻璃管拉制得到,其中,所述激光拉拔器参数为:bf100-58-10;外径1.00毫米,内径 0.58毫米,所述微毛细管的开口为2-3μm。
11.在一实施例中,所述电喷雾电离质谱采用正离子模式,干燥温度300℃,干燥气体流量2.0l/min,雾化器压力0psig,施加的电压为4000v。
12.本技术还提供了一种利用所述电喷雾电离质谱装置检测酶活性的方法,包括以下步骤:
13.准备待测细胞,配置待测酶的底物溶液,使用microloader微型进样器和移液枪将所述酶解底物溶液移入微毛细管;
14.通过膜片钳的电极夹持器将所述微毛细管固定到显微操作器的机械臂上,使用所述显微操作器,通过显微镜定位所述待测细胞,将装有酶解底物溶液的微毛细管插入待测单细胞中,将银丝置于所述微毛细管中,连接所述微毛细管中的底物与电化学工作站,通过电化学工作站施加电负压对细胞中细胞质进行电化学抽取,使所述细胞质中的所述酶与微毛细管中的所述酶解底物发生反应;
15.将微毛细吸管置于所述电喷雾电离质谱入口处,溶液进入电喷雾电离质谱进行分析,使用电喷雾电离质谱对毛细管内的溶液进行信号采集,根据反应后溶液中底物和产物的质谱信号强度,计算得到检测酶的活性。
16.在一实施例中,所述准备待测细胞为:在对细胞完成传代培养操作后,取 20μl的细胞悬浮液加入培养皿中,加入培养基在37℃和5%二氧化碳环境下孵育24小时;在进行检测前,将培养基去除,换为pbs溶液以维持细胞正常的生理状态,便于在显微镜下定位操作。
17.在一实施例中,所述酶与所述酶解底物发生反应为,在100μm金属盐溶液中将酶与底物混合,在37℃且饱和水蒸气下,反应3-5小时。
18.在一实施例中,在所述微毛细管上施加高压使管内溶液喷出形成细密的电喷雾,为在微毛细管后端插入电极,施加4000v高压使管内溶液喷出形成细密的电喷雾,进入电喷雾电离质谱进行分析。
19.在一实施例中,通过电化学工作站的信号采集系统可控制毛细管孔径、负压大小、施加电压的时间。
20.在一实施例中,所述计算得到所述待检测酶的活性为,根据反应后溶液中底物和产物的质谱信号强度,读出对应的浓度,从而计算转化率;根据转化率、毛细管内溶液体积、反应时间,根据酶活力国际单位的标准公式计算能够表示酶活性的数据u:
[0021][0022]
酶活力国际单位的定义,在特定条件下在1分钟内能转化1微摩尔底物的酶量,或是转化底物中1微摩尔的有关基团的酶量,单位是μmol/min。
[0023]
在本技术中,v为毛细管内溶液体积,c为底物浓度,α为底物的转化率,m 为底物的摩尔分子量,t为反应时间。
[0024]
本技术还提供一种所述的耦合电喷雾电离质谱装置在单细胞检测中的应用。
[0025]
有益效果
[0026]
本技术提供了一种耦合电喷雾电离质谱的纳米级酶活性检测装置、检测方法及其应用确定单细胞中的酶活性。本技术的关键在于借助显微操作系统实现对单个细胞进行取样,借助纳米试剂盒技术耦合高灵敏度的电喷雾电离质谱从而实现对单个细胞内酶活性的测量。胞质溶胶的加载、目标酶的反应和后续的质谱检测集成在一根毛细管中,适用于单细胞分析。由于本技术的检测方法依赖于底物和产物之间的质量差异,因此可以不受限制地应用于各种酶的分析。更重要的是,通过将所有这些试剂盒整合到一个毛细管中,可以很容易地开发这种方法来测量一个细胞中的多种酶活性。
[0027]
为保证实验的精确度提高检测的灵敏度,首先本技术提供的检测装置及方法,其中所使用的检测溶液组成较为简单,降低基质效应的影响。其次,检测中少量细胞质抽取到毛细管中的溶液内,起到了稀释的作用,降低细胞内非目标物的信号强度。最后,检测中限定反应时间尽可能长,从而让细胞中的信号尽可能放大。
[0028]
本技术使用电化学工作站用于施加电负压从而实现对细胞中细胞质的电化序抽取,同时记录抽取过程中的电流,判断微毛细管的直径,负压大小、施加电压的时间以控制检测的重复性和精确度。
[0029]
本技术使用电喷雾电离质谱对毛细管内的溶液进行信号采集。由于本技术的检测方法可以应用到单个细胞中的酶活性检测,因此毛细管内溶液体积较少,为了避免对信号的影响,直接在毛细管后端插入电极,施加4000v高压使管内溶液喷出形成细密的电喷雾,进入电喷雾电离质谱进行分析,可以实现单个细胞中的痕量检测。
[0030]
本技术借助显微操作器对单细胞进行操作,所述显微操作器由压电陶瓷控制,由于压电陶瓷的高灵敏的特点,能够实现对高精度的操作,总计分为9个档位。很适合用于实现对单个细胞的精细操作。通过控制显微操作器,将灌注有溶液的毛细管移动到单个细胞的上方并扎入,实现单细胞的精确识别和定位。
附图说明
[0031]
图1本技术一实施例的检测装置及原理示意图
[0032]
图2a-图2b本技术一实施例中(图2a)标准ang ii和(图2b)ang 1-7 的质谱图
[0033]
图3a-图3b本技术一实施例中不同浓度的(图3a)ang ii和(图3b) ang 1-7的峰强度
[0034]
图4本技术一实施例中ang ii的转化率
[0035]
图5a-图5d本技术一实施例中不同酶促反应时间的混合物分别填充到毛细管中的质谱分析结果(图5a、图5c)及转化率(图5b、图5d)
[0036]
图6a本技术一实施例中a549细胞中ang ii酶活性的质谱图
[0037]
图6b本技术一实施例中a549细胞中ang ii酶的转化率
[0038]
图7a本技术一实施例中微毛细血管插入到一个活细胞中的成像
[0039]
图7b从毛细管内部的反应混合物中收集的质谱
[0040]
图7c单个hace2(ace2+)细胞和在炎症期间细胞的酶活性
[0041]
图7d来自单细胞的统计酶活性误差条呈现与单细胞分析的标准偏差
[0042]
图8本技术一实施例中对单个a549细胞检测酶活性的检测结果
具体实施方式
[0043]
下面结合具体实施例,进一步阐明本发明,应理解这些实施例,仅用于说明本发明而不用于限制本发明的范围,在阅读本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本技术所附权利要求所限定的范围。
[0044]
试剂及仪器
[0045]
血管紧张素转化酶2(ace2)、血管紧张素ii(ang ii)、血管紧张素1-7 (ang 1-7)购自mce(medchemexpress)公司(中国上海)。hace2-cho细胞购自antaiji biotechnology co(中国北京)。转化生长因子β3(tgfb3)和白细胞介素1β(il1β)购自novoprotein co.(ca,usa)。除非另有说明,否则所有其他试剂均购自sigma-aldrich。实验中使用的硼硅酸盐玻璃管 (bf100-58-10)购自sutter instrument。(加利福尼亚州,美国)。超纯水来自milli-q纯化系统,电阻率≥18.25mω
·
cm。
[0046]
细胞培养
[0047]
hace2-cho细胞在补充有15%fbs(胎牛血清)和1%抗生素(青霉素/链霉素)的dmem(dulbecco's modified eagle medium)/高葡萄糖培养基中培养。将细胞在含5%co2的细胞培养箱中于37℃、潮湿气氛中培养。
[0048]
仪器
[0049]
纳喷雾质谱装置由拉制的微毛细管、金属丝和电喷雾电离质谱(agilentg6530b q-tof,usa)连接构成。采用正离子模式,干燥温度300℃,干燥气体流量2.0l/min,雾化器压力0psig。施加的电压为4000v。使用显微镜olympusx73(olympus,japan)使用4r显微操作器(eppendorf, germany)进行显微操作。使用multiclamp700b膜片钳放大器和axondigidata 1550数据采集系统(molecular devices,usa)记录单细胞电化学测试,其中ag/agcl电极作为准参比电极。艾本德公司生产的microloader微型进样器。
[0050]
实验中使用的所有玻璃微毛细管均使用p-2000激光拉拔器(sutterinstrument,ca,usa)从硼硅酸盐玻璃管(bf100-58-10;外径1.00毫米,内径0.58毫米)中拉出。微毛细管的开口为2-3μm。
[0051]
在一实施例中,本技术提供了一种利用所述耦合电喷雾电离质谱装置检测酶活性的方法,包括以下步骤:
[0052]
准备待测细胞,配置待测酶的底物溶液,使用microloader微型进样器和移液枪将所述酶解底物溶液移入微毛细管;
[0053]
通过膜片钳的电极夹持器将所述微毛细管固定到显微操作器的机械臂上,使用所述显微操作器,通过显微镜定位所述待测细胞,将装有酶解底物溶液的微毛细管插入待测单细胞中,将银丝置于所述微毛细管中,连接所述微毛细管中的底物与电化学工作站,通过电化学工作站施加电负压对细胞中细胞质进行电化学抽取,使所述细胞质中的所述酶与微毛细管中的所述酶解底物发生反应;
[0054]
将所述微毛细吸管置于所述电喷雾电离质谱入口,试剂进入电喷雾电离质谱进行分析,使用电喷雾电离质谱对毛细管内的溶液进行信号采集,根据反应后溶液中底物和产
物的质谱信号强度,计算得到检测酶的活性。
[0055]
由于细胞只有十几个到几十个微米大小,为了能够看清楚细胞,需要借助显微镜,在一实施例中,采用了20x和40x的物镜。
[0056]
在一实施例中,借助部件膜片钳的电极夹持器将微毛细管固定到显微操作器机械臂上。显微操作器由压电陶瓷控制,由于压电陶瓷的高灵敏的特点,能够实现对高精度的操作,总计分为9个档位。很适合用于实现对单个细胞的精细操作。
[0057]
在一实施例中,通过控制显微操作器,将灌注有溶液的毛细管移动到单个细胞的上方并插入。细胞在完成传代操作后,取20μl的悬浮液加入培养皿中,加入培养基在37摄氏度和5%二氧化碳环境下孵育24小时。在进行检测前,将培养基去除,换为pbs溶液以维持细胞正常的生理状态同时便于在显微镜下观察。此时借助电化学工作中通过毛细管内的银丝(银丝、溶剂、参比电极、数据采集系统构成完整的回路)施加负压-1v,通过电渗流作用实现对单个细胞的细胞质的抽取,从而获取目标酶。
[0058]
在一实施例中,通过控制毛细管孔径、负压大小、施加电压的时间来保证实验的重复性。
[0059]
在一实施例中,所述酶解底物为血管紧张素ii(ang ii),所述酶为血管紧张素转化酶2(ace2)。
[0060]
实现抽取后,单个细胞的细胞质(含有目标酶)会和毛细管内灌注好的底物溶液反应。底物溶液的组成尽可能简单,只有100μg/ml ang ii和100μmzncl2。zncl2是因为目标酶的催化作用需要借助金属离子zn
2+
才能实现。溶液之所以简单,是为了避免基质效应对质谱信号强度的影响。在37℃且饱和水蒸气的条件下,避免毛细管内溶液挥发影响信号,反应3个小时。反应时间尽可能长是为了放大单个细胞产生的信号。
[0061]
使用纳米喷雾质谱仪对毛细管内的溶液进行信号采集。由于毛细管内溶液体积较少,为了避免hplc对信号的影响,直接在毛细管后端插入电极,施加4000v 高压使管内溶液喷出形成细密的电喷雾,进入质谱仪进行分析。
[0062]
得到酶活性:首先检测不同浓度的底物和产物的标准品的质谱信号强度,得到信号强度对浓度的标准曲线。根据反应后溶液中底物和产物的信号强度,读出对应的浓度,从而计算转化率。根据转化率、毛细管内溶液体积、反应时间即可根据国际酶活力单位的标准公式计算能够表示酶活性的数据u。
[0063]
标准品测量
[0064]
本技术具体利用底物和产物之间的质量差异来测量单个活细胞中的ace2 活性。
[0065]
如图1所示,血管紧张素ii(angii)是包含8个氨基酸 (asp-arg-val-tyr-ile-his-pro-phe)的多肽序列(mw 1046.18),作为ace2 的底物。在将毛细管插入一个具有过表达ace2酶的活hace2-cho细胞后,含有 ace2酶的细胞质基质被电化学抽取到纳米毛细管中。由于液体从微孔中的极慢蒸发,ang ii和ace2酶的混合物可以保留在毛细管尖端,使反应持续数小时。该催化过程从ang ii中去除phe,生成分子量为899.00的ang 1-7。在毛细管内施加高压以启动电喷雾后,记录质谱。根据分子量的不同,在光谱中区分了 ang 1-7和ang ii。最终,它们的峰值强度被用于计算ace2的活性。
[0066]
标准ang ii和ang 1-7的质谱是通过在esi-ms后将化学品填充到微毛细管(内径2-3μm)中来测量的。质荷比为1046.54和523.77的峰与ang ii 相关(图2a),而899.47、
450.24和300.50与ang 1-7相关(图2b)。不同浓度的ang ii(图3a)和ang 1-7(图3b)的峰强度列于图3a-图3b中,显示出ang 1-7的电离效率略高于ang ii。
[0067]
酶活性分析及定量酶活性转化率
[0068]
为了验证酶活性分析,ang ii在37℃的缓冲液中与纯ace2酶反应。然后,将不同反应时间的混合物分别填充到毛细管中进行质谱分析。
[0069]
从溶液中去除ace2酶导致在孵育2小时后仅观察到ang ii的峰(图4)。这些结果显示了ace2酶对ang ii的连续转化。
[0070]
在0.5分钟时,仅观察到对应于ang ii的峰,仅显示混合物中的底物。反应10分钟后,出现与ang ii(1046.54和523.77)和ang 1-7(450.24和 300.50)相关的峰,说明ang ii部分转化为ang 1-7(图5a)。随着反应时间的延长,与ang ii相关的峰逐渐减少,而与ang 1-7相关的峰增加。
[0071]
测量了不同反应时间的ang ii和ang 1-7的峰强度。使用ang ii和 ang 1-7的峰值强度对转化率进行量化(图5b)。观察到转化率的近线性增加,这表现出ace2和ang ii之间的连续反应。反应3小时后,约。40%的angii转化为ang 1-7。由于ang ii的初始浓度为100μg/ml,毛细管内混合物的体积为10μl,计算得出ace2的催化活性为1.765μu,通过对转化率量化,将酶解反应定量。
[0072]
也进一步说明,通过本技术的装置及检测方法可以通过对底物和反应物的扫描,检测目标酶的活性。
[0073]
对于本实验采用的hace-cho细胞,首先对其细胞破碎液中ace2的酶活性进行检测。细胞破碎液的获取,是将一盒长满hace2-cho细胞的烧瓶,通过2ml 胰酶37℃消解2min,加入8ml dmem/高葡萄糖培养基终止消解,转移至15ml 离心管内。2000r/min离心2min得到约106个细胞的细胞团。倒去培养基,加入200μl超纯水吹散细胞团,2000r/min离心2min,弃去溶液部分,得到细胞团。清洗三次至无色。加入200μl超纯水,放入4℃冰箱溶胀4h,使用超声破碎仪以70w的功率,超声时间5s,暂停时间9s,总工作时间5min 的参数在冰水浴中对细胞悬浊液进行破碎。以13500r/min,4℃的条件离心10 min,将细胞碎片沉淀弃去,取上清液,得到含有ace2的hace2-cho细胞破碎液。在100μm的底物中加入50μlhace2-cho细胞破碎液,总体积500μl,在37℃下反应。反应15min的质谱结果如图5c所示。转化率与反应时间之间的关系(图 5d)显示,超过80%的ang ii在1小时内被酶转化。细胞破碎液的酶活性计算为1.06mu,远高于商业ace2酶的酶活性。作为比较,不表达ace2酶的 a549细胞用于对照实验(图6a-图6b)。3小时后只有3.14%的ang ii转化为 ang 1-7,在a549细胞中表现出明显低的酶活性。这两个实验结果都支持检测来自ace2表达细胞的酶活性。a549细胞所表现出低的酶活性的主要原因为,本实施例中采用的是细胞破碎液,里面含有较多的细胞内的复杂成分,这些成分可能导致了底物结构的不稳定,从而产生了分解,生成了产物。
[0074]
单细胞中酶活性的检测
[0075]
在单细胞分析中,将100μg/ml ang ii和100μm zncl2的混合物加载到毛细管中。然后,在显微操作系统的帮助下,将毛细管尖端定位到活的 hace2-cho细胞中。在毛细管内的ag/agcl线上施加-1v的电压,以对细胞溶质进行电化学分类3分钟。之后,将毛细管置于37℃下3h,使ang ii与 ace2酶发生反应。最后,将毛细管放置在电喷雾电离质谱入口的前面,以启动纳米喷雾。
[0076]
在微操作系统的帮助下,毛细管的尖端插入一个细胞(图7a)。使用电化学泵将细胞中的胞质溶胶分选到毛细管中。考虑到单细胞ace2的分选量少于细胞裂解液的分选量,因此将反应时间延长至3h,以最大限度地提高ang ii的转化率。在此期间,在相同反应体积的毛细管中没有观察到明显的液体损失。缓冲液从毛细管孔口缓慢挥发,保证了来自单细胞的分选酶与毛细管内的底物之间的反应。然后,收集质谱(图7b),显示ang 1-7的峰(450.24和899.47)。由于ang 1-7不是细胞内容物,因此从毛细管内的混合物中观察到ang 1-7提供了关于ace2和ang ii之间反应的直接证据。结果表明,单细胞加载的酶可以与预填充的底物发生反应,完成反应。对单个活a549细胞应用相同的检测方法,没有观察到与ang 1-7相关的峰(图8),这进一步支持了单个hace2-cho 细胞的结果。
[0077]
与细胞裂解液中酶对ang ii的部分转化不同,单细胞上载的酶不足,可以转化少量底物。结果,ang ii的峰强度几乎相同,这在光谱中没有显示出来。为了计算单细胞中的酶活性,ang 1-7的产生量是根据标准峰强度的校准曲线确定的(图2)。图7c列出了8个细胞的ace2活性。单细胞的平均酶活性确定为4.2
±
1.4nu。计算出的相对标准偏差为33.3%,这明显大于与细胞裂解物中酶的反应(图5d图中的2.5%)。观察到与单细胞分析的较大偏差为ace2活性中的细胞异质性提供了明确的证据。与现有的电化学检测相比,这种方法不需要任何电化学副产物,并且可以应用于几乎所有的酶促反应来确定其活性。
[0078]
酶活性与炎症活动的相关性
[0079]
冠状病毒可以特异性识别并结合细胞膜上的ace2,然后进入细胞内部引发炎症反应。为了研究炎症下ace2活性的改变,用炎症因子(tgfb3和il1b) 处理hace2-cho细胞24小时。之后,采用本技术的方法测量单细胞的ace2催化活性。来自10个细胞的活性也列在图7c图中。有和没有炎症处理的 hace2-cho单细胞的ace2酶活性的平均结果及标准偏差列在图7d,以便更好地看出平行实验之间的偏差成都,以及对比有无炎症处理对单细胞中目标酶活性是否有影响。有和没有炎症的活动的统计分析没有显示出显著差异。该结果提供了炎症状态可能不会影响细胞内ace2催化活性的线索。先前的蛋白质组研究表明,covid-19患者中ace2的表达没有改变。因此,它可能仅作为sars-cov-2 的载体。
[0080]
进一步的说,关于其活性与细胞炎症之间独立性的信息将为了解这种酶在疾病中的作用提供更多信息。
[0081]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来书,在不脱离本发明的原理的前提下,还可以作数若干改进和润饰,这些改进和润饰也应当视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1