检测方法与流程
1.本公开涉及一种检测方法。
背景技术:
2.在如生物技术和医疗保健等技术领域中,使用一种用于检测样品中靶物质的方法。作为此种检测方法,酶联免疫吸附测定(即,elisa)是已知的。靶物质是蛋白质或类似物。
3.在酶联免疫吸附测定中,免疫球蛋白和标记物的缀合物与靶物质结合。此种缀合物描述在biosensors and bioelectronics 117(2018)175-182中。作为免疫球蛋白,单克隆抗体、多克隆抗体等是已知的。
技术实现要素:
4.在样品中,靶物质可能靠近其他物质存在。例如,当多种靶物质形成复合物或以高密度存在于如细胞膜等外包膜上时,靶物质靠近相邻的靶物质存在。进一步地,当靶物质存在于如细胞膜等外包膜上并且另一巨型物质存在于靶物质附近时,靶物质靠近巨型物质。
5.免疫球蛋白的尺寸很大。因此,当靶物质靠近另一物质时,包括免疫球蛋白的缀合物受到其他物质干扰,并且可能无法与靶物质结合。结果,对靶物质的分析敏感性劣化。
6.在本公开的一个方面,优选提供一种其中即使当靶物质靠近另一种物质时分析敏感性也不会劣化的检测方法。
7.本公开的一个方面涉及一种用于通过使用多种缀合物来检测靶物质的方法,所述多种缀合物各自包括结合物质和标记物,所述结合物质具有与所述靶物质中的一种结合的活性,并且所述标记物引起可检测现象。所述结合物质的分子量小于免疫球蛋白的分子量。进行用于将所述多种缀合物中的一些与所述靶物质结合的处理,然后去除未与所述靶物质结合的剩余所述缀合物。之后,检测所述标记物。
8.作为本公开的一个方面的检测方法使用所述缀合物。所述缀合物中的每一种的结合物质的分子量小于免疫球蛋白的分子量。因此,在作为本公开的一个方面的该方法中使用的所述缀合物的尺寸小于包括免疫球蛋白的缀合物的尺寸。因此,即时当所述靶物质靠近另一物质时,所述缀合物也不太可能受到其他物质干扰,并且可以容易与所述靶物质结合。结果,本公开的检测方法可以提高对靶物质的分析敏感性。
附图说明
9.图1是绘示缀合物的结构和靶物质的检测方法的说明图。
10.图2是绘示合成缀合物的步骤的说明图。
11.图3是绘示由碱性磷酸酶的酶活性引起的代谢的说明图。
12.图4是绘示检测方法的步骤的说明图。
13.图5是吸光度的测量结果表。
14.图6是绘示检测方法的步骤的说明图。
15.图7是ph的测量结果表。
16.图8是绘示用于确认标记物的功能表达的测试的步骤的说明图。
17.图9是ph的测量结果表。
具体实施方式
18.将参照附图描述本公开的实例性实施方案。
19.1.缀合物
20.(1-1)缀合物的组成
21.缀合物包括结合物质。结合物质具有与靶物质结合的活性(下文称为结合活性)。结合物质即使当与标记物融合时也具有结合活性。
22.结合物质是低分子量蛋白质配制剂或核酸适体。结合物质的分子量小于免疫球蛋白的分子量。构成低分子量蛋白质配制剂的氨基酸的数目落在例如5(包括端点值)至200(包括端点值)之间的范围内。当氨基酸的数目为200或更少时,即时当靶物质靠近另一物质时,缀合物也不太可能受到其他物质干扰,并且容易与靶物质结合。例如,可以通过将各自由氨基酸组成的多个单元彼此连接来形成低分子量蛋白质配制剂。每个单元中的氨基酸的数目优选落在5(包括端点值)至200(包括端点值)之间的范围内。当每个单元中的氨基酸的数目为200或更少时,即使当靶物质靠近其他物质时,缀合物也不太可能受到另一物质干扰,并且容易与靶物质结合。
23.低分子量蛋白质配制剂的实例包括片段抗体、单链抗体、双体抗体(diabody)、纳米抗体、vhh、肽适体等。低分子量蛋白质配制剂例如既不是单克隆抗体也不是多克隆抗体。
24.核酸适体的碱基的数目落在例如10(包括端点值)至100(包括端点值)之间的范围内。当碱基的数目为100或更少时,即时当靶物质靠近另一物质时,缀合物也不太可能受到其他物质干扰,并且容易与靶物质结合。
25.例如,核酸适体可以是其中各自由核酸组成的多个单元彼此连接的核酸适体。每个单元中的碱基的数目优选落在10(包括端点值)至100(包括端点值)之间的范围内。当碱基的数目为100或更少时,即时当靶物质靠近另一物质时,缀合物也不太可能受到其他物质干扰,并且容易与靶物质结合。
26.核酸适体的实例包括dna适体和rna适体。结合物质可以例如通过体外工艺化学合成。
27.结合物质例如通过如抗原-抗体相互作用等分子内相互作用与靶物质结合。通过如抗原-抗体相互作用等分子间相互作用形成的键包括氢键、通过静电互补性形成的键、通过疏水接触形成的键、立体键等。
28.缀合物包括标记物。标记物与结合物质融合。标记物表现出功能。当标记物表现出其功能时,可检测现象发生。可检测现象的实例包括例如离子的生成、消耗或吸收。离子的实例包括氢离子、钾离子、钠离子、钙离子、锂离子、铵离子、氯离子等。可检测现象的实例包括例如氧化还原反应、显色、荧光、发光、磷光、热吸收、热生成、沉淀生成等。例如,可以通过现场观察现象来检测标记物。此外,当缀合物与靶物质结合时,可以通过检测标记物来间接检测靶物质。
29.标记物是选自磁性标记物、荧光标记物、酶、dna酶、rna酶、化学发光探针和纳米粒子中的至少一种。纳米粒子是选自金属粒子、非金属粒子、染料粒子、颜料粒子、电化学活性物质、半导体纳米晶体和量子点荧光团中的至少一种。
30.酶具有例如诱导从底物开始的代谢的活性(下文称为酶活性)。代谢的实例包括生成离子的代谢、消耗离子的代谢、吸收离子的代谢、产生吸收特定波长的光的物质的代谢等。离子的实例包括氢离子、钾离子、钠离子、钙离子、锂离子、铵离子、氯离子等。
31.当产生离子的代谢、消耗离子的代谢或吸收离子的新陈代谢发生时,溶液中的离子浓度会变化。当生成吸收特定波长的光的物质时,溶液会着色或发光。酶活性对应于酶表达的功能。溶液中离子浓度的变化、溶液的显色和发光对应于由酶活性引起的可检测现象。
32.酶是选自1,3-丙二醇脱氢酶、15-羟基前列腺素脱氢酶、1h-吡咯-2-羰基-[肽基-载体蛋白]氯化酶(chlorinase)、2,4-二氯苯甲酰-coa还原酶、2,5-二氧戊酸脱氢酶、2-氨基苯磺酸2,3-双加氧酶、2-亚氨基丁酸甲酯/2-亚氨基丙酸甲酯脱氨酶、2-烯酸甲酯还原酶,2'-脱氢卡那霉素还原酶、3,4-二羟基苯基丙氨酸还原脱氨酶、3α-羟基类固醇3-脱氢酶,3-氨基丁酰-coa氨裂解酶、3-氧代-5α-类固醇4-脱氢酶、3-氧代类固醇1-脱氢酶、3-氯代-d-丙氨酸脱氢氯化酶、4-氯代乙酸苯酯3,4-双加氧酶、4-氯代苯甲酰-coa脱卤酶、4-氯代苯甲酸脱卤酶、4-三甲基胺基丁醛脱氢酶、4-甲基氨基丁酸甲酯氧化酶、4-亚甲基谷氨酸氨连接酶、5-磷酸氧基(phosphooxy)-l-赖氨酸磷酸裂解酶、7,8-二甲基-8-羟基-5-脱氮杂核黄素合酶、7-羧基-7-脱氮杂鸟嘌呤合酶、7-氯代-l-色氨酸6-卤化酶、7-氰基-7-脱氮杂鸟嘌呤合酶、amp脱氨酶、ctp合酶、ddt-脱氢氯化酶、dtdp-4-氨基-4,6-二脱氧-d-葡萄糖氨裂解酶、d-阿拉伯糖1-脱氢酶、d-精氨酸脱氢酶、d-木糖还原酶、d-氨基葡萄糖酸-6-磷酸氨裂解酶、d-丝氨酸氨裂解酶,d-乳酸脱氢酶、gdp-4-脱氢-6-脱氧-α-d-甘露糖3-脱水酶,gmp合酶,l-2-氨基-4-氯代戊(chloropent)-4-烯酸甲酯脱氢氯化酶、l-胱氨酸β-裂解酶、l-半胱氨酸脱硫化酶(desulfidase)、l-半胱氨酸磺酸基裂解酶、l-丝氨酸氨裂解酶、l-色氨酸氨裂解酶、l-赖氨酸环化脱氨酶、n1-乙酰多胺氧化酶、n8-乙酰亚精胺氧化酶、nad(+)-白喉酰胺adp-核糖基转移酶、nad(+)合酶、nad(+)-二氮还原酶adp-d-核糖基转移酶、n-琥珀酰精氨酸二水解酶、s-(羟甲基)霉硫醇(mycothiol)脱氢酶,s-羧甲基半胱氨酸合酶、udp-2-乙酰胺-2,6-β-l-阿拉伯糖-己-4-糖还原酶、udp-n-乙酰-2-氨基-2-脱氧葡萄糖醛酸脱氢酶、udp-n-乙酰-d-甘露糖胺脱氢酶、udp-n-乙酰-α-d-奎诺糖胺脱氢酶、udp-n-乙酰葡萄糖胺3-脱氢酶、udp-n-乙酰葡萄糖胺6-脱氢酶、udp-葡萄糖醛酸脱氢酶、β-丙氨酰-coa氨裂解酶、β-脲基丙酸酶、β-内酰胺酶、γ-丁甜菜碱双加氧酶、天冬酰胺酰-trna合酶、天冬酰胺合酶、天冬氨酸氨裂解酶、天冬氨酸氨裂解酶、天冬氨酸半醛脱氢酶、天冬氨酸脱氢酶、腺苷硫酸氨腺苷酸转移酶、腺苷基氯化物合酶、阿特拉津(atrazine)氯水解酶、氨甲基转移酶、丙氨酸脱氢酶、尿囊酸脱亚胺酶、碱性磷酸酶、乙醇脱氢酶、醛脱氢酶、氨激酶、氨单加氧酶、异柠檬酸脱氢酶、咪唑磷酸甘油合酶、尿酸酶、脲酶、脲基乙醇酸酰胺水解酶、糖醛酸脱氢酶、乙醇胺氨裂解酶、赤式-3-羟基-l-天冬氨酸氨裂解酶、章鱼胺脱水酶、鸟氨酸环化脱氨酶、半乳糖脱氢酶、氨基甲酸激酶、氨基甲酰丝氨酸氨裂解酶、氨基甲酰磷酸合酶、羰基还原酶、甲酸脱氢酶、甘氨酸还原酶、甘油-3-磷酸脱氢酶、葡萄糖-6-磷酸脱氢酶、葡萄糖氧化酶、葡萄糖脱氢酶、葡萄糖激酶、氨基葡萄糖酸氨裂解酶、葡萄糖胺-6-磷酸脱氨酶、谷氨酰胺酰基-trna合酶、谷氨酰胺合成酶、谷氨酸合酶、谷氨酸脱氢酶、巴豆甜菜碱基-coa水合酶、氯
化物过氧化物酶、粪卟啉原脱氢酶、胆碱氧化酶、胆碱单加氧酶、胆固醇氧化酶、二乙酰还原酶、二氨基庚二酸脱氢酶、二氨基丙酸氨裂解酶、莽草酸脱氢酶、环己烷-1,2-二醇脱氢酶、二氯铬吡咯酸合酶(dichlorochromopyrrolate synthase)、二氯甲烷脱卤酶、胱硫醚γ-裂解酶、半胱氨酸-s-缀合物β-裂解酶、二氢硫辛酸脱氢酶、白喉素氨连接酶、肉桂酰-coa还原酶、琥珀酰谷氨酸半醛脱氢酶、水苏碱n-脱甲基酶、苏式-3-羟基-d-天冬氨酸氨裂解酶、苏式-3-羟基-l-天冬氨酸氨裂解酶、苏氨酸氨裂解酶、丝氨酸硫酸氨裂解酶、硫氧还蛋白二硫化物还原酶、酪氨酸氨裂解酶、酪氨酸酚裂解酶、四氯乙烯还原脱卤酶、四环素(tetracycline)7-卤化酶、色氨酸酶、色氨酸5-卤化酶、色氨酸6-卤化酶、色氨酸7卤化酶、nad(p)h脱氢酶、nadph-血红素蛋白还原酶、固氮酶、钒依赖性固氮酶、单吲哚型生物碱氯化酶、组氨酸氨裂解酶、肼合酶、肼脱氢酶、羟甲基胆色烷合酶、羟胺还原酶、吡哆醛5'-磷酸合酶、砷酸还原酶、苯基丙氨酸/酪氨酸氨裂解酶、苯基丙氨酸2-单加氧酶、苯基丙氨酸氨裂解酶、铁氧还蛋白-nadp(+)还原酶、铁氧化还原蛋白亚硝酸还原酶、富马酸还原酶、原卟啉原氧化酶、甜菜碱醛脱氢酶、甜菜碱还原酶、过氧化物酶、高半胱氨酸脱巯基酶、高亚精胺合酶、亚胺甲基四氢叶酸环化脱氨酶、髓过氧化物酶、甲醇脱氢酶、甲烷单加氧酶、蛋氨酸γ-裂解酶、甲基天冬氨酸解氨酶、甲胺脱氢酶、亚甲基二脲脱氨酶、乳醛酸脱氢酶、核糖-5-磷酸氨连接酶、苹果酸脱氢酶、红素氧还蛋白-nad(p)(+)还原酶、氯酸o2-裂解酶、亚硝酸还原酶、亚硫酸脱氢酶、氯化物过氧化物酶、氯酸还原酶、脂质ii异谷氨酰胺酰基合酶、碳酸脱水酶和非特异性多胺氧化酶中的至少一种。
[0033]
例如,结合物质和标记物通过化学取代基或核酸结合蛋白彼此融合。例如,标记物和结合物质中的每一种都包括化学取代基或核酸结合蛋白。例如,通过标记物的化学取代基或核酸结合蛋白与结合物质的化学取代基或核酸结合蛋白之间的结合,标记物与结合物质融合。
[0034]
标记物中所含有的化学取代基是选自生物素、伯胺、叠氮化物、炔烃、二苯并环辛炔、双环壬炔、2'-丙炔基、2'-o-炔丙基、硫醇、抗生物素蛋白、链霉亲和素、中性抗生物素蛋白、n-羟基琥珀酰亚胺、马来酰亚胺和5-卤代尿嘧啶中的至少一种。5-卤代尿嘧啶的实例包括5-碘代尿嘧啶、5-溴代尿嘧啶等。5-卤代赖氨酰基(5-halolasyl)是一种可以与uv形成交联的化学取代基。
[0035]
标记物中所含有的核酸结合蛋白是选自锌指和crispr中的至少一种。
[0036]
结合蛋白中所含有的化学取代基是选自生物素、伯胺、叠氮化物、炔烃、二苯并环辛炔、双环壬炔、2'-丙炔基、2'-o-炔丙基、硫醇、抗生物素蛋白、链霉亲和素、中性抗生物素蛋白、n-羟基琥珀酰亚胺、马来酰亚胺和5-卤代尿嘧啶中的至少一种。5-卤代尿嘧啶的实例包括5-碘代尿嘧啶、5-溴代尿嘧啶等。5-卤代赖氨酰基是一种可以与uv形成交联的化学取代基。
[0037]
结合物质中所含有的核酸结合蛋白是选自锌指和crispr中的至少一种。
[0038]
标记物中所含有的化学取代基与结合物质中所含有的化学取代基不同。例如,当标记物中所含有的化学取代基是生物素时,结合物质中所含有的化学取代基是抗生物素蛋白、链霉亲和素或中性抗生物素蛋白。
[0039]
靶物质的实例包括蛋白质、糖、脂质、核酸、低分子量化合物、抗原、细胞、病毒等。抗原的实例包括由细胞或病毒呈递的抗原、细胞或病毒中所含有的抗原等。由细胞或病毒
呈递的抗原或者细胞或病毒中所含有的抗原的实例包括新型冠状病毒sars-cov-2的rbd区(下文称为rbd)。病毒的实例包括新型冠状病毒sars-cov-2等。
[0040]
(1-2)缀合物的优点
[0041]
本公开的缀合物具有以下优点。
[0042]
(1a)多种靶物质可以形成复合物。复合物的实例包括二聚体、三聚体、四聚体等。在一种复合物中,每种靶物质都靠近另一靶物质。
[0043]
由于缀合物的尺寸小,因此当缀合物接近靶物质时,缀合物不太可能受到相邻的靶物质干扰。因此,缀合物可以与形成复合物的靶物质中的每一种结合。结果,本公开的缀合物可以提高对靶物质的分析敏感性。
[0044]
活生物体中的蛋白质通常形成复合物。活生物体中的蛋白质的实例包括膜蛋白和包膜蛋白。膜蛋白的实例包括受体蛋白等。包膜蛋白的实例包括病毒刺突蛋白等。通过使用本公开的缀合物,即使当蛋白质形成复合物时,也有可能提高对活生物体中的蛋白质的分析敏感性。
[0045]
(1b)多种靶物质可以以高密度存在于如细胞膜等外包膜上。在这种情况下,靶物质中的每一种都非常靠近相邻的靶物质。
[0046]
由于缀合物的尺寸小,因此当缀合物接近靶物质时,缀合物不太可能受到相邻的靶物质干扰。因此,缀合物可以与以高密度存在的靶物质中的每一种结合。结果,本公开的缀合物可以提高对靶物质的分析敏感性。
[0047]
活生物体中的蛋白质通常以高密度存在于如细胞膜上。活生物体中的蛋白质的实例包括(1a)中所提及的蛋白质。即使当蛋白质以高密度存在于如细胞膜上时,本公开的缀合物也可以提高对活生物体中的蛋白质的分析敏感性。
[0048]
(1c)靶物质可以存在于如细胞膜等外包膜上,并且另一巨型物质可以存在于靶物质附近。
[0049]
由于缀合物的尺寸小,因此当接近靶物质时,缀合物不太可能受到巨型物质干扰。因此,缀合物可以与存在于巨型物质附近的靶物质结合。结果,本公开的缀合物可以提高对靶物质的分析敏感性。
[0050]
活生物体中的蛋白质存在于如细胞膜等外包膜上,并且巨型物质通常存在于蛋白质附近。活生物体中的蛋白质的实例包括(1a)中所提及的蛋白质。即使当巨型物质存在于蛋白质附近时,本公开的缀合物也可以提高对活生物体中的蛋白质的分析敏感性。
[0051]
(1d)靶物质的表位可能由于突变等而变化。当靶物质的表位变化时,当前的结合物质可能失去其结合活性。具体地,当靶物质是由如流感病毒或冠状病毒等rna病毒表达的蛋白质时,突变频繁发生,并且表位频繁变化。
[0052]
本公开的缀合物的结合物质可以例如通过体外工艺化学合成。由于结合物质可以通过体外工艺化学合成,因此与合成单克隆抗体或多克隆抗体的情况相比,更容易开发对具有变化的表位的靶物质具有结合活性的结合物质。
[0053]
2.用于检测靶物质的方法
[0054]
(2-1)靶物质的检测方法的程序
[0055]
用于检测靶物质的方法可以例如通过以下程序进行。
[0056]
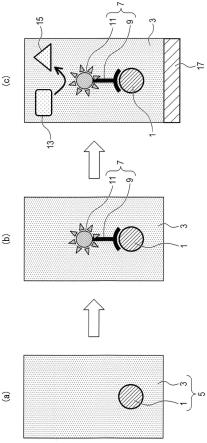
(i)如图1的(a)所示,制备靶物质1。在图1中,出于描述的目的,仅展示一种靶物质
1。靶物质1存在于例如溶液3中。靶物质1和溶液3形成样品5。
[0057]
(ii)接下来,如图1的(b)所示,进行将缀合物7中的至少一些与靶物质1结合的处理。例如,通过允许缀合物7和靶物质1共存于溶液3中,缀合物7中的至少一些与靶物质1结合。
[0058]
缀合物7中的每一种都包括结合物质9和标记物11。缀合物7是描述在上文部分“1.缀合物”中的缀合物。缀合物7中的一些的结合物质9与靶物质1结合以形成偶合体。
[0059]
(iii)接下来,在缀合物7中,去除未与靶物质1结合的未结合缀合物7。
[0060]
(iv)接下来,表达缀合物7的标记物11的功能。通过表达标记物11的功能,可检测现象发生。标记物11的功能包括酶活性、化学发光、荧光生成等。
[0061]
如图1(c)所示,酶活性可以是从底物13开始的代谢。从底物13开始的代谢产生产物15。产物15可以是氢离子。替代地,产物15消耗氢离子。因此,从底物13开始的代谢可以生成或消耗氢离子。当生成或消耗氢离子的代谢发生时,溶液3中的氢离子浓度变化。氢离子浓度的变化对应于由标记物11的功能引起的可检测现象。
[0062]
产物15可以吸收特定波长的光。结果,含有缀合物7的溶液3显色。溶液3的显色对应于由标记物11的功能引起的可检测现象。
[0063]
(v)接下来,检测标记物11。由于缀合物7与靶物质1结合,因此检测标记物11相当于检测靶物质1。
[0064]
为了检测标记物11,观察由标记物11的功能引起的现象。如果可以观察到现象,则这意味着可以检测到标记物11。
[0065]
例如,如果由标记物引起的现象是离子浓度变化,如氢离子、钾离子、钠离子、钙离子、锂离子、铵离子或氯离子的生成、消耗或吸收,则所述现象可以通过ph计、离子传感器或离子敏感电场效应晶体管来检测。
[0066]
当由标记物引起的现象是显色、发光、荧光或磷光时,所述现象可以通过使用例如光接收装置来检测。当由标记物引起的现象是热吸收或热生成时,所述现象可以通过使用例如热分析仪来检测。
[0067]
当由标记物引起的现象是氧化还原反应时,所述现象可以通过使用例如电位计、离子传感器或离子敏感场效应晶体管来检测。当由标记物引起的现象是沉淀生成时,所述现象可以通过使用例如质谱仪、吸收计或分光光度计来检测。
[0068]
例如,当标记物11的功能是诱导生成、消耗或吸收氢离子的代谢的酶活性时,氢离子浓度的变化量用图1(c)中所示的测量仪器17来测量。当氢离子浓度发生变化时,这意味着检测到标记物11。
[0069]
进一步地,当标记物11的功能是引起溶液显色的酶活性时,显色的强度通过使用测量仪器17来测量。如果有显色,则这意味着检测到标记物11。
[0070]
当标记物11的功能是化学发光或荧光产生时,使用测量仪器17来测量光量。当可以观察到化学发光或荧光的生成时,这意味着检测到标记物11。
[0071]
(2-2)用于检测靶物质的方法的优点
[0072]
本公开的用于检测靶物质的方法实现了上文描述的优点(1a)至(1d),并且进一步实现了以下优点。
[0073]
(2a)根据本公开中的用于检测靶物质的方法,可以容易且高敏感性地测量样品中
靶物质的浓度。
[0074]
(2b)当标记物的功能是引起溶液显色的酶活性时,靶物质可以通过溶液显色来检测。
[0075]
根据本公开的用于检测靶物质的方法,只有与靶物质结合的缀合物才会引起溶液显色。因此,靶物质的浓度越高,溶液显色越强。因此,根据本公开的用于检测靶物质的方法,靶物质的浓度可以基于溶液显色的强度来定量。
[0076]
(2c)当标记物的功能是诱导生成、消耗或吸收氢离子的代谢的酶活性时,靶物质可以通过溶液中氢离子浓度的变化来检测。
[0077]
根据本公开中所公开的用于检测靶物质的方法,只有与靶物质结合的缀合物才会诱导产生、消耗或吸收氢离子的代谢。因此,靶物质的浓度越高,溶液中氢离子浓度的变化量越大。因此,根据本公开中的用于检测靶物质的方法,靶物质的浓度可以基于溶液中氢离子浓度的变化量来定量。
[0078]
3.实施例
[0079]
(3-1)缀合物的合成
[0080]
通过体外工艺化学合成具有seq id no:1的碱基序列的dna适体(在下文中被称为未修饰的dna适体)。未修饰的dna适体的碱基序列为“5'-cagcaccgac cttgtgcttt gggagtgctg gtccaagggc gttaatggac a-3'”。未修饰的dna适体描述在anal.chem.2020,92,9895-9900(在下文中被称为参考文献1)中。
[0081]
根据参考文献1的描述,未修饰的dna适体是一种以新型冠状病毒sars-cov-2的刺突糖蛋白的rbd为靶物质的dna适体。接下来,经由c6间隔区用生物素对未修饰的dna适体的5'末端进行化学修饰。
[0082]
通过上述步骤,获得dna适体。dna适体对应于结合物质。将dna适体溶解在磷酸盐缓冲溶液(在下文中被称为1xpbs/t)中,以制备dna适体溶液。dna适体溶液中dna适体的浓度为10μmol/l。
[0083]
1xpbs/t含有0.05%(v/v)的表面活性剂tween 20。另外,1xpbs/t含有137mmol/l的nacl、8.1mmol/l的na2hpo4、2.7mmol/l的kcl和1.47mmol/l的kh2po4。
[0084]
作为标记物,制备链霉亲和素-碱性磷酸酶缀合物(由thermo fisher scientific inc.生产,产品编号s921)。
[0085]
该标记物是一种酶。链霉亲和素-碱性磷酸酶缀合物通过用链霉亲和素修饰碱性磷酸酶来获得。链霉亲和素素是一种修饰标记物的化学取代基。将标记物溶解在1xpbs/t中,以制备标记物溶液。标记物溶液中标记物的浓度为20μmol/l。
[0086]
将100μl的dna适体溶液和5μl的标记物溶液混合,并且在室温下静置1小时。此时,生物素-链霉亲和素之间的相互作用使dna适体与标记物融合,并且合成了缀合物。
[0087]
然后将缀合物纯化并回收。具体而言,使用超滤过滤器将未与标记物融合的dna适体与缀合物分离,以回收缀合物。合成缀合物的工艺流程示出在图2中。
[0088]
结合物质可以是除上述dna适体之外的结合物质。结合物质可以是例如低分子量蛋白质配制剂或rna适体。低分子量蛋白质配制剂的实例包括片段抗体、单链抗体、双体抗体、纳米抗体、vhh、肽适体等。
[0089]
进一步地,dna适体的碱基序列可以是除seq id no:1的碱基序列之外的碱基序
列。dna适体的碱基序列可以根据靶物质进行选择。
[0090]
进一步地,结合物质与标记物的融合可以是除基于生物素-链霉亲和素相互作用的融合之外的融合。当核酸适体用作结合物质时,除核酸适体的5'末端之外的末端可以与标记物融合。
[0091]
当低分子量蛋白质配制剂用作结合物质时,低分子量蛋白质配制剂的n端或c端可以与标记物融合。
[0092]
(3-2)使用用于检测靶物质的方法
[0093]
作为靶物质,制备spike s1-his重组蛋白(由sino biological inc.生产,产品编号4059-v08h)。该靶物质在下文中被称为s1。s1的氨基酸序列包括rbd。
[0094]
将s1溶解在0.1m碳酸盐缓冲液中,以制备s1-a溶液和s1-b溶液。s1-a溶液中s1的浓度为5μmol/l。s1-b溶液中s1的浓度为1μmol/l。将0.1m碳酸盐缓冲液的ph调节至9.6。
[0095]
另外,制备α-淀粉酶(由lee biosolutions,inc.生产,产品编号120-17)作为阴性对照的靶物质。将α-淀粉酶溶解在0.1m碳酸盐缓冲液中,以制备α-淀粉酶溶液。α-淀粉酶溶液中α-淀粉酶的浓度为5μmol/l。
[0096]
用于制备s1-a溶液、s1-b溶液和α-淀粉酶溶液的缓冲溶液可以是除上文描述的0.1m碳酸盐缓冲溶液之外的缓冲溶液。缓冲溶液的实例包括常用的缓冲溶液,如1xpbs/t、1xpbs、1xtbs/t和1xtbs。
[0097]
接下来,将100μl的s1-a溶液滴加到elisa用96孔板h型(由sumitomo bakelite co.,ltd.生产,产品编号ms-8896f)的elisa孔的一部分上,并且将其在4℃下静置过夜。在下文中,其上滴加有s1-a溶液的elisa孔的部分被称为s1-a孔。此时,s1固定在s1-a孔上。
[0098]
另外,将100μl的s1-b溶液滴加到除s1-a孔之外的elisa孔的一部分上,并且将其在4℃下静置过夜。在下文中,其上滴加有s1-b溶液的elisa孔的部分将被称为s1-b孔。此时,s1固定在s1-b孔上。
[0099]
进一步地,将100μl的α-淀粉酶溶液滴加到既不是s1-a孔也不是s1-b孔的elisa孔的一部分上,并且将其在4℃下静置过夜。在下文中,其上滴加有α-淀粉酶溶液的elisa孔的部分将被称为α-淀粉酶孔。此时,α-淀粉酶固定在α-淀粉酶孔上。
[0100]
接下来,将s1-a孔、s1-b孔和α-淀粉酶孔分别用200μl 1xpbs/t洗涤。洗涤进行3次。
[0101]
接下来,将牛血清衍生的白蛋白(由fujifilm wako pure chemical industries,ltd.生产,商品编号013-15104)溶解在1xpbs/t中,以制备bsa溶液。在下文中,牛血清衍生的白蛋白被称为bsa。bsa溶液中bsa的浓度为3%(w/v)。
[0102]
接下来,将200μl的bsa溶液滴加到s1-a孔、s1-b孔和α-淀粉酶孔中的每一个上,并且将其在室温下静置2小时。此时,进行了阻断。
[0103]
接下来,将s1-a孔、s1-b孔和α-淀粉酶孔分别用200μl 1xpbs/t洗涤。洗涤进行3次。
[0104]
接下来,将50μl的缀合物溶液滴加到s1-a孔、s1-b孔和α-淀粉酶孔中的每一个上,并且将其在室温下静置1小时。缀合物溶液是含有上述“(3-1)缀合物的合成”中所合成的缀合物的溶液。此时,在s1-a孔和s1-b孔中,缀合物中的一些与s1结合。
[0105]
接下来,将s1-a孔、s1-b孔和α-淀粉酶孔分别用200μl 1xpbs/t洗涤。洗涤进行3
次。此时,未与靶物质结合的未结合缀合物被去除。
[0106]
制备4-硝基苯基磷酸二钠六水合物(由tokyo chemical industry生产,产品编号n0241)。在下文中,4-硝基苯基磷酸二钠六水合物被称为pnpp。pnpp是碱性磷酸酶诱导的代谢的底物。
[0107]
接下来,将pnpp溶解在含有碳酸盐缓冲溶液和硫酸镁的溶液中,以制备pnpp溶液。pnpp溶液中pnpp的浓度为10mmol/l。含有碳酸盐缓冲溶液和硫酸镁的溶液含有1mmol/l碳酸盐缓冲溶液和1mmol/l硫酸镁。将含有碳酸盐缓冲溶液和硫酸镁的溶液的ph调节至9.6。
[0108]
溶解pnpp的溶液可以是除含有碳酸盐缓冲溶液和硫酸镁的溶液之外的溶液。溶解pnpp的溶液的实例包括tris缓冲溶液、磷酸盐缓冲溶液、good's缓冲液等。good's缓冲液包括mes、bis-tris、ada、pipes、aces、mopso、bes、mops、tes、hepes、dipso、tapso、popso、heppso、epps、tricine、bicine、taps、ches、capso、caps等。
[0109]
溶解pnpp的溶液的ph可以是除9.6之外的值。溶解pnpp的溶液优选为弱碱性溶液。溶解pnpp的溶液的ph优选落在8(包括端点值)至11(包括端点值)之间的范围内。当溶解pnpp的溶液为弱碱性溶液时,由于使用pnpp作为底物的代谢而导致的ph变化变大。当溶解pnpp的溶液的ph落在8(包括端点值)至11(包括端点值)之间的范围内时,由于使用pnpp作为底物的代谢而导致的ph变化变大。
[0110]
接下来,将100μl的pnpp溶液滴加到s1-a孔、s1-b孔和α-淀粉酶孔中的每一个上,并且将其在37℃下静置10分钟。此时,如图3所示,在s1-a孔和s1-b孔中,缀合物的碱性磷酸酶的酶活性诱导使用pnpp作为底物的代谢,并且磷酸基团从pnpp中消除。
[0111]
结果,在s1-a孔和s1-b孔中生成了无机磷酸和对硝基苯酚。由于对硝基苯酚的最大吸收波长为405nm,因此在含有对硝基苯酚的溶液中显黄色。另外,使生成的无机磷酸在溶液中离子化,以释放出氢离子。因此,溶液的ph降低。
[0112]
接下来,将5μl的最终浓度为0.5mol/l的乙二胺四乙酸滴加到s1-a孔、s1-b孔和α-淀粉酶孔中的每一个上。此时,由碱性磷酸酶引起的代谢停止。
[0113]
接下来,在s1-a孔、s1-b孔和α-淀粉酶孔中的每一个中,使用酶标仪测量405nm波长处的吸光度。此外,以相同的方式测量空白样的吸光度。
[0114]
上述工艺流程示出在图4中。吸光度的测量结果示出在图5中。图5中的“s1 5μg/ml”对应于s1-a孔。图5中的“s1 1μg/ml”对应于s1-b孔。图5中的“α-淀粉酶5μg/ml”对应于α-淀粉酶孔。如图5所示,仅在s1-a孔和s1-b孔中观察到显色。
[0115]
吸光度的测量结果指示以下情况。缀合物的碱性磷酸酶即使在与dna适体融合的状态下也具有诱导使用pnpp作为底物的代谢的酶活性。另外,缀合物的dna适体即使在与标记物融合的状态下也具有对s1的结合活性。此外,缀合物的dna适体不具有对α-淀粉酶的结合活性。
[0116]
(3-3)进行用于靶物质的检测方法
[0117]
作为靶物质,制备新型冠状病毒sars-cov-2(在下文中被称为sars-cov-2)。通过将sars-cov-2悬浮在1xpbs/t中,制备5种类型的悬浮体。五种悬浮体仅在悬浮体中所含有的sars-cov-2的拷贝数方面有所不同。依据定量pcr,五种悬浮体中sars-cov-2的拷贝数分别为每1μl悬浮体101、102、103、104、105。针对五种悬浮体中的每一种进行以下步骤。
[0118]
接下来,将25μl的缀合物溶液滴加到25μl的悬浮体上,并使其在室温下静置10分
钟。缀合物溶液是含有上述“(3-1)缀合物的合成”中所合成的缀合物的溶液。缀合物溶液中缀合物的浓度为10mmol/l。此时,缀合物中的一些与靶物质结合。
[0119]
接下来,将静置后的全部量的悬浮体滴加到截留分子量为300k的nanocep离心过滤装置(由pall公司制造,产品编号od300c34)上,并且进行高速离心。将与靶物质结合的一些缀合物回收,并且将未与靶物质结合的剩余缀合物通过高速离心分离。
[0120]
接着,将截留分子量为300k的nanocep离心过滤装置用1xpbs/t洗涤3次。此时,未与sars-cov-2结合的未结合缀合物被去除。
[0121]
接下来,将pnpp溶解在含有碳酸盐缓冲溶液和硫酸镁的溶液中,以制备pnpp溶液。pnpp溶液中pnpp的浓度为10mmol/l。含有碳酸盐缓冲溶液和硫酸镁的溶液含有1mmol/l碳酸盐缓冲溶液和1mmol/l硫酸镁。将含有碳酸盐缓冲溶液和硫酸镁的溶液的ph调节至9.6。
[0122]
接下来,将pnpp溶液滴加到截留分子量为300k的nanocep离心过滤装置上,并且将其在37℃下静置10分钟。此时,如图3所示,碱性磷酸酶的酶活性诱导使用pnpp作为底物的代谢,并且磷酸基团从pnpp中消除。结果,生成无机磷酸和对硝基苯酚。由于对硝基苯酚的最大吸收波长为405nm,因此在含有对硝基苯酚的溶液中显黄色。另外,使生成的无机磷酸在溶液中离子化,以释放出氢离子。因此,溶液的ph降低。
[0123]
接下来,将截留分子量为300k的nanocep离心过滤装置中的溶液滴加到ph计上。ph计是紧凑型ph计laquatwin(由horiba,ltd.生产,产品编号ph-33b)。然后,记录滴加在ph计上的溶液的ph。上述步骤的流程示出在图6中。ph记录结果示出在图7中。图7中的“拷贝数”意指悬浮体中每1μl sars-cov-2的拷贝数。
[0124]
如图7所示,悬浮体中sars-cov-2的拷贝数越大,ph的变化量越大。ph的变化量意指该ph相对于空白样的ph的变化量。
[0125]
ph记录结果指示以下情况。缀合物的dna适体即使在与标记物融合的状态下也具有对sars-cov-2的结合活性。另外,缀合物的碱性磷酸酶即使在与dna适体融合的状态下也具有诱导使用pnpp作为底物的代谢的酶活性。另外,通过使用pnpp作为底物的代谢来生成无机磷酸,并且使其在溶液中离子化以释放氢离子。结果,溶液的ph降低。进一步地,当悬浮体中sars-cov-2的拷贝数为103或更多时,ph的变化量甚至更大。
[0126]
此外,为了去除未与靶物质结合的未结合缀合物,可以使用除截留分子量为300k的nanocep离心过滤装置之外的离心过滤装置。该离心过滤装置的分子量截留值例如相当于截留分子量为300k的nanocep离心过滤装置的分子量截留值。
[0127]
进一步地,用于去除未与靶物质结合的未结合缀合物的方法可以是除离心过滤之外的方法。用于去除未与靶物质结合的未结合缀合物的方法可以是使用elisa板或磁珠的夹心去除方法、通过使用滤纸或凝胶进行过滤层析的去除方法、或通过在载体(如凝胶)处携带抗体进行亲和层析的去除方法。
[0128]
进一步地,溶解pnpp的溶液可以是除含有碳酸盐缓冲溶液和硫酸镁的溶液之外的溶液。溶解pnpp的溶液的实例包括tris缓冲溶液、磷酸盐缓冲溶液、good's缓冲液等。good's缓冲液包括mes、bis-tris、ada、pipes、aces、mopso、bes、mops、tes、hepes、dipso、tapso、popso、heppso、epps、tricine、bicine、taps、ches、capso、caps等。
[0129]
进一步地,溶解pnpp的溶液的ph可以是除9.6之外的值。溶解pnpp的溶液优选为弱碱性溶液。溶解pnpp的溶液的ph优选落在8(包括端点值)至11(包括端点值)之间的范围内。
当溶解pnpp的溶液为弱碱性溶液时,由于使用pnpp作为底物的代谢而导致的ph变化变大。当溶解pnpp的溶液的ph落在8(包括端点值)至11(包括端点值)之间的范围内时,由于使用pnpp作为底物的代谢而导致的ph变化变大。
[0130]
(3-4)用于确认标记物的功能表达的测试
[0131]
通过将pnpp溶液添加到缀合物中,制备三种缀合物-pnpp溶液。缀合物通过上述“(3-1)缀合物的合成”来合成。pnpp溶液是在上述“(3-2)使用用于检测靶物质的方法”中产生的。
[0132]
三种缀合物-pnpp溶液仅在缀合物的浓度方面有所不同。三种缀合物-pnpp溶液中缀合物的浓度分别为1pmol/l、10pmol/l和100pmol/l。
[0133]
在三种缀合物-pnpp溶液中的每一种中,缀合物中所含有的碱性磷酸酶引起使用pnpp作为底物的代谢。针对三种缀合物-pnpp溶液中的每一种进行以下步骤。
[0134]
在制备缀合物-pnpp溶液之后,立即将缀合物-pnpp溶液滴加到ph计上。ph计是紧凑型ph计laquatwin(由horiba,ltd.生产,产品编号ph-33b)。
[0135]
在滴加后10分钟、滴加后20分钟和滴加后30分钟记录缀合物-pnpp溶液的ph。上述步骤的流程示出在图8中。ph记录结果示出在图9中。图9中的“缀合物的最终浓度”意指缀合物-pnpp溶液中缀合物的浓度。
[0136]
如图9所示,缀合物-pnpp溶液中缀合物的浓度越高,ph的变化量越大。ph的变化量是该ph相对于滴加后立即测量的ph的变化量。
[0137]
ph记录结果指示以下情况。缀合物中所含有的碱性磷酸酶即使在与dna适体融合的状态下也具有诱导使用pnpp作为底物的代谢的酶活性。另外,使通过使用pnpp作为底物的代谢生成的无机磷酸在溶液中离子化,以释放氢离子。结果,溶液的ph降低。
[0138]
4.其他实施方案
[0139]
尽管上文已经描述了本公开的实施方案,但本公开不限于上文描述的实施方案,并且可以进行各种修改以实现本公开。
[0140]
(4-1)上述实施方案中的一个要素的多种功能可以由多个要素实现,或者一个要素的一种功能可以由多个要素实现。进一步地,多个要素的多种功能可以由一个要素实现,或者由多个要素实现的一种功能可以由一个要素实现。可以省略上述实施方案的配置的一部分。进一步地,上述实施方案的配置的至少一部分可以被添加到上述另一实施方案的配置中或被其代替。
[0141]
(4-2)除上述缀合物之外,本公开还可以以如下等各种形式来实现:具有缀合物作为组分的构件、用于产生缀合物的方法、以及用于检测靶物质的方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1