一种极性脂质的定量测定方法及应用
1.本发明属于检测分析技术领域,涉及极性脂质的检测方法,尤其涉及一种应用超临界流体色谱-串联质谱法检测极性脂质的方法。
背景技术:
2.极性脂质包括磷脂、胆固醇、神经酰胺和神经节苷脂等。尽管极性脂质的含量在一些生物样品中含量较低(如仅占乳脂肪的2%),但其在生物和生理功能方面十分重要。极性脂质决定了细胞膜的完整性,并参与细胞信号、增殖和炎症反应等。在母乳中,极性脂质大部分分布于乳脂肪球膜(mfgm)上。胆固醇是母乳主要的固醇类脂质,也是mfgm的重要成分。近期研究表明,母乳极性脂质的组成非常复杂,且其中一些极性脂质与婴儿的认知发育高度相关乳脂以脂肪球形式存在于乳中,其核心甘油三酯被外部由磷脂、胆固醇等极性脂质组成的膜包围,从而保持整个乳液体系稳定。胆固醇是细胞膜的重要成分,乳中磷脂与婴儿大脑和肠道免疫系统发育、胃肠道感染保护以及老年人记忆力改善相关,磷脂酰胆碱(pc)和神经鞘磷脂(sm)是重要的极性脂质,是器官和细胞膜快速生长所需的结构成分。
3.由于在一些生物样本中极性脂质含量极少。因此,在一些检测过程中,高含量的甘油三酯等其他脂类物质对极性脂质的检测造成干扰,这为组成复杂、性质差异大的极性脂质分析大大增加了难度。因此,往往需要对极性脂质进行富集和净化。
4.固相萃取(spe)是样品制备的有效方法之一,其基本原理类似于液-液萃取,该方法能够从样品溶液中吸附并富集和纯化固体吸附剂填料上的分析物。针对极性脂质的富集和净化,目前已有的专利和文献针对磷脂进行富集,然而现有方法大多存在神经鞘磷脂和胆固醇损失的问题。胆固醇相比于磷脂,与甘油三酯的极性更接近,使得分离纯化难度提高。另外,已有专利cn106153763a通过液相对极性脂质进行分离纯化,但该方法存在操作繁复,易造成胆固醇和神经鞘磷脂的损失,且单次样本乳脂消耗量大等问题。
5.相关技术中,鲜有报道能够同时定量检测胆固醇、磷脂和神经节苷脂的组成,这往往需要多种不同的检测方法,进而导致了数据无法统一并且增加了样品消耗量,使得一些珍稀样品的检测受到了限制。另外,相关技术中的极性脂质的色谱检测方法时间普遍较长,使得极性脂质分子种类难以实现准确定性。
技术实现要素:
6.因此,为了克服上述目前相关技术中的缺陷,本发明的第一个目的是提供一种极性脂质的检测方法,包含以固相萃取为前处理方法和以超临界流体色谱-质谱为检测分析仪器,包括以下步骤:
7.(1)提取含有极性脂质的总脂质物:
8.向乳液体原料、乳制品或血浆中加入有机溶剂a后震荡混匀,加入内标溶液b,再加入有机溶剂c后震荡混匀,然后超声,冰水浴超声5~20分钟,再加入液体d震荡混匀促进分层,得到混合物ⅰ;
pe(15:0/18:1-d7),10μg/ml pi(15:0/18:1-d7),5μg/ml lpe 18:1-d7,7μg/ml pa(15:0/18:1-d7),5μg/ml ps(15:0/18:1-d7),160μg/ml pc(15:0/18:1-d7),30μg/ml sm(d18:1-d9)和25μg/ml lpc 18:1-d7。
27.可选地,所述乳液体原料、乳制品或血浆与所述甲醇的体积比为1:2~1:8;所述乳液体原料、乳制品或血浆与所述内标溶液b的体积比为20:1~80:1;所述乳液体原料、乳制品或血浆与所述甲基叔丁基醚的体积比为1:4~1:15;所述乳液体原料、乳制品或血浆与所述超纯水的体积比为1:1~1:5。
28.通过对有机溶剂a、内标溶液b、有机溶剂c、液体d的选用,和其各配比范围的选取调整,实现了在上述各配比的条件下,含有极性脂质的总脂质物的提取效果最佳;
29.可选地,所述含有极性脂质的总脂质提取物与所述有机溶剂e的质量体积比为30mg:1ml~100mg:1ml;所述含有极性脂质的总脂质提取物与所述有机溶剂f的质量体积比为5mg:1ml~25mg:1ml;所述含有极性脂质的总脂质提取物与所述有机溶剂g的质量体积比为10mg:1ml~50mg:1ml;所述含有极性脂质的总脂质提取物与所述有机溶剂h的质量体积比为30mg:1ml~90mg:1ml;所述含有极性脂质的总脂质提取物与所述有机溶剂i的质量体积比为5mg:1ml~25mg:1ml;含有极性脂质的总脂质提取物与所述有机溶剂j的质量体积比为5mg:1ml~50mg:1ml。
30.通过对有机溶剂e、有机溶剂f、溶液g、有机溶剂h和有机溶剂i的选用,和其各配比范围的选取调整,实现了在上述各配比条件下,含有极性脂质的极性脂质的富集和净化所用样品消耗少,能够实现14个大类极性脂质的富集。
31.对胆固醇、神经酰胺和磷脂采用内标法并结合标准曲线对极性脂质进行定量检测,计算标准浓度/内标物浓度-标准浓度面积/内标物面积的标准曲线方程,并计算线性范围和相关系数;对神经节苷脂采用外标法进行定量检测,计算线性方程、线性范围和相关系数。
32.可选地,所述超声条件为40khz;离心条件为25℃,8000rpm,离心10min。
33.可选地,所述固相萃取洗脱时的流速为0.03~0.1ml/min,优选为0.05ml/min。
34.可选地,所述极性脂质包含:胆固醇、神经酰胺cer、磷脂酰甘油pg、磷脂酰乙醇胺pe、磷脂酰肌醇pi、溶血磷脂酰乙醇胺lpe、磷脂酸pa、单唾液酸神经节苷酯gm3、磷脂酰丝氨酸ps、磷脂酰胆碱pc、双唾液酸神经节苷酯gd3、神经鞘磷脂sm、溶血磷脂酰胆碱lpc和心磷脂cl。
35.本发明的有益效果:
36.本发明的检测方法包括:含有极性脂质的总脂质物的提取步骤,极性脂质的富集和净化得到极性脂质富集物的步骤以及对极性脂质富集物复溶后进行超临界流体色谱-质谱检测分析的步骤,实现了极性脂质极低含量(小于5%)样品的富集,操作简便、样品消耗量少、成本较低、检测迅速、定性定量能力较强、实用性强,结果稳定可靠,适合统一检测乳中极性范围分布较广的极性脂质。可在10分钟内检测14大类极性脂质,适用于各种乳液、乳制品、乳粉及其他生物样本中的极性脂质的快速分析。通过使用内标法测定的结果较为准确,由于是通过测量内标物及被测组分的峰面积的相对值来进行计算的,因而在一定程度上消除了操作条件和上样体积等的变化所引起的误差。
附图说明
37.附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
38.图1为实施例1的极性脂质富集与净化各洗脱液薄层色谱结果图,薄层色谱条件为:20*20cm硅胶玻璃板,点样后在展开剂正己烷:乙醚:乙酸(80:20:1,v/v/v)内展开,溶剂前沿展开至距板前沿1cm处时将板取出,干燥后用碘显色,下同;
39.图2为实施例3的极性脂质富集与净化各洗脱液薄层色谱结果图;
40.图3为实施例5的极性脂质富集与净化各洗脱液薄层色谱结果图;
41.图4为实施例1的超临界流体色谱总离子流色谱图;
42.图5为实施例2的超临界流体色谱总离子流色谱图;
43.图6为实施例3的超临界流体色谱总离子流色谱图;
44.图7为实施例4的超临界流体色谱总离子流色谱图;
45.图8为实施例5的超临界流体色谱总离子流色谱图;
46.图9为实施例6的超临界流体色谱总离子流色谱图。
具体实施方案
47.下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:以下将详细说明本发明的具体实施方式,使本领域的技术人员更清楚地理解如何实践本发明。应当理解,尽管结合其优选的具体实施方案描述了本发明,但这些实施方案只是阐述,而不是限制本发明的范围。
48.本发明中极性脂质包含以下14个大类:胆固醇、神经酰胺(cer)、磷脂酰甘油(pg)、磷脂酰乙醇胺(pe)、磷脂酰肌醇(pi)、溶血磷脂酰乙醇胺(lpe)、磷脂酸(pa)、单唾液酸神经节苷酯(gm3)、磷脂酰丝氨酸(ps)、磷脂酰胆碱(pc)、双唾液酸神经节苷酯(gd3)、神经鞘磷脂(sm)、溶血磷脂酰胆碱(lpc)和心磷脂(cl)。
49.本发明中的“乳液体原料”是指人、牛、羊、驴或骆驼等哺乳动物从乳腺分泌的白色或者微黄色不透明液体;“乳制品”是指使用牛乳、羊乳、驴乳或骆驼乳及其加工制品为主要原料,加入或不加入适量的维生素、矿物质和其他辅料,经加工制成的液体剂、粉剂、凝胶剂、糊剂、固体剂、浓缩剂、混悬剂、或即用形式的各种食品。
50.本发明中所用材料与试剂:
51.磷脂酰甘油pg(16:0/18:1),磷脂酰乙醇pe(14:0/14:0),磷脂酰肌醇pi(16:1/16:0),溶血磷脂酰乙醇胺lpe(18:1/0:0),磷脂酸pa(16:0/18:1),单唾液酸神经节苷酯gm3,神经鞘磷脂sm(d18:1/23:0),溶血磷脂酰胆碱lpc(18:1/0:0)和双唾液酸神经节苷酯gd3标准品均购自瑞典larodan fine chemicals ab公司。
52.神经酰胺cer(d18:1/16:0),心磷脂cl(14:0/14:0/14:0/14:0)标准品:美国avanti polar lipids公司;磷脂酰丝氨酸ps(14:0/14:0)标准品:美国sigma公司;胆固醇标准品:中国aladdin公司;同位素内标神经酰胺cer(d18:1-d7/15:0),心磷脂cl(18:2/18:2/18:2/18:2)-d5和splash lipidomix混合内标:美国avanti polar lipids公司硅胶固相萃取柱:上海安谱实验科技公司;色谱级正己烷:中国泰坦科技公司;色谱级甲醇:美国tedia high purity solvents公司;色谱级氯仿:中国国药试剂公司;高纯二氧化碳(纯度
≥99.999%):无锡鑫锡仪气体公司。
53.实施例中超临界流体色谱分析条件:色谱柱为acquity upc
2 beh(150mm
×
3.0mm,1.7μm,waters,usa);柱温55℃,背压1500psi,进样体积2μl;洗脱液a为超临界co2(纯度≥99.99%),洗脱液b为甲醇/水溶液(甲醇体积百分比97%),洗脱液b中含有20mm的甲酸铵,流动相流速为1.1ml/min洗脱梯度为0min,5%洗脱液b;5.5min,48%洗脱液b;10min,48%洗脱液b。
54.实施例中质谱分析条件:碰撞气体(氩气)流速50l/h,去溶剂化气体(氮气)流速700l/h,离子源温度100℃,脱溶剂温度400℃,锥孔电压30ev,低能量碰撞设为6ev,高能量碰撞设为20~45ev,质荷比扫描范围为100~1600m/z。
55.本发明中所涉及的同位素内标混合液包含以下几种:
56.cer(d18:1-d7/15:0):该神经酰胺分子结构中鞘氨醇部分为c18:1且含7个氘,脂肪酸部分为c15:0;
57.cl(18:2/18:2/18:2/18:2)-d5:该心磷脂分子结构中所有脂肪酸均为c18:2,且连接两个磷酸基团的甘油骨架含5个氘;
58.胆固醇-d7:该胆固醇结构中含有7个氘;
59.pg(15:0/18:1-d7):该磷脂酰甘油分子结构中的两条脂肪酸侧链为c15:0和c18:1,其中c18:1含7个氘;
60.pe(15:0/18:1-d7):该磷脂酰乙醇胺分子结构中的两条脂肪酸侧链为c15:0和c18:1,其中c18:1含7个氘;
61.pi(15:0/18:1-d7):该磷脂酰肌醇分子结构中的两条脂肪酸侧链为c15:0和c18:1,其中c18:1含7个氘;
62.lpe 18:1-d7,该溶血磷脂酰乙醇胺分子结构中的脂肪酸侧链为c18:1,其中c18:1含7个氘;
63.pa(15:0/18:1-d7):该磷脂酸分子结构中的两条脂肪酸侧链为c15:0和c18:1,其中c18:1含7个氘;
64.ps(15:0/18:1-d7):该磷脂酰丝氨酸分子结构中的两条脂肪酸侧链为c15:0和c18:1,其中c18:1含7个氘;
65.pc(15:0/18:1-d7):该磷脂酰胆碱分子结构中的两条脂肪酸侧链为c15:0和c18:1,其中c18:1含7个氘;
66.sm(d18:1-d9):该神经酰胺分子结构中鞘氨醇部分为c18:1且含9个氘;
67.lpc 18:1-d7:该溶血磷脂酰胆碱分子结构中的脂肪酸侧链为c18:1,其中c18:1含7个氘;
68.以下通过实施例对本发明做进一步介绍。
69.实施例1:母乳样品中极性脂质的检测
70.1)含有极性脂质的总脂质物的提取:
71.向4ml母乳中,即乳液体原料中加入10ml甲醇和40μl内标溶液后震荡30秒混匀,再加入20ml甲基叔丁基醚后震荡15分钟至混匀,然后超声冰水浴10分钟,再加入超纯水4.5ml,促进分层并震荡60秒混匀,得到混合物ⅰ。
72.将所得的混合物ⅰ经离心机离心,移取上层有机溶液,用真空离心浓缩仪去除水分
和溶剂,得到含有极性脂质的总脂质提取物;
73.2)极性脂的富集和净化得到极性脂质富集物:
74.先对固相萃取柱进行活化处理,固相萃取柱填料为硅胶500mg/3ml,通过使用正己烷实现活化;将10mg含有极性脂质的总脂质提取物溶解于100μl氯仿:甲醇按体积比为8:1的混合液,得到上样液,加载到活化的固相萃取柱上;
75.先后用1ml正己烷:乙醚按体积比为50:1的混合液和0.6ml正己烷:乙醚按体积比为6:1的混合液洗脱柱体,得到含有大部分甘油三酯的中性脂洗脱液;
76.先后用0.5ml正己烷:乙醚按体积比为1:1的混合液、3ml甲醇和1.5ml氯仿:甲醇:水按体积比为3:5:2的混合液洗脱柱体,得到富含极性脂质的洗脱液,并用氮气吹干得到极性脂质富集物。
77.3)对极性脂质富集物进行超临界流体色谱-质谱检测分析:
78.将胆固醇、神经酰胺(cer)、磷脂酰甘油(pg)、磷脂酰乙醇胺(pe)、磷脂酰肌醇(pi)、溶血磷脂酰乙醇胺(lpe)、磷脂酸(pa)、磷脂酰丝氨酸(ps)、磷脂酰胆碱(pc)、神经鞘磷脂(sm)和溶血磷脂酰胆碱(lpc)标准品用氯仿甲醇(2:1,v/v)配成极性脂质混合标准溶液储备液。采用内标法结合浓度-峰面积标准曲线实现定量分析,运用progenesis qi软件中的lipidblast和progenesis metscope自建本地数据库进行定量分析。
79.结果如下:
80.1、固相萃取回收率采用通过将比较固相萃取前后极性脂质平均峰面积(6次平行),确定极性脂质标准品的回收率,结果如表1。薄层色谱结果,参见图1,显示大部分的甘油三酯被有效去除,胆固醇被保留在极性脂质富集物的组分中。
81.表1极性脂质回收率测定
[0082][0083]
2、计算标准浓度/内标物浓度-标准浓度面积/内标物面积的标准曲线方程,并计算线性范围和相关系数。取3份10mg母乳极性脂质富集物作为空白样品,用氯仿:甲醇按体积比为2:1的混合液复溶至5mg/ml,分别添加含量约为母乳极性脂质富集物中各极性脂质
含量1.2倍、1倍、0.8倍的高、中、低3个浓度水平的混合标准溶液和等量40ul内标溶液,进行方法学验证,每个加标水平下做3次平行,并结合标准曲线方程,计算本方法的日内精密度、日间精密度和回收率,参见表2、表3。
[0084]
表2胆固醇、神经酰胺和磷脂标准品的标准曲线方程
[0085][0086][0087]
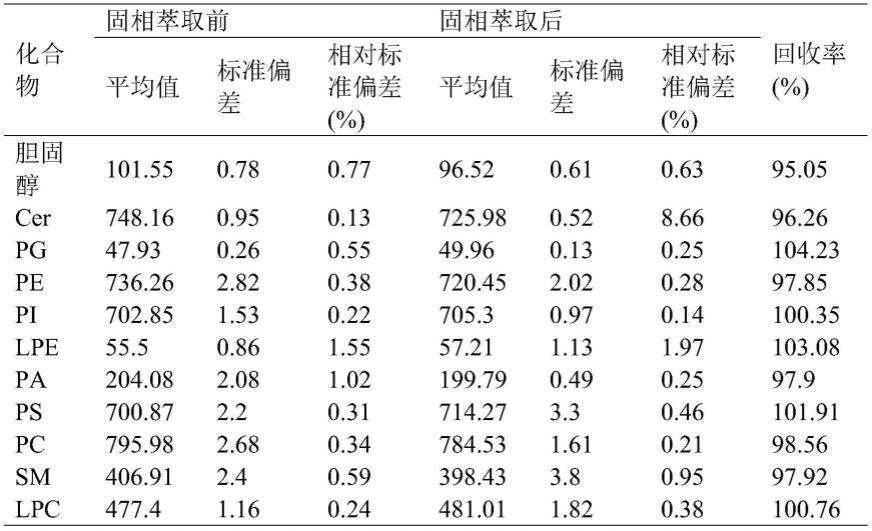
表3胆固醇、神经酰胺和磷脂标准品的精密度和加标回收率
[0088][0089]
3、超临界流体色谱结果如图4。质谱检测结果:母乳中共检测出187种极性脂质,且含胆固醇11.263mg/100ml、神经酰胺(cer)7.813mg/100ml、磷脂酰甘油(pg)0.018mg/100ml、磷脂酰乙醇胺(pe)2.154mg/100ml、磷脂酰肌醇(pi)0.341mg/100ml、溶血磷脂酰乙醇胺(lpe)0.546mg/100ml、磷脂酸(pa)0.118mg/100ml、磷脂酰丝氨酸(ps)0.949mg/100ml、磷脂酰胆碱(pc)2.146mg/100ml、神经鞘磷脂(sm)8.541mg/100ml、溶血磷脂酰胆碱(lpc)0.039mg/100ml,并检测出心磷脂(cl)8种。
[0090]
实施例2:母乳样品中神经节苷脂的检测
[0091]
1)神经节苷脂富集物提取:
[0092]
向4ml母乳经过实施例1中加入4ml去离子水后震荡30秒混匀,再加入21.6ml甲醇和10.8ml氯仿。在25℃下以150rpm缓和震荡30分钟后,所得的混合物用离心机在25℃下,以8000rpm离心10分钟。收集富含极性脂质的上清液,并向下层沉淀中加入4ml去离子水和2ml氯仿:甲醇按体积比为1:2的混合液进行二次提取。在25℃下,以150rpm缓和震荡30分钟后,混合物用离心机25℃以8000rpm离心10分钟。收集富含极性脂质的上清液,将两次提取的富含极性脂质的上清液合并后加入10.4ml去离子水,然后轻轻倒置4次,用离心机25℃以8000rpm离心10分钟。收集富含神经节苷脂的上清液。向剩余混合物加入4ml浓度为0.01mol/l的氯化钾溶液,并用离心机25℃以8000rpm离心10分钟,收集富含神经节苷脂的上清液。合并两次提取的富含神经节苷脂的上清液,用氮气吹干,得到神经节苷脂富集物。
[0093]
2)将所得的神经节苷脂富集物进行超临界流体色谱-质谱检测分析:
[0094]
将单唾液酸神经节苷酯(gm3)和双唾液酸神经节苷酯(gd3)标准品用氯仿:甲醇按体积比为2:1的混合液,配成神经节苷脂混合标准溶液储备液。采用外标法实现定量分析,运用progenesis qi软件中的lipidblast和progenesis metscope自建本地数据库进行定量分析。
[0095]
结果如下:
[0096]
1、取3份从4ml母乳富集的神经节苷脂富集物作为空白样品,用0.5ml氯仿:甲醇按体积比为2:1的混合液复溶,分别添加含量约为母乳神经节苷脂富集物中各神经节苷脂含量1.2倍、1倍、0.8倍的高、中、低3个浓度水平的混合标准溶液,进行方法学验证,每个加标水平下做3次平行,计算方法的日内精密度、日间精密度和回收率,参见表3、表4。
[0097]
表3神经节苷脂的线性回归方程
[0098][0099]
表4神经节苷脂标准品的精密度和加标回收率
[0100][0101]
2、超临界流体色谱结果如图5。质谱检测结果:母乳中检测出单唾液酸神经节苷酯(gm3)0.186mg/100ml、双唾液酸神经节苷酯(gd3)0.666mg/100ml。母乳中双唾液酸神经节苷酯(gd3)浓度单唾液酸神经节苷酯(gm3)的3.5倍。
[0102]
实施例3:骆驼乳样品中极性脂质的检测
[0103]
1)含有极性脂质的总脂质物的提取:
[0104]
向4ml骆驼乳中,即乳液体原料中加入10ml甲醇和40μl内标溶液后震荡30秒混匀,再加入20ml甲基叔丁基醚后震荡15分钟至混匀,然后超声冰水浴10分钟,再加入超纯水4.5ml,促进分层并震荡60秒混匀,得到混合物ⅰ。
[0105]
将所得的混合物ⅰ经离心机离心,移取上层有机溶液,用真空离心浓缩仪去除水分和溶剂,得到含有极性脂质的总脂质提取物;
[0106]
2)极性脂质的富集和净化得到极性脂质富集物:
[0107]
先对固相萃取柱进行活化处理,固相萃取柱填料为硅胶1g/6ml,通过使用正己烷实现活化;将55mg含有极性脂质的总脂质提取物溶解于1ml氯仿:甲醇按体积比为4:1的混合液,得到上样液,加载到活化的固相萃取柱上;
[0108]
先后用5ml正己烷:乙醚按体积比为50:1的混合液和3ml正己烷:乙醚按体积比为4:1的混合液洗脱柱体,得到含有大部分甘油三酯的中性脂洗脱液;
[0109]
先后用2ml正己烷:乙醚按体积比为1:1的混合液、4ml甲醇和3ml氯仿:甲醇:水按体积比为3:5:2的混合液洗脱柱体,得到富含极性脂质的洗脱液,并用氮气吹干得到极性脂质富集物。
[0110]
3)对极性脂质富集物进行超临界流体色谱-质谱检测分析:
[0111]
将胆固醇、神经酰胺(cer)、磷脂酰甘油(pg)、磷脂酰乙醇胺(pe)、磷脂酰肌醇(pi)、溶血磷脂酰乙醇胺(lpe)、磷脂酸(pa)、磷脂酰丝氨酸(ps)、磷脂酰胆碱(pc)、神经鞘磷脂(sm)和溶血磷脂酰胆碱(lpc)标准品用氯仿甲醇(2:1,v/v)配成极性脂质混合标准溶液储备液。采用内标法结合浓度-峰面积标准曲线实现定量分析,运用progenesis qi软件中的lipidblast和progenesis metscope自建本地数据库进行定量分析。
[0112]
结果如下:
[0113]
1、薄层色谱结果,参见图2,显示大部分的甘油三酯被有效去除,但同时胆固醇因部分随中性脂洗脱液流出而损失。
[0114]
2、同实施例1。
[0115]
3、超临界流体色谱结果如图6。质谱检测结果:骆驼乳中共检测出170种极性脂质,且其中含胆固醇56.166mg/100ml、神经酰胺(cer)60.885mg/100ml、磷脂酰甘油(pg)0.200mg/100ml、磷脂酰乙醇胺(pe)108.151mg/100ml、磷脂酰肌醇(pi)1.603mg/100ml、溶血磷脂酰乙醇胺(lpe)0.599mg/100ml、磷脂酸(pa)0.336mg/100ml、磷脂酰丝氨酸(ps)7.704mg/100ml、磷脂酰胆碱(pc)40.923mg/100ml、神经鞘磷脂(sm)62.292mg/100ml、溶血磷脂酰胆碱(lpc)0.238mg/100ml、并检测出心磷脂(cl)7种、实施例4:乳脂肪球膜配料样品中极性脂质的检测
[0116]
1)脂质提取:
[0117]
将1g配方奶粉末溶解于4ml去离子水,并加入10ml甲醇和40μl内标溶液后震荡30秒混匀,再加入20ml甲基叔丁基醚后震荡15分钟至混匀,然后超声冰水浴10分钟,再加入超纯水4.5ml,促进分层并震荡60秒混匀,得到混合物ⅰ。
[0118]
将所得的混合物ⅰ经离心机离心,移取上层有机溶液,用真空离心浓缩仪去除水分和溶剂,得到含有极性脂质的总脂质提取物,因乳脂肪球膜配料中甘油三酯含量较少,因此可作为极性脂质富集物。
[0119]
2)所得的极性脂质富集物进行超临界流体色谱-质谱检测分析:
[0120]
将胆固醇、神经酰胺(cer)、磷脂酰甘油(pg)、磷脂酰乙醇胺(pe)、磷脂酰肌醇(pi)、溶血磷脂酰乙醇胺(lpe)、磷脂酸(pa)、磷脂酰丝氨酸(ps)、磷脂酰胆碱(pc)、神经鞘磷脂(sm)和溶血磷脂酰胆碱(lpc)标准品用氯仿甲醇(2:1,v/v)配成极性脂质混合标准溶
液储备液。采用内标法结合浓度-峰面积标准曲线实现定量分析,运用progenesis qi软件中的lipidblast和progenesis metscope自建本地数据库进行定量分析。
[0121]
结果如下:
[0122]
1、同实施例1。
[0123]
2、同实施例1。
[0124]
3、超临界流体色谱结果如图7。质谱检测结果:乳脂肪球膜配料中共检测出146种极性脂质,且其中含胆固醇125.715mg/g、神经酰胺(cer)34.164mg/g、磷脂酰甘油(pg)0.706mg/g、磷脂酰乙醇胺(pe)363.542mg/g、磷脂酰肌醇(pi)12.130mg/g、溶血磷脂酰乙醇胺(lpe)2.072mg/g、磷脂酸(pa)2.054mg/g、磷脂酰丝氨酸(ps)55.555mg/g、磷脂酰胆碱(pc)103.587mg/g、神经鞘磷脂(sm)184.074mg/g、溶血磷脂酰胆碱(lpc)0.189mg/g,并检测出心磷脂(cl)4种。
[0125]
实施例5:配方奶样品中极性脂质的检测
[0126]
1)脂质提取:
[0127]
将1g配方奶粉末溶解于4ml去离子水,并加入10ml甲醇和40μl内标溶液后震荡30秒混匀,再加入20ml甲基叔丁基醚后震荡15分钟至混匀,然后超声冰水浴10分钟,再加入超纯水4.5ml,促进分层并震荡60秒混匀,得到混合物ⅰ。
[0128]
将所得的混合物ⅰ经离心机离心,移取上层有机溶液,用真空离心浓缩仪去除水分和溶剂,得到含有极性脂质的总脂质提取物;
[0129]
2)富集和净化:
[0130]
先对固相萃取柱进行活化处理,固相萃取柱填料为硅胶1g/6ml,通过使用正己烷实现活化;将50mg含有极性脂质的总脂质提取物溶解于1ml氯仿:甲醇按体积比为4:1的混合液,得到上样液,加载到活化的固相萃取柱上;
[0131]
先后用5ml正己烷:乙醚按体积比为50:1的混合液和3ml正己烷:乙醚按体积比为8:1的混合液洗脱柱体,得到含有大部分甘油三酯的中性脂洗脱液;
[0132]
先后用1ml正己烷:乙醚按体积比为1:1的混合液、4ml甲醇和3ml氯仿:甲醇:水按体积比为3:5:2的混合液洗脱柱体,得到富含极性脂质的洗脱液,并用氮气吹干得到极性脂质富集物。
[0133]
3)对极性脂质富集物进行超临界流体色谱-质谱检测分析:
[0134]
将胆固醇、神经酰胺(cer)、磷脂酰甘油(pg)、磷脂酰乙醇胺(pe)、磷脂酰肌醇(pi)、溶血磷脂酰乙醇胺(lpe)、磷脂酸(pa)、磷脂酰丝氨酸(ps)、磷脂酰胆碱(pc)、神经鞘磷脂(sm)和溶血磷脂酰胆碱(lpc)标准品用氯仿甲醇(2:1,v/v)配成极性脂质混合标准溶液储备液。采用内标法结合浓度-峰面积标准曲线实现定量分析,运用progenesis qi软件中的lipidblast和progenesis metscope自建本地数据库进行定量分析。
[0135]
结果如下:
[0136]
1、薄层色谱结果,参见图3,显示胆固醇被保留在极性脂质的组分,但甘油三酯在极性脂质洗脱液中保留较多。
[0137]
2、同实施例1
[0138]
3、超临界流体色谱结果如图8。质谱检测结果:配方奶中共检测出207种极性脂质,且其中含胆固醇1.311mg/g、神经酰胺(cer)1.224mg/g、磷脂酰甘油(pg)0.714mg/g、磷脂酰
乙醇胺(pe)49.722mg/g、磷脂酰肌醇(pi)1.063mg/g、溶血磷脂酰乙醇胺(lpe)0.413mg/g、磷脂酸(pa)0.810mg/g、磷脂酰丝氨酸(ps)0.986mg/g、磷脂酰胆碱(pc)64.789mg/g、神经鞘磷脂(sm)24.428mg/g、溶血磷脂酰胆碱(lpc)0.509mg/g,并检测出心磷脂(cl)7种。
[0139]
通过以上优选实施例可以看出,本发明的检测方法在所有优选实施例中实现了10分钟内统一检测乳中极性范围分布较广的14大类极性脂质,且检测迅速、定性定量能力较强、实用性强,结果稳定可靠,适合。对比实施例2,实施例3富集和净化时中性脂去除效果与实施例2类似,但造成了少量胆固醇的损失;对比实施例2,实施例5富集和净化时胆固醇保留能力与实施例2类似,但甘油三酯残留较多。但总体而言,本发明中富集和净化所用的固相萃取方法能够适用于极性脂质极低含量(小于5%)样品的富集,操作简便、样品消耗量少且成本较低。
[0140]
实施例6:血液样品中极性脂质的检测
[0141]
1)脂质提取:
[0142]
向100μl血浆加入250μl加入0.3ml甲醇和10μl内标溶液后震荡30秒混匀,再加入1ml甲基叔丁基醚后震荡15分钟至混匀,然后超声冰水浴10分钟,再加入超纯水0.35ml,促进分层并震荡60秒混匀,得到混合物ⅰ。
[0143]
将所得的混合物ⅰ经离心机离心,移取上层有机溶液,用真空离心浓缩仪去除水分和溶剂,得到含有极性脂质的总脂质提取物;因血液样品中甘油三酯含量较少,因此可作为极性脂质富集物。
[0144]
4)所得的极性脂质富集物进行超临界流体色谱-质谱检测分析:
[0145]
将胆固醇、神经酰胺(cer)、磷脂酰甘油(pg)、磷脂酰乙醇胺(pe)、磷脂酰肌醇(pi)、溶血磷脂酰乙醇胺(lpe)、磷脂酸(pa)、磷脂酰丝氨酸(ps)、磷脂酰胆碱(pc)、神经鞘磷脂(sm)和溶血磷脂酰胆碱(lpc)标准品用氯仿甲醇(2:1,v/v)配成极性脂质混合标准溶液储备液。采用内标法结合浓度-峰面积标准曲线实现定量分析,运用progenesis qi软件中的lipidblast和progenesis metscope自建本地数据库进行定量分析。
[0146]
结果如下:
[0147]
1、同实施例1。
[0148]
2、同实施例1。
[0149]
3、超临界流体色谱结果如图9。质谱检测结果:血浆中共检测出247种极性脂质,其中含胆固醇312.913μg/ml、神经酰胺(cer)20.686μg/ml、磷脂酰甘油(pg)0.235μg/ml、磷脂酰乙醇胺(pe)20.868μg/ml、磷脂酰肌醇(pi)33.487μg/ml、溶血磷脂酰乙醇胺(lpe)3.909μg/ml、磷脂酸(pa)1.858μg/ml、磷脂酰丝氨酸(ps)20.666μg/ml、磷脂酰胆碱(pc)814.709μg/ml、神经鞘磷脂(sm)129.198μg/ml、心磷脂(cl)3.378μg/ml、溶血磷脂酰胆碱(lpc)49.996μg/ml。
[0150]
通过以上优选实施例可以看出,本发明的检测方法在所有优选实施例中实现了10分钟内统一检测乳中极性范围分布较广的14大类极性脂质,且检测迅速、定性定量能力较强、实用性强,结果稳定可靠,适合。对比实施例2,实施例3富集和净化时中性脂去除效果与实施例2类似,但造成了少量胆固醇的损失;对比实施例2,实施例5富集和净化时胆固醇保留能力与实施例2类似,但甘油三酯残留较多。但总体而言,本发明中富集和净化所用的固相萃取方法能够适用于极性脂质极低含量(小于5%)样品的富集,操作简便、样品消耗量少
且成本较低。
[0151]
以上仅以较佳实施例对本发明的技术方案进行介绍,但是对于本领域的一般技术人员,依据本发明实施例的思想,应能在具体实施方式上及应用范围上进行改变,故而,综上所述,本说明书内容不应该理解为本发明的限制,凡在本发明的精神和原理之内所作的任何修改、等同替换、改进等,均应包含在本发明的权利要求范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1