无酶核酸放大和选择性识别反应辅助IFN-γ的均相双荧光和二元可视化分析方法及应用
无酶核酸放大和选择性识别反应辅助ifn-γ
的均相双荧光和二元可视化分析方法及应用
技术领域
1.本发明涉及生物医学诊断技术领域,尤其是涉及一种无酶核酸放大和选择性识别反应辅助结核ifn-γ的均相双荧光和二元可视化分析方法。
背景技术:
2.现有结核ifn-γ检测技术主要包含:1.应用于临床的基于抗原-抗体识别的酶联免疫吸附分析(enzyme-linked immunosorbent assay,elisa);2.近年来取得不断发展的基于适配体识别的检测技术。
3.针对第一种情形,基于elisa的ifn-γ检测首先利用包被抗体识别结合样本中的ifn-γ,然后加入辣根过氧化物酶(horse radishperoxidase,hrp)标记抗体进行二次温育,形成“包被抗体-ifn-γ-酶标抗体复合物”,复合物上连接的hrp催化显色底物(tmb)显色,最终通过酶标仪检测吸光度(a值)以定量。
4.该技术尚存在以下不足:
①
包含多次孵育,且每次孵育结束均需洗涤以去除未结合试剂,过程为非均相,操作步骤复杂耗时,影响检测结果准确性和可重复性;
②
灵敏度不足,检测浓度范围窄(2-400pg/ml);
③
抗体的使用使得检测成本高且试剂存储条件苛刻。
5.针对第二种情形,适配体是一类由体外筛选技术从随机单链寡核苷酸文库中筛选得到的可与目标物(包括无机离子、小分子、多肽、蛋白质、细菌、药物甚至细胞)高特异性、高亲和力结合的单链寡核苷酸,是长度一般为25-80个碱基的dna或rna序列。适配体结合相应目标物的亲和力可与抗原-抗体亲和力相媲美,且较之抗体更加灵活,同时具备易合成、易修饰、稳定性好的优点。利用ifn-γ与其特异性适配体的高特异性、高亲和力结合特性以进行ifn-γ检测为摆脱抗体依赖提供了更好的选择。
6.适配体与ifn-γ的结合具备较强的特异性,可有效解决因抗体造成的试剂及其存储成本高的问题,但已报道的基于适配体识别的ifn-γ检测技术仍存在以下缺点:
①
大多缺乏信号放大策略,灵敏度低(局限于pg/ml水平);
②
缺乏不依赖仪器设备的可视化技术,难以实现即时检测(point-of-care testing,poct);
③
基于荧光信号的报告多通过化学修饰引入荧光基团,成本高,设计难。
7.为获得更高的灵敏度,引入信号放大策略对基于适配体识别的ifn-γ分析具有重要意义。近年来,可提高分析性能的多种信号放大策略相继被报道,其中主要包括核酸放大和纳米材料辅助两种方式。不同于依赖酶促的聚合酶链式反应(polymerase chain reaction,pcr)、环介导等温扩增(loop-mediated isothermal amplification,lamp)等核酸扩增技术,无酶扩增技术如催化发卡组装(cha)、链置换放大(strand displacement amplification,sda)、杂交链式反应(hybridization chainreaction,hcr)等可在室温条件反应,不依赖精密控温设备,被广泛使用。其中,cha还具备设计简单、成本低的优势。然而,相比于基于酶促的扩增技术,无酶cha的扩增能力有限。
技术实现要素:
8.有鉴于此,本发明的目的之一在于提供一种无酶核酸放大和选择性识别反应辅助ifn-γ的均相双荧光和二元可视化分析方法,以解决现有ifn-γ检测技术不能兼顾信号识别、信号放大、信号分子选择、分析设备及分析步骤和成本的缺陷。
9.本发明的目的之二在于提供一种无酶核酸放大和选择性识别反应辅助ifn-γ的均相双荧光和二元可视化分析方法的应用。
10.为了实现上述目的之一,本发明提供了一种无酶核酸放大和选择性识别反应辅助ifn-γ的均相双荧光和二元可视化分析方法,所述方法包括以适配体识别为基础,将蛋白检测转换为核酸检测,利用无酶催化发卡组装进行信号放大,并基于钙黄绿素和量子点选择性识别ag
+
和c-ag
+-c结构,得到钙黄绿素的荧光信号和量子点的荧光信号,并基于钙黄绿素的荧光信号和量子点的荧光信号定量单一目标物。
11.根据一种可选实施方式,所述二元可视化包括颜色可视化和距离可视化。
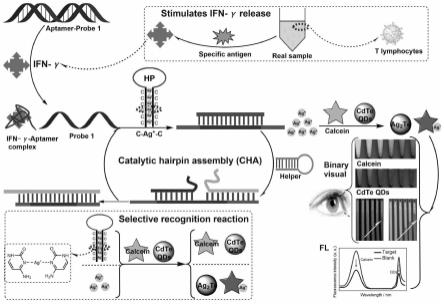
12.根据一种可选实施方式,所述颜色可视化为钙黄绿素和量子点在紫外灯下分别呈现绿色和红色。
13.根据一种可选实施方式,所述距离可视化为采用喷墨打印技术制备双色试纸条。
14.根据一种可选实施方式,所述的基于钙黄绿素选择性识别ag
+
和c-ag
+-c结构以得到钙黄绿素的荧光信号,包括利用钙黄绿素与ag
+
和c-ag
+-c结构进行选择性络合反应,基于ag
+
和c-ag
+-c结构分别以不同程度淬灭钙黄绿素荧光信号,以使各体系分别产生明显不同的颜色改变。
15.根据一种可选实施方式,所述的基于量子点选择性识别ag
+
和c-ag
+-c结构以得到量子点的荧光信号,包括利用量子点与ag
+
和c-ag
+-c结构进行选择性阳离子交换反应,基于ag
+
和c-ag
+-c结构分别以不同程度淬灭量子点荧光信号,以使各体系分别产生明显不同的颜色改变。
16.根据一种可选实施方式,所述量子点和所述钙黄绿素的特征紫外吸收峰分别位于615nm和490nm。
17.根据一种可选实施方式,所述量子点包括cdte qds或者cdse qds。
18.根据一种可选实施方式,所述单一目标物为ifn-γ或者具备特异性适配体的靶标。
19.为了实现上述目的之二,本发明提供了一种无酶核酸放大和选择性识别反应辅助ifn-γ的均相双荧光二元可视化分析方法的应用,所述应用包括将上述任一所述的酶核酸放大和选择性识别反应辅助ifn-γ的均相双荧光和二元可视化分析方法应用于临床ifn-γ相关疾病的诊断。
20.本发明提供的无酶核酸放大和选择性识别反应辅助ifn-γ的均相双荧光和二元可视化分析方法及应用,具有以下技术效果:
21.本发明以适配体识别为基础,将ifn-γ蛋白的检测转换为核酸的检测,利用具备设计简单、成本低且不依赖精密控温设备优势的无酶催化发卡组装(catalytic hairpin assembly,cha)进行信号放大,利用钙黄绿素和量子点(quantum dots,qds)对于ag
+
和c-ag
+-c结构的选择性识别特性,在cha循环放大过程中引入可形成c-ag
+-c发卡探针,实现无标记双荧光信号报告,同时,利用钙黄绿素和qds在紫外灯下分别呈现绿色、红色,可实现无仪
器依赖的双色可视化信号报告。此外,借助喷墨打印技术制备双色试纸条,可实现相比颜色辨别更能客观分析的距离读取可视化信号报告。最终,提供一种高灵敏、准确、简单、低成本的ifn-γ均相双荧光和“颜色-距离”二元可视化分析策略,该策略大大简化操作步骤,且易于实现多场景应用,为ifn-γ的poct分析奠定了基础,可为临床ifn-γ相关疾病诊断提供更多选择,兼顾了信号识别、信号放大、信号分子选择、分析设备及分析步骤和成本。
附图说明
22.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
23.图1是ifn-γ均相“红-绿”双荧光和“颜色-距离”二元可视化分析原理图;
24.图2是材料表征(a-d);选择性识别现象验证(e-h);ifn-γ双荧光分析可行性验证(i和j);
25.图3是ifn-γ分析条件优化;
26.图4是ifn-γ分析性能考察;
27.图5是临床样本的ifn-γ分析结果及ct图像;
28.图6是临床样本的ifn-γ距离读取可视化分析。
具体实施方式
29.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
30.所述poct,为即时检验(point-of-care testing),指在病人旁边进行的临床检测及床边检测((bedside testing),通常不一定是临床检验师来进行。是在采样现场即刻进行分析,省去标本在实验室检验时的复杂处理程序,快速得到检验结果的一类新方法。
31.本发明分析方法的原理如下:
32.结核病诊断中结核分枝杆菌特异性抗原刺激全血样本产生ifn-γ的检测,如图1所示,本发明的检测原理为:
33.①
根据ifn-γ的适配体序列(aptamer),设计其互补探针probe 1(后统一为p1),两者在室温条件下孵育形成稳定的aptamer-p1双链;
34.②
将待测样本加至aptamer-p1双链体系中,一旦存在ifn-γ,便从aptamer-p1双链中竞争性结合其适配体,从而释放出p1单链;
35.③
释放的p1单链通过碱基互补配对原则,进一步识别并打开体系中的hp发卡探针,该探针两端特别设计的c碱基与ag
+
形成稳定c-ag
+-c结构,随着hp的开链,其末端c-ag
+-c结构中的ag
+
不断释放到溶液,同时,释放的末端序列进一步打开helper发夹探针,并将p1单链再次释放到溶液中参与新一轮等温无酶cha放大反应,释放更多的ag
+
,且ifn-γ越多,最终释放的ag
+
也越多;
36.④
利用ag
+
对钙黄绿素和cdte qds荧光的淬灭作用强于c-ag
+-c结构的特性,同时引入钙黄绿素和qds双信号报告分子,对ifn-γ进行双荧光信号定量检测。同时,结合喷墨打印试纸条,利用层析作用,ag
+
在试纸上移动,通过监测试纸条移动的距离,实现“颜色和距离”二元可视化分析;
37.⑤
最终通过该技术实现检测标本中是否具有针对结核分枝杆菌特异性的t细胞免疫反应的准确检测。
38.具有发光性质的纳米材料,不仅可用作信号报告分子,还可提高分析灵敏度,如发光qds、纳米团簇、镧系化合物等。其中,本发明中的qds具有与ag
+
在室温条件下发生阳离子交换反应而导致其荧光淬灭的特性,其反应快速,既可实现荧光仪检测,也可肉眼识别。但ag
+
与核酸序列中的c碱基形成c-ag
+-c结构后很难触发其与qds间的阳离子交换反应,即选择性识别。通过在cha循环放大过程中引入可形成c-ag
+-c结构的发夹探针可有效结合无酶核酸放大与qds选择性识别,有望实现更高的分析灵敏度。
39.下面结合实施例对本发明的技术方案进行具体验证。
40.1.qds合成
41.根据一锅法合成cdte qds:
42.首先,将0.5mmol cdcl2和0.20g柠檬酸三钠溶解在50ml水中,并立即加入52μl巯基丙酸(mpa),使用naoh溶液,将以上混合物溶液ph调节至10.5;
43.然后,向上述溶液中继续加入0.1mmol na2teo3和50mg kbh4,回流1小时,至溶液呈红色且在紫外灯下呈现出强烈的红色荧光;
44.最后,通过沉淀(使用正丙醇)和离心(11000rpm,30分钟)纯化cdte qds,并于4℃保存备用。
45.2.ifn-γ及临床样本的分析步骤
46.2.1 ifn-γ双荧光报告分析步骤
47.①
溶液a:取4μl aptamer(10μm)和4μl p1(10μm)加至10μl mops缓冲液(10mm mops,100mm nano3,ph 7.3)中,室温孵育30分钟以形成稳定的aptamer-p1双链;然后,加入4μl不同浓度的ifn-γ,室温反应45分钟;同时,配制溶液b;
48.②
溶液b:取8μl hp(10μm)和9.6μl agno3溶液(50μm)加至10μl mops缓冲液中,在室温下避光反应45分钟,形成末端为c-ag
+-c结构的发夹探针。
49.③
取4μl helper(10μm)和全部溶液a加至溶液b中,混合溶液在室温下避光反应90分钟;反应结束后加入0.35μl钙黄绿素(0.25μm)和50μl mops缓冲液,室温反应20分钟后加入4.5μl qds(储备液稀释10倍),并在室温下继续孵育30分钟以充分完成阳离子交换反应,最后,监测溶液中钙黄绿素和qds双荧光信号。
50.2.2 ifn-γ颜色读取可视化报告分析步骤
51.同2.1所述分析步骤
①②
,进行至第
③
步“避光反应90分钟”后,对于钙黄绿素颜色读取可视化:加入0.9μl钙黄绿素(10μm),混匀后于紫外灯下读取反应液颜色变化;对于qds可视化:加入2.8μl qds(储备液稀释10倍),混匀后于紫外灯下读取反应液颜色变化。
52.2.3 ifn-γ距离读取可视化报告分析步骤
53.①
距离试纸条制备:取5ml cdte qds储备液和200μm钙黄绿素溶液分别加至喷墨打印机的空墨盒中。然后利用色谱纸(12
×
13cm)进行打印,并统一裁剪成7.5
×
0.3cm规格
的试纸条,室温密封保存备用。
54.②
距离试纸条反应条件:对于qds和钙黄绿素试纸条,150μl反应溶液为优化的最佳试纸条反应体积;同2.1所述分析步骤
①②
,进行至第
③
步“避光反应90分钟”后,加入100μl mops缓冲液并充分混匀后离心至管底,然后在反应液中分别插入qds或钙黄绿素试纸条,严格控制反应时间,分别在1分钟50秒或1分钟30秒后取出,晾干后置于紫外灯下读取淬灭距离。
55.2.4临床样本分析步骤
56.①
样本前处理:收集临床经刺激培养过夜的全血样本(每个病例包含n、t、p三个刺激培养管,n管为含基质液的本底对照培养管,t管为结核分枝杆菌特异性重组抗原esat-6、cfp-10刺激管,p管为含有丝分裂原的阳性对照培养管),首先在4℃条件下,以3000rpm离心5分钟以收集上清。将所得上清液稀释100倍后,取200μl相继使用30kda和3kda在8000rpm条件下超滤15分钟,超滤结束补足体积至200μl后稀释10000倍备用。
57.②
将2.1所述ifn-γ双荧光报告分析步骤中“加入4μl不同浓度的ifn-γ”替换为“加入4μl经超滤和稀释的临床待检样本”,其余步骤相同。
58.3.材料表征
59.在机理验证之前,首先对体系内的cdte qds和钙黄绿素进行了表征。透射电镜(tem)结果显示合成的cdte qds呈类球状均匀分布,粒径约为4nm(图2a)。当在cdte qds溶液中加入ag
+
后,发生阳离子交换反应而生成ag2te,电镜下可见明显团聚(图2b)。qds和钙黄绿素的特征紫外吸收峰分别位于615nm(图2c)和490nm(图2d)。
60.4.选择性识别现象验证
61.在进行ifn-γ双荧光分析之前,对qds和钙黄绿素选择性识别ag
+
和c-ag
+-c的现象进行了充分探讨。在1nm-0.1mm的浓度范围内,随着ag
+
浓度的增加,qds(图2e)和钙黄绿素(图2g)的荧光强度显著降低。且通过观察溶液颜色和距离试纸条上淬灭距离的变化,可肉眼直观判断qds和钙黄绿素荧光信号被ag
+
淬灭的情况(图2e和2g内插图)。而当hp与ag
+
共存时会因形成c-ag
+-c结构而使游离ag
+
减少,可见随hp浓度从1nm增加到10μm,qds(图2f)和钙黄绿素(图2h)的荧光强度显著增加。且随hp浓度的增加,c-ag
+-c结构的形成增多,有效抑制了ag
+
对qds和钙黄绿素荧光信号的淬灭,因此试纸条上的淬灭距离显著缩短(图2f和2h内插图)。上述结果表明,qds和钙黄绿素可敏感地响应ag
+
和c-ag
+-c。
62.5.ifn-γ双荧光分析可行性验证
63.为实现双荧光信号报告,通过激发波长筛选,最终选择了486nm作为双信号共存的最佳激发波长(图2i)。基于该条件,进一步进行了ifn-γ双荧光分析可行性考察。验证了双信号分子的共存于各自对ag
+
和c-ag
+-c的选择性识别没有明显影响,同时验证了p1链可从c-ag
+-c结构中成功释放游离ag
+
(图2j-a,b vs.c)。且c-ag
+-c结构、helper和aptamer-p1双链可在体系中稳定共存(图2j-b vs.d,e)。随着0.1、1、10fg/ml ifn-γ的加入,qds和钙黄绿素荧光信号均逐渐降低,初步试验结果表明双荧光检测模式能检出低至0.1fg/ml的ifn-γ(图2j-e vs.f-h)。
64.6.ifn-γ分析条件优化
65.以上述ifn-γ双荧光分析可行性验证为基础,在方法性能考察之前,对所有相关实验条件进行了系统优化,主要包括:
66.①
c-ag
+-c结构形成时间;
67.②
hp链浓度;
68.③
aptamer-p1双链形成时间;
69.④
ifn-γ与aptamer-p1双链反应时间;
70.⑤
cha反应时间;
71.⑥
钙黄绿素反应时间;
72.⑦
钙黄绿素用量;
73.⑧
qds用量;
74.⑨
qds反应时间。
75.条件优化结果表明:45分钟足以形成稳定c-ag
+-c结构(图3a);4μl hp(10μm)为最佳使用量(图3b);30分钟便可形成稳定的aptamer-p1双链(图3c);ifn-γ从aptamer-p1双链中释放p1链的最佳反应时间为45分钟(图3d);最佳cha反应时间为90分钟(图3e);当钙黄绿素反应20分钟时,可获得相对最大的信号差异(1ag/ml ifn-γvs.1fg/ml ifn-γ)(图3f);钙黄绿素(0.25μm)的最佳用量为0.3μl(图3g);qds(储备液稀释10倍)的最佳用量为4.5μl(图3h);对于qds的反应时间,在30分钟时可获得相对最大的信号差异(1ag/ml ifn-γvs.1fg/ml ifn-γ)(图3i)。
76.7.ifn-γ分析性能考察
77.基于上述优化的实验条件,在荧光和可视化模式下对本发明的分析性能进行了考察(图4)。
78.首先,在钙黄绿素和qds作为单荧光信号报告分子的模式下考察了检测灵敏度。在1ag/ml至10fg/ml范围内,钙黄绿素和qds的荧光强度与ifn-γ浓度的对数呈良好的线性关系(图4a-4d),且钙黄绿素和qds的检测限(limit of detection,lod)分别为0.5ag/ml和0.4ag/ml(基于三倍信噪比)。随后,考察了钙黄绿素和qds双荧光分析模式的分析灵敏度。
79.结果表明,钙黄绿素和qds的荧光强度随着ifn-γ浓度的增加而同时呈现降低趋势(图4e),且在1ag/ml到10fg/ml的浓度范围内表现出良好的线性(图4f),与单荧光分析模式线性范围一致。在双荧光分析模式下钙黄绿素和qds的lod分别为0.25ag/ml和0.3ag/ml。
80.此外,利用钙黄绿素和qds的强发光特性及其肉眼可识别的特点,对两者进行了基于颜色变化的可视化分析性能考察。对于qds,随着ifn-γ浓度的增加,溶液所呈现红色逐渐变淡,且肉眼可辨别低至100ag/ml的ifn-γ(图4g)。相比之下,随着ifn-γ浓度的变化,钙黄绿素的颜色变化不如qds明显(图4h)。然而,两者共存时,不仅保持了与qds相同的分析灵敏度,还使溶液颜色变得更容易区分(图4i)。
81.进一步,本发明基于钙黄绿素和qds具有稳定荧光的性质,结合喷墨打印技术成功制作了二者的距离读取试纸条,并考察了距离读取可视化分析模式的分析性能。随ifn-γ浓度的增加,两种试纸条上的荧光淬灭距离显著变长,并与ifn-γ浓度呈线性关系,且低至100ag/ml的ifn-γ可被肉眼识别(图4j和4k)。该距离读取可视化模式在辨别能力上优于颜色可视化,可有效避免不同人对颜色变化的主观判断,且对色盲或色弱人群友好。
82.基于双荧光分析模式,共选择了17种共存蛋白质作为潜在干扰物质,以对本发明进行选择性考察(图4l)。与空白对照相比,10fg/ml共存蛋白引起的双荧光强度变化几乎可忽略。而低浓度的ifn-γ(0.1和1fg/ml)引起了明显的双荧光强度降低。证实了本发明具有
良好的选择性,原因在于ifn-γ与其适配体间的高特异性识别结合。
83.8.临床样本的ifn-γ分析
84.为考察本发明的临床适用性,发明人以检测结核病诊断中结核分枝杆菌特异性抗原刺激全血样本产生的ifn-γ作为本发明的具体实施例,收集并测试了来自51例(20例阴性和31例结核阳性)患者的临床血浆样本。经本发明检测结果判定的阴阳性结果与临床elisa分析的符合率为100%(t管和n管测得ifn-γ浓度的差值大于14pg/ml为阳性,否则为阴性,图5a和图5b),且两种方法得到的ifn-γ定量结果显著相关(图5c)。此外,本发明所得ifn-γ定量结果与临床ct结果高度一致(图5d)。
85.进一步,在距离读取可视化模式下对6例阴性和6例结核阳性患者的临床血浆样本进行了ifn-γ可视化分析(图6,每个样本包含t管和n管)。与ifn-γ的标准曲线相对应,基于距离读取的试纸条能以更简单、更快的方式区分阴性和阳性样本,并与ifn-γ的荧光报告结果高度一致。以4号患者(n值为5.00pg/ml,t值为5.50pg/ml,阴性)和48号患者(n值为16.20pg/ml,t值为503.00pg/ml,阳性)为例,对于阴性样本,t管与n管在钙黄绿素和qds试纸条上引起的淬灭距离无显著差异(图6a和6c)。而对于阳性样本,t管引起的淬灭距离比n管更长(图6b和6d)。综上,本发明可应用于复杂临床样本检测,并具有良好的分析性能,且具有巨大的poct应用潜力。
86.9.结论
87.综上所述,整合适配体识别、cha信号放大、钙黄绿素和qds双信号报告分子对于ag
+
和c-ag
+-c结构的选择性识别特性及喷墨打印技术,发明人成功构建了高灵敏、准确、简单、经济的ifn-γ均相双荧光和二元可视化(颜色与距离)分析策略,并应用于具体实施例探究,其突出的优势可为今后临床转化奠定基础。
88.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1