一种基于比色法的检测试剂盒及其应用
1.本发明属于生物检测领域,具体涉及一种基于比色法的检测试剂盒及其应用。
背景技术:
2.循环肿瘤细胞(circulating tumor cells,ctcs)是从肿瘤部位脱落的肿瘤细胞,在肿瘤发育过程中侵入外周血,其被认为携带着肿瘤发生、发展和转移的重要信息,与肿瘤转移密切相关;ctcs检测作为新兴的液体活检技术,具有取样方便、侵入性小、信息全面、无放射性污染、成本低等优势,是目前最具发展潜力的肿瘤无创诊断和实时疗效监测手段之一,已成为当前癌症诊断领域的前沿热点。由于外周血中ctcs的数量稀少,以及随着肿瘤转移ctcs亚型不断变化,所以对ctcs捕获及鉴定技术的研究是关键环节。
3.目前静脉血中循环肿瘤细胞(circulating tumorcells,ctc)检测方法主要有2种,反转录聚合酶链反应(reverse transcription-polymerase chain reaction,rt-pcr)和免疫细胞化学法(immunocytochemistry,icc);rt-pcr检测是通过扩增出肿瘤细胞相关或特异的转录标志物来证实肿瘤细胞的存在;该方法具有高效率、高敏感度和特异度,缺点是假阳性率较高;icc法是常用的ctc检查方法之一,缺点是免疫识别需要通过蛋白结合来进行细胞识别,而基于蛋白识别的方法成本高且制备繁琐。近年来,dna适配体由于其能够高度特异性的识别肿瘤标志蛋白,被广泛的应用于ctc检测。相较于传统的icc法,dna适配体识别在保证识别效率的同时能够大大降低检测成本,受到科研工作者们越来越多的关注。
4.met是肝细胞生长因子hgf的受体蛋白,是emt过程的重要参与者。目前在多种类型肿瘤组织中,都观察到hgf/met信号通路的异常激活,并与肿瘤细胞增殖和转移密切相关。近年来,met常常作为一种特异性标志物用于循环肿瘤细胞ctc的检测。但是,met蛋白只有在hgf/met信号通路的异常激活后才会在肿瘤增殖转移过程中发挥作用,单一的met蛋白表达和基因扩增,均和hgf/met信号通路激活没有显著相关性。因此分析hgf/met信号通路激活及其下游的met蛋白磷酸化状态对于癌症诊断尤其是ctc的检测更有指导意义,但是这对于大多数检测机构都是更加困难的事情。在hgf/met信号通路激活过程中,met二聚化通常被认为是细胞内信号转导的第一步,是一种高度特异性的事件。因此,met蛋白二聚,能够直接反应hgf/met信号通路激活情况,对肿瘤发生发展及预后情况具有重要意义。
5.目前,met蛋白二聚的检测主要是通过荧光法包括荧光蛋白基因修饰和基于dna结构的非遗传荧光方法,虽然这些传统的检测方法在检测灵敏度和准确度上有所提高,取得了一定的进展,但由于这些方法本身的局限性,难以避免光漂白与生物荧光背景信号,且这些检测方法仍存在成本高,过程繁琐,设备要求高,难以实现定量检测的缺点。
技术实现要素:
6.本发明的主要目的在于提供一种基于比色法的检测试剂盒,用于循环肿瘤细胞定量检测,以降低循环肿瘤细胞检测的成本和操作复杂度,提高检测灵敏度和准确度。
7.比色法是商业化的首选策略,因为其机制简单,易于操作,在床边快速诊断中具有广泛的应用前景,一种高效的g四联体dna酶经常被用于生物传感,g四联体dna酶是一种具有模仿过氧化物酶催化活性的生物催化核酸,与血红素结合后g四联体可以催化abts被h2o2氧化成有色产物,然而一般情况下,肿瘤患者外周血中每毫升血液只有0~10个ctc,浓度极低,且比色法的灵敏度较低,met蛋白二聚态信号弱,难以满足实际检测的需要,而本发明提供的检测试剂盒用于检测循环肿瘤细胞时,可通过将met蛋白二聚态信号进行放大,循环构建g四联体酶催化显色信号以实现met蛋白二聚态的发生进行定量检测。
8.本发明的基于比色法的循环肿瘤细胞定量检测试剂盒用于膜蛋白二聚的检测,其原理在于:利用met膜蛋白识别链t1和t2锚定met膜蛋白,在膜蛋白发生二聚时发生邻近杂交,触发h1和h2的催化发夹自组装(cha)形成大量g四联体结构,当h2o2存在时,g四联体结合血红素形成的g四联体/血红素能够催化abts氧化产生显色反应。
9.第一方面,本发明提供的一种基于比色法的检测试剂盒,所述试剂盒包括:两种膜蛋白识别链t1和t2;用于形成g四联体的两种dna发夹h1和h2;显色反应所需的血红素;过氧化氢h2o2;以及abts;其中,所述膜蛋白识别链t1和t2用于锚定膜蛋白met,且在膜蛋白发生二聚时发生邻近杂交,邻近杂交后的复合物能够触发h1和h2的催化发夹自组装cha形成大量g四联体结构,当h2o2存在时,g四联体结合血红素形成的g四联体/血红素能够催化abts氧化产生显色反应;所述膜蛋白识别链t1和t2具体包括用于识别c-met膜蛋白的适配体序列、邻近杂交的互补序列以及cha的触发序列,其中膜蛋白识别链t1和t2的适配体序列相同,邻近杂交的互补序列的碱基数为6-8个且优选为7个;需要说明的是,所述abts指的是2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐;
10.优选的,所述膜蛋白识别链t1的核苷酸碱基序列即seq id no:1如下所示:
[0011]5’‑
tggatggtagctcggtcggggtgggtgggttggcaagtcttttttttttttttttagtgaggttcgtgt-3’;
[0012]
所述膜蛋白识别链t2的序列即seq id no:2如下所示:
[0013]5’‑
cggcatcgtctacatccctcactttttttttttttttttggatggtagctcggtcggggtgggtgggttggcaagtct-3’[0014]
所述dna发夹h1的核苷酸碱基序列即seq id no:3如下所示:
[0015]5’‑
acacgaatgtagacgatgccggtagggtagggcggcatcgtctacat-3’;
[0016]
所述dna发夹h2的核苷酸碱基序列即seq id no:4如下所示::
[0017]5’‑
acgatgccgccctaccctaccggcatcgtctacatggtagggtagggcgggttggg-3’。
[0018]
第二方面,本发明还提供了上述基于比色法的检测试剂盒在膜蛋白二聚检测中的应用,所述应用具体步骤包括:在不含fbs和双抗的dmem培养基中,将待测细胞与所述膜蛋白识别链t1和t2共培养,使所述膜蛋白识别链锚定在待测细胞的膜蛋白met上即获得标记后的待测细胞;采用pbs冲洗后,采用含有dna发夹h1和h2的hepes缓冲液孵育标记后的待测细胞;孵育后加入含有abts和h2o2的hepes缓冲液反应;分析最终样品的显色情况。
[0019]
优选的,所述检测具体步骤为:在1ml不含fbs和双抗的dmem培养基中,将待测细胞与100nm的靶标(包括t1和t2)共培养10min,使靶标锚定在细胞膜蛋白上,经过三次pbs冲洗后,用含有400nm h1和h2的500μlhepes缓冲液继续孵育细胞;孵育30min后,加入含有12mmabts和1.5mm h2o2的500μlhepes缓冲液反应10min,测试反应后的吸收光谱或对显色结
果进行图像分析。
[0020]
优选的,所述hepes缓冲液包含25mm hepes,200mm nacl,25mm kcl,150mm nh4cl,1%dmso,ph为7.4。
[0021]
第三方面,本发明还提供了上述检测试剂盒在细胞信号通路可视化中的应用,所述应用具体步骤包括:将待测细胞在培养基中培养,提高其生长密度;对细胞进行饥饿处理后分为三组,分别进行三种不同的处理,第一组处理方式为无处理即直接使用胰蛋白酶重悬细胞;第二组处理为膜蛋白二聚诱导处理,即在dmem培养基中加入膜蛋白二聚诱导剂hgf孵育,使用胰蛋白酶重悬细胞;第三组处理方式为抑制剂处理,即将hgf与hgf抑制剂共孵育,然后将混合物与细胞孵育,使用胰蛋白酶重悬细胞;经过不同方法进行处理的细胞,使用上述检测试剂盒对三组处理的细胞分别进行上述膜蛋白二聚检测,获得比色分析结果。
[0022]
以du145细胞膜蛋白二聚检测为例,上述应用步骤具体包括:以du145细胞在dmem培养基中培养,并使其生长至密度约60%;然后在不含fbs和双抗的dmem培养基中饥饿细胞24h,并进行三种处理,1)无处理:直接使用胰蛋白酶重悬细胞;2)膜蛋白二聚诱导处理:在dmem培养基中加入膜蛋白二聚诱导剂hgf(100ng/ml)孵育30min,使用胰蛋白酶重悬细胞;3)抑制剂处理:将100ng/ml的hgf与hgf抑制剂(2μg/ml)共孵育1h,然后将混合物与细胞孵育30min,使用胰蛋白酶重悬细胞;将三种经过不同方法进行处理的细胞,按照上述膜蛋白二聚检测步骤进行比色分析。
[0023]
第四方面,本发明还提供了上述检测试剂盒在非诊断目的的循环肿瘤细胞检测中的应用,所述应用具体步骤包括:标准比色卡的配置、待检测样品的细胞提取、待测细胞的膜蛋白二聚检测、比色分析:
[0024]
所述标准比色卡的配置的步骤包括:将含有不同数量梯度的癌细胞在等体积的dmem培养基中与足量单核细胞混合,作为不同数量梯度的标准样品,一般根据不同的待测样品来源进行设定,例如肿瘤患者外周血中每毫升血液只有0~10个ctcs;所述足量的单核细胞指的是浓度范围在1
×
10
5-1
×
107cells/ml的单核细胞,采用上述检测试剂盒对标准样品中的细胞进行膜蛋白二聚检测以获得相应的标准比色卡;
[0025]
所述待测样品的细胞提取过程包括:将等体积的待测样品与分离培养基混合,所述待测样品包括外周血、尿液、唾液,所述分离培养基优选为histopaque-1119和histopaque-1077;将培养后的混合液进行离心获得初步提取的核细胞,所述离心过程优选为每次取600-800g进行离心20-40min;将步骤s4.2中初步提取的核细胞经过两次离心pbs洗涤后,收集纯单核细胞并分散在pbs中,离心过程优选为每次取150-250g进行离心8-12min;
[0026]
待测细胞的膜蛋白二聚检测的步骤包括:采用与所述标准样品细胞的膜蛋白二聚检测完全相同的检测试剂盒对待测细胞进行膜蛋白二聚检测;
[0027]
所述比色分析的步骤包括:将待测细胞的膜蛋白二聚检测的检测结果与标准比色卡进行显色比对,从而确定待测细胞分散液中癌细胞的浓度。
[0028]
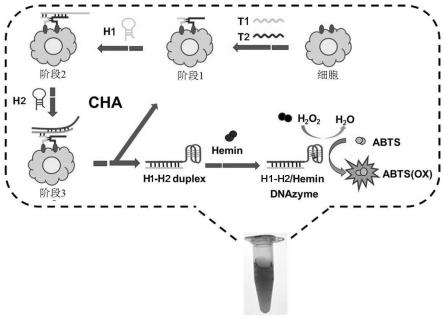
反应机理:如图1a所示,本发明所述检测试剂盒中包括特别设计的t1和t2,两者之间只有6-8个互补碱基,这使得它们在室温下的溶液环境中难以形成稳定的t1-t2双链;当与目标细胞孵育时,t1和t2的适配体序列可以分别识别并结合met单体,这些单体是分散在活细胞膜上的受体蛋白。一旦形成met蛋白的二聚体,t1和t2可以通过七个互补碱基进行杂
交,形成部分t1-t2复合体即邻近杂交,留下t1和t2的两个单链碱基序列作为立足点,共同触发催化发夹组装(cha),即立足点可以与h1杂交,形成t1-t1-h1双立复合体。之后,在h2的帮助下,t1-t1-h1复合体可以脱离,形成更稳定的带有g四联体的h1-h2双链,然后活细胞膜上释放t1-t2双链,使其可以重新捕获h1并触发下一个组装周期,即催化发夹组装。由于met二聚体的触发,大量的g四联体在溶液中自主组装,然后通过g四联体和血红素之间的结合引起dna酶的急剧积累,它可以有效地催化abts被h2o2氧化,生成绿色的氧化abts。如图1b所示,可以通过图像分析软件或吸收光谱对最终的显色结果进行分析比对。
[0029]
本发明具备以下优势:
[0030]
现有的肿瘤细胞检测技术通常基于肿瘤细胞高表达的膜蛋白(如met)来进行细胞计数,而这些蛋白(如met)在许多正常细胞中也会表达,单一的膜蛋白表达和基因扩增,与其相关信号通路激活没有显著相关性,仅当信号通路的异常激活后才会在肿瘤增殖转移过程中发挥作用,因此,肿瘤高表达膜蛋白与肿瘤细胞的通路激活没有显著相关性,这大大影响了对肿瘤细胞的检测效果;而在细胞信号传导过程的膜蛋白二聚具有高度特异性,因此对信号通路激活的特应性环节(如膜蛋白二聚)进行检测对肿瘤细胞的识别更有意义,本发明提供的检测试剂盒则是基于细胞膜蛋白met二聚态的检测,应用于循环肿瘤细胞的检测时,具备较高的准确性;
[0031]
鉴于循环肿瘤细胞在实际获取样本中的细胞数量占比非常小,一般情况下,肿瘤患者外周血中每毫升血液只有0~10个ctcs,本发明提供的检测试剂盒基于膜蛋白邻近杂交后需结合cha循环放大技术与dna酶催化显色反应技术,才能将膜蛋白二聚信号转化为可快速检出的比色信息,比色检测操作简单、成本低、设备依赖度低,因此,本发明提供的检测试剂盒可以实现肿瘤细胞床边低成本的快速诊断,具有广泛的应用前景;
[0032]
综上,本发明提供的基于比色法的检测试剂盒,结合了dna邻近杂交技术,cha循环放大技术与dna酶催化显色反应技术,实现了膜蛋白二聚的检测,并基于此可以实现细胞信号通路可视化和肿瘤细胞床边快速诊断,具有广泛的应用前景。
附图说明
[0033]
图1a为本发明所述基于比色法的检测试剂盒用于膜蛋白met二聚检测的工作原理图;
[0034]
图1b为本发明所述基于比色法的检测试剂盒用于膜蛋白met二聚检测的结果分析流程图;
[0035]
图2为本发明所述基于比色法的检测试剂盒中所述膜蛋白识别链t1和t2的邻近杂交模拟、邻近杂交触发的cha过程的凝胶电泳实验表征结果;
[0036]
图3a为本发明实施例2中用于表征所述基于比色法的检测试剂盒比色传感可行性的五组样品的紫外-可见吸收光谱图;
[0037]
图3b为实施例2中用于表征所述基于比色法的检测试剂盒比色传感可行性的五组样品溶液吸收峰强度对比图,图中的插图为样品的摄影图像;
[0038]
图4a为本发明实施例2中用于表征基于比色法的检测试剂盒基于cha的比色传感可行性的五组样品的紫外-可见吸收光谱图;
[0039]
图4b为本发明实施例2中用于表征基于比色法的检测试剂盒基于cha的比色传感
可行性的五组样品溶液吸收峰强度对比图,图中的插图为样品的摄影图像;
[0040]
图5a为本发明血红素浓度优化实验中使用不同浓度的血红素比色检测结果的紫外-可见吸收光谱;
[0041]
图5b为图5a相应的使用不同浓度的血红素进行比色检测结果在420nm处的吸收峰强度得到的信噪比(snr);
[0042]
图6a为本发明h2o2浓度的优化实验中使用不同浓度的h2o2比色检测结果的紫外-可见吸收光谱;
[0043]
图6b为图6a相应的使用不同浓度的h2o2进行比色检测结果在420nm处的吸收峰强度得到的信噪比(snr);
[0044]
图7a为本发明比色传感孵育时间优化实验结果的紫外-可见吸收光谱图;
[0045]
图7b为图7a相应的不同孵育时间进行比色检测结果在420nm处的吸收峰强度得到的信噪比(snr);
[0046]
图8a为不同刺激响应下met蛋白二聚体比色检测的紫外-可见吸收光谱,其中,插图为样品完成比色检测的摄影图像,
[0047]
图8b为图8a中比色检测结果在420nm处的吸收峰强度;
[0048]
图8c为图8a中样品完成比色检测的摄影图像的智能手机读取结果;
[0049]
图8d为du145细胞中p-met、met和β-actin表达的蛋白质印迹分析;
[0050]
图9a为本发明检测试剂盒对mkn-45细胞检测结果的浓度依赖的紫外-可见光吸收光谱;
[0051]
图9b为图9a中比色检测结果拍摄的图像,
[0052]
图9c为图9a中比色检测结果的光谱相对应的420nm处的吸收强度图,
[0053]
图9d为图9c中吸收强度的吸收光谱拟合的线性校准曲线;
[0054]
图9e为图9b拍摄的图像采用智能手机读取的强度;
[0055]
图9f为图9e中智能手机读取强度值的线性校准曲线;
[0056]
图10a为本发明试剂盒对四种细胞(mkn-45、mcf-7、du145和lo2细胞)的比色检测结果的紫外-可见吸收光谱,其中,插图为相应样品的摄影图像;
[0057]
图10b为图10a中所示光谱对应的420nm处的吸收峰强度以及拟合的线性校准曲线;
[0058]
图10c为图10a中相应样品的摄影图像采用智能手机读取的结果;
[0059]
图10d为细胞中p-met、met和β-actin表达的western印迹分析;
[0060]
图11a为本发明检测试剂盒对人类外周血中的mkn-45细胞的检测结果,浓度依赖的紫外-可见光吸收光谱图;
[0061]
图11b为图11a中所示光谱对应的420nm处的吸收峰强度;
[0062]
图11c为图11a中检测结果的拍照的图像,
[0063]
图11d为图11c图像采用智能手机读取结果;
[0064]
图11e为试剂盒回收率。
具体实施方式
[0065]
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解
这些实施例仅用于说明本发明而不用于限制本发明的范围。另外,实施例中未详细说明的分子生物学方法均为本领域常规的方法,具体操作可参看分子生物指南或产品说明书。
[0066]
需要说明的是,作为本发明的一种较优选的方案,以下实施例涉及的dna序列具体如下:
[0067]
膜蛋白识别链t1的核苷酸碱基序列即seq id no:1如下所示:
[0068]5’‑
tggatggtagctcggtcggggtgggtgggttggcaagtcttttttttttttttttagtgaggttcgtgt-3’;
[0069]
膜蛋白识别链t2的序列即seq id no:2如下所示:
[0070]5’‑
cggcatcgtctacatccctcactttttttttttttttttggatggtagctcggtcggggtgggtgggttggcaagtct-3’[0071]
dna发夹h1的核苷酸碱基序列即seq id no:3如下所示:
[0072]5’‑
acacgaatgtagacgatgccggtagggtagggcggcatcgtctacat-3’;
[0073]
dna发夹h2的核苷酸碱基序列即seq id no:4如下所示:
[0074]5’‑
acgatgccgccctaccctaccggcatcgtctacatggtagggtagggcgggttggg-3’。
[0075]
需要说明的是,以下实施例中所述abts和血红素均购于阿拉丁试剂有限公司。
[0076]
实施例1邻近杂交以及邻近杂交触发cha反应机理及可行性表征
[0077]
为了验证比色检测试剂盒邻近杂交以及邻近杂交触发cha的工作机理的正确性,本实施例使用page胶进行凝胶电泳实验,除了上述膜蛋白识别链t1、膜蛋白识别链t2、dna发夹h1和dna发夹h2以外,为了模拟t1和t2在膜蛋白二聚时发生的邻近杂交过程,本实施例通过延长t1和t2的互补碱基数,获得模拟链t1s和t2s,使得其在溶液环境中也可以实现杂交,以模拟膜蛋白识别链t1和t2锚定在膜蛋白上后的邻近杂交过程,模拟链t1s和t2s的核苷酸碱基序列如下所示:
[0078]
t1s序列如seq id no:5所示:aaaaaaaaaaaaagtgaggttcgtgt;
[0079]
t2s序列如seq id no:6所示:cggcatcgtctacatccctcacttttttttttttt;
[0080]
实验过程共设置10组dna样品,第1组为模拟链t1s、第2组模拟链t2s、第3组为t1s-t2s复合体、第4组为h1、第5组为h2、第6组为发夹结构h1和h2、第7组为退火处理的h1和h2混合物、第8组为发夹结构的h1与t1s-t2s复合体反应产物、第9组为发夹结构的h1和h2与t1s-t2s复合体反应产物、第10组为空白对照组仅含有等量的清水;每组dna样品取5μl与1μl的6
×
dnaloading buffer混匀,80v电压下运行80min后获得page凝胶电泳表征图,第1组-第10组dna样品的凝胶电泳表征结果依次对应如图2所示的电泳表征图中的第1泳道-第10泳道;
[0081]
如图2所示,对比第1泳道的t1s和第2泳道的t2s,可以通过第3泳道清晰而缓慢的迁移条带证明ts1-ts2复合体的高产率组装。第4和第5泳道分别对应单个h1和h2的条带。h1和h2具有互补的碱基序列,在退火处理后可以形成h1-h2双链(第7泳道),而具有发夹结构的h1和h2在室温下可以保护自己不被杂交,仅能观察到少量的迁移缓慢的h1-h2双链条带(第6泳道)。第8泳道的条带显示,h1可以与t杂交。当h2存在时,能够进一步触发h1-h2双链的形成,同时伴随着t的释放(第9泳道)。综上所述,凝胶电泳证实了邻近杂交触发的cha是可行的。
[0082]
实施例2基于g四联体的比色反应的可行性表征实验
[0083]
g四联体dna酶是一种过氧化物酶模拟物,能够催化许多底物的氧化,为了证明本
发明基于g四联体的比色反应的可行性,本实验共设置了包含不同成分配置的五组样品反应溶液,并在420nm处分别进行了样品反应溶液的吸收峰强度测试,五组样品分别采用如下成分配置:(a)组为abts;(b)组为h2o2;(c)组为abts+h2o2;(d)组为abts+h2o2+血红素;(e)组为abts+h2o2+血红素+g四联体,五组样品反应溶液的吸收光谱如图3a所示,相应的光吸收强度表如图3b所示,其中每组显示的结果是三次重复样本的实验结果的平均值,图3b中还插入了实际样品反应溶液的照片;结果表明,只有在g四联体存在的情况下即(e)组,才会观察到颜色从无色到深绿色的快速变化;具体的,(e)组样品溶液的配置过程为:首先将200nm g四联体与1.2μm血红素在500μlhepes缓冲液中共孵育10min,然后加入含有12mm的abts和1.5mm h2o2的500μl hepes缓冲液;孵育10min后,收集照片图像和并测试其紫外-可见吸收光谱。(a)组-(d)组样品溶液的配置同(e)组,缺少的成分采用等体积的hepes缓冲液替代配置;上述g四联体由dna发夹h1和dna发夹h2组装而成;hepes缓冲液由25mm hepes,200mm nacl,25mm kcl,150mm nh4cl,1%dmso组成,ph 7.4;
[0084]
为了证明本发明基于cha扩增的g四联体的比色反应的可行性,同样的,本实验共设置了包含不同成分配置的五组样品反应溶液,并在420nm处分别进行了样品反应溶液的吸收峰强度测试,五组样品的配置成分中均包含abts、h2o2和血红素、不同之处在于还包括以下配置成分(a)组为blank空白组;(b)组为h1+h2;(c)组为h2+t;(d)组为h1+t;(e)组为h1+h2+t,五组样品反应溶液的吸收光谱如图4a所示,相应的光吸收强度表如图4b所示,图4b中还插入了实际样品反应溶液的照片;具体的,(e)组样品溶液的配置过程为:向含有200nm的t1s-t2s复合体(简称t)的500μl hepes缓冲液中加入终浓度为400nm的h1和h2,然后在37℃下轻轻摇动孵育30min,形成t触发的h1-h2双链;接着将12μl 50μm血红素与h1-h2双链混合,接着进行10分钟的孵育处理以组装dna酶。最后,将dna酶与500μl含有12mmabts和1.5mm h2o2的hepes缓冲液共孵育10min,收集照片图像和并测试其紫外-可见吸收光谱;(a)组-(d)组样品溶液的配置同(e)组,缺少的成分采用等体积的hepes缓冲液替代配置;图4a和图4b的结果显示,在混合样品中缺乏三种物质即h1、h2、t中的任何一种或多种时,均未产生颜色信号;与空白(a)组的浅绿色相比,(e)组中t的存在可以引发非常明亮的绿色;重要的是,如图4b中的的表明t的存在可以很容易地用肉眼进行区分而不需要任何仪器的检测。
[0085]
实施例3比色检测试剂盒中试剂浓度和酶促反应时间优化验证实验
[0086]
为了提高比色生物传感的灵敏度,主要通过调整血红素和h2o2的浓度来优化比色检测试剂盒的比色效果;
[0087]
血红素浓度的优化验证实验过程:向含有400nm h1-h2双链的500μl hepes缓冲液中分别加入4、8、12、16和20μl的50μm血红素混合制备dna酶;除了改变血红素的浓度,其他实验条件和过程均与上述实施例2中基于cha扩增的g四联体比色反应可行性实验的(e)组相同;
[0088]
h2o2浓度的优化验证实验:向含有12mmabts的500μlhepes缓冲液中分别加入5μl、10μl、15μl、20μl和25μl的50mm h2o2,得到一系列的催化底物;除了改变h2o2的浓度,其他实验条件和过程均与上述实施例2中基于cha扩增的g四联体比色反应可行性实验的(e)组相同;
[0089]
酶促反应时间优化验证实验:较长的酶促反应时间能够使比色信号增加,但吸收峰的背景信号也会因此增加。为了表征信号强度对孵化时间的依赖性,本实验分别设置h1
和h2与t在37℃下孵育的时间梯度,时间梯度设置为0min,10min,20min,30min,40min,60min,90min和120min;
[0090]
如图5a显示了分别使用0.2、0.4、0.6、0.8和1μm浓度的血红素对100nm t进行比色检测的吸收光谱;图5b所示为分析处理后绘制的相应不同血红蛋白浓度进行检测的snr和s-n。如图5b所示,由于血红蛋白的催化作用,无论是否存在t,420nm处的吸收峰强度都会随着血红蛋白浓度的增加而逐渐增加,综合考虑snr和s-n,0.6μm血红素显示出最佳的检测性能。
[0091]
图6a为h2o2浓度的优化验证实验结果,具体为不同浓度h2o2所对应的比色检测的吸收光谱图,图6b为相应的snr和s-n图,结果表明0.75mm h2o2是最佳浓度。
[0092]
图7a为酶促反应时间优化验证实验结果的比色检测的吸收光谱图,图7b为相应的snr和s-n图,结果显示,酶促反应的时间为30min时,表现出较好的检测效果。
[0093]
实施例4肿瘤细胞检测的比色检测试剂盒在细胞信号通路可视化中的应用
[0094]
为了可视化hgf/met信号通路的膜蛋白二聚体,本实施例选择了表达中等水平内源met蛋白的du145细胞系作为模型。首先,将du145细胞与t1、t2、h1和h2进行共孵育。如图8a所示,在没有hgf刺激的情况下观察到浅绿色,这表明met受体主要以单体形式存在。在与hgf孵育30min后,再加入dna探针,du145细胞显示出更亮的绿色,表明hgf确实能够诱导met受体单体在活细胞上的二聚化。对比色法检测数据的定量分析显示,颜色是没有刺激时的1.64倍如图8b;此外,在用hgf抑制剂预处理的细胞中,观察到绿色比色信号明显减少。值得注意的是,图8c中的手机检测结果与吸收光谱结果保持一致。此外,通过蛋白质印迹分析表征了不同类型刺激下的met磷酸化水平。与图8d中的第2泳道所示未处理的细胞相比,用图8d中的第1泳道所示hgf处理的细胞的p-met的表达量明显增加。在hgf和抑制剂的刺激下,图8d中的通道3对应的p-met的表达下降;这些结果与广泛接受的关于met激活机制的假说一致,即二聚体met受体的形成诱导met蛋白的自磷酸化。因此,这些结果表明,肿瘤细胞检测的比色检测试剂盒可以特异性地、准确地检测活细胞hgf/met信号通路中的met蛋白二聚体。
[0095]
实施例5肿瘤细胞检测的比色检测试剂盒在肿瘤细胞床边快速诊断中的应用
[0096]
首先,为了研究比色检测试剂盒的检测灵敏度,以具有高表达met且自发形成met二聚的mkn-45细胞为例,本实施例测试了试剂盒对不同浓度mkn-45细胞响应的紫外-可见吸收光谱和智能手机读取结果;
[0097]
如图9a所示,在0到1000个细胞范围内,吸收强度随着mkn-45细胞浓度的增加而增加。如图9b所示,由2个mkn-45细胞引起的颜色变化也是肉眼可见的。图9c和图9e分别对应于吸收峰强度和智能手机读取强度随mkn-45细胞浓度变化的统计结果。图9d和图9f分别表示了吸收峰强度和智能手机读取强度与目标浓度之间良好的动态关系,他们的线性范围均超过了3个数量级。其中,吸收峰强度的线性回归方程为a=0.225
×
logc
cn
+0.117(r2=0.971),检测限低至1个细胞;而智能手机读取强度的线性回归方程为i=0.231
×
logc
cn
+0.160(r2=0.951),检测限同样为1个细胞,其中a、i和c
cn
分别代表吸收峰强度、智能手机读取强度和目标细胞浓度。与之前的一些报道相比,本发明仅仅通过简单的混合和手机读取数据就达到了相当甚至更高的灵敏度。
[0098]
如图10a,图10b,图10c所示,本实施例还使用了肿瘤细胞检测的比色检测试剂盒
检测了包括mkn-45、mcf-7、du145和lo2细胞在内的多种细胞的met二聚情况,由于hgf/met信号通路在多种癌细胞中是上调的,因此观察到了mkn-45、mcf-7和du145细胞的met二聚信号,其中,由于mkn-45细胞的met二聚程度要高于其他两种肿瘤细胞,表现出最强的比色信号;相比之下,不表达met受体的人类正常肝脏lo2细胞没有出现任何可观察的比色信号;这些结果与如图10d所示的蛋白质印迹分析的结果保持一致。
[0099]
如图11a、图11b、图11c、图11d所示,为了表征肿瘤细胞检测的比色检测试剂盒的可靠性和重现性,在人类血液中加入五种不同浓度的mkn-45细胞来测试比色检测试剂盒的检测效果。通过对每个样品进行三次平行检测,相应的吸收峰强度和智能手机读取结果的回收率如图11e所示;吸收结果的回收率在91.50-96.15%之间,智能手机读取结果的回收率在89.59-101.08%之间,这表明肿瘤细胞检测的比色检测试剂盒在mkn-45细胞的检测中显示出良好的可靠性和重复性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1