医疗器械溶血试验能力验证样品及其制备方法
1.本发明涉及一种医疗器械溶血试验质量控制技术领域,特别涉及一次性医疗器械(含各类采血针、采血管)、输血管路、储血袋、心血管植入器械等医疗器械溶血试验能力验证样品及其制备方法。
背景技术:
2.血液相容性是血液接触材料的核心性能要求,了解材料的溶血机制对于改进和设计新型血液接触材料具有重要的指导意义。血液接触医疗器械直接接触血液、皮肤或黏膜,其质量好坏直接影响医疗器械的医疗效果和质量,进而影响器械的行业认可,同时也与人类健康密切相关。在材料表面进行溶血试验,是表征材料血液相容性的常用方法。
3.定量检测医疗器械的溶血性能,不仅可以直接反映出器械血液相容性的程度,也是评价在生产过程中所用的原料、工具设备、工艺流程安全的必要手段,是对医疗器械安全风险监测和评估的专业依据。由于血液接触医疗器械溶血性能检验领域的特殊性,国内外尚未有组织/机构制备以医疗器械溶血试验定性检测的实物能力验证样品,也没有相关的文献报道。
4.生物材料的血液相容性是指生物材料表面抑制血管内血液形成血栓的能力和生物材料对血液的溶血现象、血小板功能降低、白细胞暂时性减少、功能下降以及补体激活等血液生理功能的影响。当外来物与血液接触时,会破坏红细胞,使血小板活化、聚集,进而诱发血栓的形成。血液相容性是生物材料最重要的生物相容性性能指标;溶血试验是血液相容性主要研究内容的其中一种,是生物材料与血细胞的相互作用判断血液相容性检测。当材料与血液接触后,会引起溶血、凝血和免疫等一系列反应,机制复杂且受多种因素影响。生物材料的血液相容性是决定该材料能否在临床成功应用的重要标准之一。因此,急需一种医疗器械溶血性能检测能力的验证样品。
技术实现要素:
5.本发明的目的在于弥补目前该领域能力验证样品空白,提供一种以输血管、采血针、采血管储血袋等为基质的溶血试验能力验证样品及制备方法,为医疗器械的血液相容性能力验证提供重要保证。
6.本发明解决的第一个技术问题是提供一种稳定均匀医疗器械溶血试验的能力验证样品,保证可以常温储存、运输,均匀性和稳定性达到cnas-gl03《能力验证样品均匀性和稳定性评价指南》要求。本发明要解决的第二个技术问题是提供一种医用器械溶血试验的能力验证样品的制备方法,该方法要求基质经过负载、冻干后,溶血阳性物质稳定、浸提完全,且操作简单,成功率高。
7.本发明的目的通过下述技术方案实现
8.本发明首先提供了医用器械溶血试验能力验证样品,所述样品包括基质和阳性物质,阳性物质为十二烷基苯磺酸钠(gbwe 081623)、氯化钠(nacl)、冰醋酸、十二烷基硫酸钠
(sds)、氢氧化钠(naoh)、硫氰酸钠、硅酸钠等中的一种或多种。医疗器械溶血试验能力验证样品中,阳性物质的浓度为5-40mg/l,溶剂为生理盐水。
9.上述医疗器械溶血试验能力验证样品是将阳性物质与生理盐水均匀配置成贮备液,涂覆或灌注于基质内而获得。其中优选的基质为输血管、带软管的一次性采血针、真空静脉采血管和储血袋。溶血试验检测标准iso 10993-4,gb/t 16886.4,gb/t 14233.2要求浸提溶液为生理盐水,通过改变阳性物质贮备液浓度实现制备不同浓度梯度的阳性验证样品。
10.一种医疗器械溶血试验能力验证样品的制备方法,该方法包括以下步骤:
11.1)选择基质:输血管、一次性采血针、真空静脉采血管和储血袋等;
12.2)配制阳性物质:将十二烷基苯磺酸钠的国家级标准物质溶液加入到生理盐水中,配置终浓度为10-30mg/l的溶液,混合均匀,超声震荡消除气泡,过夜,得到均匀稳定的阳性物质,过膜0.22μm除菌;
13.3)将步骤2)制备的阳性物质注入医疗器械,摇匀,均匀黏附于器壁,本领域的技术人员可以根据所需的阳性物质的含量对其总质量进行更改,该更改也属于本发明的保护范围;
14.4)将灌注阳性物质的样品,置于真空冷冻干燥机,冷冻干燥40-60小时;或将灌注母液的样品,置于电热鼓风干燥箱,于60℃恒温干燥24-48小时,得到干燥样品;
15.8)干燥后的样品分别装于自封袋中,用热熔封口机封口,干燥避光储存,利于保证样品的稳定性;
16.9)辐照灭菌,避免引入新的热源和溶血物质。
17.上述方法中,配制阳性物质时,所用的溶液均使用生理盐水,符合溶血试验检测标准iso 10993-4,gb/t 16886.4,gb/t 14233.2浸提用溶液和试验方法;
18.上述方法中,所述基质为一次性使用输血管或采血针或真空静脉采血管或储血袋等,为取得医疗器械注册证的常规产品;
19.本发明相对于现有技术具有如下的优点及效果。
20.本发明的医疗器械溶血试验能力验证样品,首次采用输血管、采血针和采血管等作为基质,添加目标阳性物质制备阳性样品,提供了一种可以复现检测流程的实物样品,为医疗器械领域溶血试验能力验证的先例。该样品可用于实验室检测能力的评价,检测过程的质量控制,人员考核、方法验证等,填补了国内外空白。同时能够依据目的溶血试验测定范围,通过改变阳性物质的负载量调整,获得目的样品,样品制备方法简单、成功率高、可常温储存、运输,均匀性和稳定性达到cnas-gl03《能力验证样品均匀性和稳定性评价指南》要求。
附图说明
21.图1是本发明制备的医疗器械溶血试验能力验证样品;
22.图2是实施例1能力验证样品溶血试验实物照片。
具体实施方式
23.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限
于此。
24.本发明提供了医疗器械溶血试验能力验证样品,所述样品为阳性参考样品,其中阳性物质包括:十二烷基苯磺酸钠(gbwe 081623)、氯化钠(nacl)、冰醋酸、十二烷基硫酸钠(sds)、氢氧化钠(naoh)、硫氰酸钠、硅酸钠等中的一种或多种;溶液为9%生理盐水。能够准确判定样品溶血率为主要考核目标。
25.其中基质为血液接触相关医疗器械,本发明采用的阳性物质为十二烷基苯磺酸钠标准液(gbwe 081623),十二烷基硫酸钠(sds),保证了阳性物质的溯源性,以上阳性物质只作为本发明实施方式的示范性举例,均可转换成其他等效阳性物质。
26.为了使本领域的技术人员更好的理解本发明的技术方案,下面将结合实施例对本发明作进一步的详细介绍。
27.实施例1
28.一次性输血管溶血试验能力验证样品制备,包括如下步骤:
29.a)基质:一次性输血管软管段;
30.b)配制阳性物质母液:取十二烷基苯磺酸钠标准物质溶液(1000mg/l)适量,加入到合适体积的容量瓶中,用生理盐水定容至刻度,配置成浓度为100mg/l的母液,混合均匀,超声震荡消除气泡,过夜,得到均匀稳定的阳性物质母液;
31.c)取步骤b)制备的母液0.3ml注入输血管软管段;
32.d)将灌注母液的样品,置于真空冷冻干燥机;冷冻干燥机参数设置:冷冻速度1℃/min,早期冷冻点-1℃保持15min,冷冻温度-45℃;启动冷冻干燥机,进入程序化冷冻干燥过程,冻干40小时,得到冻干样品;
33.e)干燥后的样品分别装于自封袋中,用热熔封口机封口;
34.f)随机编号,粘贴标签,干燥避光储存;
35.g)对制备的样品性能进行测试。
36.实施例2
37.一次性使用静脉采血针溶血试验能力验证样品的制备,包括如下步骤:
38.a)基质:一次性使用静脉采血针;
39.b)配制阳性物质母液:取十二烷基苯磺酸钠标准溶液(1000mg/l)适量,加入到合适体积的容量瓶中,用生理盐水定容至刻度,配置成浓度为100mg/l的母液,混合均匀,超声震荡消除气泡,过夜,得到均匀稳定的阳性物质母液;
40.c)取步骤b)制备的母液0.3ml,缓慢注入一次性使用静脉采血针内,摇匀,均匀黏附于器壁;
41.d)将灌注母液的样品,置于电热鼓风干燥箱,于60℃恒温干燥48小时,得到干燥样品;
42.e)干燥后的样品分别装于自封袋中,用热熔封口机封口;
43.f)随机编号,粘贴标签,干燥避光储存;
44.g)对制备的样品性能进行测试。
45.实施例3
46.一次性使用静脉采血针溶血试验能力验证样品的制备,包括如下步骤:
47.a)基质:一次性使用静脉采血针;
48.b)配制阳性物质母液:取十二烷基硫酸钠(1000mg/l)适量,加入到合适体积的容量瓶中,用生理盐水定容至刻度,配置成浓度为100mg/l的母液,混合均匀,超声震荡消除气泡,过夜,得到均匀稳定的阳性物质母液;
49.c)取步骤b)制备的母液350μl注入一次性使用静脉采血针内,摇匀,均匀黏附于器壁;
50.d)将灌注母液的样品,置于真空冷冻干燥机;冷冻干燥机参数设置:冷冻速度1℃/min,早期冷冻点-1℃保持15min,冷冻温度-45℃;启动冷冻干燥机,及其直接进入程序化冷冻干燥过程,冻干40小时,得到冻干样品;
51.e)干燥后的样品分别装于自封袋中,用热熔封口机封口;
52.f)随机编号,粘贴标签,干燥避光储存;
53.g)对制备的样品性能进行测试。
54.实施例4
55.一次性使用静脉采血管溶血试验能力验证样品的制备,包括如下步骤:
56.a)基质:一次性使用静脉采血管;
57.b)配制阳性物质母液:称取十二烷基硫酸钠标准溶液(1000mg/l)适量,加入到合适体积的容量瓶中,用生理盐水定容至刻度,配置成浓度为100mg/l的母液,混合均匀,超声震荡消除气泡,过夜,得到均匀稳定的阳性物质母液;
58.c)取步骤b)制备的母液0.3ml注入一次性使用静脉采血管内,摇匀,均匀黏附于器壁;
59.d)将灌注母液的样品,置于真空冷冻干燥机;冷冻干燥机参数设置:冷冻速度1℃/min,早期冷冻点-1℃保持15min,冷冻温度-45℃;启动冷冻干燥机,及其直接进入程序化冷冻干燥过程,冻干40小时,得到冻干样品;
60.e)干燥后的样品分别装于自封袋中,用热熔封口机封口;
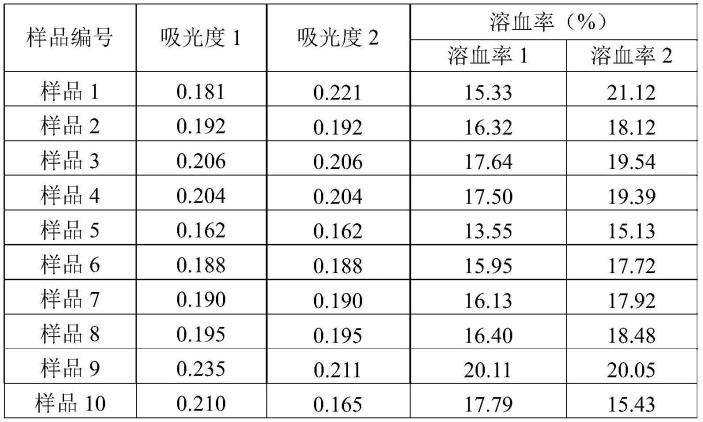
61.f)随机编号,粘贴标签,干燥避光储存;
62.g)对制备的样品性能进行测试。
63.实施例5
64.一次性使用输血管溶血试验能力验证样品均匀性和稳定性验证。
65.对样品中阳性物质的稳定性和均匀性检查是验证样品制备错过成有效性的主要方法。检查样品均匀性和稳定性按照cnas-gl03《能力验证样品均匀性和稳定性评价指南》进行。
66.所得样品均匀性和稳定性检测方法和结果如下:
67.随机选取实施例1的10个样品,按照检测标准iso 10993-4,gb/t 16886.4,gb/t 14233.2检测方法,再重复条件下测试2
×
10份样品的溶血率。结果数据用方差分析法进行统计处理,统计步骤和结果如表1所示。
68.表1实施例1能力验证样品溶血试验检测结果
[0069][0070]
表2实施例1能力验证样品溶血率的方差统计分析结果:
[0071]
组观测数求和平均方差
ꢀꢀ
列110166.717216.671723.027059
ꢀꢀ
列210182.893418.289343.620037
ꢀꢀ
差异源ssdfmsfp-valuef crit组间13.08353113.083533.930.0634.41组内59.82386183.323548
ꢀꢀꢀ
总计72.9073919
ꢀꢀꢀꢀ
[0072]
结论:临界值f0.05=4.41,计算得出f值为3.93,样品f值<临界值,表明在0.05显著水平时,该样品溶血率分布是均匀的。
[0073]
稳定性评价采用两种类型的试验:一种是储存温度25℃下的稳定性试验,另一种是室温(42℃)下的稳定性试验。随机取实施例1的样品,定期检测样品,完成不同温度点不同保存时间测试5个样本,稳定性测试样品的检测值与指定值(样品初始状态的检测值)无显著性差异(p值》0.05),则说明该能力验证样品的稳定性符合cnas-gl03的要求,同时确定在不同温度下,符合该能力验证样品长期保存时间的要求。稳定性试验结果见表3。
[0074]
表3本发明能力验证样品稳定性实验结果
[0075][0076][0077]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1