测定同时含有氯和溴的废水的化学需氧量的方法与流程
1.本发明属于水环境监测技术领域,具体涉及一种测定同时含有氯和溴的废水的化学需氧量的方法。
背景技术:
2.化学需氧量(chemical oxygen demand,以下简称cod)是衡量环境水质和污染源排放的重要指标,是指在一定的条件下,采用一定的强氧化剂处理水样时所消耗的氧化剂量,其结果折算为对应氧量。cod是表示水中还原性物质多少的一个综合性指标,也是衡量水中有机物质含量的评价指标。cod值越大,说明水体受有机物的污染越严重,其危害体现在有机物对环境的危害。有机化合物主要由氧、氢和碳元素组成。当有机物排放到环境水体时,以毒性和使水中溶解氧减少的形式对生态系统及环境造成危害,尤其是挥发性有机物以及难降解有机物等。
3.随着工业产品多样化和工业技术的发展,工业废水中所包含的污染物种类及其含量都发生了较大的变化,如特定工业废水中含有溴化物,以及氯化物与溴化物共存的情况,部分工业废水中溴化物浓度可达100mg/l以上。
4.重铬酸钾法是测定cod的常规检测方法,所得结果为codcr,目前普遍使用的重铬酸钾法中的干扰消除措施主要针对氯化物,通过硫酸汞屏蔽其干扰,但对溴化物未提出任何处理措施,而氯化物、溴化物共存时产生的协同效应对codcr检测结果产生了极大的偏差,导致同一水体采用不同方法测定时结果存在明显差异,说明重铬酸钾法的准确性已不适用于氯离子与溴离子共存时水样codcr的检测,失去对工业废水codcr真实水平的监控作用与意义,给企业带来了巨大的环保风险及经济损失。
5.水体中的氯离子一直是影响codcr测试结果的主要干扰物质(范丽华,等.酸化吹气-重铬酸钾法测定高氯地表水中化学需氧量[j].中国无机分析化学,2021,11(05):97-101.),理论上氧化l mg氯离子相当于codcr值增加0.226mg;而溴与氯作为同一主族元素,具有相似的化学性质,理论上氧化l mg溴离子相当于codcr值增加0.1mg,且水中溴离子比氯离子更容易被氧化,当氯溴共存时,codcr测定结果偏差更大,且相对误差及标准偏差较大。因此,如何消除的氯溴共存对于水样codcr检测的干扰成为为水质监测领域中亟待解决的技术问题。
[0006]
现有技术中适用于codcr含量检测的方法主要有《水质化学需氧量的测定重铬酸盐法》(hj 828-2017)和《高氯废水化学需氧量的测定氯气校正法》(hj/t 70-2001),方法标准hj 828-2017在“5干扰和消除”章节指出,测定水中codcr的主要干扰物质为氯化物,并通过硫酸汞屏蔽其干扰。只对氯离子干扰进行消除,未涉及水中溴离子干扰的消除,所用的掩蔽剂硫酸汞仅可有效掩蔽氯离子,对溴离子几乎无掩蔽作用,在应用于含氯含溴废水cod检测时偏差较大,不能准确反映出水体的实际污染状况。
[0007]
本发明人团队在监测某化工园区污水处理厂水样的codcr时,发现水样中cl-粗测浓度为1100mg/l左右,离子色谱法测定浓度为894mg/l,并同时测出溴化物,br-浓度为
97mg/l。按照hj 828-2017方法的规定,cl-粗测浓度必须小于等于1000mg/l。因此,将水样稀释2倍后采用低浓度模式测定,测定浓度为51mg/l;但由于氯离子精确浓度低于1000mg/l,所以尝试不稀释、直接高浓度模式测定,测定浓度竟高达72mg/l,两次测定结果的差异较大。为探明测定浓度偏高的原因,课题组进一步开展模拟实验:在空白水中加入邻苯二甲酸氢钾标准溶液,使空白加标样品的codcr为40mg/l,并同时加入氯化钾和溴化钾,使加标样品中cl-、br-浓度分别为800mg/l、100mg/l。试验结果显示,高浓度模式下样品测定浓度为71mg/l,低浓度模式下为49mg/l。试验结果表明,当水样中含有溴化物时,对测定浓度具有正干扰影响,且高浓度测定模式的影响高于低浓度测定模式,工业园区的水样高低模式测定结果间的差异也是类似的原因所致。
[0008]
研究表明,当待测废水中氯离子和溴离子共存时,会对codcr测定结果产生较大的正干扰。现有技术的测定方法只对氯离子干扰进行了消除,未涉及水中溴离子干扰的消除,如何排除上述的干扰,鲜有文献披露。因此,一种准确度和精密度高的测定同时含有氯和溴的废水的化学需氧量的方法亟需开发出来。
技术实现要素:
[0009]
为了解决上述的技术问题,本发明呈现出了溴离子对含氯含溴废水codcr测定产生干扰的机理,并采用了消除溴离子干扰的措施,发明了一种适用于含氯含溴废水codcr的检测方法。
[0010]
本发明的技术方案是,通过对水样的分析,针对于水样中溴离子的浓度情况,采取不同的检测方法;当样品中溴离子浓度低于3mg/l,氯离子浓度小于1000mg/l(稀释后)时,溴离子干扰可忽略不计,并参照hj 828方法去除氯离子干扰。水样中氯离子的质量浓度采用gb11896测定,也可测定电导率后按照hj506附录a进行换算,或参照gb17378.4测定盐度后进行换算。
[0011]
当样品中溴离子浓度大于3mg/l、氯离子浓度小于1000mg/l(稀释后)时,将样品稀释至codcr≤50mg/l后测定,从测得的表观codcr值中扣除溴离子干扰值后,得出样品实际codcr值。
[0012]
同时,关于如何排除溴离子导致的干扰浓度,本发明在计算时通过特定的方法来进行,计算公式如下:样品中化学需氧量的质量浓度按下式计算:
[0013][0014]
式中:ρρ——样品中化学需氧量的质量浓度,mg/l;
[0015]
c1——硫酸亚铁铵标准溶液的浓度,mol/l;
[0016]v0
——空白试验所消耗的硫酸亚铁铵标准溶液的体积,ml;
[0017]v1
——水样测定所消耗的硫酸亚铁铵标准溶液的体积,ml;
[0018]v2
——水样的体积,ml;
[0019]
8000——1/4o2的摩尔质量以mg/l为单位的换算值。
[0020]
c0——溴离子浓度,mol/l;
[0021]
f——稀释倍数。
[0022]
具体的,本发明所提供的测定同时含有氯和溴的废水的化学需氧量的方法,包括
以下的步骤:
[0023]
(1)对待测含氯含溴废水样中溴离子和氯离子浓度进行测定;
[0024]
(2)当废水样品中溴离子浓度小于或等于3mg/l、氯离子浓度小于1000mg/l时,采用hj 828方法排除氯离子的干扰,测定水样codcr值;
[0025]
(3)当废水样品中溴离子浓度大于3mg/l、氯离子浓度小于1000mg/l时,将样品稀释至codcr≤50mg/l后测定,在预处理后的水样中加入已知量的重铬酸钾溶液,并在强酸介质下以银盐作催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾,由消耗的硫酸亚铁铵的量换算成消耗氧的质量浓度,即表观表观codcr;从测得的表观codcr值中扣除溴离子干扰值后,得出样品实际codcr值,所述的扣除溴离子导致的干扰浓度,是采用上述公式(1)进行计算。本发明的方法适用于氯化物浓度小于或等于1000mg/l的水样品中化学需氧量的测定;所述的氯化物浓度是指稀释后的浓度。
[0026]
优选的,步骤(1)中所述的溴离子浓度测定采用《水质无机阴离子(f-、ci-、no
2-、br-、no
3-、po
43-、so
32-、so
42-)的测定离子色谱法》(hj 84-2016)的标准方法对含氯含溴废水中的溴离子浓度进行测定。
[0027]
优选的,步骤(1)中所述的氯离子的质量浓度采用gb11896测定,或者是测定电导率后按照hj506附录a进行换算,或参照gb17378.4测定盐度后进行换算。
[0028]
优选的,步骤(3)中所述的作为催化剂的银盐为硫酸银。
[0029]
优选的,所述的废水为工业含氯含溴废水。
[0030]
本发明的检测方法原理是,在水样中加入已知量的重铬酸钾溶液,并在硫酸介质中以硫酸银作催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵溶液滴定水样中未被还原的重铬酸钾,由消耗的硫酸亚铁铵的量计算出消耗氧的质量浓度,扣除/排除重铬酸钾氧化溴化物所对应的氧的质量浓度,即为所测样品的化学需氧量浓度。
[0031]
本发明的有益效果在于:
[0032]
首先,解决了现有技术中的以下问题:针对于废水水体中同时含有溴离子和氯离子的情况,目前并未见有相关的准确度高、精确性好的方法来对其进行检测。而普遍使用的重铬酸钾法中的干扰消除措施主要针对氯化物,并通过硫酸汞屏蔽其干扰,但对溴化物未提出任何处理措施,而氯化物、溴化物共存时产生的协同效应对codcr检测结果产生了极大的正干扰,导致同一水体采用不同方法测定时结果存在明显差异;
[0033]
本发明通过测得的codcr值扣除溴离子干扰值,得出样品实际codcr值,消除溴化物对测定codcr的正干扰影响,排除了溴离子导致的干扰浓度的检测方法,填补了现有的标准关于上述情况的空白。
[0034]
第二,本发明所提供的方法检测的数据准确性和精确性高,并且相对简单,可操作性强。
附图说明
[0035]
图1为水体中含有单独溴离子对codcr高低浓度测定的影响;
[0036]
图2为水体中含有单独氯离子对codcr高低浓度测定的影响;
[0037]
图3为氯离子(800mg/l)和溴离子共存对codcr高低浓度测定的影响;
[0038]
图4为氯离子(900mg/l)和溴离子共存对codcr高低浓度测定的影响;
[0039]
图5为氯离子(1000mg/l)和溴离子共存对codcr高低浓度测定的影响;
[0040]
图6为重铬酸钾浓度与氧化还原电位、codcr测定值的关系;
[0041]
图7为codcr测量值与重铬酸钾氧化还原电位的关系;
[0042]
图8为溴离子浓度对codcr测定浓度的干扰;
[0043]
图9为codcr测定浓度与理论浓度的差值和cl-浓度梯度的关系图;
[0044]
图10为φ(cl2/cl-)与cl-以及φ(br2/br-)与br-的浓度关系。
具体实施方式
[0045]
为了能使本领域技术人员更好的理解本发明,现结合具体实施方式对本发明进行更进一步的阐述。
[0046]
实施例1
[0047]
1.1本发明中所涉及到的国标、行标等具体如下:
[0048]
gb 11896水质氯化物的测定硝酸银滴定法;
[0049]
hj 506水质溶解氧的测定电化学探头法;
[0050]
gb 17378.4海洋监测规范第4部分:海水分析;
[0051]
hj 828水质化学需氧量的测定重铬酸盐法;
[0052]
hj/t 70高氯废水化学需氧量的测定氯气校正法;
[0053]
hj 84水质无机阴离子(f-、ci-、no
2-、br-、no
3-、po
43-、so
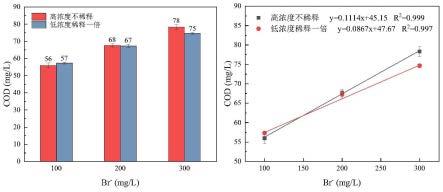
32-、so
42-)的测定离子色谱法。
[0054]
本发明中所提及的化学需氧量为,经重铬酸钾氧化处理时,水样中的溶解性物质和悬浮物所消耗的重铬酸盐相对应的氧的质量浓度,以mg/l表示。
[0055]
1.2试剂种类与保管;
[0056]
除非另有说明,实验时所用试剂均为符合国家标准的分析纯试剂,实验用水均为新制备的超纯水、蒸馏水或同等纯度以上的水。
[0057]
1.2.1硫酸银(ag2so4)分析纯;硫酸汞(hgso4)分析纯;硫酸:ρ(h2so4)=1.84g/ml,优级纯;硫酸溶液:1+9;硫酸银-硫酸溶液:称取10g硫酸银,加到1l硫酸中,放置1d~2d使之溶解,并摇匀,使用前小心摇动。硫酸汞溶液:ρ(hgso4)=100g/l。称取10g硫酸汞,溶于100ml硫酸溶液中,混匀。
[0058]
1.2.2重铬酸钾标准溶液
[0059]
重铬酸钾,基准试剂:取适量重铬酸钾在105℃烘箱中干燥2h。
[0060]
重铬酸钾标准溶液:c(1/6k2cr2o7)=0.2500mol/l。准确称取12.258g重铬酸钾溶于水中,定容至1000ml,或购置市售标准溶液,有效期为1个月。
[0061]
硫酸亚铁铵标准溶液
[0062]
硫酸亚铁铵标准溶液:c[(nh4)2fe(so4)2·
6h2o]≈0.05mol/l。称取19.5g硫酸亚铁铵[(nh4)2fe(so4)2·
6h2o]溶解于水中,加入20ml硫酸,待溶液冷却后稀释至1000ml。或购置市售标准溶液。
[0063]
每日临用前,必须用重铬酸钾标准溶液准确标定硫酸亚铁铵标准溶液i的浓度。取10.00ml重铬酸钾标准溶液置于锥形瓶中,用水稀释至约100ml,缓慢加入30ml硫酸,混匀,冷却后加入3滴(约0.15ml)试亚铁灵指示剂,用硫酸亚铁铵标准溶液滴定,溶液的颜色由黄
色经蓝绿色变为红褐色即为终点。记录下硫酸亚铁铵标准溶液i的消耗量v(ml)。硫酸亚铁铵标准溶液浓度按如下的公式(2)计算:
[0064][0065]
式中:c——硫酸亚铁铵标准溶液浓度,mol/l;
[0066]
v——滴定时消耗硫酸亚铁铵标准溶液i的体积,ml。
[0067]
每日临用前,必须用重铬酸钾标准溶液ii准确标定此溶液的浓度。
[0068]
1.2.3邻苯二甲酸氢钾标准溶液:
[0069]
c(kc8h5o4)=2.0824mmol/l。称取105℃干燥2h的邻苯二甲酸氢钾(kc8h5o4)0.4251g,溶于水,并稀释至1000ml,混匀。以重铬酸钾为氧化剂,将邻苯二甲酸氢钾完全氧化的耗氧量为1.176g/g(即1g邻苯二甲酸氢钾耗氧1.176g),故该标准溶液理论的codcr值为500mg/l,用时新配。或购买有证标准溶液。
[0070]
6.10试亚铁灵指示剂溶液
[0071]
1.2.4邻菲罗啉(也称1,10-菲罗啉等)指示剂溶液:
[0072]
即为试亚铁灵指示剂。溶解0.7g七水合硫酸亚铁(feso4·
7h2o)于50ml水中,加入1.5g 1,10-菲罗啉,搅拌至溶解,稀释至100ml。
[0073]
1.2.5防爆沸玻璃珠或沸石。
[0074]
1.3实验仪器设备等
[0075]
1.3.1回流冷却装置:磨口250ml锥形瓶的全玻璃回流装置,若取样量在30ml以上,可采用磨口500ml锥形瓶的全玻璃回流装置。冷却方式可选用水冷或风冷全玻璃回流装置,其他等效冷凝回流装置亦可。
[0076]
1.3.2加热装置:电炉或其它等效标准消解装置。
[0077]
1.3.3天平:精度为0.0001g。
[0078]
1.3.4酸式滴定管(25ml或50ml)或其它精度满足要求的等效电子滴定器。
[0079]
1.3.5codcr自动测定仪:带有自动加热和回流装置,具有定量量取滴定标准溶液和根据颜色判断滴定终点的功能。
[0080]
1.3.6一般实验室常用仪器和设备。
[0081]
1.4水样品的采集和保存
[0082]
按照hj/t91的相关规定进行水样的采集和保存。采集水样的体积不得少于100ml。
[0083]
采集的水样应置于玻璃瓶中,并尽快分析。如不能立即分析时,应加入硫酸(参照hj828—2017中6.1)至ph<2,置于4℃下保存,保存时间不超过5d。
[0084]
1.5检测分析方法:
[0085]
1.5.1样品测定
[0086]
将水样充分摇匀,取20.0ml于锥形瓶中,依次加入硫酸汞溶液、10.00ml重铬酸钾标准溶液和几颗防爆沸玻璃珠,摇匀。硫酸汞溶液按m(hgso4):m(cl-)≥20:1的比例加入。
[0087]
将锥形瓶连接到回流装置冷凝管下端,从冷凝管上端缓慢加入30ml硫酸银-硫酸溶液,以防止低沸点有机物的逸出,不断旋动锥形瓶使之混合均匀。自溶液开始沸腾起回流2h。若为水冷装置,应在加入硫酸银-硫酸溶液之前,通入冷凝水。
[0088]
回流冷却后,自冷凝管上端加入90ml水冲洗冷凝管,使溶液体积在140ml左右,取
下锥形瓶。
[0089]
溶液冷却至室温后,加入3滴试亚铁灵指示剂溶液,用硫酸亚铁铵标准溶液滴定,溶液的颜色由黄色经蓝绿色变为红褐色即为终点。记下硫酸亚铁铵标准溶液的消耗体积v1。
[0090]
1.5.2空白试验
[0091]
按样品测定相同步骤以蒸馏水代替水样进行空白试验,记录下空白滴定时消耗硫酸亚铁铵标准溶液的体积v0。
[0092]
在检测时,空白试验步骤中,每批次样品应至少测定2个实验室空白样品和1个全程序空白样品。
[0093]
1.5.3在特殊情况下,取样体积可根据需要在1.0ml到10.0ml之间,硫酸汞溶液按m(hgso4):m(cl-)≥20:1的比例加入,其余试剂的用量则按比例作相应的调整。
[0094]
注:空白试验中硫酸银-硫酸溶液和硫酸汞溶液的用量应与样品中的用量保持一致。
[0095]
上述的方法所对应的操作如下:
[0096]
(1)当废水样品中溴离子浓度小于或等于3mg/l、氯离子浓度小于1000mg/l时,采用hj 828方法排除氯离子的干扰;水样中氯离子的质量浓度采用gb11896测定,或者是测定电导率后按照hj506附录a进行换算,或参照gb17378.4测定盐度后进行换算;
[0097]
(2)当废水样品中溴离子浓度大于3mg/l、氯离子浓度小于1000mg/l时,将样品稀释至codcr≤50mg/l后测定,在预处理后的水样中加入已知量的重铬酸钾溶液,并在强酸介质下以银盐作催化剂,经沸腾回流后,以试亚铁灵为指示剂,用硫酸亚铁铵滴定水样中未被还原的重铬酸钾,由消耗的硫酸亚铁铵的量换算成消耗氧的质量浓度,即表观codcr;从测得的表观codcr值中扣除溴离子干扰值后,得出样品实际codcr值;
[0098]
所述的扣除溴离子导致的干扰浓度,采用如下的公式进行计算:
[0099][0100]
式中:ρ——样品中化学需氧量的质量浓度,mg/l;
[0101]
c1——硫酸亚铁铵标准溶液的浓度,mol/l;
[0102]v0
——空白试验所消耗的硫酸亚铁铵标准溶液的体积,ml;
[0103]v1
——水样测定所消耗的硫酸亚铁铵标准溶液的体积,ml;
[0104]v2
——水样的体积,ml;
[0105]
8000——1/4o2的摩尔质量以mg/l为单位的换算值。
[0106]
c0——溴离子浓度,mol/l;
[0107]
f——稀释倍数。
[0108]
将计算所获得的结果进行处理,使小数点位数与方法检出限保持一致,最多保留3位有效数字。
[0109]
此外,关于精密度控制,按如下的要求进行:每批样品应做10%的平行样。若样品数少于10个,应至少做一个平行样。当样品质量浓度≤15mg/l时,平行样相对偏差应≤
±
20%;当样品质量浓度>15mg/l时,平行样相对偏差应≤
±
10%。
[0110]
准确度控制按如下的要求进行:每批样品(≤20个)应至少测定1个有证标准样品,
有证标准样品的测定值应在允许范围内。
[0111]
实施例2
[0112]
为了验证溴离子对化学需氧量检测的干扰,本发明人进行了单含有溴离子、氯离子的水体检测实验,具体如下:
[0113]
2.1水体含有单独溴离子不含有氯离子的实验:
[0114]
配制codcr浓度为50mg/l的标准溶液,加入溴化钠使溶液中溴离子浓度分别为100、200和300mg/l。依照hj 828-2017方法分别采用高浓度不稀释法和低浓度稀释一倍法对每个待测液进行测定,结果如附图1所示。
[0115]
从附图1中可以看出,水体中含有单独溴离子对codcr高低浓度测定的影响如图1所示,codcr理论值为50mg/l,高浓度不稀释法和低浓度稀释一倍法两种方法下单独溴离子均会对codcr检测结果造成正向干扰,且影响程度相近;从拟合结果可看出,高浓度法的斜率为0.1114mg codcr/mg br-,低浓度法的斜率为0.0867mgcodcr/mg br-,均接近溴离子影响理论值0.1mg codcr/mg br-。
[0116]
2.2水体含有单独氯离子不含有溴离子的实验:
[0117]
配制codcr浓度为40mg/l的标准溶液,加入氯化钠使溶液中氯离子浓度分别为800、1000、1200和1400mg/l。依照hj 828方法分别采用高浓度不稀释法和低浓度不稀释法对每个待测液进行测定,结果如附图2所示。
[0118]
高浓度法检测结果为38~44mg/l,与无氯离子的对照组相比,高浓度法的codcr相对误差分别为14.8%、7.9%、10.5%和10.5%。低浓度法检测结果为39~44mg/l,低浓度法的codcr相对误差分别为2.6%、5.1%、12.8%和5.1%,说明单独氯离子不会显著影响codcr的测定结果,且高、低浓度法的检测结果基本一致,测定结果的相对误差满足《水和废水监测分析方法(第四版)》实验室质控指标体系中含量为5mg/l~50mg/l的codcr样品其室内相对误差≤15%的要求。
[0119]
2.3当氯离子和溴离子共同存在时的实验
[0120]
2.3.1codcr为60mg/l,氯离子为800mg/l,溴离子为0~100mg/l;
[0121]
配制codcr含量为60mg/l,氯离子为800mg/l,溴离子浓度分别为0、1、3、5、7、9、11、20、30、40、50、60、70、80、90和100mg/l的待测标准溶液。依照hj 828-2017方法分别采用高浓度不稀释法和低浓度稀释一倍法对每个待测液进行测定,结果如附图3、表1、续表1、表2、续表2所示。
[0122]
表1 氯离子(800mg/l)和溴离子共存对codcr高浓度模式测定的影响
[0123][0124][0125]
续表1 氯离子(800mg/l)和溴离子共存对codcr高浓度模式测定的影响
[0126][0127]
表2 氯离子(800mg/l)和溴离子共存对codcr低浓度模式测定的影响
[0128]
[0129][0130]
续表2 氯离子(800mg/l)和溴离子共存对codcr低浓度模式测定的影响
[0131]
[0132][0133]
从附图3、表1、续表1、表2、续表2中的结果可以看出,在不同梯度的溴离子浓度下测定codcr时,高浓度不稀释和低浓度稀释一倍的测定结果均与溴离子浓度呈正相关,但高浓度测定结果影响系数更大。从拟合曲线斜率可看出低浓度稀释一倍下偏差值0.0767mg codcr/mg br-较接近溴离子影响的理论值0.1mg codcr/mgbr-;高浓度不稀释下系数为0.2339mg codcr/mg br-,溴离子在高浓度不稀释下对codcr检测结果的影响更大。
[0134]
2.3.2codcr为60mg/l,氯离子为900mg/l,溴离子为0~100mg/l;
[0135]
配制codcr含量为60mg/l,氯离子为900mg/l,溴离子浓度分别为0、1、3、5、7、9、11、20、30、40、50、60、70、80、90和100mg/l的待测标准溶液。依照hj 828-2017方法分别采用高浓度不稀释法和低浓度稀释一倍法对每个待测液进行测定,结果如附图4、表3、续表3、表4、续表4所示。
[0136]
表3 氯离子(900mg/l)和溴离子共存对codcr高浓度模式测定的影响
[0137]
[0138][0139]
续表3 氯离子(900mg/l)和溴离子共存对codcr高浓度模式测定的影响
[0140][0141]
表4 氯离子(900mg/l)和溴离子共存对codcr低浓度模式测定的影响
[0142]
[0143][0144]
续表4 氯离子(900mg/l)和溴离子共存对codcr低浓度模式测定的影响
[0145]
[0146]
当氯离子浓度为900mg/l时,高浓度与低浓度测定结果与氯离子浓度为800mg/l时的实验结果相一致,从拟合曲线斜率可看出低浓度稀释一倍下偏差值0.1146mg codcr/mg br-较接近溴离子影响的理论值0.1mgcodcr/mg br-;高浓度不稀释下系数为0.2509mg codcr/mg br-,高浓度下codcr测定结果与理论值偏差更大。
[0147]
2.3.3codcr为60mg/l,氯离子为1000mg/l,溴离子为0~100mg/l
[0148]
配制codcr含量为60mg/l,氯离子为1000mg/l,溴离子浓度分别为0、1、3、5、7、9、11、20、30、40、50、60、70、80、90和100mg/l的待测标准溶液。依照hj 828-2017方法分别采用高浓度不稀释法和低浓度稀释一倍法对每个待测液进行测定,结果如附图5、表5、续表5、表6、续表6所示。
[0149]
表5 氯离子(1000mg/l)和溴离子共存对codcr高浓度模式测定的影响
[0150][0151]
续表5 氯离子(1000mg/l)和溴离子共存对codcr高浓度模式测定的影响
[0152]
[0153][0154]
表6氯离子(1000mg/l)和溴离子共存对codcr低浓度模式测定的影响
[0155]
[0156][0157]
续表6 氯离子(1000mg/l)和溴离子共存对codcr低浓度模式测定的影响
[0158][0159]
从附图5、表5、续表5、表6、续表6中可以看出,当氯离子浓度增加至1000mg/l时,高浓度与低浓度测定结果与前两组实验结果相一致,从拟合曲线斜率可看出低浓度稀释一倍下偏差值0.1069mg codcr/mg br-与溴离子影响理论值0.1mg codcr/mg br-接近,高浓度不稀释下系数为0.2984mg codcr/mg br-,且随着氯离子浓度增加,高浓度codcr测定结果影响系数呈升高趋势。
[0160]
综合以上的附图、表格中的数据可以看出,通过与单独氯离子、单独溴离子的试验相比可发现,氯离子与溴离子共存时,codcr检测结果与理论值的偏差更大,由此说明,codcr检测的高浓度法和低浓度法的偏差是由于溴离子与氯离子共同存在下干扰所导致。溴离子浓度范围为0~100mg/l时,从拟合曲线斜率可看出高浓度不稀释下偏差值介于
0.2339~0.2984mg codcr/mg br-,相对误差较大,在8%~43%。低浓度稀释一倍下偏差值介于0.0767~0.1146mg codcr/mg br-,较接近溴离子影响的理论值0.1mg codcr/mg br-,相对误差在-3%~9%,与单独溴离子存在时规律相一致。
[0161]
因此,对于低浓度codcr含量,在br-含量在0~100mg/l时,样品codcr含量的实际测量值可通过测定的表观值与br-理论值进行修正。修正关系为:样品实际codcr含量=表观codcr含量-br-含量/10。
[0162]
实施例3
[0163]
3.1关于溴离子在检测过程中产生干扰的机理,本发明人进行了如下的分析:
[0164]
codcr分析过程中,氯离子、溴离子各自的干扰反应如下:
[0165]
cr2o
72-+14h
+
+6cl-→
2cr
3+
+7h2o+3cl2[0166]
cr2o
72-+14h
+
+6br-→
2cr
3+
+7h2o+3br2[0167]
其中,cr2o
72-与cr
3+
的电极反应为:
[0168]
cr2o
72-+14h
+
+6e
‑→
2cr
3+
+7h2o
[0169]
根据能斯特方程,得出电极电位表达式:
[0170][0171]
根据不同重铬酸钾浓度,计算出对应的氧化电位φ(cr2o
72-/cr
3+
)。同时配制codcr为50mg/l的标准溶液,设置溴离子100mg/l,氯离子800mg/l,选取0.025mol/l至0.25mol/l共10个梯度的重铬酸钾浓度,进行codcr测定,具体结果如附图6所示。
[0172]
由附图6、7中显示的结果可知,氧化电位φ(cr2o
72-/cr
3+
)随着重铬酸钾浓度的增加而升高;当重铬酸钾从0.025mol/l增加至0.25mol/l时,氧化电位由1.626v升高至1.640v。氧化电位φ(cr2o
72-/cr
3+
)越高,氯离子、溴离子就越容易被氧化,引入的误差就越大。对所测codcr值与氧化电位φ(cr2o
72-/cr
3+
)进行拟合,结果表明二者变化趋势相一致,由此验证了重铬酸钾氧化电位越高,氯离子、溴离子越容易被氧化这一事实。高浓度重铬酸钾测定结果与理论值(50mg/l)偏差更大,而低浓度测定结果更接近理论值。因此,在氯离子与溴离子共存条件下,宜选用低浓度重铬酸钾进行测定。
[0173]
3.2分析br-产生的正干扰
[0174]
当取样量为10.0ml时,所述的方法检出限为4mg/l,测定下限为16mg/l;未经稀释的水样测定上限为50mg/l,超过此上限时将水样品稀释后测定。
[0175]
在对本发明进行研究时,本发明人设置了如下试验条件:空白样品中加入邻苯二甲酸氢钾标准溶液,配制codcr空白加标样品,浓度为40mg/l,并同时加入不同浓度溴化钾,使br-浓度梯度为10mg/l、20mg/l、50mg/l、100mg/l、200mg/l,考察不同浓度的br-对codcr测定浓度的影响。5个样品加标样品的测定浓度分别为42mg/l、43mg/l、46mg/l、49mg/l、61mg/l。以br-浓度为横坐标,codcr测定浓度与理论浓度的差值为纵坐标,拟合出线性方程:y=0.1007x+0.3433(r2=0.9872),详见图8。由此可见,br-产生的正干扰约为其浓度的1/10。
[0176]
通过图8的结果分析,本发明人解释产生上述现象的原因如下:
[0177]
从氧化还原电位上看,br2的电极电位低于cl2,所以br-相对于cl-更容易被氧化。根据重铬酸钾氧化br-的化学公式可以得出,6个br-对应3个o
2-,质量关系为:6
×
79.9:3
×
16,即479.4:48≈10:1,与实验结果恰好吻合。
[0178]
以下是反应式:
[0179]
cr2o
72-+14h
+
+6br-=2cr
3+
+7h2o+3br2[0180][0181]
通过上述的实验,基本上可以得出如下的结论:
[0182]
水样中br-对codcr测定浓度有正干扰结论,但仍然无法解释前面工业废水在高低两种测定模式下codcr测定浓度间的差异(br-浓度为97mg/l,cl-浓度为894mg/l)。因此,本发明人的团队模拟工业废水的情况,在codcr空白加标浓度为60mg/l、br-浓度为100mg/l的基础上,加入不同浓度的氯化物,使水样中cl-浓度分别为0、200mg/l、400mg/l、600mg/l、800mg/l、1000mg/l,分别采用高低浓度模式测定,codcr测定浓度与理论浓度的差值和cl-浓度梯度的关系见图9。
[0183]
从图9可以看出,高浓度测定模式下,codcr测定浓度随cl-浓度的增大而升高;低浓度测定模式下,当cl-浓度小于等于1000mg/l时,codcr测定浓度没有随cl-浓度的增加而变化。
[0184]
氧化还原反应中,可根据两个电对的电极电位相对大小,判断该反应能否发生以及发生的难易程度。通过对比φ(cr2o
72-/cr
3+
)与φ(cl2/cl-)、φ(br2/br-)的相对大小,来判断特定条件下cl-、br-被重铬酸钾氧化的程度。根据cl-、br-的电极反应和计算公式,计算出不同条件下对应的氧化电位,即φ(cl2/cl-)和φ(br2/br-),得到附图10。从图10可以看出,当cl-、br-浓度越高,对应的φ(cl2/cl-)和φ(br2/br-)氧化电位越低,即在相同的φ(cr2o
72-/cr
3+
)氧化电位(或重铬酸钾浓度)下,cl-、br-被氧化的趋势就越大。在高浓度测定模式下,因加入的氧化剂重铬酸钾溶液浓度大,所以反应体系的氧化还原点位比较高,cl-、br-相对低浓度测定模式更容易被氧化;而在低浓度测定模式下,当cl-或br-达到一定浓度时,其被氧化的电位降低到小于一定程度时,cl-、br-便容易被氧化,从原理上诠释了高低浓度测定模式下codcr测定浓度的差异。
[0185]
实施例4
[0186]
本发明人还考察了氧化剂的浓度对于本发明的方法的影响,具体的方法如下:
[0187]
考察重铬酸钾的浓度,包括高低两个浓度,即0.25mol/l和0.025mol/l,对于氯离子与溴离子共存的水样,在codcr测定时,氧化剂浓度如何选择需进一步探究。因此,本次分别采用高、低浓度两种氧化剂对氯离子与溴离子共存的水样进行codcr测定。
[0188]
用邻苯二甲酸氢钾配制成codcr为60mg/l的标准溶液,氯离子浓度1000mg/l,设置溴离子浓度0~100mg/l,对每个浓度的水样采用高浓度和低浓度两种方法进行测定,低浓度采用稀释一倍进行测定,具体试验结果如表7和续表7所示:
[0189]
表7 codcr为60mg/l,氯离子为1000mg/l高浓度模式测定结果
[0190]
[0191][0192]
续表7 codcr为60mg/l,氯离子为1000mg/l高浓度模式测定结果
[0193]
[0194][0195]
表8 codcr为60mg/l,氯离子为1000mg/l低浓度模式测定结果
[0196][0197]
续表8 codcr为60mg/l,氯离子为1000mg/l低浓度测定结果
[0198]
[0199][0200]
结果说明,采用高浓度法实际测定结果偏离了样品溶液的理论值,产生了系统性误差,相对误差为11%~43%,且随着溴离子增加,相对误差增大。直接对样品稀释一倍后依照低浓度法的实际测定结果与样品溶液的理论值一致,相对误差为4~9%,符合相对误差≤15%的要求。
[0201]
因此,对于含氯含溴水质codcr的测定,本发明用低浓度重铬酸钾(0.025mol/l)进行测定(要求codcr小于50mg/l),当codcr大于50mg/l时,通过稀释使得codcr小于50mg/l后,采用低浓度重铬酸钾进行测定。
[0202]
实施例5
[0203]
关于溴离子、氯离子的浓度的临界值,本发明人进行了如下的实验:
[0204]
5.1使用邻苯二甲酸氢钾、氯化钠和溴化钠配制成codcr含量为60mg/l,氯离子为1000mg/l,设置不同浓度溴离子。依照hj 828-2017方法分别采用高浓度不稀释法和低浓度稀释一倍法对每个待测液进行测定,结果如下。
[0205]
表9 codcr为60mg/l,氯离子为1000mg/l高浓度模式测定结果
[0206]
[0207][0208]
续表9 codcr为60mg/l,氯离子为1000mg/l高浓度测定结果
[0209]
[0210][0211]
表10 codcr为60mg/l,氯离子为1000mg/l低浓度测定结果
[0212][0213]
续表10 codcr为60mg/l,氯离子为1000mg/l低浓度测定结果
[0214]
[0215][0216]
采用高浓度法测定时,当溴离子浓度为3mg/l时,codcr相对误差为14%,测定结果的相对误差能满足《水和废水监测分析方法(第四版)》实验室质控指标体系中的相关要求,据此可确定溴离子影响临界值为3mg/l。因此,当溴离子浓度不超过3mg/l时(氯离子浓度小于1000mg/l),溴离子干扰可忽略不计,样品codcr的测定可直接参照hj 828-2017方法进行测定。
[0217]
采用低浓度法测定时,与理论codcr相比,相对误差在4~9%,符合相对误差≤15%的要求。因此,对于溴离子浓度超过3mg/l的水样,可将样品稀释至codcr≤50mg/l且氯离子浓度≤1000mg/l后采用低浓度法测定,从测得的表观codcr值中扣除溴离子干扰值后,得出样品实际codcr值。
[0218]
5.2考察氯离子浓度上限
[0219]
使用邻苯二甲酸氢钾、氯化钠和溴化钠配制成codcr为40mg/l,溴离子浓度为100mg/l的标准溶液,设置6个梯度的氯离子浓度(700、800、900、1000、1100、1200mg/l),采用低浓度重铬酸钾法进行测定,具体试验结果如下表11:
[0220]
表11 codcr为40mg/l,溴离子为100mg/l低浓度测定结果
[0221]
氯离子(mg/l)20040060080010001500平行1484848485760平行2494849505760平行3484848495660平均值(mg/l)48.348.048.349.056.760.0标准偏差si(mg/l)0.5770.0000.5771.0000.5770.000相对标准偏差rsd(%)1%0%1%2%1%0%理论codcr(mg/l)404040404040相对误差re(%)21%20%21%23%42%50%含溴理论codcr(mg/l)505050505050相对误差re(%)-3%-4%-3%-2%13%20%
[0222]
从表11中可以看出,在采用低浓度重铬酸钾法测定的情况下,当氯离子浓度超过
1000mg/l时,codcr测定结果相对误差为20%,不符合相对误差≤15%的要求;而当氯离子浓度低于1000mg/l时,codcr测定结果接近理论值,相对误差为-4~-2%,符合相对误差≤15%的要求。因此,本发明中所提供的方法适用于氯离子浓度不超过1000mg/l的情况,对于氯离子超过1000mg/l的水样,可经稀释后,采用本发明的方法测定。
[0223]
实施例6
[0224]
6.1本发明的方法检出限
[0225]
按照样品分析的全部步骤,对氯离子800mg/l、溴离子50mg/l,codcr值为15mg/l和20mg/l的标准溶液进行测定,计算7次平行测定的标准偏差,按公式(3)计算方法检出限。
[0226]
mdl=t
(n-1,0.99)
×s…………………………
公式(3)
[0227]
式中:mdl——方法检出限;
[0228]
n——样品的平行测定次数;
[0229]
t——自由度为n-1,置信度为99%时的t分布(单侧),n=7时,t
(6,0.99)
=3.143;
[0230]
s——n次平行测定的标准偏差。
[0231]
单一实验室测得的方法检出限为3mg/l。按照《环境监测分析方法标准制修订技术导则》(hj 168-2010)中规定以4倍检出限作为测定下限,本方法测得的测定下限为12mg/l。本方法检出限、测定下限的测试结果见表12。
[0232]
表12方法检出限和测定下限的测试结果
[0233][0234]
6.2精密度测试
[0235]
分别对氯离子800mg/l、溴离子50mg/l,codcr浓度分别为20mg/l、35.5mg/l和60mg/l的标准溶液进行测定,相对标准偏差范围分别为4.7%、2.1%、2.0%。结果详见表13。
[0236]
表13 标准溶液精密度测试数据
[0237][0238]
6.3准确度
[0239]
分别对氯离子800mg/l、溴离子50mg/l,codcr值为20mg/l、35.5mg/l和60mg/l的标准溶液进行测定,相对误差分别为-5.0%、1.9%、2.8%。结果详见表14。
[0240]
表14 标准溶液准确度测试数据
[0241][0242]
从以上表格12~14中的数据可以看出,采用本发明的方法对同时含有溴离子和氯离子的水体进行检测,准确性高、精确性好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1