Atad3a在制备治疗或预防心肌缺血再灌注损伤的药物中的应用
atad3a在制备治疗或预防心肌缺血再灌注损伤的药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及atad3a在制备治疗或预防心肌缺血再灌注损伤的药物中的应用。
背景技术:
2.目前,急性心肌梗死发生率趋高不下,直接经皮冠状动脉介入已经成为减少心肌梗死面积的最有效的治疗手段,显著降低急性心肌梗死患者的死亡率。然而,再灌注治疗在挽救心肌梗死的同时也会造成进行性的、不可逆的心肌缺血再灌注(i/r)损伤,已成为影响急性心肌梗死患者预后的主要原因。但是,目前心肌缺血再灌注损伤的临床治疗或预防仍缺乏有效的药物及措施。
3.线粒体在心肌细胞中含量十分丰富,作为心肌细胞的能量工厂,线粒体可通过生成atp为心肌细胞提供能量从而维持心肌收缩。此外,线粒体的稳态失衡(即线粒体的数量、形态、功能等失衡)也是引起心肌损伤的重要病理生理机制。线粒体稳态失衡可通过atp合成受阻、线粒体活性氧(ros)产生增多,线粒体通透转换孔(mptp)异常开放以及线粒体动力学改变等导致心肌细胞死亡并造成心肌i/r损伤。因此,探索线粒体稳态的调控机制及调控靶点对于心肌i/r损伤的预防及治疗至关重要。
4.atp酶家族aaa结构域包含蛋白3a(atad3a)是一种线粒体膜蛋白,在维持线粒体超微结构及线粒体正常功能中发挥重要作用。多项研究表明,atad3a缺失或突变可引起线粒体脊破坏、线粒体膜损伤、线粒体动态异常等。此外,也有研究表明携带atad3a突变体的人群可出现肥厚性心肌病的临床特征。上述研究证实atad3a是调控线粒体稳态并保护心肌细胞的关键分子,并且提示研发可促进atad3a表达的措施可能是治疗或预防心肌i/r损伤的重要应用方向。
技术实现要素:
5.为解决临床上预防或治疗心肌缺血再灌注损伤仍缺乏有效治疗手段的问题,本发明的主要目的在于提供atad3a在筛选或制备保护心脏药物中的应用,通过确定atad3a的表达对心肌缺血再灌注损伤的调控作用,将atad3a基因或蛋白用于心肌缺血再灌注损伤的预防或治疗,即atad3a在治疗心肌缺血再灌注损伤中的功能和应用,具体是atad3a作为靶基因在制备保护心肌线粒体损伤、维持心肌线粒体稳态、缓解或治疗心肌缺血再灌注损伤药物中的应用。
6.本发明的另一目的是提供atad3a的诱导剂在筛选或制备保护心脏药物中的应用。
7.为实现上述目的,本发明的技术方案如下:
8.第一方面,本发明提供atad3a作为药物靶标在筛选或制备保护心脏的药物中的应用,所述保护心脏的药物活性成分是atad3a,或者是提高atad3a表达量的试剂。
9.作为优选方案,所述应用包括atad3a作为药物靶标用于筛选或制备预防、缓解和/
或治疗心肌缺血再灌注损伤的药物。
10.进一步地,所述预防、缓解和/或治疗心肌缺血再灌注损伤的药物是提高atad3a表达量的试剂、或者促进atad3a表达的药物、或者增强atad3a作用的药物。
11.更进一步地,所述提高atad3a表达量的试剂的给药方式为直接裸dna注射法、脂质体包裹dna直接注射法、金包被dna基因枪轰击法、繁殖缺陷细菌携带质粒dna法、复制缺陷腺病毒携带目的dna法、peg修饰蛋白药物注射法、脂质体包裹蛋白静脉注射法或蛋白微球制剂皮下注射法中任一种。
12.第二方面,本发明还提供atad3a的诱导剂在制备保护心脏功能的药物中的应用,所述应用包括atad3a的诱导剂用于制备预防、缓解和/或治疗心肌缺血再灌注损伤药物。
13.作为优选方案,所述atad3a的诱导剂是促进atad3a蛋白质活性或蛋白质水平的激动剂、或者促进atad3a的mrna水平的激动剂,其促进作用是可逆的或不可逆的。
14.进一步地,所述促进atad3a蛋白质活性或蛋白质水平的激动剂包括促进atad3a蛋白质活性或蛋白质水平的蛋白质、多肽、酶、天然化合物、合成化合物、有机物和无机物。
15.本发明的药物可施用于会发生或已经发生心肌缺血再灌注损伤的任何动物,包括人类和非人类的动物。
16.本发明的药物可以本领域已知的途径施用于受试者,包括但不限于口服、胃肠外、皮下、肌内、静脉内、心肌内、舌下等方式,施用的剂量取决于接受者的年龄、健康和体重以及联用药物的种类、治疗频率、给药途径等,药物可以单一日剂量施用,或者总日剂量以每天两次、三次或四次的分开剂量施用,剂量可以施用一次或多次,施药时间可以单日至几个月或更长时间。
17.与现有技术相比,本发明具有如下有益效果:
18.(1)本发明发现atad3a的新功能,即atad3a具有保护心肌缺血再灌注损伤的作用。以野生型小鼠及atad3a全身过表达的小鼠为实验对象,通过结扎冠状动脉左前降支并松解进行心肌缺血再灌注损伤模型的建立,来研究atad3a对心肌缺血再灌注损伤的作用。结果发现,心肌缺血再灌注损伤会导致小鼠心肌组织atad3a的表达下调,而atad3a过表达可显著减少心肌梗死面积,缓解心肌收缩功能障碍,并保护线粒体结构和线粒体功能损伤,表明atad3a过表达可显著缓解心肌缺血再灌注所导致的心肌损伤,即atad3a基因能够对心肌缺血再灌注损伤起保护作用。
19.(2)基于atad3a在保护心脏中的功能,其可以为研制预防、缓解和/或治疗心肌缺血再灌注损伤的药物提供靶标。
20.(3)atad3a的诱导剂可用于制备预防、缓解和/或治疗心肌缺血再灌注损伤的药物。
附图说明
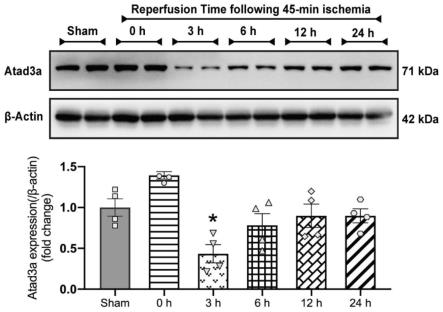
21.图1是实施例中western blot检测小鼠心肌缺血再灌注心肌组织中atad3a表达的结果,wt:野生型小鼠;atad3a:atad3a过表达小鼠;sham:假手术组(*p《0.05vs.sham)。
22.图2是实施例中western blot检测小鼠心脏组织中atad3a表达的结果,wt:野生型小鼠;atad3a:atad3a过表达小鼠;sham:假手术组*p《0.05vs.sham-wt)。
23.图3是实施例中急性心肌缺血再灌注损伤引起的心肌梗死严重程度的检测结果,
aar/lv:危险区/左心室;infraction size/aar:梗死区/危险区(*p《0.05vs.i/r-wt)。
24.图4是实施例中心脏超声检测缺血再灌注损伤后小鼠心脏收缩功能障碍结果(*p《0.05vs.sham-wt,#p《0.05vs.i/r-wt)。
25.图5是实施例中电镜观察缺血再灌注损伤后小鼠心肌线粒体损伤结果(*p《0.05vs.sham-wt,#p《0.05vs.i/r-wt)。
26.图6是实施例中海马仪检测缺氧复氧后乳鼠心肌细胞线粒体呼吸功能和atp生成能力的结果,ad-lacz:转染对照载体腺病毒组;ad-atad3a:转染携带atad3a的腺病毒组;h/r:缺氧/复氧处理;basal respiration:基础呼吸率;atp production:atp生成;spare respiration:剩余呼吸率;maximal respiration:最大呼吸率(*p《0.05vs.ad-lacz,#p《0.05vs.h/r-ad-lacz)。
27.图7是实施例中jc-1检测缺氧复氧后乳鼠心肌细胞线粒体膜电位损伤结果,cccp:线粒体氧化磷酸化解偶联剂(*p《0.05vs.ad-lacz,#p《0.05vs.h/r-ad-lacz)。
28.图8是实施例中mitosox检测缺氧复氧后乳鼠心肌细胞线粒体内ros生成结果(*p《0.05vs.ad-lacz,#p《0.05vs.h/r-ad-lacz)。
具体实施方式
29.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例的附图对本发明实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其它实施例,都属于本发明保护的范围。
30.实验动物的饲养与atad3a过表达小鼠的构建:atad3a过表达的转基因小鼠在c57bl/6jgpt鼠的背景上由集萃药康公司构建,将片段cag-atad3a-6x-flag-polya插入到位点h11中,最后得到atad3a全身过表达小鼠。本发明使用f3代及以上的子代雄鼠,选用8-10周龄、体重在23.5-27.5g,雄性,野生型小鼠和atad3a基因过表达小鼠为实验对象,所有实验小鼠均饲养在复旦大学附属中山医院spf级实验动物中心,室温在22-24℃之间,湿度在40-70%之间,明暗交替照明时间为12h,自由饮水摄食。
31.实施例1
32.根据基因小鼠构建方式建立atad3a心肌细胞特异性过表达的小鼠,western blot检测验证atad3a的表达情况,结果如图1和2所示,在小鼠心肌缺血再灌注心肌组织中atad3a表达显著下调,其中缺血45min再灌注3h时atad3a的表达量下降最为显著(图1)。与对照组相比,atad3a过表达小鼠的心脏组织中atad3a表达量显著升高,提示过表达atad3a基因小鼠构建成功(图2)。
33.实施例2
34.本实施例通过动物实验验证atad3a过表达显著改善心肌缺血再灌注损伤引起的心脏功能损伤及心肌线粒体结构功能损伤,具体如下:
35.(1)实验分组:野生型小鼠假手术组(sham-wt),野生型小鼠心肌缺血再灌注组(i/r-wt),atad3a小鼠假手术组(sham-atad3a),atad3a小鼠心肌缺血再灌注组(i/r-atad3a)。
36.(2)心肌缺血再灌注损伤模型的建立:成年雄性小鼠采用异氟烷麻醉后固定于操作台上,剪开小鼠心前区皮肤,并用止血钳将筋膜及肌肉分离充分暴露肋骨,于第三四肋间
用止血钳撑开肋骨后,轻轻挤压胸腔将心脏弹出充分暴露心脏。使用6-0丝线将左前降支打活结结扎,然后将心脏复位,使用活结缝合胸前皮肤。缺血45min后打开胸腔并松解心脏结扎线,恢复心脏血流,缝合皮肤,心肌再灌注6h。假手术组的小鼠同样进行手术,在左前将支周围绕一圈手术线但不结扎。
37.(3)术后24h通过伊文氏蓝-ttc双染来测定心肌梗死面积:再次结扎左前将支血管及降主动脉,并于升主动脉注射1%的伊文氏蓝0.2ml,蓝色染液可自主动脉根部逆行灌注到冠状动脉,并均匀分布于非缺血心肌或危险区心肌的心肌组织。随后迅速将心脏取下并置于冰上,冷冻后于预冷的板子上均匀切成5片1mm后的组织切片。将切片置于1%的ttc溶液中37℃避光孵育10min后拍照。梗死心肌不能被染色呈白色,缺血心肌不能被尹文氏蓝染色但可被ttc染色,呈红色,而正常心肌可被伊文氏蓝染成蓝色。最后用image j软件测定并统计左心室面积、缺血心肌面积及梗死心肌面积。
38.(4)术后24h进行心脏超声检测:在剃毛区均匀涂抹超声耦合剂,采用高频超声诊断仪,频率为40mhz,选取标准左心室乳头肌短轴切面,测量心率(heart rate)、射血分数(ejection fraction)及短轴缩短率(fractional shortening)。
39.(5)透射电镜(tem)观察线粒体结构:将小鼠采用异氟烷麻醉后,迅速取出心脏并使用pbs冲洗,将残存血液等洗净。切取梗死边缘心肌组织,并切成1mm3大小,放入2%戊二醛溶液中固定2h,使用100mm磷酸缓冲液漂洗组织3次,每次15min,然后放入1%的四氧化锇中固定3h,继续用100mm磷酸缓冲液漂洗组织3次,每次15min,经一系列乙醇和环氧丙烷萃取法进行脱水后,将样品包埋于环氧树脂中并固化切片。最后使用透射电镜观察切片并拍片,每个样品至少观察5个视野,每个视野至少30个细胞。
40.(6)原代乳鼠心肌细胞(nmcms)分离及培养:将1-2天龄的小鼠乳鼠酒精消毒后在无菌操作台中快速剪开胸腔,取下心脏并放入预冷的pbs中清洗。洗净后用剪刀将心脏剪碎,并将剪碎的心肌组织放入1%的胶原酶i中继续消化,重复5-7次至心肌组织为白色絮状物。将组织消化液离心,弃去上清后用10%的dmem重悬沉淀。将细胞均匀铺在10cm的培养皿中,放入细胞培养箱,差速贴壁1.5h,使成纤维细胞贴壁;小心吸出培养皿中的培养基,重新种于新的培养皿中并放入培养箱贴壁。24-48h后去除上层未贴壁的死细胞,便得到贴壁并恢复跳动的心肌细胞。换上新鲜培养基后放入培养箱继续培养。
41.(7)细胞缺氧复氧模型的建立:取生长状态良好的乳鼠原代心肌细胞,将正常培养基换成无糖培养基,并将细胞放入充满缺氧气体(5%co2,95%n2)的缺氧盒中,并放入co2培养室中培养6小时,缺氧期间可将氧浓度检测仪置于缺氧盒中并确保氧含量低于1%,缺氧完成后取出细胞并将缺氧培养基换成造成培养基放入普通培养箱中培养3小时,即完成h/r处理。
42.(8)细胞病毒转染:构建atad3a腺病毒(padeno-mcmv-atad3a-3flag)和对照腺病毒(padeno-mcmv-mcs-3flag)。将病毒取出并置于冰上融化,用无血清培养基稀释,并按照moi(multiplicity of infection)为10的比例加入细胞中进行感染,感染6-8h后将含病毒的培养基吸去,换上新的培养基继续培养,24-48h感染完成。
43.(9)细胞氧耗率(ocr)检测:将心肌细胞接种于xf96专用的96孔板中,细胞密度控制在10000个细胞/孔。细胞处理后按照说明将探针水化,并放入无co2培养箱。然后准备xf检测液,37℃预温备用。用xf检测液清洗细胞后,吸去生长培养液至每孔剩余50μl,再用xf
检测液清洗细胞2次,每孔加入检测液至终体积500μl/孔,置于37℃无co2培养箱培养1h。将水化好的测试板取出,按照如下顺序加入配置好的药物:加药孔a:oligomycin,10μm,56μl,加药孔b:fccp,7.5μm,62μl,加药孔c:rotenone/antimycin,10μm,69μl。将培养板置入seahorse xf96 analyzer后在预设的程序控制下先后加入下列药物检测不同状态下的细胞耗氧能力,oligomycin,1μm,fccp,0.75μm,rotenone,1μm,antimycin,1μm。最后进行氧耗量检测,并得到basal respiration、atp production、spare respiration和maximal respiration数值。
44.(10)蛋白免疫印迹技术(western blots):利用ripa裂解液(加入1mm蛋白酶抑制剂及1mm磷酸酶抑制剂)提取心肌组织或心肌细胞中的蛋白。利用十二烷基硫酸钠聚丙烯酞氨凝胶电泳(sds-page)将蛋白分离后,再使用bio-rad仪器进行转膜(250ma),使用封闭剂封闭后加入相应浓度一抗(稀释比),atad3a(1:1000),β-actin1(1:1000)。4℃摇床过夜,洗涤后敷育二抗。将条带浸泡入发光液中,然后置于自动曝光机中显影,最后利用image j软件分析图像各泳道条带灰度值,以目的蛋白/内参蛋白计算相对灰度值,并进行组间比较。
45.(11)jc-1染色检测线粒体膜电位:将cccp(10mm)按照1:1000的比例加入对照nmcms中稀释至10μm,处理20min后作为阳性对照组;提前按照说明书配好jc-1染色工作液,加到处理好的nmcms中,细胞培养箱中37℃避光孵育20min;除去上清后用jc-1染色缓冲液清洗细胞表面残存的染色液,并加入适量细胞培养液,最后在激光共聚焦显微镜下采集图像,并用image j软件分析568nm的荧光强度用于评估线粒体ros的生成。
46.(12)mitosox染色检测线粒体内ros生成:先用培养基将mitosox染液配成10μm的工作液,并加入处理好的细胞中,在培养箱中避光孵育20min,使用pbs清洗3次后加入新的培养基。最后在激光共聚焦显微镜下采集图像,并用image j软件分析568nm的荧光强度用于评估线粒体ros的生成。
47.结果
48.western blot检测结果显示,在小鼠心肌缺血再灌注心肌组织中atad3a表达显著下调,其中缺血45min再灌注3h时atad3a的表达量下降最为显著(图1);与对照组相比,atad3a过表达小鼠的心脏组织中atad3a表达量显著升高,提示过表达atad3a基因小鼠构建成功(图2);atad3a过表达降低急性心肌缺血再灌注损伤引起的心肌梗死严重程度(图3);心脏超声检测结果显示,atad3a过表达显著改善缺血再灌注损伤后小鼠心脏收缩功能障碍(图4);电镜观察结果显示,atad3a过表达显著改善了缺血再灌注损伤后小鼠心肌线粒体损伤(图5);海马仪检测结果显示,atad3a过表达显著改善缺氧复氧后乳鼠心肌细胞线粒体呼吸功能和atp生成能力(图6);jc-1检测结果显示,atad3a过表达显著改善了缺氧复氧后乳鼠心肌细胞线粒体膜电位损伤(图7);mitosox检测结果显示,atad3a过表达显著减少缺氧复氧后乳鼠心肌细胞线粒体内ros生成(图8)。
49.综上可知,本发明以野生型小鼠及atad3a全身过表达的小鼠为实验对象,通过结扎冠状动脉左前降支并松解进行心肌缺血再灌注损伤模型的建立,结果发现心肌缺血再灌注损伤会导致小鼠心肌组织atad3a的表达下调,而atad3a过表达可显著减少心肌梗死面积,缓解心肌收缩功能障碍,并保护线粒体结构和线粒体功能损伤,表明atad3a过表达可显著缓解心肌缺血再灌注所导致的心肌损伤,即atad3a基因能够对心肌缺血再灌注损伤起保护作用,atad3a、提高atad3a表达量的试剂或atad3a的诱导剂可用于筛选或制备保护心脏
的药物,特别是制备预防、缓解和/或治疗心肌缺血再灌注损伤的药物。
50.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应所述以权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1