检测水溶性维生素的方法和试剂盒与流程
1.本技术涉及体外诊断医学检验领域,尤其是一种用于检测维生素的标准品及试剂盒,以及相应的检测方法。
背景技术:
2.水溶维生素分为维生素c和各种b族维生素,在人体中参与各种代谢,且在人体中不能长期储存,极易流失。因此,检测人血清中水溶维生素的水平可作为评估人体营养健康状态和糖尿病、骨质疏松症、心血管疾病等病变的预测因子。检测水溶维生素的含量水平4,可对相关疾病的防治及延缓病变提供早期预警。
3.目前检测人血清中水溶维生素的方法主要有维生素检测法、荧光法、液相色谱法和液相色谱-串联质谱法等。液相色谱-串联质谱法可一次检测多种水溶维生素,与其他方法相比该方法准确度高、用血量少、分析速度快,特别适用于孕妇、儿童、老人、病患等特殊人群,得到了普遍认可,是国际公认的维生素检测“金标准”。
4.水溶维生素及其代谢物种类繁多,仅b族维生素就具有不同的亚型,例如,维生素b6主要活性形式为5
’‑
磷酸吡哆醛(plp),其在体内能转化成吡哆酸(pa);维生素b9主要活性形式为5-甲基四氢叶酸。不同亚型的水溶性维生素具有不同的生理功能,能够反映不同的生理或病理指标,例如,甲基丙二酸为维生素b12缺乏的早期标志物;维生素b6、维生素b9和维生素b12缺乏时都可导致同型半胱氨酸水平增高。因此,只有对水溶维生素及其代谢物水平全面检测,才能充分评估人体的营养健康状态。
5.然而,不同水溶维生素之间logp,pka等理化性质差异较大,造成多种水溶性维生素同时检测时,难以兼顾多个检测指标。目前已报道的方法可以通过质谱检测6种或9种水溶维生素,但难以达到临床所需的要求。如中国专利申请号cn201310744507.3“一种同时测定9种水溶性维生素的检测方法”检测样品为维生素功能饮料,非血液类样品。中国专利申请号cn202010172197.2“超高效液相色谱串联质谱技术检测血清中9种水溶性维生素的试剂盒”,检测样品为血清样品,其检测指标虽为9种,但缺乏烟酰胺(维生素b3活性形式)、5
’‑
磷酸吡哆醛(维生素b6的活性形式)和叶酸(维生素b9)的检测,且未公布检测试剂的稳定性数据。
6.此外,临床检验对样品通量要求较高,灵敏度要求高。近些年针对人体水溶维生素临床检测方法中,对水溶维生素检测的指标较少,且样品处理较为复杂,难以满足临床上高通量的需求;如中国专利申请号cn201510818863.4“一种同时检测血液样品中多种水溶性维生素的方法”,该方法采用体积比为1:1的甲醇和乙腈溶液沉淀蛋白,离心后取上清液,需氮气吹干,样品处理较为复杂。
7.此外,水溶维生素稳定性较差,目前已上市的检测试剂中,均储存在-20℃,且有效期12个月。如北京华大吉比爱生物的水溶性维生素多项质控品(京械注准20202400504),山东英盛生物的水溶性维生素测定试剂盒(鲁械注准20202400129)等。因此,水溶维生素临床检测试剂开发过程中,如何延长试剂的稳定性从而延长试剂的储存时间是不可回避的一个
问题。
技术实现要素:
8.本技术的一个方面是提供了一种用于检测维生素及代谢物的标准品,所述标准品包括:组分1,人或动物的血浆蛋白;组分2,异抗坏血酸和甘露醇中的至少一种;组分3,吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸中的至少一种。
9.优选地,所述组分3包括吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸。
10.优选地,所述组分2还包括抗坏血酸、茶多酚、蔗糖和可溶性淀粉中的至少一种。
11.优选地,组分1与异抗坏血酸的质量比为(0.1~5):(0.05~0.5),和/或组分1与甘露醇的质量比为(0.1~5):(1~5);优选地,组分1:抗坏血酸:茶多酚:蔗糖:可溶性淀粉的质量比为(0.1~5):(0.05~0.5):(0.0001~0.01):(1~5):(1~5)。
12.优选地,所述组分3还包括硫铵素、核黄素、烟酸、烟酰胺、泛酸、吡哆酸、生物素和叶酸中的至少一种。
13.优选地,所述组分3还包括硫铵素、核黄素、烟酸、烟酰胺、泛酸、吡哆酸、生物素和叶酸。
14.优选地,所述标准品还包括:tcep(即,三(2-羧乙基)膦(tris(2-carboxyethyl)phosphine)或其盐)。
15.优选地,所述标准品还包括:偏磷酸和三氯乙酸中的至少一种;优选地,还包括硫酸铵和高氯酸中的至少一种。
16.本技术的另一个方面是提供了一种检测血清中至少一种维生素及代谢物的试剂盒,其包括:组分a,饱和硫酸铵、2%~10%偏磷酸溶液、5%~10%高氯酸溶液、5%~20%三氯乙酸溶中的至少一种;组分b,根据权利要求1至6中任一项所述的标准品;组分c,tcep。
17.优选地,所述试剂盒还包括:组分d,氢氧化钠溶液。
18.优选地,所述试剂盒还包括:组分e,流动相添加剂,优选地为甲酸和乙酸铵。该流动相添加剂可以添加至水和/或甲醇中,用作色谱检测或lc-ms/ms检测中所使用的流动相。
19.本技术的另一个方面是提供了一种检测溶液中吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸中的至少一种维生素及代谢物的液相色谱-质谱检测方法,包括:采用两个时间段进行正负离子切换扫描,其中,每个时间段包括正离子模式和负离子模式,所述正离子模式用于检测吡哆醛和/或同型半胱氨酸,所述负离子模式用于检测甲基丙二酸。
20.优选地,所述方法进一步用于同时检测吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸。
21.优选地,所述方法进一步用于同时检测硫铵素、核黄素、烟酸、烟酰胺、泛酸、吡哆酸、生物素、和叶酸中的至少一种或全部。
22.优选地,第一时间段的正离子模式用于检测核黄素、硫胺素、烟酸、烟酰胺、磷酸吡哆醛和同型半胱氨酸中的至少一种;第一时间段的负离子模式用于检测甲基丙二酸;第二时间段用于检测泛酸、核黄素、吡哆酸、生物素、叶酸、和5-甲基四氢叶酸中的至少一种或全部。
23.优选地,质谱参数设定为:
24.离子源:电喷雾离子源;
25.离子模式:正负离子模式切换;
26.监测模式:多反应监测;
27.离子源温度为500℃~750℃,优选地,离子源温度为550℃;
28.正离子的喷雾电压为4500v~5500v,优选地,正离子的喷雾电压为5500v;
29.负离子的喷雾电压为-3500v~-4500v;
30.气帘气为25~40psi,优选地,气帘气为30psi;
31.雾化气gas1和辅助加热气压力gas2的压力为30~60psi,优选地为50psi。
32.优选地,质谱参数设定为:离子源温度为200℃~350℃,优选地为350摄氏度;正离子喷雾电压为2000v~4000v,优选地为4000v;负离子喷雾电压为-2000v~-4000v,优选地为-3500v;鞘气流速为10~40arb。
33.优选地,色谱条件为:
34.流动相a:含有甲酸(0.05%~0.2%)和乙酸铵(1mm~10mm)的水溶液,流动相b:含有甲酸(0.2%)和乙酸铵(2mm)的甲醇溶液;优选地,流动相a为含有甲酸(0.05%~0.2%)和乙酸铵(1mm~10mm)的水溶液;优选地,流动相b为含有甲酸(0.2%)和乙酸铵(2mm)的甲醇溶液;
35.梯度洗脱程序:流动相a+流动相b=100%;0~1.8min,流动相b体积百分比维持在0%;1.8~4.0min,流动相b体积百分比由0%增至55%;4.0~5.0min,流动相b体积百分比由55%增至72%;5.0~5.5min,流动相b体积百分比由72%增至90%;5.5~5.7min,流动相b体积百分比由90%递减至0%;5.7~7.5min,流动相b保持体积百分比为0%;
36.优选地,柱温度为30~60℃,优先50℃。
37.本技术的又一方面是提供了一种检测溶液中吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸中的至少一种维生素及代谢物的方法,其包括:
38.向标准品、质控品、以及待测样品中加入与待测种类维生素或代谢物相对应的内标物质,混匀;优选地,再加入tcep;
39.向上述溶液中分别加入2%~10%偏磷酸溶液、5%~20%三氯乙酸溶液中的至少一种,混匀后离心;优选地,加入标准品、质控品或待测样品的1/2~2倍体积的2%~10%偏磷酸溶液或5%~20%三氯乙酸溶液;优选地,加入上述溶液1/2体积的10%三氯乙酸水溶液;
40.取上清液,加入氢氧化钠溶液,优选地,加入标准品、质控品或待测样品的1/50~1/20体积的1m的氢氧化钠溶液;瞬离后震荡混匀,按照根据权利要求10至16中任一项所述的液相色谱-质谱检测方法进行检测。
41.优选地,所述内标物质中包括以下中的至少一种:硫胺素-13
c4;核黄素-13
c4,
15
n2;烟酰胺-d4;烟酸-d4;泛酸-13
c3,
15
n;5
’‑
磷酸吡哆醛-d3;吡哆酸-d3;生物素-d4;叶酸-d4;5-甲基四氢叶酸-d3;甲基丙二酸-d3;高胱氨酸-d8。
42.本技术的有益效果
43.本技术各个方面提供了一种检测维生素的表及试剂盒,检测维生素的液相色谱-质谱检测方法,以及检测溶液中多种维生素的方法,这些方面至少可以实现以下有益效果中的至少一者:
44.1)增加了检测指标及提高检测灵敏度
45.本技术可以同时在血清或其他液体中检测维生素b1(硫胺素)、维生素b2(核黄素)、维生素b3(烟酰胺)、维生素b3(烟酸)、维生素b5(泛酸)、维生素b6(磷酸吡哆醛)、维生素b6(吡哆酸)、维生素b7(生物素)、维生素b9(叶酸)、维生素b9(5-甲基四氢叶酸)、甲基丙二酸和同型半胱氨酸等12种水溶维生素及代谢物,特别是能够同时检测吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸,每个检测指标的浓度均能覆盖临床参考水平。
46.根据本技术的方案,至少可以克服现有技术中无法同时检测吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸的缺陷,进而克服了现有技术中无法同时区分活性形式和非活性形式的维生素(例如,维生素b6、维生素b9、维生素b12)。例如,同时检测吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸可以区分维生素b6缺乏、维生素b9缺乏、还是维生素b12缺乏,并且可以相对其他指标更加有利地早期诊断维生素b12缺乏症。根据本技术的方案,可以同时检测12种水溶维生素及代谢物,从而可以有利地准确且全面诊断维生素相关的疾病和身体营养状况。
47.2)提高样品检测通量
48.本技术的技术方案仅需极为简便的样品处理,在样品处理过程中不需要氮气吹干、无需固相萃取、无需复溶处理等耗时较长的过程,可以实现人血清样品中12种水溶性维生素及代谢物的高通量和高灵敏度检测。
49.3)延长检测试剂的稳定性
50.本技术技术方案的标准品及试剂盒能够在非超低温环境下(例如,-15℃~-25℃的冷冻环境或2℃~8℃的冷藏环境)长期保存而不影响水溶维生素检测试剂,解决了水溶维生素检测通量低、样品处理繁琐、试剂储存时间短等问题。
51.本技术的详述
52.在详细地描述本技术的各种示例实施例和各种示例实施方式之前,为了使本技术的各方面更加明晰,定义以下术语。未定义或未特别说明的术语和缩写应当符合本领域中所使用的常规含义。除非在本文中另有明确的特别说明,否则本技术中所有的科技术语都具有如本领域普通技术人员通常理解的相同含义。除非在本文中另有明确的特别说明,本技术涉及通常用于医学检验领域的常规技术。本领域技术人员可以理解的是,具有相同或类似含义的名称或术语可以在本技术中互换地使用。
53.血浆蛋白
54.如本文中所使用的,术语“血浆蛋白”(plasma proteins)、“血液蛋白”或其他类似表述,指人或动物血浆中的蛋白质,可以包括血清蛋白(例如,血清白蛋白)、球蛋白等。血清白蛋白可以是例如,牛血清白蛋白(bsa)。
55.水溶性维生素
56.如本文中所使用的,术语“水溶性维生素”(water-soluble vitamins)、或其他类似表述可以是可溶于水而不溶于非极性有机溶剂的维生素(例如,维生素c和b族维生素)、维生素衍生物、维生素代谢物或维生素类似物(例如,腺嘌呤、邻羟基苯甲酸)。优选地,本发明所述的“水溶性维生素”是维生素c和/或b族维生素,及其衍生物、代谢物和类似物。如在本文中所使用的,除非另有明确的说明,“维生素”、“维生素衍生物”、“维生素代谢物”和“维生素类似物”可以表示相同的含义,都可以用来表示:维生素及其经过基团修饰、基团添加、基团取代的类似物,维生素经过体内或体外反应获得的衍生物,维生素经过代谢反应而产
生的具有生物活性的代谢物,体内用于合成维生素的生物前体,以及具有类似结构或生化性质的类似物。
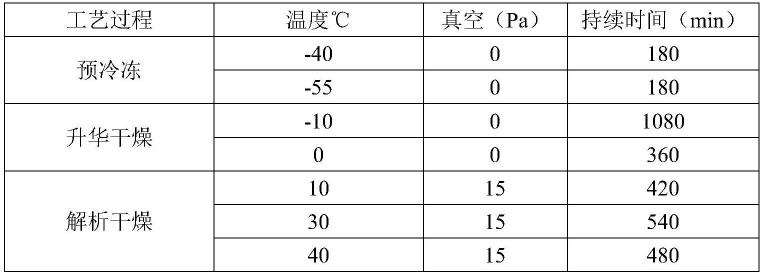
57.b族维生素
58.除非另有明确说明,本文中所使用的术语“b族维生素”、“维生素b”、“维生素b
n”(n为数字)或其他类似表述可以表示包括b族维生素及其各种衍生物或中间物,并非特指某个具体编号的特定物质,例如,术语“维生素b3”可以表示“烟酸”、“烟酰胺”和“烟酰胺核糖”。本领域技术人员可以理解的是,b族维生素可以包括吡哆醛(vb6-plp)、甲基丙二酸(mma)、5-甲基四氢叶酸(vb9-5mthf)和同型半胱氨酸(hcy)、硫铵素(vb1)、核黄素(vb2)、烟酸(vb3-na)、烟酰胺(vb3-nm)、泛酸(vb5)、吡哆酸(vb6-pa)、生物素(vb7)、和叶酸(vb9-fa)。
59.标准液和标准曲线
60.如本文所使用的,术语“标准液/溶液”、“标准品”、“校准液/溶液”、“校准品”或类似表述都表示:使用定量的纯度》98%或有证标准物质的维生素c和/或b族维生素中的至少一种,配置的标准品。将标准品经过下述预处理处理和检测步骤后,以一种或多种待测物(例如,生物素)与对应内标物的浓度比值(concentration ratio)为横坐标,该一种或多种待测物与对应内标的质谱峰面积的比值(area ratio)为纵坐标,可以绘制标准曲线或得到标准回归函数,用于计算待测样品中该一种或多种待测物的实际含量。本领域技术人员可以根据实际应用需要,对标准曲线或回归函数进行各种改变,例如其他等效函数、查找表等。
61.质控品
62.如在本文中使用的,术语“质控品”、“质控样品”、“质控溶液”或其他类似表述,可以指用于检查分析仪器或分析方法的性能的一种或多种脂溶性维生素溶液/混合物。本领域技术人员可以理解的是,针对待测的脂溶性维生素,质控品/质控溶液的组成成分可以与标准品相同,可以根据体外诊断试剂的相关通用标准,确定一种或多种水溶性维生素的具体含量和浓度。
63.内标物
64.如在本文中使用的,术语“内标”、“内标物”、“内标液”或其他类似表述,可以指针对待检测的一种或多种水溶性维生素的同位素标记物,用于根据同位素内标法(isotopically labeled internal standard)分析待测种类的维生素(例如,采用现有技术文献anal bioanal chem.2015apr;407(11):2965-74.doi:10.1007/s00216-014-8354-y中所述的内标方法)。
65.负离子模式和正离子模式
66.术语“负离子模式”、“以负模式操作”或“以负电离模式操作”是指其中产生和检测负离子的质谱方法。术语“正离子模式”、“以正模式操作”或“以正电离模式操作”是指其中产生和检测正离子的质谱方法。
67.串联质谱
68.串联质谱是是质谱仪中质谱分析器进行串接的质谱仪,一般含有两个或两个以上的质量分析器,质量分析器之间进行串接。如本发明使用此处的串联质谱仪可以为三重四极杆质谱仪,缩写ms/ms或者qqq,第一个ms指的是三重四极杆的碰撞池前面的四极杆质量分析器,用来扫描物质的母离子,第二个ms指的是碰撞池后面的四极杆,用来扫描物质的碎
片离子。两个四极杆直接为碰撞池,用于化合物碎裂,形成碎片离子。在第一个ms中,在创建一级质谱期间检测并记录了代表一种(和可能多于一种)化学成分的离子。离子所代表的物质要经过第二个ms或后续多个ms,其中感兴趣的物质会发生碎片化,以使该物质分解为子成分,这些子成分将被检测并记录为二级质谱。
69.色谱
70.术语“色谱”或“色谱法”是指一种物理分离方法,其中待分离的组分(即化学成分)分配在两相之间,其中一相为固定的(固定相),而另一相(流动相)沿确定的方向移动。流动相可以是气体(“气相色谱法”、“gc”)或液体(“液相色谱法”、“lc”)。本发明中的lc-ms/ms是指液相色谱-串联质谱法。
71.标准品溶剂的配制
72.标准品溶剂可以包括:组分1,浓度(w/v)为0.1%~5%的牛血清白蛋白(bsa);组分2,浓度(w/v)为0.05~0.5%的异抗坏血酸和/或浓度(w/v)为1%~5%的甘露醇;其余为溶剂,可选地,溶剂为水。在一种优选的实施方式中,组分2可以包括浓度(w/v)为0.05~0.5%的抗坏血酸、浓度(w/v)为0.0001~0.01%的茶多酚、浓度(w/v)为1%~5%的蔗糖或浓度(w/v)为1%~5%的可溶性淀粉。在一种优选的实施方式中,组分2可以至少包括浓度(w/v)为0.05~0.5%的异抗坏血酸和/或浓度(w/v)为1%~5%的甘露醇,优选地,组分2还可以包括浓度(w/v)为0.05~0.5%的抗坏血酸、浓度(w/v)为0.0001~0.01%的茶多酚、浓度(w/v)为1%~5%的蔗糖或浓度(w/v)为1%~5%的可溶性淀粉。
73.制备标准品冻干粉
74.将标准品和内标物每0.5~1.5ml分装于3ml棕色玻璃瓶中,置于冷冻干燥机中,敞开瓶口。冻干过程主要包括预冷冷冻、升华干燥、解析干燥这三个阶段。预冷冻过程可以固定产品,使溶液温度迅速降低至其共晶点之下,为下阶段的升华做好准备。升华干燥是冷冻干燥的主要过程,可以将溶液中的水通过升华而排出产品体外,整个过程中一方面可以将形成的水蒸气抽走,另一方面可以连续不断地提供维持升华所需的热量,加快干燥速度。解析干燥可以要把残余的未冻结水分排出,为使含水量符合要求,可在规定的温度范围内适当提高温度。当制品温度完全达到设定的温度时,再次恢复真空,这样可加快升华速度,缩短干燥时间。最终得到冻干粉。冻干条件如下:1)首先在-55℃至-20℃下预冷冻,持续70至300min;2)在-10至5℃下,真空0-15(单位:pa)条件下升华干燥100至1500min;3)最后在5至40℃下,真空10-15(单位:pa)条件下解析干燥200-600min。
75.在一个优选实施方案中,冻干机机器的参数设置见下表1。
76.表1.冻干机冻干程序1
77.78.在另一个优选实施方案中,冻干机器的参数设定见下表2。
79.表2.冻干机冻干程序2
[0080][0081]
在另一个优选实施方案中,冻干机器的参数设定见下表3。
[0082]
表3.冻干机冻干程序3
[0083][0084]
标准品冻干粉的稳定性检测
[0085]
冷冻干燥结束后,将标准品和内标物取出,加盖密封,分为两份,一份置于-70℃冰箱中保存,一份置于37℃和75%湿度的恒温恒湿箱中保存。分别在第1天,第3天,第7天取出冻干粉置于2~8℃冰箱,于第7天取出-70℃冰箱中的冻干粉,使用“本技术的详述”部分中参照表4描述的标准品配制方法、样品处理方法和lc-ms/ms检测检测方法,对冻干粉进行稳定性检测。
[0086]
1)冻干粉可溶性
[0087]
将冻干粉瓶盖取下,加入0.5~1.5ml水,观察冻干粉溶解的速度,冻干粉在1min内全部溶解至无色透明液体。
[0088]
2)冻干粉稳定性
[0089]
将恒温恒湿箱中储存不同时间的冻干粉和储存在-70℃冰箱中冻干粉全部溶解,使用“本技术的详述”部分中参照表4描述的标准品配制方法、样品处理方法和lc-ms/ms检测方法。恒温恒湿箱中储存的低值质控品冻干粉和高值质控品冻干粉中12种水溶维生素与理论值相比,偏倚(即,bias%)≤
±
15%,恒温恒湿箱中储存的内标冻干粉中内标与-70℃冰箱中冻干粉相比,偏倚≤
±
30%。
[0090]
根据本技术的方案的冻干粉(例如,标准品冻干粉或质控品冻干粉)在较高的温度(诸如2~8℃和37℃的非超低温冷冻环境,)环境下仍然可以长期稳定保存其中的水溶性维生素,不要求超低温保存,降低了运输、保存成本,增加了产品稳定性。
[0091]
混合标准品的配制
[0092]
混合标准品可以包括吡哆醛、甲基丙二酸、5-甲基四氢叶酸或同型半胱氨酸;可以包括吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸中的至少两者或三者的组合;可以包括吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸。在一种可选的实施方式中,混合标准品可以包括吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸,并且还可以包括硫铵素、核黄素、烟酸、烟酰胺、泛酸、吡哆酸、生物素和叶酸。
[0093]
称量12种水溶维生素及代谢物标准品和对应的内标标准品粉末,配制12种水溶维生素及代谢物的分析物混合标准品溶液和混合内标溶液。混合标准品溶液为含维生素b1(硫胺素)、维生素b2(核黄素)、维生素b3(烟酰胺)、维生素b3(烟酸)、维生素b5(泛酸)、维生素b6(5
’‑
磷酸吡哆醛)、维生素b6(吡哆酸)、生物素b7(生物素)、维生素b9(叶酸)、维生素b9(5-甲基四氢叶酸)、同型半胱氨酸、甲基丙二酸的分析物混合溶液。混合内标溶液为含硫胺素-13
c4;核黄素-13
c4,
15
n2;烟酰胺-d4;烟酸-d4;泛酸-13
c3,
15
n;5
’‑
磷酸吡哆醛-d3;吡哆酸-d3;生物素-d4;叶酸-d4;5-甲基四氢叶酸-d3;甲基丙二酸-d3;以及高胱氨酸-d8。
[0094]
采用标准品溶液释混合标准品溶液,配制成用于绘制水溶维生素标准曲线的标准品,标准曲线浓度如表4所示。其中,标准品溶液可以包括:组分1,浓度(w/v)为0.1%~5%的牛血清白蛋白(bsa);组分2,浓度(w/v)为0.05~0.5%的异抗坏血酸和浓度(w/v)为1%~5%的甘露醇;其余为溶剂,可选地,溶剂为水。在一种优选的实施方式中,组分2可以包括浓度(w/v)为0.05~0.5%的抗坏血酸、浓度(w/v)为0.0001~0.01%的茶多酚、浓度(w/v)为1%~5%的蔗糖或浓度(w/v)为1%~5%的可溶性淀粉。
[0095]
表4. 12种水溶维生素及代谢物的标准曲线浓度
[0096][0097][0098]
在表4中,c1~c6分别为浓度从低到高的6个用于标准曲线的标准品,lqc、mqc、hqc分别为低浓度、中浓度和高浓度三个质控品,其中,同型半胱氨酸浓度单位为μmol/l,其余化合物的浓度均为ng/ml。
[0099]
在一个优选的实施方式中,采用水(例如,经纯化过滤的去离子水)作为内标溶剂,配成水溶性维生素混合内标溶液,内标物浓度如表5所示。
[0100]
表5.水溶性维生素混合内标溶液的浓度
[0101]
中文名缩写混合内标溶液的浓度
硫胺素-13
c4vb1-13
c4150ng/ml核黄素-13
c4,
15
n2vb2-13
c4,
14
n2150ng/ml烟酰胺-d4nm-d42,400ng/ml烟酸-d4na-d4100ng/ml泛酸-13
c3,
15n13
c3,
15
n-vb56,000ng/ml磷酸吡哆醛-d3plp-d3600ng/ml吡哆酸-d3pa-d3150ng/ml生物素-d4vb7-d430ng/ml叶酸-d4fa-d4300ng/ml5-甲基四氢叶酸-d35mthf-d31,000ng/ml甲基丙二酸-d3mma-d39,000ng/ml高胱氨酸-d8hcy-d80.5μmol/l
[0102]
样品处理方法
[0103]
样品的处理方法如下:从6个标准品溶液(即,表4中的c1~c)中分别取100μl~200μl的标准曲线样品(或质控品样品),以及100μl~200μl的待检测的血清样品,将其分别置于1.5ml或2ml离心管中,加入20μl表5所示的混合内标溶液,600~1000rpm下混合5-10min后,然后加入50μl~200μl蛋白沉淀剂,混匀后在4000rpm~14000rpm转速下离心2~10min,得到上清液;其中,蛋白沉淀剂为饱和硫酸铵、2%~10%偏磷酸溶液、5%~10%高氯酸溶液、5%~20%三氯乙酸溶液中的至少一种。在优选的实施方式中,蛋白沉淀剂可以是饱和硫酸铵、2%~10%偏磷酸溶液、5%~10%高氯酸溶液、或者5%~20%三氯乙酸溶液,也可以是这四种中的至少两种或三种的组合。在优选的实施方式中,蛋白沉淀剂可以至少包括2%~10%偏磷酸溶液和5%~20%三氯乙酸,并且还可以包括饱和硫酸铵和/或5%~10%高氯酸溶液。
[0104]
在一个优选的实施方案中,分别取200μl的标准曲品样品和血清样品置于1.5ml离心管中,加入20μl的混合内标溶液,600~1000rpm下混合2min后,然后加入100μl的2%~10%偏磷酸溶液或5%~20%三氯乙酸溶液,在14000rpm转速下离心3min,得到上清液。
[0105]
在另一个优选实施方式中,向50μl~200μl上清液加入0~20μl 1mol/l的氢氧化钠溶液,混合3min后,利用本技术记载的各种lc-ms/ms检测方法,将上清液置于液相色谱仪自动进样器中进样分析。进样体积为5μl~20μl。
[0106]
根据各种示例性的实施方式和实施例,本技术的样品处理方法,可以在处理和检测过程中保持样品中各种水溶性维生素的稳定性,从而可以简便、高通量地同时测量12种水溶维生素及代谢物。例如,可以有利地维持还原型的同型半胱氨酸,使得可以准确地检测到同型半胱氨酸;并且可以有利地维持5-甲基四氢叶酸和甲基丙二酸的稳定性。
[0107]
12种水溶维生素及代谢物的lc-ms/ms检测
[0108]
将经过上述样品前处理所得到的上清液,使用液相色谱-串联质谱仪进行分析。
[0109]
在一种可选的实施方式中,色谱柱为acquity uplc hss t3(2.1
×
100mm,1.8μm)或waters xselect hss t3(2.1
×
100mm,2.5μm)或discovery hs c18(2.1
×
75mm,3μm);流动相a为含1mm~10mm乙酸铵和0.1%~0.5%甲酸的水溶液,流动相b为含1mm~10mm乙酸铵和0.1%~0.5%甲酸的甲醇溶液。
[0110]
在一种优选的实施方式中,该检测方法可以检测吡哆醛、甲基丙二酸、5-甲基四氢叶酸、或同型半胱氨酸;可以通过一次实验,检测吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸。在一种优选的实施方式中,该检测方法可以至少检测吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸,还可以进一步检测硫铵素、核黄素、烟酸、烟酰胺、泛酸、吡哆酸、生物素和叶酸。
[0111]
在一个优选的实施方式中,可以采用ab sciex 4500 md质谱仪,质谱条件采用两个时间段进行正负离子切换扫描。时间段1含有两个子方法,子方法1采用正离子模式,用于采集硫胺素、核黄素、烟酸、烟酰胺、5
’‑
磷酸吡哆醛及对应内标的信号,本领域技术人员可以明确获知的是,在子方法1的正离子模式中检测硫胺素、核黄素、烟酸、烟酰胺、5
’‑
磷酸吡哆醛是互不干扰的,检测其中一种或多种物质不会干扰其他物质的检测,子方法1的正离子模式可以检测其中的任何一种或者任何组合;子方法2采用负离子模式,用于采集甲基丙二酸的信号和/或甲基丙二酸-d3的信号;时间段2用于采集泛酸、核黄素、吡哆酸、生物素、叶酸、5-甲基四氢叶酸及其对应内标的信号,本领域技术人员可以明确获知的是,在时段2中检测硫胺素、核黄素、烟酸、烟酰胺、5
’‑
磷酸吡哆醛是互不干扰的,检测其中一种或多种物质不会干扰其他物质的检测,时段2可以检测其中的任何一种或者任何组合。离子源温度为500℃~750℃,正离子的喷雾电压为4500v~5500v,负离子的喷雾电压为-4500v;气帘气为25~40psi,雾化气gas1的压力为30~60psi,辅助加热气压力为30~60psi。lc-ms/ms方法中,质谱方法和液相梯度具体参见表6和表7。
[0112]
其中,本领域技术人员可以理解的是,时间段(period)表示时间段的意思,属于质谱仪的参数(例如,ab sciex厂商的质谱仪),每个时间段可以包括正离子模式和负离子模式。
[0113]
表6. 12种维生素及代谢物的质谱方法(ab sciex 4500md)
[0114]
[0115][0116]
在表6中,q1表示质谱仪第一根四极杆选择的母离子,q3表示质谱仪第三根四极杆选择的碎片离子,dwell表示驻留时间,dp表示去簇电压,ce表示碰撞电压。
[0117]
表7. 12种维生素及代谢物的液相方法
[0118]
[0119][0120]
表7中的流动相a为包含甲酸(0.2%)和乙酸铵(2mm)的水溶液,流动相b为包含甲酸(0.2%)和乙酸铵(2mm)的甲醇溶液。
[0121]
在一种优选的实施方案中,可以采用thermo tsq altis质谱仪,质谱条件采用正负离子切换扫描,离子源温度为350℃,正离子的喷雾电压为4000v,负离子的喷雾电压为-3500v;鞘气流速为10~40arb。lc-ms/ms方法中,质谱方法和液相梯度如表8和表9。
[0122]
表8. 12种维生素及代谢物的质谱方法(thermo tsq altis)
[0123]
[0124][0125]
其中q1是指质谱仪第一根四极杆选择的母离子;q3是指质谱仪第三根四极杆选择的碎片离子;碰撞能(collision energy)是指离子进入四极杆2(q2)时的加速速率,q2通常被外壳覆盖,使其在高真空环境下保持较小的正气压,其中离子与碰撞气体和碎片发生热相互作用。,驻留时间是指质谱仪仪器为特定srm质量转换收集数据的时间量(以毫秒为单位);rf电压是指四极杆内的一对相对杆之间施加射频(rf)电压。
[0126]“m/z”是指通过将离子的质量数除以其电荷数而形成的无量纲量。也称为“质荷比”。
[0127]
表9. 12种维生素及代谢物的液相方法
[0128]
时间(min)流速(ml/min)流动相a的百分比(%)流动相b的百分比(%)0.00.310001.80.310004.00.340555.00.328725.50.310905.70.310007.50.31000
[0129]
表9中的流动相a为包含甲酸(0.2%)和乙酸铵(2mm)的水溶液,流动相b为包含甲酸(0.2%)和乙酸铵(2mm)的甲醇溶液。
[0130]
在以上的样品处理方法和lc-ms/ms检测中,采用考察方法灵敏度、精密度、准确度、线性等来验证水溶维生素lc-ms/ms条件和样品处理方法的可用性。灵敏度的接受标准为在临床参考水平下限处信噪比s/n》10,精密度的接受标准重复测定10份样品的变异系数≤10%,准确度的接受标准为血清样品的加标回收率为85%~115%或检测有证参考物质的偏倚≤
±
15%。线性的接受标准为标准曲线相关系数r2》0.99。
[0131]
本技术可以提供能够在血清中同时检测12种水溶维生素及代谢物的方法和提高检测试剂稳定性的方法。本领域技术人员可以理解的是,虽然本技术的各种示例实施方式示出了加入/检测12种水溶性维生素及代谢物的具体实验和结果,但加入12种水溶性维生
素及代谢物的具体实验和结果也可以单独地应用于其中一种或多种水溶性维生素及代谢物,各种水溶性维生素及代谢物对彼此的检测结果不会相互干扰,12种水溶性维生素及代谢物的具体实验和结果也可以用于针对其中一种或多种水溶性维生素及代谢物进行分析。本领域技术人员可以对以下的示例性实施方式进行各种组合、变形和更改。
附图说明
[0132]
图1为12种水溶维生素在定量下限(样品为标准曲线c1)浓度的色谱图。
[0133]
图2为人血清样品中12种水溶维生素及代谢物和对应的内标化合物色谱图。
[0134]
图3为12种水溶维生素标准曲线图。
具体实施方式
[0135]
为了使本技术领域的人员更好地理解本技术方案,下面将结合本技术的各种示例实施例和比较例、以及附图,对本技术的技术方案进行描述。本领域技术人员可以理解的是,本文中的各种示例实施例和比较例仅仅旨在于描述本技术一部分的实施方式,而不是穷举全部的实施方式。基于本文中的各种示例,本领域普通技术人员可以对实施例和比较例进行组合和各种改变。
[0136]
缩写词意义如下:“h”指小时,“min”指分钟,“s”指秒,“d”指天,“μl”指微升,“ml”指毫升,“l“指升,“mm”指毫摩尔,“μm”指微摩尔。
[0137]
实施例1.前处理
[0138]
1)加样:取出标准品、质控品、待检测样品置于室温解冻(其中,标准品和质控品包含稳定剂,该稳定剂为按照标准品或质控品的1%(w/v)牛血清白蛋白、0.1%(w/v)抗坏血酸、0.1%(w/v)异抗坏血酸、0.0001%(w/v)茶多酚、5%(w/v)蔗糖),涡旋混匀后向96孔板中分别加入200μl上述标准品、质控品或待检测样品,其中,标准品、质控品的种类和含量如表4所示,标准品和质控品的溶液为0.1%bsa的水溶液,每个标准品、质控品和待检测样品分别设置3个平行试验;
[0139]
2)反应:向96孔板的每个孔分别中加入20.0μl混合内标溶液和30.0μl 100mm的tcep(即,三(2-羧乙基)膦(tris(2-carboxyethyl)phosphine)或其盐),1000rpm涡旋震荡10min,其中,混合内标液的种类和浓度如表5所示;
[0140]
3)蛋白沉淀:向上述96孔板中加入100μl 10%三氯乙酸水溶液,1000rpm/min涡旋振荡10min,将96孔板置于离心机中,4000rpm,离心10min;
[0141]
4)稀释:取出96孔板,移取150μl上清液置于新96孔板中,加入5μl 1m(即,1mol/l)的氢氧化钠水溶液,瞬离后震荡混匀(800rpm,5min),取上清液置于液相色谱仪自动进样器中进样分析。
[0142]
实施例2. 12种水溶维生素及代谢物的lc-ms/ms检测
[0143]
色谱条件与质谱参数的设定如下:
[0144]
色谱柱:waters xselect hss t3(2.1
×
100mm,2.5μm);
[0145]
柱温度:50℃;
[0146]
进样量:10μl;
[0147]
流动相a:包含甲酸(0.2%)和乙酸铵(2mm)的水溶液,流动相b:包含甲酸(0.2%)
和乙酸铵(2mm)甲醇溶液;
[0148]
梯度洗脱程序:流动相a+流动相b=100%;0~1.8min,流动相b体积百分比维持在0%;1.8~4.0min,流动相b体积百分比由0%增至55%;4.0~5.0min,流动相b体积百分比由55%增至72%;5.0~5.5min,流动相b体积百分比由72%增至90%;5.5~5.7min,流动相b体积百分比由90%递减至0%;5.7~7.5min,流动相b保持体积百分比为0%;
[0149]
质谱参数设定为:离子源:电喷雾离子源,离子模式:正负离子模式切换,监测模式:多反应监测,离子源温度为550℃,正离子的喷雾电压为5500v,负离子的喷雾电压为-4500v;气帘气为30psi,雾化气gas1的压力为50psi,辅助加热气压力为50psi。
[0150]
按此方法对实施例1的水溶维生素标准品测定,测定结果如图1所示,测定时间为7.5min。图1中的a~l区域分别对应维生素b1、维生素b2、烟酰胺、烟酸、维生素b5、磷酸吡哆醛、吡哆酸、维生素b7、叶酸、5-甲基四氢叶酸、甲基丙二酸、同型半胱氨酸,图中标出了各分析物的保留时间和浓度。本领域技术人员可以理解的是,在该实施例中,对于各种维生素或其代谢物的检测是独立的,即,针对任一种维生素或代谢物的实验并不会影响对其他任一种维生素或代谢物的实验;因此,尽管本实施例示出了同时检测12种维生素或代谢物的结果,但是也可以按照本实施例的方法检测其中任意一种或多种维生素或代谢物,也可以从检测12种维生素或代谢物的结果中选取任一种或多种组合进行独立地分析。
[0151]
按此方法对待检测的血清样品(按照实施例1处理)中水溶维生素和水溶维生素内标进行测定,结果如图2所示。在图2中,图2的a1区域表示维生素b1,图2的b1区域表示维生素b1,图2的c1区域表示烟酰胺,图2的d1区域表示烟酸,图2的e1区域表示维生素b5,图2的f1区域表示磷酸吡哆醛,图2的g1区域表示吡哆酸,图2的h1区域表示维生素b7,图2的i1区域表示叶酸,图2的j1区域表示5-甲基四氢叶酸,图2的k1区域表示甲基丙二酸,图2的l1区域表示同型半胱氨酸;图2的a2区域表示硫胺素-13
c4,图2的b2区域表示核黄素-13
c4,
15
n2,图2的c2区域表示烟酰胺-d4,图2的d2区域表示烟酸-d4,图2的e2区域表示泛酸-13
c3,
15
n,图2的f2区域表示磷酸吡哆醛-d3,图2的g2区域表示吡哆酸-d3,图2的h2区域表示生物素-d4,图2的i2区域表示叶酸,图2的j2区域表示5-甲基四氢叶酸-d3,图2的k2区域表示甲基丙二酸-d3,图l2表示高胱氨酸-d8(对应于同型半胱氨酸-d4)。
[0152]
从图1和图2的结果可以看出,特别是图2的结果,各种维生素或代谢物的检测基线平稳,无基质干扰。
[0153]
实施例3.标准品的线性测定
[0154]
用含0.1%bsa、1%pbs(磷酸盐缓冲液)的水溶液配制12种水溶性维生素及代谢物的线性范围6个浓度水平的标准品(样品浓度见表4的c1~c6),并在同一个分析批内测定,重复测定3批,标准品拟合标准曲线。按实施例2的方法进行定量检测,以理论浓度为横坐标,以测定浓度为纵坐标进行线性回归,结果如图3所示。
[0155]
在图3中,a~l分别对应维生素b1、维生素b2、维生素b3-烟酰胺、维生素b3-烟酸、维生素b5、维生素b6-磷酸吡哆醛、维生素b6-吡哆酸、维生素b7、叶酸-d4、5-甲基四氢叶酸-d3、甲基丙二酸、同型半胱氨酸。从图3中可以看出,12种水溶性维生素及代谢物中的每一种的线性相关系数r>0.99。
[0156]
本领域技术人员可以理解的是,在该实施例中,对于各种维生素或其代谢物的检测是独立的,即,针对任一种维生素或代谢物的实验并不会影响对其他任一种维生素或代
谢物的实验;因此,尽管本实施例示出了同时检测12种维生素或代谢物的结果,但是也可以按照本实施例的方法检测其中任意一种或多种维生素或代谢物,也可以从检测12种维生素或代谢物的结果中选取任一种或多种组合进行独立地分析
[0157]
实施例4.标准曲线的准确度测定
[0158]
用混合人血清(以一定数量的人血清样品混合获得,用于提现人血清的共有生化性质并排除个体差异的影响,具体数量可以根据实验需求确定,例如50个来源的人血清样品)作为基础样品,然后加入含12种水溶维生素及代谢物的稀释液(加入稀释液体积不超过样品总体积的5%,稀释液用水配制)配制低、高浓度回收样品。基础样品就是未添加标准品溶液前的血清样品,回收样品指的是把标准品溶液加入基础样品后的血清样品。样品处理方法同实施例1,色谱条件和质谱参数同实施例2,每个浓度水平3个样品平行,在同一个分析批中完成,取其均值进行。
[0159]
计算回收率:
[0160][0161]
结果如表10所示,同型半胱氨酸浓度单位为μmol/l,其余物质的浓度单位均为ng/ml。从表10中可以看出,12种水溶性维生素及代谢物的每个浓度水平回收率在85%-115%之间。在表10中,稀释溶液是指在做加标回收实验时,配制的含有已知浓度维生素或其代谢物(例如,硫胺素)的溶液,该溶液会被以特定的比例加入到基础样品中。
[0162]
本领域技术人员可以理解的是,在该实施例中,对于各种维生素或其代谢物的检测是独立的,即,针对任一种维生素或代谢物的实验并不会影响对其他任一种维生素或代谢物的实验;因此,尽管本实施例示出了同时检测12种维生素或代谢物的结果,但是也可以按照本实施例的方法检测其中任意一种或多种维生素或代谢物,也可以从检测12种维生素或代谢物的结果中选取任一种或多种组合进行独立地分析。
[0163]
表10. 12种水溶性维生素及代谢物的加标回收率
[0164]
[0165][0166][0167][0168]
[0169][0170][0171][0172]
[0173][0174][0175][0176]
实施例5.质控品的批内和批间精密度检验
[0177]
在混合人血清样品(与实施例4的混合人血清样品相同)中加入相应量的标准品配制一定浓度的质控样品:lqc、mqc、hqc,每个浓度水平测定10个重复,每天3个浓度,连续测定3天(即,重复测定三个批次(批次1,批次2,批次3),即就是实验重复三次)。其中,lqc、mqc、hqc的配制方法和浓度与表4所示lqc、mqc、hqc的相一致,根据实施例1和实施例2的方法进行样品处理和检测,计算每个浓度水平变异系数(cv%),以该cv%表示相应的批内和批间精密度(批内精密度公式:cv%=(批内标准差/批内均值)
×
100%。批间精密cv%=3批数据标准差/3批数据均值)
×
100%)。根据下表11的计算结果,12种水溶维生素及代谢物批内和批间精密度均在15.0%以内,表明本实施例的质控品具有良好的精密度,也相应地说明与本实施例相同条件的标准品也应当具有良好的精密度。
[0178]
本领域技术人员可以理解的是,在该实施例中,对于各种维生素或其代谢物的检测是独立的,即,针对任一种维生素或代谢物的实验并不会影响对其他任一种维生素或代谢物的实验;因此,尽管本实施例示出了同时检测12种维生素或代谢物的结果,但是也可以按照本实施例的方法检测其中任意一种或多种维生素或代谢物,也可以从检测12种维生素或代谢物的结果中选取任一种或多种组合进行独立地分析。
[0179]
表11. 12种水溶维生素及代谢物批内和批间精密度
[0180][0181][0182]
[0183][0184]
[0185][0186][0187]
[0188][0189][0190]
[0191][0192][0193]
[0194][0195]
实施例6.标准品的热稳定性分析
[0196]
采用由1%的牛血清白蛋白、0.1%的抗坏血酸、0.1%的异抗坏血酸、0.0001%的茶多酚,5%的蔗糖组成的溶剂配制标准品和质控样品(lqc、hqc)的含12种水溶维生素样品(lqc、hqc的浓度与表4所示lqc、hqc的相一致),然后调用表3冻干程序3冻干,冻干后的标准品保存在-70℃冰箱中,质控品(冻干粉)置于温度为37℃;湿度为75%的恒温恒湿箱中,分别于第7天和第9天取出恒温恒湿箱的样品,取出标准品测定质控品,加入1.5ml水溶解后,采用实例1和实例2的方法处理和检测样品,检测结果如表12(其中,偏倚%=(测定值-理论值)/理论值
×
100%)。
[0197]
本领域技术人员可以理解的是,在该实施例中,对于各种维生素或其代谢物的检测是独立的,即,针对任一种维生素或代谢物的实验并不会影响对其他任一种维生素或代谢物的实验;因此,尽管本实施例示出了同时检测12种维生素或代谢物的结果,但是也可以按照本实施例的方法检测其中任意一种或多种维生素或代谢物,也可以从检测12种维生素或代谢物的结果中选取任一种或多种组合进行独立地分析。
[0198]
表12. 12种水溶维生素及代谢物热稳定性结果vb1
[0199][0200][0201]
vb2
[0202][0203]
vb3-na
[0204][0205]
vb3-nm
[0206][0207]
vb5
[0208][0209]
vb6-pa
[0210][0211]
vb6-plp
[0212][0213]
[0214]
vb7
[0215][0216]
vb9-fa
[0217][0218]
vb9-5-mthf
[0219][0220]
hcy
[0221][0222]
mma
[0223][0224]
从表12的检测结果显示,各种维生素及代谢产物的偏倚临界值均在
±
15%内(或者邻近于
±
15%),数据表明该试剂配方和冻干工艺下生产的12种维生素及代谢物检测试剂可长期使用。
[0225]
实施例7.内标的热稳定性分析
[0226]
采用超纯水、0.1%的抗坏血酸、0.1%的异抗坏血酸、0.0001%的茶多酚、5%的蔗糖组成的溶剂配制含12种水溶维生素混合内标溶液(浓度见表5),然后采用表3的冻干程序进行冻干,冻干后的内标分为两份,一份置于-70℃冰箱中,另一份置于温度为37℃、湿度为75%的恒温恒湿箱中。于第7天取出恒温恒湿箱和-70℃冰箱中的内标,加入2ml水溶解后,采用实例1和实例2的方法处理和检测内标,检测结果如表13(其中,cv%的计算方法同实施例5,偏倚值(bias%)的计算方法同实施例6)。下表中,e表示科学计数法,例如,2.84e+05意思为2.84*105。
[0227]
本领域技术人员可以理解的是,在该实施例中,对于各种维生素或其代谢物的检测是独立的,即,针对任一种维生素或代谢物的实验并不会影响对其他任一种维生素或代谢物的实验;因此,尽管本实施例示出了同时检测12种维生素或代谢物的结果,但是也可以按照本实施例的方法检测其中任意一种或多种维生素或代谢物,也可以从检测12种维生素
或代谢物的结果中选取任一种或多种组合进行独立地分析。
[0228]
表13. 12种水溶维生素及代谢物的内标热稳定性结果
[0229][0230][0231][0232][0233][0234][0235]
[0236][0237][0238][0239][0240][0241]
由于内标作用为校正不同样品中基质差异或样品处理过程中操作平行性差导致的检测结果的偏倚,故内标在使用时并不要求浓度上较高准确性高;所以,内标的偏倚均<
±
30%即可以表明内标物是可以使用的。根据表12中的结果,本实施例的内标浓度偏倚均在
±
30%作为可接受标准,并以内标的峰面积作为浓度变化的衡量指标。检测结果显示,各内标热稳定性偏倚均<
±
30%或接近
±
30%,数据表明,在该试剂配方和冻干工艺下生产的内标可长期使用。
[0242]
本发明提供了如下技术方案:
[0243]
1.一种用于检测维生素及代谢物的标准品,所述标准品包括:
[0244]
组分1:人或动物的血浆蛋白;
[0245]
组分2:异抗坏血酸和甘露醇中的至少一种;
[0246]
组分3:吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸中的至少一种或全部。
[0247]
2.技术方案1所述的的标准品,其中,所述组分3包括吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸。
[0248]
3.技术方案1或2所述的所述的标准品,其中,所述组分2还进一步包括抗坏血酸、茶多酚、蔗糖和可溶性淀粉中的至少一种。
[0249]
4.前述任一项技术方案所述的标准品,
[0250]
其中,组分1与异抗坏血酸的质量比为(0.1~5):(0.05~0.5),和/或组分1与甘露醇的质量比为(0.1~5):(1~5);优选地,组分1:抗坏血酸:茶多酚:蔗糖:可溶性淀粉的质量比为(0.1~5):(0.05~0.5):(0.0001~0.01):(1~5):(1~5)。
[0251]
5.前述任一项技术方案所述的标准品,所述组分3还包括硫铵素、核黄素、烟酸、烟酰胺、泛酸、吡哆酸、生物素和叶酸中的至少一种或全部。
[0252]
6.前述任一项技术方案所述的标准器,其中,所述组分3还包括硫铵素、核黄素、烟酸、烟酰胺、泛酸、吡哆酸、生物素和叶酸。
[0253]
7.前述任一项技术方案所述的标准品,还包括:tcep。
[0254]
8.前述任一项技术方案所述的标准品,还包括:偏磷酸和三氯乙酸中的至少一种;优选地,还包括硫酸铵和高氯酸中的至少一种。
[0255]
9.一种检测血清中至少一种维生素及代谢物的试剂盒,包括:
[0256]
组分a:饱和硫酸铵、2%~10%偏磷酸溶液、5%~10%高氯酸溶液、5%~20%三氯乙酸溶中的至少一种;
[0257]
组分b:根据前述任一项所述的标准品;
[0258]
组分c:tcep。
[0259]
10.根据前述任一项所述的试剂盒,还包括:
[0260]
组分d:氢氧化钠溶液。
[0261]
11.前述技术方案10所述的试剂盒,还包括:
[0262]
组分e:流动相添加剂,优选地为甲酸和乙酸铵。
[0263]
12.一种检测溶液中吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸中的至少一种维生素及代谢物的液相色谱-质谱检测方法,包括:
[0264]
采用两个时间段进行正负离子切换扫描,其中,每个时间段包括正离子模式和负离子模式,所述正离子模式用于检测吡哆醛和/或同型半胱氨酸,所述负离子模式用于检测甲基丙二酸。
[0265]
13.前述技术方案12所述的方法,所述方法进一步用于同时检测吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸。
[0266]
14.前述技术方案12或13所述的方法,所述方法进一步用于同时检测硫铵素、核黄素、烟酸、烟酰胺、泛酸、吡哆酸、生物素和叶酸中的至少一种或全部。
[0267]
15.前述技术方案12-14中的任一项所述的方法,其中,第一时间段的正离子模式用于检测核黄素、硫胺素、烟酸、烟酰胺、磷酸吡哆醛和同型半胱氨酸中的至少一种;
[0268]
第一时间段的负离子模式用于检测甲基丙二酸;
[0269]
第二时间段用于检测泛酸、核黄素、吡哆酸、生物素、叶酸和5-甲基四氢叶酸中的至少一种或全部。
[0270]
16.前述技术方案12-15中的任一项所述的方法,其中,质谱参数设定为:
[0271]
离子源:电喷雾离子源;
[0272]
离子模式:正负离子模式切换;
[0273]
监测模式:多反应监测;
[0274]
离子源温度为500℃~750℃,优选地,离子源温度为550℃;
[0275]
正离子的喷雾电压为4500v~5500v,优选地,正离子的喷雾电压为5500v;
[0276]
负离子的喷雾电压为-3500v~-4500v;
[0277]
气帘气为25~40psi,优选地,气帘气为30psi;
[0278]
雾化气gas1和辅助加热气压力gas2的压力为30~60psi,优选地为50psi。
[0279]
17.前述技术方案12-16中的任一项所述的方法,其中,质谱参数设定为:离子源温度为200℃~350℃,优选地为350摄氏度;正离子喷雾电压为2000v~4000v,优选地为4000v;负离子喷雾电压为-2000v~-4000v,优选地为-3500v;鞘气流速为10~40arb。
[0280]
18.前述技术方案12-17中的任一项所述的方法,其中,色谱条件为:
[0281]
流动相a:含有甲酸(0.05%~0.2%)和乙酸铵(1mm~10mm)的水溶液,流动相b:含有甲酸(0.2%)和乙酸铵(2mm)的甲醇溶液;优选地,流动相a为含有甲酸(0.05%~0.2%)和乙酸铵(1mm~10mm)的水溶液;优选地,流动相b为含有甲酸(0.2%)和乙酸铵(2mm)的甲醇溶液;
[0282]
梯度洗脱程序:流动相a+流动相b=100%;0~1.8min,流动相b体积百分比维持在0%;1.8~4.0min,流动相b体积百分比由0%增至55%;4.0~5.0min,流动相b体积百分比由55%增至72%;5.0~5.5min,流动相b体积百分比由72%增至90%;5.5~5.7min,流动相b体积百分比由90%递减至0%;5.7~7.5min,流动相b保持体积百分比为0%;
[0283]
优选地,柱温度为30~60℃,优选为50℃。
[0284]
19.一种检测溶液中吡哆醛、甲基丙二酸、5-甲基四氢叶酸和同型半胱氨酸中的至少一种维生素及代谢物的方法,包括:
[0285]
向标准品、质控品、以及待测样品中加入与待测种类维生素或维生素的代谢物相对应的内标物质,混匀;优选地,再加入tcep;
[0286]
向上述溶液中分别加入2%~10%偏磷酸溶液、5%~20%三氯乙酸溶液中的至少一种,混匀后离心;优选地,加入标准品、质控品或待测样品的1/2~2倍体积的2%~10%偏磷酸溶液或5%~20%三氯乙酸溶液;优选地,加入上述溶液1/2体积的10%三氯乙酸水溶液;
[0287]
取上清液,加入氢氧化钠溶液,优选地,加入标准品、质控品或待测样品的1/50~1/20体积的1m的氢氧化钠溶液;瞬离后震荡混匀,按照根据权利要求10至16中任一项所述的液相色谱-质谱检测方法进行检测。
[0288]
20.技术方案19所述的方法,其中,所述内标物质中包括以下中的至少一种或全部:硫胺素-13
c4;核黄素-13
c4,
15
n2;烟酰胺-d4;烟酸-d4;泛酸-13
c3,
15
n;5
’‑
磷酸吡哆醛-d3;吡哆酸-d3;生物素-d4;叶酸-d4;5-甲基四氢叶酸-d3;甲基丙二酸-d3;高胱氨酸-d8。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1