多传感集成MIGFET生物传感器的制备方法及检测装置
多传感集成migfet生物传感器的制备方法及检测装置
技术领域
1.本发明属于生物传感器领域技术领域,尤其涉及一种多传感集成migfet生物传感器的制备方法及检测装置。
背景技术:
2.为了检测生物学或仿生学信号,生物传感器应运而生。生物传感器旨在定性或定量的分析待测目标物(包括核酸、蛋白质、细胞等),其检测原理是待测目标物与生物敏感材料结合后,当通过特定的理化换能器时,能够改变一种乃至多种物理化学性质,这种性质的改变可以作为可测信号检测。生物传感器相较于传统检测手段在灵敏性、经济性、特异性、响应时间等方面有较大提升,已成为当今世界炙手可热的科技发展方向。而对dna的定量检测及其结合动力学的研究,在临床诊断、微量分析、药物研发、食品筛选、工业生产以及环境检测等方面都有重要的应用价值。因此,对dna生物传感器的研究吸引了越来越多的专家学者。
3.近年来,研究开发出基于不同工作特性的dna生物传感器已成为国内外学者拓宽科学边界的重要课题,并且经过不懈努力取得了丰硕的成果,尤其是灵敏度高、检测范围广、选择性好、反应速度快的生物传感器更加受到研究学者们的青睐。在众多生物传感器中,光学型和电子型生物传感器表现尤为突出。
4.光学型生物传感器的工作原理是通过检测光学信号的变化量实现对待测生物分子的定量分析,其广泛应用在疾病诊断、法医鉴定、污染环境监测、生命科学研究等领域。在光学方法中,无标记表面等离子体共振(surface plasmon resonance,spr)是一种常用于dna杂交动力学过程检测的标准工具。但spr传感器的光响应与待测物分子量有关,难以探测到小分子之间结合产生的微弱信号变化,如寡肽、寡核苷酸结合。因此,spr检测方式在定量分析dna杂交动力学的灵敏度方面具有局限性。除spr外,基于荧光共振能量转移(fluorescence resonance energy transfer,fret)的荧光生物传感器是另一种常用的用于监测dna杂交动力学过程的光学技术。由于基于fret的荧光生物传感器具有分析灵敏度高、选择性强以及使用简便等优点,已经成为当前应用最为普遍的一种光学传感技术。fret是一种非辐射的跃迁过程,它利用远距离偶极子之间的相互作用,把一个激发态的供体能量转移到近侧的基态受体。通常,供体分子与受体分子的间距的变化为纳米级(与r6成正比),而fret对这一过程有着内在的敏感性。因此,fret对生物分析非常具有吸引力,它有潜力实现对dna的高灵敏检测。基于此原理,已报道一种基于碳点和aunps之间的fret,可用于检测与hiv相关的dna序列的超灵敏的生物传感器。
5.电子型生物传感器一般是检测生化反应过程中伴随的电学信号,实现对目标物的定量分析。在电学方法中,一维纳米材料(碳纳米管和纳米线等)已被证明可用于实时检测多种生物活性分子。基于此原理,已报道一个自上而下的硅纳米线场效应晶体管(field-effect transistor,fet)生物传感器,可以实现对目标dna高灵敏、无标记检测。
6.然而,由于基于硅纳米线fet生物传感器的器件制作工艺成本比较高,无法普适于
各种应用场景中,并且硅纳米线fet生物传感器中的高探针密度能够降低dna杂交和动力学的效率。因此,制造一个可靠和经济有效的硅纳米线fet生物传感器仍然面临困难。
7.石墨烯是近几十年得到大规模应用的一种单层二维碳材料。由于其具有零带隙结构,极高的载流子迁移率,高比表面积,对分析物表面的反应或吸附引起的电荷变化相当敏感等优良特性,使得二维石墨烯场效应晶体管(graphene field-effect transistor,gfet)生物传感器比一维纳米材料fet生物传感器在探测dna杂交动力学方面更具优势。在常规gfet生物传感器中,主要基于gfet生物传感器的双导电层电容模型理论对dna杂交动力学检测进行分析。当栅极电压通过电介质被外加在石墨烯薄膜上时,在石墨烯和电解质的交界处会产生具有双导电层的结构,其电阻率也会发生相应的改变,并且可以被gfet生物传感器定量检测。因此,通过向栅极提供一定栅极电压,分析gfet生物传感器获取的电信号变化,能够实现对待测目标dna(target dna,tdna)的检测。基于此原理,已报道一种褶皱的gfet生物传感器,用于检测患者病毒转运介质样本中sars-cov-2病毒的存在。
8.磁镊技术是一种单分子力谱法,在tdna末端耦合磁性纳米颗粒(magnetic nanoparticles,mps),在外加磁场的作用下,利用mps与磁场之间的磁力,可以对石墨烯和耦合了mps的tdna之间的距离进行机械控制,从而调制磁控的石墨烯场效应晶体管(magnetic graphene field-effect transistor,mgfet)生物传感器的双导电层结构。因此,mgfet生物传感器因其具有高信噪比、物理和化学性质稳定、有生物相容性,环保等独特的优势引起了广泛关注。基于此原理,已报道一个mgfet生物传感器用于dna的高灵敏度检测。
9.然而,尽管上述基于fret的荧光生物传感器和gfet生物传感器已经被广泛研究,但它们通常在一个生物传感器中仅采用一种传感方法,传感方法比较单一导致准确度难以保障;同时,生物传感器依赖现有大型仪器分析,集成化检测装置不足。而微流控芯片分析系统是一种采用微纳加工技术,实现集样品进样、检测等于一体的快速、低耗的微型分析实验装置。微流控芯片成本低、污染少、方便携带、自动化、易集成,能够实现高通量、高灵敏分析。因此,在微流控芯片分析系统集成多种传感技术实现对目标物检测的方式得到了大家广泛关注。
技术实现要素:
10.针对现有技术中的上述不足,本发明提供的一种多传感集成migfet生物传感器的制备方法及检测装置,以提高传统单一传感器的检测灵敏度和可靠性。
11.为了达到上述发明目的,本发明采用的技术方案为:一种多传感集成migfet生物传感器的制备方法,包括以下步骤:
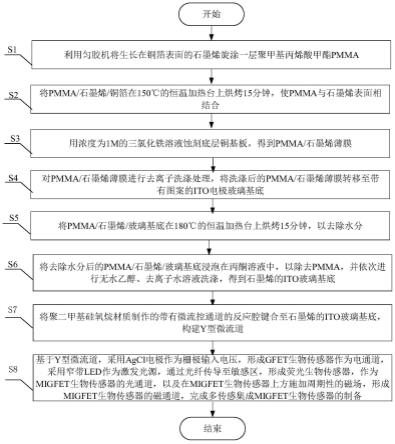
12.s1、利用匀胶机将生长在铜箔表面的石墨烯旋涂一层聚甲基丙烯酸甲酯pmma;
13.s2、将pmma/石墨烯/铜箔在150℃的恒温加热台上烘烤15分钟,使pmma与石墨烯表面相结合;
14.s3、用浓度为1m的三氯化铁溶液蚀刻底层铜基板,得到pmma/石墨烯薄膜;
15.s4、对pmma/石墨烯薄膜进行去离子洗涤处理,将洗涤后的pmma/石墨烯薄膜转移至带有图案的ito电极玻璃基底上;
16.s5、将pmma/石墨烯/玻璃基底在180℃的恒温加热台上烘烤15分钟,以去除水分;
17.s6、将去除水分后的pmma/石墨烯/玻璃基底浸泡在丙酮溶液中,以除去pmma,并依次进行无水乙醇、去离子水溶液洗涤,得到石墨烯的ito玻璃基底;
18.s7、将聚二甲基硅氧烷材质制作的带有微流控通道的反应腔键合至石墨烯的ito玻璃基底,构建y型微流道;
19.s8、基于y型微流道,采用agcl电极作为栅极输入电压,形成gfet生物传感器作为电通道,采用窄带led作为激发光源,通过光纤传导至敏感区,形成荧光生物传感器,作为migfet生物传感器的光通道,以及在migfet生物传感器上方施加周期性的磁场,形成migfet生物传感器的磁通道,完成多传感集成migfet生物传感器的制备。
20.本发明的有益效果是:本发明的目的是提供一种基于微流控的多传感集成的石墨烯场效应晶体管(multi-sensing integrated graphene field-effect transistor,migfet)生物传感器,将石墨烯场效应管生物传感、荧光生物传感集成并结合mps构建了一种基于微流控的多传感集成的生物芯片实现对相同目标分子的光电磁多检传感器检测,从而提高生物传感器检测准确性和可靠性。本发明将场效应管与微流控结合,生物传感器不需要依赖大型仪器分析,易于集成化、自动化,同时本发明采用光电磁多检测模式对同一目标物进行检测,提高检测的准确性和可靠性。
21.进一步地,所述多传感集成migfet生物传感器包括以下功能化过程:
22.a1、向制备好的微流控反应腔注入10mm溶于二甲基亚砜dmso的1-芘丁酸n-羟基琥珀酰亚胺酯pbase溶液,并在室温下将其孵育2小时;
23.a2、依次分别用dmso、去离子水溶液冲洗migfet生物传感器,除去多余的未结合的pbase分子,并将2um的探针适配体溶液注入微流控反应腔,在室温下孵育4小时;
24.a3、依次选用包含0.2%二烷基硫酸钠sds的pbs、pbs溶液对migfet生物传感器进行洗涤,除去多余的探针适配体,完成对migfet生物传感器的功能化处理。
25.上述进一步方案的有益效果是:本发明借助适配体的特异性识别,使生物传感器对待测物具有特异性。
26.本发明提供了一种多传感集成migfet生物传感器的检测装置,所述检测装置包括光路模块、与所述光路模块连接的电路模块以及与所述电路模块连接的上位机。
27.进一步地,所述光路模块包括光纤准直器以及光电倍增管;
28.利用光纤准直器将led灯发出的光进行聚焦和耦合,形成第一准直光束;将第一准直光束经光纤传输至migfet生物传感器,以提供激发光源,激发标记在目标dna上的荧光基团6'-羧基荧光素;当荧光基团6'-羧基荧光素激发后,经光纤准直器转变成第二准直光束,通过光纤准直器将第二准直光束传输至高通滤光片进行过滤;将过滤后的准直光束汇聚至光电倍增管的有效敏感区域,并经光电转换后利用上位机对获取的光信号进行显示与保存,并反映荧光强度。
29.上述进一步方案的有益效果是:请本发明利用光路模块能有效去除杂散光。
30.再进一步地,所述电路模块包括:
31.电源子模块,用于为检测装置供电;
32.led灯驱动子模块,用于提供激发光源;
33.pmt增益控制子模块,用于为光电倍增管提供增益电压;
34.信号调理子模块,用于放大经光电倍增管光电转后化输出的电信号,并结合双运
算放大器设置一四阶低通滤波器作为滤波电路,利用滤波电路对电信号进行调理,并传输至ad信号采集子模块;
35.栅压输出子模块,用于通过spi的通信方式实现正负电压范围的栅压输出;
36.场效应管等效电阻测量子模块,用于采集migfet生物传感器源极和漏极之间的电压;
37.步进电机驱动子模块,用于采用脉宽调制的方式驱动步进电机向migfet生物传感器施加周期性的磁场时,通过mps/tdna的机械运动引起migfet生物传感器的电阻强度波动,以改变石墨烯的导电性;
38.ad信号采集子模块,用于将电信号转换为数字信号,并与上位机进行通信。
39.上述进一步方案的有益效果是:本发明通过设置多传感集成migfet生物传感器的检测装置,能同步采集三种检测信号。
附图说明
40.图1为本发明的制备方法流程图。
41.图2为本实施例中migfet生物传感器制备过程的示意图。
42.图3为本发明的检测装置示意图。
43.图4为本实施例中migfet生物传感器功能化过程示意图。
44.图5为本实施例中migfet生物传感器修饰过程示意图。
45.图6为本实施例中migfet生物传感器对dna灵敏度检测结果比较示意图。
46.图7为本实施例中migfet生物传感器对dna特异性检测结果比较示意图。
47.图8为本实施例中migfet生物传感器检测结果对比图。
具体实施方式
48.下面对本发明的具体实施方式进行描述,以便于本技术领域的技术人员理解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保护之列。
49.实施例
50.如图1所示,本发明提供了一种多传感集成migfet生物传感器的制备方法,包括以下步骤:
51.s1、利用匀胶机将生长在铜箔表面的石墨烯旋涂一层聚甲基丙烯酸甲酯pmma;
52.s2、将pmma/石墨烯/铜箔在150℃的恒温加热台上烘烤15分钟,使pmma与石墨烯表面相结合;
53.s3、用浓度为1m的三氯化铁溶液蚀刻底层铜基板,得到pmma/石墨烯薄膜;
54.s4、对pmma/石墨烯薄膜进行去离子洗涤处理,将洗涤后的pmma/石墨烯薄膜转移至带有图案的ito电极玻璃基底上;
55.s5、将pmma/石墨烯/玻璃基底在180℃的恒温加热台上烘烤15分钟,以去除水分;
56.s6、将去除水分后的pmma/石墨烯/玻璃基底浸泡在丙酮溶液中,以除去pmma,并依次进行无水乙醇、去离子水溶液洗涤,得到石墨烯的ito玻璃基底;
57.s7、将聚二甲基硅氧烷材质制作的带有微流控通道的反应腔键合至石墨烯的ito玻璃基底,构建y型微流道;
58.s8、基于y型微流道,采用agcl电极作为栅极输入电压,形成gfet生物传感器作为电通道,采用窄带led作为激发光源,通过光纤传导至敏感区,形成荧光生物传感器,作为migfet生物传感器的光通道,以及在migfet生物传感器上方施加周期性的磁场,形成migfet生物传感器的磁通道,完成多传感集成migfet生物传感器的制备。
59.本实施例中,所述多传感集成migfet生物传感器包括以下功能化过程:
60.a1、向制备好的微流控反应腔注入10mm溶于二甲基亚砜dmso的1-芘丁酸n-羟基琥珀酰亚胺酯pbase溶液,并在室温下将其孵育2小时;
61.a2、依次分别用dmso、去离子水溶液冲洗migfet生物传感器,除去多余的未结合的pbase分子,并将2um的探针适配体溶液注入微流控反应腔,在室温下孵育4小时;
62.a3、依次选用包含0.2%二烷基硫酸钠sds的pbs、pbs溶液对migfet生物传感器进行洗涤,除去多余的探针适配体,完成对migfet生物传感器的功能化处理。
63.如图3所示,本发明提供了一种多传感集成migfet生物传感器的检测装置,所述检测装置包括光路模块、与所述光路模块连接的电路模块以及与所述电路模块连接的上位机;
64.所述光路模块包括光纤准直器以及光电倍增管;
65.利用光纤准直器将led灯发出的光进行聚焦和耦合,形成第一准直光束;将第一准直光束经光纤传输至migfet生物传感器,以提供激发光源,激发标记在目标dna上的荧光基团6'-羧基荧光素;当荧光基团6'-羧基荧光素激发后,经光纤准直器转变成第二准直光束,通过光纤准直器将第二准直光束传输至高通滤光片进行过滤;将过滤后的准直光束汇聚至光电倍增管的有效敏感区域,并经光电转换后利用上位机对获取的光信号进行显示与保存,并反映荧光强度。
66.所述电路模块包括:
67.电源子模块,用于为检测装置供电;
68.led灯驱动子模块,用于提供激发光源;
69.pmt增益控制子模块,用于为光电倍增管提供增益电压;
70.信号调理子模块,用于放大经光电倍增管光电转后化输出的电信号,并结合双运算放大器设置一四阶低通滤波器作为滤波电路,利用滤波电路对电信号进行调理,并传输至ad信号采集子模块;
71.栅压输出子模块,用于通过spi的通信方式实现正负电压范围的栅压输出;
72.场效应管等效电阻测量子模块,用于采集migfet生物传感器源极和漏极之间的电压;
73.步进电机驱动子模块,用于采用脉宽调制的方式驱动步进电机向migfet生物传感器施加周期性的磁场时,通过mps/tdna的机械运动引起migfet生物传感器的电阻强度波动,以改变石墨烯的导电性;
74.ad信号采集子模块,用于将电信号转换为数字信号,并与上位机进行通信。
75.下面结合附图对本发明进行详细说明:
76.(1)耦合待测tdna与mps的过程
77.mps与待测tdna能够实现耦合的原理是由于tdna的一端修饰了氨基,可以与羧基化的mps(4mg.ml-1)发生脱水缩合反应,进而将mps修饰在待测tdna末端。在强磁场的富集下,洗涤未结合的tdna,随后将其分散于磷酸缓冲盐(phosphate-buffered saline,pbs)液备用。
78.首先,将mps(4mg.ml-1)用羧基进行修饰,取20μl使用超声仪对其进行超声,20分钟后即可获得均匀分散的mps溶液。其次,取200μl n-羟基丁二酰亚胺(2mg.ml-1)溶液与200μl 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(2mg.ml-1)溶液进行混合并将均匀分散的mps溶液加入持续混合15分钟,获得活化的mps。然后,在上述混合溶液中加入20μl待测tdna,对其进行轻微晃动并在室温下孵育2小时。接下来,采用强磁场来富集耦合了mps的待测tdna(magnetic nanoparticles/tdna,mps/tdna)。最后,用pbs溶液洗涤多余的未结合的tdna并分散在pbs溶液,在4℃的环境下存储备用。
79.(2)migfet生物传感器的制备
80.由于制备的migfet生物传感器需要转移出高品质的石墨烯,因此本发明使用典型化学气相沉积方法制作的石墨烯薄膜,采取湿法转移的方式将生长在铜箔上的石墨烯薄膜转移到带有氧化铟锡(indium tin oxide,ito)电极的玻璃基底作为migfet生物传感器的源极和漏极。migfet生物传感器的制作过程如图2所示。
81.首先,使用匀胶机将生长在铜箔表面的石墨烯旋涂一层薄薄的聚甲基丙烯酸甲酯(polymethylmethacrylate,pmma)(图2a)。pmma旋涂完成后,将pmma/石墨烯/铜箔在150℃的恒温加热台上烘烤15分钟,使pmma与石墨烯表面紧密结合。然后,用浓度为1m三氯化铁溶液蚀刻底层铜基板,得到pmma/石墨烯薄膜(图2b)。经过去离子水洗涤后,将洁净的pmma/石墨烯转移到带有图案的ito电极玻璃基底上(图2c)。接着,将干净的pmma/石墨烯/玻璃基底在180℃的恒温加热台上烘烤15分钟以去除水分。最后,将pmma/石墨烯/玻璃基底浸泡在丙酮溶液中用来除去pmma。经过无水乙醇、去离子水溶液依次洗涤后,即可得到干净的、转移有石墨烯的ito玻璃基底。为了制备gfet生物传感器器件,将聚二甲基硅氧烷材质制作的带有微流控通道的反应腔键合到ito玻璃基底,构建y型微流道(图2d)。采用agcl电极作为栅极输入电压,形成gfet生物传感器作为电通道;窄带led作为激发光源,通过光纤传导至敏感区,形成荧光生物传感器,作为migfet生物传感器的光通道;在传感器上方施加周期性的磁场,形成migfet生物传感器的磁通道。由此,得到migfet生物传感器结构实物构造图(如图2e)。
82.(3)光电磁多传感集成生物传感检测系统
83.基于微流控的光电磁多传感方式集成的生物传感检测系统(multi-sensing integrated biosensing detection system,mibds)如图3所示,实验室自制的mibds主要包括光路部分、电路部分以及labview编写的上位机部分。
84.光路部分利用光纤准直器把led灯发出的光聚焦、耦合并形成第一准直光束,该第一准直光束经过光纤传输到migfet生物传感器,提供激发光源激发标记在目标dna的荧光基团6'-羧基荧光素(fluorophore 6'-carboxy-fluorescein,6'-fam)。荧光基团6'-fam受到激发后,首先经过光纤准直器转变成第二准直光束,然后通过光纤把该第二准直光束传输至520nm的高通滤光片过滤,光被过滤后,汇聚到光电倍增管(photoelectric multiplier tube,pmt)的有效敏感区域,最后经过pmt的光电转换后,利用labview编写的
上位机对所获取的电信号实时显示、保存并以此来反映当前的荧光强度(the fluorescence intensity,if)。
85.电路系统设计部分主要包括电源模块、led灯驱动模块、pmt增益控制模块、信号调理模块、栅压输出模块、场效应管等效电阻测量模块、步进电机驱动模块、ad信号采集模块。电源模块接220v交流电输入,经整流、降压为
±
12v、
±
5v直流电,稳压后为整个系统分模块供电。led灯驱动模块利用恒流芯片max1916为系统提供亮度可调且发光强度稳定的激发光源。pmt增益控制模块为pmt提供增益控制电压,从而实现pmt增益的控制。信号调理模块将经过pmt光电转化后输出的电信号采用ad623仪表放大器放大,并结合双运算放大器lm358设计一个四阶“巴特沃斯响应”低通滤波器作为滤波电路对其进行调理后传输至ad数据采集模块。栅压输出模块采用stm32f103微控制器并结合dac8501模块通过spi的通信方式实现正负电压范围可调的栅压输出。场效应管等效电阻测量模块利用惠斯通平衡电桥检测原理设计了场效应管等效电阻测量模块实现migfet源极和漏极之间的电压(voltage between the source and drain,vds)的采集,其中,migfet电流强度(the current intensity,ic)可以通过vds来计算。当步进电机驱动模块采用脉宽调制方式驱动步进电机向migfet生物传感器施加一个周期性的磁场时,能够引起mps/tdna的机械运动从而引起传感器的电阻强度(the resistance intensity,ir)动,改变石墨烯的导电性。migfet生物传感器中的电学参量同样经过场效应管等效电阻测量模块放大传送至ad数据采集模块。可以实现模数转换的ad数据采集模块能够将电压信号转换为二进制数字信号,并通过usb数据接口与labview编写的上位机进行串口通信。利用labview编写的上位机实现对数据的显示、处理和存储。
86.(4)migfet生物传感器的功能化
87.migfet生物传感器的功能化流程如图4所示,首先,向制备好的微流控反应腔注入10mm溶于二甲基亚砜(dimethyl sulfoxide,dmso)1-芘丁酸n-羟基琥珀酰亚胺酯(1-pyrenebutyric acid n-hydroxysuccinimide ester,pbase)溶液,并在室温下将其孵育2小时。pbase分子上存在可以和石墨烯六元环产生化学键反应的芘基,该芘基通过π-π堆垛作用能够附着于石墨烯薄膜上,以保持石墨烯固有的高导电率。然后,依次分别用dmso、去离子水溶液冲洗该生物传感器,以此来除去多余的未结合的pbase分子。将2um的探针适配体(aptamer)溶液注入反应腔并在室温下孵育4小时,由于pbase的分子中有可以和aptamer上的氨基反应的酰胺键,故两者可在化学键的作用下紧密结合。其次,为了将传感器中多余的aptamer去除,依次选用包含0.2%十二烷基硫酸钠(sodium dodecyl sulfate,sds)pbs、pbs溶液对migfet生物传感器进行洗涤。最后,在反应腔内分别加入不同浓度的mps/tdna的耦合物溶液,对待测tdna依次展开一系列的检测实验。
88.(5)待测tdna检测
89.tdna的检测步骤具体如下,将待测mps/tdna加入migfet生物传感器中1小时,以保障待测mps/tdna与aptamer生物传感器充分杂交结合。然后,使用0.2%sds的pbs溶液对传感器反应腔进行洗涤,之后使用pbs溶液再次洗涤并重复三次,以便于洗去多余未充分结合的被荧光基团6'-fam标记的mps/tdna和过量的mps。采用实验室自制的光电磁mibds记录migfet生物传感器的电信号变化与荧光强度的变化进而实现对tdna的检测。每次测量后,用10mm naoh溶液(25℃)冲洗该装置60s,以再生aptamer,实现重组实验。
90.(6)migfet生物传感器修饰结果检测
91.由于在对待测tdna检测之前需要对石墨烯进行修饰,即实现石墨烯的功能化,是否能够成功实现石墨烯功能化将影响待测tdna的检测结果,因此,接下来本发明将分别探究migfet生物传感器电通道、光通道和磁通道修饰结果。
92.光电磁migfet修饰过程如图5所示,图5中,图5(a)为电通道检测结果,图5(b)为清洗传感器后实现aptamer再生,图5(c)为光通道检测结果;图5(d)为磁通道检测结果。实验中,本发明利用栅压输出模块设置[-1v,1.5v]范围内以50mv等间距输出的栅极电压(gate voltage,vg),并在提供激发光源和施加周期性磁场的情况下,通过mibds进行检测并记录migfet生物传感器在修饰过程中产生的ic、if、ir的变化。当加入pbs、pbase、2μm aptamer溶液时,一方面,由于石墨烯的零带隙结构并且载流子迁移率极高,migfet生物传感器电通道表现出以狄拉克(dirac)点为中心的典型双极特性(图5(a)),并且dirac依次向右偏移,migfet中ic依次降低,这是由于当外来分子吸附到石墨烯上时带隙对费米能量的开放,导致石墨烯吸收系统的电导率降低。另一方面,migfet由于没有激发荧光基团,if基本保持不变(图5(c))。与此同时,migfet由于没有mps影响石墨烯双导电层结构,ir基本不变(图5(d))。接着,加入mps/tdna溶液,migfet的if和ir显著增加,migfet的dirac向左移并且电流继续降低。migfet的if显著增加表明标记有6'-fam的mps/tdna与aptamer进行杂交会引起if变化;migfet的ir显著增加表明mps/tdna能够与aptamer进行结合并富集;migfet的dirac左移、电流下降,这归因于dna分子与石墨烯薄膜的接触存在着非静电堆积现象,进而引起自由电子的转移。由此可知,通过注入pbase,aptamer溶液,成功实现了石墨烯的功能化,进而实现对tdna的检测。此外,每次试验后快速注入10mm的naoh溶液,冲洗60s,然后用pbs溶液洗涤。如图5(b)所示,清洗后石墨烯的dirac点恢复,与aptamer一致,说明aptamer被再生,实现了重组实验。因此,本发明设计的migfet可以通过光电磁三种传感方式实现对dna的检测。
[0093]
(7)migfet对dna灵敏度检测
[0094]
为了检验migfet生物传感器的实用性,本发明研究了不同浓度的tdna和aptamer之间实时dna杂交的结合动力学。如图6所示,图6中,图6(a)为光通道;图6(b)为电通道;图6(c)为磁通道;图6(d)为不同互补tdna浓度的电阻波动时域图。首先,将不同浓度梯度的mps/tdna加入被修饰后的石墨烯上,含量由高到低依次是2um、100nm、10nm、1nm、10pm。然后,基于migfet生物传感器的光电磁多检传感特性和mibds的监测装置,可以获得if、ic和ir的变化。对于电通道,migfet生物传感器的ic随着待测mps/tdna浓度的增加而逐渐降低,并且dirac点逐渐左移(图6(a))。对于光-磁通道,在提供激发光激发以及施加周期性磁场的情况下,migfet生物传感器中的if和ir随着待测mps/dna浓度的增加而逐渐增加(图6(b),(c),(d))。上述结果都表明mps/tdna成功与aptamer结合。mibds的光电磁三通道在检测tdna敏感性方面显示出一致的趋势,并且灵敏度为10pm,检测限度较低。
[0095]
(8)migfet对dna特异性检测
[0096]
为了验证migfet生物传感器的特异性,本发明使用完全错配的mps/tdna进行验证,如图7所示,图7中,图7(a)为电通道;图7(b)为光通道;图7(c)为磁通道。首先,配制2μm完全错配的mps/tdna溶液,并将其加入migfet生物传感器的反应池中反应60分钟。然后,使用浓度为0.2%的sds溶液和pbs溶液清洗migfet生物传感器,清除未反应的完全错配mps/
dna。最后,作为对照实验,将2μm完全匹配的mps/tdna加入反应池,60分钟后再次洗涤,使用mibds检测整个反应过程中if、ic和ir的变化。对于电通道,完全错配的mps/tdna的ic和dirac点没有显著变化,完全匹配的mps/tdna的ic显著降低,dirac点出现左移(图7(a)),这表明完全匹配的mps/tdna与aptamer完全结合,完全错配的mps/tdna与aptamer没有结合。对于光-磁通道,完全匹配的mps/tdna的if和ir明显增加,完全错配的mps/tdna的if和ir基本不变(图7(b),(c)),if和ir的变化也表明aptamer只与完全匹配的mps/tdna结合。本发明证明migfet生物传感器具有优良的特异性。
[0097]
(9)光电磁三通道检测结果对比
[0098]
为了验证检测结果的一致性和可靠性,对光电磁三通道检测结果进行了对比。图8显示了migfet生物传感器在石墨烯功能化后,固定vg在500mv,分别对不同浓度的tdna进行检测,通过mibds采集并记录源漏极之间的ic、当下的if以及在周期性磁场下产生的ir。如图8(b),(c)所示,由于对tdna的一端标记了荧光基团6'-fam并且耦合了mps,migfet生物传感器的if和ir随着mps/tdna浓度的增加而逐渐增加,说明mps/tdna已经与aptamer杂交。同时,ic则随着mps/tdna浓度的增加而持续降低(图8(a)),这归因于电解液中不断增加的外来负电荷不仅能够对石墨烯形成掺杂而且还扩大石墨烯的能量间隙,因此减小了石墨烯的电导率。综上,本发明设计的migfet生物传感器能够通过修饰后的石墨烯并结合电通道与荧光通道实现待测tdna定量分析,相比单一传感检测方式的生物传感器,采用多传感方式检测过程更加高效,检测结果在10pm量级上具有一致性,可以相互验证,更加准确。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1