基于铂包金纳米探针的肿瘤标志物的电化学检测方法
1.本发明涉及生物分析检测技术领域,尤其涉及基于铂包金纳米探针的肿瘤标志物的电化学检测方法。
背景技术:
2.癌症是一种由于细胞生长和增殖机制异常而引起的影响人类健康和生存的重大疾病。根据世界卫生组织的最新数据显示,2020年全球新发癌症患者约1930万,癌症死亡人数达1000万。癌症患者死亡的主要原因之一是延误诊断和治疗,因为大多数恶性肿瘤在早、中期通常没有明显症状。在大多数情况下,准确的早期发现和治疗可以大大提高癌症患者的生存率。癌胚抗原(cea)是一种约200kda糖蛋白,在许多恶性组织中过度表达。cea目前已成为最有希望用于癌症诊断、监测和预后评估的肿瘤生物标志物之一。因此,定量分析血液中cea含量对癌症的诊断具有重要意义。
3.目前,cea蛋白检测的主要临床方法有酶联免疫吸附试验(elisa)、放射免疫分析(ria)、荧光免疫分析和化学发光免疫分析(clia)。无一例外,这些方法都使用抗体作为特异性检测cea的识别元件。与抗体相比,适体作为一种很有前景的抗体替代物,由于其稳定性好、易于制备、成本低、毒性低,对构建生物传感器具有巨大的吸引力。更重要的是,由于其磷酸骨架,适配体可以很容易地用纳米材料进行功能化应用于生物传感领域。
4.电化学分析因其操作简单、成本低、效率高、适合小型化而备受关注。然而,它们仍然存在一些缺陷,如灵敏度和稳定性低。因此,迫切需要探索和开发信号放大策略,以满足日益增长的医疗服务需求。
技术实现要素:
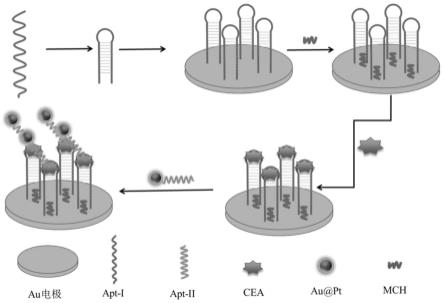
5.针对现有技术的不足,本发明所要解决的技术问题是提供基于铂包金纳米探针的肿瘤标志物的电化学检测方法。本发明的方法是基于铂包金(au@pt)双金属纳米探针的电流型适配体传感器用于癌胚抗原(cea)高灵敏度检测的方法,通过金种介导生长法合成对过氧化氢(h2o2)具有优异催化活性的核壳结构au@pt。通过与巯基化的cea适配体apt-ii直接偶联,用作对cea的识别元件及信号输出的纳米信号探针。当肿瘤标志物cea存在时,修饰在电极表面的发夹结构的初级适配体(apt-i)特异性捕获cea,此时cea可以作为纳米信号探针apt-ii-au@pt的识别位点,从而形成三明治结构的apt-i/cea/apt-ii-au@pt修饰电极。这样,纳米信号探针apt-ii-au@pt催化h2o2产生由时间-电流曲线检测到的催化电流信号,从而指示cea的浓度信息。
6.本发明通过以下技术方案实现的:
7.本发明的第一个目的在于提供基于铂包金纳米探针的肿瘤标志物的电化学检测方法,包括如下步骤:
8.s1:将纳米探针au@pt加入到巯基化的癌胚抗原适配体apt-ii中进行反应,使用巯基化的癌坯抗原适配体apt-ii通过与纳米探针au@pt表面裸露的au形成au-s键,得到纳米
信号探针apt-ii-au@pt;
9.s2:取活化后的癌胚抗原适配体apt-i滴加到预处理后的金电极表面,孵育,高温退火形成环茎结构,并修饰电极表面,得到修饰电极apt-i-aur;
10.s3:将s2制备的修饰电极apt-i-aur上加入待测液进行孵育,然后滴加s1中所得纳米信号探针apt-ii-au@pt,孵育,形成带有三明治结构的apt-i/cea/apt-ii-au@pt修饰电极;
11.s4:将s3制备的带有三明治结构的apt-i/cea/apt-ii-au@pt修饰电极置于缓冲液中,检测电极的电化学信号,以此定性或定量测定癌胚抗原的浓度。
12.在本发明的一个实施例中,所述癌胚抗原适配体apt-i的核酸序列为sh-ataccagcttattcaatt;
13.所述癌胚抗原适配体apt-ii的核酸序列为sh-agggggtgaagggataccc。
14.在本发明的一个实施例中,s1中,所述纳米探针au@pt通过以下方法制备得到:将aunps与h2ptcl6于溶剂中进行混合,进行加热反应,后加入l-抗坏血酸溶液,继续进行加热反应,得到所述纳米探针au@pt。
15.在本发明的一个实施例中,所述aunps与h2ptcl6的摩尔比为8:1~5:1。
16.在本发明的一个实施例中,所述aunps与h2ptcl6混合加热反应的温度为70~90℃。
17.在本发明的一个实施例中,所述aunps通过以下方法制备得到:将haucl4溶液搅拌并加热,加入柠檬酸钠水溶液,继续加热反应,得到所述aunps。
18.在本发明的一个实施例中,所述haucl4与所述柠檬酸钠的质量比是1:2~1:5。
19.在本发明的一个实施例中,s1中,所述巯基化的癌胚抗原适配体apt-ii通过以下方法制备得到:取还原剂与癌胚抗原适配体apt-ii混匀反应,得到所述巯基化的癌胚抗原适配体apt-ii。
20.在本发明的一个实施例中,所述还原剂选自三(2-羧乙基)膦(tcep)和/或二硫苏糖醇(dtt)。
21.在本发明的一个实施例中,所述还原剂与cea适配体apt-ii的摩尔比为1:3~1:7。
22.在本发明的一个实施例中,所述cea适配体apt-ii的浓度为1μm~8μm。
23.在本发明的一个实施例中,s2中,所述活化后的癌胚抗原适配体apt-i通过以下方法制备得到:将癌胚抗原适配体apt-i经过预热和冰浴之后形成发夹结构,并加入还原剂进行还原活化,得到所述活化后的癌坯抗原适配体apt-i。
24.在本发明的一个实施例中,所述还原剂选自三(2-羧乙基)膦(tcep)和/或二硫苏糖醇(dtt)。
25.在本发明的一个实施例中,所述癌胚抗原适配体apt-i与还原剂的摩尔比为1:10~1:100。
26.在本发明的一个实施例中,s2中,所述金电极的预处理方法为:将金电极在食人鱼溶液中浸泡后,在不同粒径的氧化铝悬浮液中打磨,得到预处理后的金电极。
27.在本发明的一个实施例中,所述在氧化铝悬浮液的粒径为0.3μm~0.05μm。
28.在本发明的一个实施例中,所述清洗为硫酸扫描清洗。
29.在本发明的一个实施例中,s4中,所述缓冲液为pbs缓冲液和/或tris-hcl缓冲溶液;所述缓冲液的ph为6~8。
30.本发明的第二个目的在于提供所述的电化学检测方法在检测癌胚抗原cea中的应用。
31.本法明制备方法的原理如下:
32.本发明基于铂包金(au@pt)纳米探针的肿瘤标志物的电化学检测方法的原理图如图1所示。本发明基于纳米探针au@pt对h2o2催化信号放大策略,构建了一种用于cea的电流型传感器。当没有肿瘤标志物cea存在时,固定在电极上的捕获探针apt-i不会结合cea,因此apt-ii-au@pt共轭物不能够通过夹心式捕获在电极表面固定,以产生催化电流。当肿瘤标志物cea存在时,固定在电极上的cea适配体apt-i可以特异性捕获目标cea,从而形成三明治结构的apt-i/cea/apt-ii-au@pt修饰电极。这样,纳米信号探针apt-ii-au@pt催化h2o2产生由时间-电流曲线检测到的催化电流信号,从而指示cea的浓度信息。
33.本发明的技术方案具有以下优点:
34.(1)本发明使用具有核壳结构的纳米探针au@pt作为信号探针,显著增大催化金属pt在au纳米颗粒中的负载密度,提高传感器的催化电流响应,提升传感器的灵敏度。与此同时,以纳米探针代替生物酶作为信号催化元件,大大增加了传感器的稳定性并且降低了构建成本。并且,基于双适配体为识别探针的三明治夹心结构的电化学传感器的构建,通过二次识别捕获,进一步增加传感器对于肿瘤标志物cea检测的特异性。本发明构建的电化学传感器的制备简单、稳定性强、重复性高、检测成本低廉、检测结果精确性与准确性高,为医学领域的临床诊断提供更加便捷、可靠的检测方法和依据。
35.(2)与天然酶相比,纳米酶具有许多固有优势,包括在严苛条件下的高稳定性、催化活性的可调性和低制备成本。其中,含金和铂的双金属纳米粒子因其多功能和协同性能而备受关注。金可以提供可调节的大小和形状,良好的化学稳定性和适体固定位点。pt可以提供过氧化物酶催化活性作为信号探针。以金为核心,外层装载铂,形成独特的铂包金(au@pt)结构。au和pt的结合有助于改善双金属性能并提高pt的分散水平,从而提高纳米酶的催化活性并降低贵金属材料的成本。
附图说明
36.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中
37.图1为基于au@pt纳米信号探针的电流型适配体传感器用于cea检测的原理图;
38.图2为本发明实施例1中不同浓度cea的电流-时间曲线;
39.图3为本发明实施例1中不同浓度cea的电流响应值及检测标准曲线;
40.图4为本发明特异性实验中传感器特异性检测结果。
具体实施方式
41.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
42.实施例1:癌胚抗原cea浓度标准曲线的绘制
43.(1)纳米探针au@pt的制备:将50ml haucl4(0.01%,w/v)添加到100ml的圆底烧瓶中,搅拌并加热至沸腾。随后,将2ml柠檬酸钠水溶液(1%,w/v)快速添加到沸腾溶液中,继
续煮沸30min,同时搅拌直到溶液变红。冷却后,得到15nm的aunps。将30ml上述aunps加入到150ml锥形瓶中,并依次加入224μl 10mmol/lh2ptcl6和18.656ml超纯水。以转速150r/min~200r/min磁力搅拌加热至80℃后,用注射器以0.2ml/min加入1.12ml 10mmol/l的l-抗坏血酸溶液,继续加热30min后停止反应,冷却至室温,得到纳米探针au@pt,在4℃冰箱中避光保存。
44.(2)纳米探针au@pt与适配体偶联:取50μl 2μmtcep与50μl 10μm的适配体apt-ii混匀,25℃条件下反应1h,得到巯基化的适配体apt-ii;取100ml 10倍浓缩的au@pt加入到上述巯基化的适配体apt-ii中,25℃温度下反应1h后,离心后取出沉淀重悬于缓冲溶液中,放置在4℃冰箱中冷却保存至少24h,得到稳定的apt-ii-au@pt缀合物(即纳米信号探针apt-ii-au@pt)。
45.(3)金电极预处理:将金电极在食人鱼溶液(h2so4:h2o2=7:3)中浸泡15min,分别在超纯水和无水乙醇中超声3min,再在0.3μm和0.05μm氧化铝悬浮液中分别打磨3min。用水冲干净后进行0.5m硫酸扫描清洗(-0.2v到1.5v,扫描速率1v s-1
,循环次数100次),再用水冲干净,氮气吹干以备后续使用。
46.(4)适配体与金电极孵育:将95℃金属浴再冰浴处理的捕获探针cea适配体apt-i与tecp以1:5的摩尔比反应活化1h后,用缓冲溶液将活化后的适配体apt-i稀释到目标浓度0.1μm、0.15μm、0.2μm、0.25μm。取10μl上述捕获探针溶液滴加到预处理后的金电极表面,室温下孵育12h后用pbs缓冲溶液及超纯水清洗电极。将修饰有适配体apt-i的金电极浸泡在2mmol/l 6-巯基己醇(mch)中,37℃下孵育1h后用pbs缓存液及超纯水清洗电极,得到apt-i-aur,以备后续使用。
47.(5)癌胚抗原cea的检测:在电化学测量之前,将8μl含有一定浓度(0.1μm、0.15μm、0.2μm、0.25μm)cea的pbs缓冲液均匀地分散在apt-i-aur上。在37℃下孵育1.5h后,用pbs缓冲液及超纯水仔细冲洗所得电极,以去除非特异性吸附的物质。随后,将8μl纳米信号探针apt-ii-au@pt滴加在电极上并孵育1h。此时,纳米探针上的cea适配体可特异性捕获固定在电极表面的cea形成三明治结构的apt-i/cea/apt-ii-au@pt修饰层。将该apt-i/cea/apt-ii-au@pt修饰电极置于含有0.5mmol/l h2o2的10mmol/l pbs缓冲液(ph 7.4)中,施加电压为-400mv,进行电流-时间曲线的测定,结果如图2所示。由图2可以得出随着目标为cea的添加量由0.1ng/ml增加到200ng/ml,i-t曲线的电流响应值也逐渐增大。根据测定电流响应值与加入的cea浓度之间的关系,绘制相应的线性关系曲线如图3所示,由图3可以看出,在0.1ng/ml到100ng/ml的浓度范围内,电极表面电流响应值随着溶液中cea浓度的增加而增加,线性回归方程是i=0.0921c
cea
+0.3261,r2=0.9928,该方法的检测限为0.31ng ml-1
。
48.实施例2:癌胚抗原cea含量的测定
49.为了进一步验证该方法在测定实际样品中cea含量的准确性,选取人体血清样品进行实际样品检测。
50.分别将1ng/ml、10ng/ml和100ng/ml的cea加入到血清样品中,各取出8μl滴涂在修饰有捕获探针的电极上,在37℃下孵育1.5h后,用pbs缓冲液及超纯水仔细冲洗电极。随后,将8μl纳米信号探针apt-ii-au@pt滴加在电极上并孵育1h,用pbs缓冲液及超纯水仔细冲洗电极,形成三明治结构的apt-i/cea/apt-2-au@pt修饰层。将此修饰电极置于含有0.5mmol/l h2o2的10mmol/l pbs缓冲液(ph 7.4)中,施加电压为-400mv进行电流-时间曲线的测定。
将测得电流响应值代入标准曲线可计算出cea浓度。具体样品和检测结果如表1所示。
51.表1
[0052][0053]
特异性实验
[0054]
为检测该电化学检测方法的特异性,选用100ng/ml ca125、10μg/ml甲胎蛋白afp、10μg/ml尿酸ua、10μg/ml牛血清白蛋白bsa、100u/ml ca125和10μg/ml l-抗坏血酸aa进行检测,实验结果如图4所示。由图4表明,该电化学检测方法对100ng/ml cea电流响应显著,而对其它三种蛋白几乎没有电流响应。由此可以判断,构建的电化学检测方法对cea的测定具有良好的选择性。
[0055]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1