一种利用流式细胞术检测细胞功能的方法与流程
1.本发明涉及细胞检测领域,特别涉及一种利用流式细胞术检测细胞功能的方法。
背景技术:
2.免疫细胞是指参与免疫应答或与免疫应答相关的细胞。包括淋巴细胞、树突状细胞、单核/巨噬细胞、粒细胞、肥大细胞等。免疫细胞可以分为多种,在人体中各种免疫细胞担任着重要的角色。t淋巴细胞是具有细胞免疫功能的细胞,对b细胞起促进作用,以及对免疫细胞起抑制、调整作用的细胞,所组成细胞群总称,又称胸腺依赖性淋巴细胞,是淋巴细胞主要组分。它具有多种生物学功能,比如直接杀伤靶细胞,辅助或抑制b细胞产生抗体。对于特异性抗原和促有丝分裂原应答反应,以及产生细胞因子等,使免疫效应扩大和增强。
3.在细胞功能检测过程中,细胞增殖是生命体的重要特征,是指细胞在周期调控因子的作用下通过dna复制、rna转录和蛋白质合成等反应进行的分裂过程。生物通过细胞增殖产生新的个体,当细胞增殖失控时,就会导致各种疾病,例如癌症就是由于肿瘤细胞在机体内无序增殖而形成的恶性肿瘤。
4.在对细胞增殖功能进行检测的过程中,大多通过胸腺嘧啶核苷(3h-tdr)渗入法,胸腺嘧啶核苷(3h-tdr),但是在检测过程中,由于3h-tdr具有较强的放射性,同时,此种检测方法,在制备闪烁测定样品时,洗脱未被摄入的放射性物,沉淀大分子物质,并使之消化溶解,便于均匀分布在闪烁液中,须反复多次离心沉淀,操作繁琐,耗费时间,在检测过程中,洗脱离心后的待测样品在长时间的检测过程中容易呈团块状,导致对检测结果产生影响。
技术实现要素:
5.针对上述问题,本技术提供了一种利用流式细胞术检测细胞功能的方法。
6.为实现上述目的,本技术提供如下技术方案:一种利用流式细胞术检测细胞功能的方法,该方法包括以下步骤:
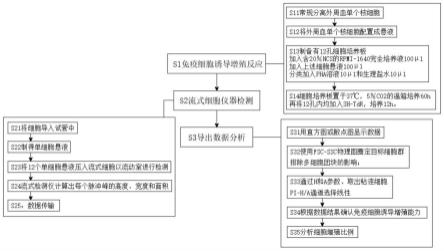
7.s1:免疫细胞诱导增殖反应。
8.s2:流式细胞仪器检测。
9.s3:导出数据分析。
10.本发明技术方案的进一步改进在于,所述s1免疫细胞诱导增殖反应包括以下步骤:
11.s11:常规分离外周血单个核细胞,采用聚蔗糖-泛影葡胺密度梯度离心法,利用分层液作为密度梯度离心,得到单个核细胞,分层液比重为1.077
±
0.001。
12.s12:用含20%ncs的rpmi1640作为培养基,将外周血单个核细胞配置成悬液,细胞浓度为2.0
×
10^6/ml。
13.s13:制备有12孔细胞培养板,每三孔为一组,共4组,在细胞培养板上12孔内均加入含20%ncs的rpmi-1640完全培养液100μl,然后于12孔内均加入上述细胞悬液100 μl,于
前三组试验孔中加入pha溶液10μl,第四组加入生理盐水10μl。
14.s14:将12孔细胞培养板置于37℃,5%co2的温箱培养60h,再将12孔内均加入3h-tdr,培养12h。
15.本发明技术方案的进一步改进在于,所述s2流式细胞仪器检测包括以下步骤:
16.s21:通过多孔收集仪器分别收集12孔内的细胞导入试管中。
17.s22:将12孔内的细胞制成单细胞悬液。
18.s23:将12个单细胞悬液压入流式细胞以流动室进行检测,液流系统将样本悬液定位在光源的中心处,激发光学系统,当一个细胞流经过流式细胞仪器的激光束时,会对散射和荧光检测器产生光脉冲,光脉冲随后被转化为电压脉冲。
19.s24:流式检测仪内的检测分析系统将脉冲信号转化为数字信号,计算出每个脉冲峰的高度、宽度和面积。
20.s25:流式检测仪和计算机相连传出数据。
21.本发明技术方案的进一步改进在于,所述步骤s3数据分析包括以下步骤:
22.s31:用直方图或散点图显示数据(使用线性或对数模型生成)。
23.s32:使用fsc-ssc物理图圈定目标细胞群,排除多细胞团块的影响。
24.s33:通过h和a参数,取出粘连细胞,pi-h/a通道选择线性。
25.s34:根据数据结果确认免疫细胞诱导增殖能力,用直方图或散点图为指标选择免疫细胞,为了减少初始细胞的影响,本发明可采用细胞的增值率作为衡量细胞增殖的参数,并绘制细胞增殖曲线。
26.s35:分析细胞增殖比例。
27.本发明技术方案的进一步改进在于,所述步骤s22包括以下步骤:
28.s221:在细胞内加入适量的酶,在37℃静置适当时间,再将细胞震荡消化25min,使其完全消化混匀。
29.s222:采用300目的筛网过滤细胞悬液。
30.本发明技术方案的进一步改进在于,所述步骤s221中,如若细胞样本当天无法检测,则需要在样品内部加入20℃无水乙醇,在滴加的同时进行高度搅拌,防止细胞成团状。
31.本发明技术方案的进一步改进在于,所述步骤s221中,如若如组织块已分散而失去块的形状,一经摇动即成细胞团或单个细胞,则认定细胞样本认为已消化充分。
32.综上,本发明的技术效果和优点:
33.本发明用3h-tdr作为dna合成的前体能掺入dan合成代谢过程,诱导免疫细胞的增殖反应,培养获得的细胞样品纯度较高,能够提供更准确的结果,再通过流式细胞检测法检测细胞的增殖状况,能够有效反应细胞在诱导增殖后的活化状况,减少了离心沉淀所需要的时间,同时在数据分析时,可排除多细胞团块在检测数据中的影响,能够准确反映细胞的代谢及细胞增殖情况,可全面、综合反映了t淋巴细胞内部的单核细胞的增殖能力,便于推论免疫细胞活性,提高了对单核细胞样品的检测效率,使细增殖检测结果更加准确。
附图说明
34.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅是本申
请的一些实施例,对于本领域技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
35.图1为本发明方法具体步骤顺序架构示意图。
36.图2为本发明步骤s22架构示意图。
具体实施方式
37.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
38.实施例:参考图1-2所示的一种利用流式细胞术检测细胞功能的方法,该方法包括以下步骤:
39.s1:免疫细胞诱导增殖反应。
40.s2:流式细胞仪器检测。
41.s3:导出数据分析。
42.在该过程中,需要首先对取样的细胞进行诱导增殖,再通过流式细胞仪检测取样细胞的增殖情况。
43.s1免疫细胞诱导增殖反应包括以下步骤:
44.s11:常规分离外周血单个核细胞,采用聚蔗糖-泛影葡胺密度梯度离心法,利用分层液作为密度梯度离心,得到单个核细胞,分层液比重为1.077
±
0.001。
45.s12:用含20%ncs的rpmi1640作为培养基,将外周血单个核细胞配置成悬液,细胞浓度为2.0
×
10^6/ml。
46.s13:制备有12孔细胞培养板,每三孔为一组,共4组,在细胞培养板上12孔内均加入含20%ncs的rpmi-1640完全培养液100μl,然后于12孔内均加入上述细胞悬液100 μl,于前三组试验孔中加入pha溶液10μl,第四组加入生理盐水10μl。
47.s14:将12孔细胞培养板置于37℃,5%co2的温箱培养60h,再将12孔内均加入3h-tdr,培养12h。
48.在步骤s11中,获取外周血单个核细胞的过程中,由于外周血单个核细胞包括淋巴细胞和单核细胞。单个核细胞的体积、形态和比重与外周血其他细胞不同,红细胞和多核白细胞的比重在1.092左右,单个核细胞的比重为1.075-1.090,血小板为1.030-1.035,通过聚蔗糖-泛影葡胺密度梯度离心法可得到单个核细胞,离心后,管内可分为以下四层:上层为血浆、血液稀释液及绝大部分血小板,下层为红细胞及粒细胞,中层为细胞分层液,分层液与血浆交界部位混浊的灰白色层即为单个核细胞层。
49.在分离单个核细胞层时,可用毛细吸管轻轻插入灰白色层,沿管壁轻轻吸出灰白色的单个核细胞,盛试管管中。
50.在步骤s14中,由于淋巴细胞受分裂原(pha等)或特异性抗原刺激发生转化时,必然伴有dna的大量合成,若将具有放射性的3htdr加到培养液内,则可被作为合成dna的原料而摄入转化中的细胞内,刺激细胞分化增殖。培养获得的细胞样品纯度较高,能够提供更准确的结果。
51.步骤s2流式细胞仪器检测包括以下步骤:
52.s21:通过多孔收集仪器分别收集12孔内的细胞导入试管中。
53.s22:将12孔内的细胞制成单细胞悬液。
54.s23:将12个单细胞悬液压入流式细胞以流动室进行检测,液流系统将样本悬液定位在光源的中心处,激发光学系统,当一个细胞流经过流式细胞仪器的激光束时,会对散射和荧光检测器产生光脉冲,光脉冲随后被转化为电压脉冲。
55.s24:流式检测仪内的检测分析系统将脉冲信号转化为数字信号,计算出每个脉冲峰的高度、宽度和面积。
56.s25:流式检测仪和计算机相连传出数据。
57.在步骤s21-25中,通过直接制备将单细胞悬液。可减少了在对样品细胞离心沉淀所需要的时间,由于流式检测仪的原理是采用其特点是通过快速测定库尔特电阻、荧光、光散射和光吸收来定量测定细胞dna含量、细胞体积、蛋白质含量、酶活性、细胞膜受体和表面抗原等许多重要参数。因此,在对样品的处理过程中,无需将dna过滤,同时在制备单细胞悬液的过程中无需脱去多余3h-tdr,也无需用甲醇洗涤。的所需要的时间,使样品细胞与酶混合均匀即可制成单细胞悬液以供检测。
58.步骤s3数据分析包括以下步骤:
59.s31:用直方图或散点图显示数据(使用线性或对数模型生成)。
60.s32:使用fsc-ssc物理图圈定目标细胞群,排除多细胞团块的影响。
61.s33:通过h和a参数,取出粘连细胞,pi-h/a通道选择线性。
62.s34:根据数据结果确认免疫细胞诱导增殖能力,用直方图或散点图为指标选择免疫细胞,为了减少初始细胞的影响,本发明可采用细胞的增值率作为衡量细胞增殖的参数,并绘制细胞增殖曲线。
63.s35:分析细胞增殖比例。
64.在步骤s31-34中,通过对数据进行处理,可减少外界影响因素对在细胞增殖检测数据中的比重,可排除多细胞团块在检测数据中的影响,能够准确反映细胞的代谢及细胞增殖情况,可全面、综合反映了t淋巴细胞内部的单核细胞的增殖能力,便于推论免疫细胞活性。
65.步骤s22包括以下步骤:
66.s221:在细胞内加入适量的酶,在37℃静置适当时间,再将细胞震荡消化25min,使其完全消化混匀。
67.s222:采用300目的筛网过滤细胞悬液。
68.在步骤s222中,过滤细胞悬液的作用是让细胞沉降并倒出多余的含酶液体,避免含酶液体进入流式检测仪内部对检测结果产生影响。
69.值得一提的是,步骤s221中,如若细胞样本当天无法检测,则需要在样品内部加入 20℃无水乙醇,在滴加的同时进行高度搅拌,防止细胞成团状。保障了细胞样品在检测前的质量,有效避免由于样本延迟检测导致样本细胞产生团状反应。有利于后续的合成工作筛选工作。
70.同时,步骤s221中,如若如组织块已分散而失去块的形状,一经摇动即成细胞团或单个细胞,则认定细胞样本认为已消化充分。
71.最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1