一种抗OX40抗体的生物活性检测方法与流程
一种抗ox40抗体的生物活性检测方法
技术领域
1.本发明属于生物医药领域,涉及一种抗ox40抗体的生物活性检测方法。
背景技术:
2.ox40(又叫cd134)及其相互作用的配体ox40l(又叫cd252)是tnf(r)sf的成员。ox40是一个含有275个氨基酸由3个完整的富含半胱氨酸的结构域(cysteine-rich domains, crds)和1个部分以梭基为末端的crds组成的分子重量约为50kd的i型跨膜糖蛋白。无论是人的还是小鼠的ox40都主要表达在活化的t细胞上,包括cd4
+
/cd8
+ t细胞,中性粒细胞,nk细胞及nkt细胞,在t细胞的活化和增殖中起到了一个重要的作用。
3.正如我们所知免疫检查点无论是在肿瘤还是在感染性疾病中都扮演着重要的角色。近来有报道这些细胞表面的分子中的大部分均存在可溶性的形式,能够在患者的血清中检测到且可能跟疾病的严重程度及炎症活动性等有关。虽然ox40作为二代免疫检查点的代表性靶点成为研究的热点,但是并没有针对ox40的药物上市,而目前用于肿瘤免疫治疗的抗ox40的单抗都处在临床i期或ii期,如medi-6469、pf-04518600、gsk-3174998、incagno-1949、bms-986178、tavolixizumab等。
4.生物学活性是抗体类药物的关键质量属性,其准确测定是保证药物安全性和有效性的基本前提。目前抗体类药物生物学活性测定主要是根据其体内作用机制,在体外建立相应的细胞评价模型,将实验结果进行直线性或曲线性拟合,并与参比品比较评价其相对生物学活性。在体外,针对ox40靶点的活性测定方法主要包括酶联免疫吸附测定、表面等离子共振效价测定法、人脐静脉内皮细胞增殖抑制法和transwell细胞迁移实验。 其中elisa和spr效价测定法仅能反应出抗体和抗原的结合能力,transwell细胞迁移实验法操作复杂且难以定量。而目前应用最广泛的huvec增殖抑制法方法具有原代细胞难以培养、实验周期长、变异度高的缺点。前期我们开发了一种检测ox40的生物的活性的方法(专利申请号2019103249216),但是该方法对早期工艺产品(纯度为93%的样品)具有较好的检测效果,但是对最终工艺产品(纯度为98.3%的样品)检测效果较差,不能形成高点平台。为了解决相关问题,做了大量的研究工作如样品浓度的摸索、细胞分板密度的摸索、cd3/cd28浓度的摸索等等,但是结果仍然不理想,不能得到稳定的高平台和较高的回收率。基于此开发了本技术的检测方法。
技术实现要素:
5.为了弥补现有技术的不足, 本发明的目的在于提供一种快速、稳定、简单、准确、特异性且具有广泛适用性的抗ox40抗体活性检测方法。
6.为了实现上述目的,本发明采用如下技术方案:本发明第一方面提供了一种检测抗ox40抗体的生物活性的方法,包括:将hek293-fcγrⅱb细胞和过表达ox40的细胞与抗ox40抗体共孵育,通过荧光素酶报告基因法检测抗ox40抗体的生物活性。
7.进一步,过表达ox40的细胞选自天然过表达ox40的细胞或者工程化改造的过表达ox40的细胞。
8.进一步,所述过表达ox40的细胞选自工程化改造的过表达ox40的细胞。
9.进一步,所述工程化改造的过表达ox40的细胞还包含荧光素酶报告基因。
10.进一步,所述工程化改造的过表达ox40的细胞还包含反应元件。
11.进一步,所述反应元件选自nf-κb。
12.进一步,所述工程化改造的过表达ox40的细胞包括jurkat细胞、huvec细胞、293细胞、cos7细胞、l929细胞、hepg2细胞、cho细胞、3t3细胞。
13.进一步,所述工程化改造的过表达ox40的细胞选自jurkat细胞。
14.进一步,所述工程化改造的过表达ox40的细胞选自细胞。
15.进一步,所述方法还包括使用加入刺激因子的缓冲液稀释过表达ox40的细胞。
16.进一步,所述刺激因子选自抗cd3的抗体和/或抗cd28的抗体。
17.进一步,所述刺激因子选自抗cd3的抗体。
18.进一步,所述抗cd3抗体的浓度选自2~4μg/ml。
19.进一步,所述抗cd3抗体的浓度选自4μg/ml。
20.进一步,所述缓冲液为rpmi-1640培养基。
21.进一步,所述rpmi-1640培养基还加入了10%fbs。
22.进一步,过表达ox40的细胞稀释后的密度为8
×
105个/ml。
23.进一步,过表达ox40的细胞的接种数量为8
×
105个/孔。
24.进一步,先培养hek293-fcγrⅱb细胞5~6h,然后和过表达ox40的细胞与抗ox40抗体共孵育。
25.进一步,所述方法包括:1)将hek293-fcγrⅱb细胞种到检测板中培养5~6h;2)将稀释后的过表达ox40的细胞加到培养了hek293-fcγrⅱb细胞的检测板中;3)加入经过系列稀释的抗ox40抗体进行培养;4)向各孔中加入检测试剂,进行酶标检测。
26.进一步,检测试剂为荧光素酶检测试剂。
27.进一步,将hek293-fcγrⅱb细胞稀释后加入到检测板中。
28.进一步,hek293-fcγrⅱb细胞的稀释密度为5.0
×
105个/ml。
29.进一步,hek293-fcγrⅱb细胞的接种数量为5.0
×
104个/孔。
30.进一步,稀释hek293-fcγrⅱb的缓冲液为rpmi-1640培养基。
31.进一步,所述rpmi-1640培养基中加入了10%fbs。
32.进一步,所述检测板为96孔的酶标板。
33.进一步,所述抗ox40抗体稀释倍数为3倍。
34.进一步,稀释抗ox40抗体的缓冲液为rpmi-1640培养基。
35.进一步,rpmi-1640培养基中加入了10%fbs。
36.在本发明的具体实施方式中,所述方法包括:使用加入10%fbs的rpmi-1640培养基将hek293-fcγrⅱb细胞稀释到密度为5.0
×
105个/ml,将稀释后的hek293-fcγrⅱb细胞接种到的96孔酶标板中培养5-6h;使用加入抗cd3抗体和10%fbs的rpmi-1640培养基将细胞稀释到密度为8.0
×
105个/ml,将稀释后的细胞加到培养了hek293-fcγrⅱb细胞的酶标板中;加入经过3倍系列稀释的抗ox40抗体,在37℃、5%co2的培养箱中培养16-18h,加入荧光素酶检测试剂进行酶标检测。
37.本发明第二方面提供了如下任一项应用:1)hek293-fcγrⅱb细胞在检测抗ox40抗体生物活性中的应用;2)hek293-fcγrⅱb细胞联合抗cd3的抗体在检测抗ox40抗体生物活性中的应用。
38.本发明第三方面提供了一种检测抗ox40抗体的产品,所述产品包括hek293-fcγrⅱb细胞、过表达ox40的细胞和抗cd3抗体。
39.进一步,所述产品还包括检测试剂。
40.进一步,所述检测试剂为荧光素酶检测试剂。
41.进一步,所述过表达ox40的细胞选自。
42.本发明第四方面提供了一种检测抗ox40抗体生物活性的设备,所述设备包括执行本发明第一方面所述方法的装置。
43.在本发明可选择的实施方式中,所述设备包括执行本发明第一方面所述方法的细胞培养装置、加样装置、检测装置。
44.在本发明可选择的实施方式中,所述设备包括执行本发明第一方面所述方法的细胞培养装置、加样装置、检测装置和输出装置。
45.本发明的优点和有益效果:本发明提供了一种检测抗ox40抗体生物活性的方法,该方法成本低,操作简便,周期短,不需要进行动物实验,结果稳定可靠,准确度高,特异性好,适用于不同纯度的ox40抗体的检测,有利于促进药品的研究开发,质量控制与临床应用,具有较高的应用价值。
附图说明
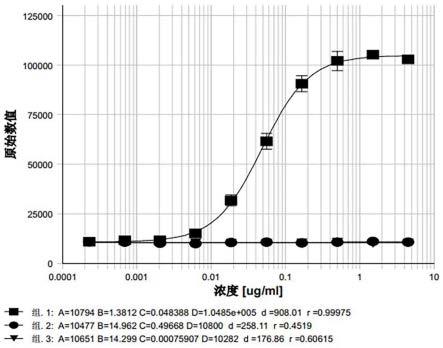
46.图1是生物活性检测方法专属性验证图。
47.图2是生物活性检测方法线性验证图。
具体实施方式
48.下面结合实施例对本发明作进一步详细的说明。
49.以下实施例仅用于说明本发明而不用于限制本发明的范围。
50.实施例1利用hek293-fcγrⅱb细胞的抗体生物活性检测方法的建立1、细胞培养密度的优化为了确定生物活性检测方法,对细胞培养密度进行优化。
51.具体方法如下:(1)分析缓冲液的配制:取rpmi1640基础培养基,加入10%体积fbs。
52.(2)分析培养基的配制:加cd3和cd28:取rpmi1640基础培养基,加入10%体积fbs、终浓度4μg/ml抗人cd3
抗体、终浓度4μg/ml抗人cd28抗体。
53.(3)细胞铺板:将hek293-fcγrⅱb细胞(中检院赠予)消化、离心后用dmem完全培养基重悬,调整密度为5
×
105个/ml或3
×
105个/ml,100
ꢀµ
l/孔加入到白色不透明细胞培养板,于二氧化碳培养箱中37℃,5% co2条件下培养5-6h后弃上清,细胞(实验室制备,参考专利2019103249216)离心后上述分析培养基吹打重悬,调整密度为1
×
106个/ml 、8
×
10
5 个/ml、4
×
10
5 个/ml,50
ꢀµ
l/孔加入到上述白色不透明细胞培养板中。
54.(4)样品稀释:使用分析缓冲液将样品(前期工艺样品,纯度为93%)以1.5
µ
g/ml为起始浓度,3倍稀释,共10个浓度点。
55.(5)加样:对应加入梯度稀释样品,每孔50
ꢀµ
l。将细胞板置于二氧化碳培养箱中37℃,5% co2条件下培养16-18h。
56.(6)检测:将已经恢复至室温的bright-glo luciferase assay system,以100μl/孔加入到96孔白细胞培养板中。室温避光孵育3-5min,多功能酶标仪测定各孔荧光强度,采用luminescence模式下,积分时间一般为500-1000ms;以抗体浓度为横坐标,以化学发光值为纵坐标,拟合四参数s形曲线。
57.检测不同效价将50μg/ml抗ox40抗体作为对照,分别对64%,80%,100%,125%,156%活性效价水平的供试品重复进行细胞活性检测,每个效价水平分别独立测定 3 次。
58.(7)分别对100%效价、64%效价、和156%效价活性效价水平的供试品重复进行细胞活性检测,每个效价水平分别独立测定 3 次。
59.(8)结果结果显示, 当jurkat-ox40细胞密度为8
×
105个/ml,曲线窗口值较大,确定jurkat-ox40细胞密度设为8
×
105个/ml,hek293-fcγrⅱb细胞密度为5
×
105个/ml时,高点平台期没有出现交叉现象,回收率较好,rsd均<10,确定hek293-fcγrⅱb细胞密度为5
×
105个/ml。
60.2、分析培养基的优化为了确定生物活性检测方法,对分析培养基进行了优化,采用优化后的细胞密度hek293-fcγrⅱb细胞(5
×
105个/ml)(中检院赠予),细胞(8
×
105个/ml)(参考专利2019103249216)对分析培养基进行优化。
61.具体方法如下:(1)分析缓冲液的配制:取rpmi 1640基础培养基,加入10%体积fbs。
62.(2)分析培养基的配制:a.只加cd3:取rpmi 1640基础培养基,加入10%体积fbs、终浓度4μg/ml 抗人 cd3抗体;b.加cd3和cd28:取rpmi 1640基础培养基,加入10%体积fbs、终浓度4μg/ml 抗人 cd3抗体、终浓度4μg/ml 抗人cd28抗体;c.不加cd3和cd28:取rpmi 1640基础培养基,加入10%体积fbs。
63.(3)细胞铺板:将hek293-fcγrⅱb细胞消化、离心后用dmem完全培养基重悬,调整密度为5
×
10
5 个/ml,100
ꢀµ
l/孔加入到白色不透明细胞培养板,于二氧化碳培养箱中37℃,5% co2条件下培养5-6h后弃上清,细胞离心后分别用上述三种
分析培养基吹打重悬,调整密度为8
×
105个/ml,50
µ
l/孔加入到上述白色不透明细胞培养板中。
64.(4)样品稀释:使用分析缓冲液将样品(前期工艺样品,纯度为93%)以9
µ
g/ml为起始浓度,3倍稀释,共10个浓度点。
65.(5)加样:对应加入梯度稀释样品,每孔50
µ
l。将细胞板置于二氧化碳培养箱中37℃,5%co2条件下培养16-18h。
66.(6)检测:将已经恢复至室温的bright-gloluciferaseassaysystem,以100μl/孔加入到96孔白细胞培养板中。室温避光孵育3-5min,多功能酶标仪测定各孔荧光强度,采用luminescence模式下,积分时间一般为500-1000ms;以抗体浓度为横坐标,以化学发光值为纵坐标,拟合四参数s形曲线。
67.(7)结果结果如表1所示,cd3组的信噪比最高,选择仅加入抗人cd3抗体的分析培养基进行ox40抗体的检测。
68.根据以上参数优化的实验结果,整理得到基于报告基因的抗ox40抗体生物学活性方法的实验参数如表2所示:实施例2 raji细胞中的抗体活性的检测使用不同的细胞系raji细胞和hek293-fcγrⅱb细胞分别使用优化后的参数检测不同分析培养基对抗体活性检测的影响。方法如下:raji细胞+jurkat-ox40-nfκb-luc细胞:(1)分析缓冲液的配制:取rpmi 1640基础培养基,加入10%体积fbs。
69.(2)分析培养基的配制:
a. 只加cd3:取rpmi 1640基础培养基,加入10%体积fbs、终浓度8μg/ml 抗人cd3抗体;b.加cd3和cd28:取rpmi 1640基础培养基,加入10%体积fbs、终浓度8μg/ml 抗人 cd3抗体、终浓度8μg/ml 抗人cd28抗体;c. 不加cd3和cd28:取rpmi 1640基础培养基,加入10%体积fbs。
70.(3)细胞铺板:raji细胞离心后用分析缓冲液吹打重悬,调整密度为2
×
10
6 个/ml;细胞离心后分别用上述三种分析培养基吹打重悬,调整密度为4
×
10
5 个/ml。两种细胞分别25
µ
l/孔加入到白色不透明细胞培养板中。
71.(4)样品稀释:使用分析缓冲液将样品(前期工艺样品,纯度为93%)以200
µ
g/ml为起始浓度,第二个浓度点2倍梯度稀释,后面8个浓度点分别4倍稀释,共10个浓度点。。
72.(5)加样:对应加入梯度稀释样品,每孔50
µ
l。将细胞板置于二氧化碳培养箱中37℃,5% co2条件下培养16-18h。
73.(6)检测:将已经恢复至室温的bright-glo luciferase assay system,以100μl/孔加入到96孔白细胞培养板中。室温避光孵育3-5min,多功能酶标仪测定各孔荧光强度,采用luminescence模式下,积分时间一般为500-1000ms;以抗体浓度为横坐标,以化学发光值为纵坐标,拟合四参数s形曲线。
74.hek293-fcγrⅱb细胞+ jurkat-ox40-nfκb-luc细胞的检测方法同实施例1,具体如下:(1)分析缓冲液的配制:取rpmi 1640基础培养基,加入10%体积fbs。
75.(2)分析培养基的配制:a.只加cd3:取rpmi 1640基础培养基,加入10%体积fbs、终浓度4μg/ml 抗人 cd3抗体;b.加cd3和cd28:取rpmi 1640基础培养基,加入10%体积fbs、终浓度4μg/ml 抗人cd3抗体、终浓度4μg/ml 抗人cd28抗体;c.不加cd3和cd28:取rpmi 1640基础培养基,加入10%体积fbs。
76.(3)细胞铺板:将hek293-fcγrⅱb细胞消化、离心后用dmem完全培养基重悬,调整密度为5
×
10
5 个/ml,100
ꢀµ
l/孔加入到白色不透明细胞培养板,于二氧化碳培养箱中37℃,5% co2条件下培养5-6h后弃上清,细胞离心后分别用上述三种分析培养基吹打重悬,调整密度为8
×
10
5 个/ml,50
ꢀµ
l/孔加入到上述白色不透明细胞培养板中。
77.(4)样品稀释:使用分析缓冲液将样品(前期工艺样品,纯度为93%)以9
µ
g/ml为起始浓度,3倍稀释,共10个浓度点。
78.(5)加样:对应加入梯度稀释样品,每孔50
ꢀµ
l。将细胞板置于二氧化碳培养箱中37℃,5% co2条件下培养16-18h。
79.(6)检测:将已经恢复至室温的bright-glo luciferase assay system,以100μl/孔加入到96孔白细胞培养板中。室温避光孵育3-5min,多功能酶标仪测定各孔荧光强度,采用luminescence模式下,积分时间一般为500-1000ms;以抗体浓度为横坐标,以化学发光值为纵坐标,拟合四参数s形曲线。
80.结果如表3所示,使用hek293-fcγrⅱb细胞,仅加抗人cd3抗体的信噪比最高,且
使用hek293-fcγrⅱb细胞的信噪比显著高于raji细胞。最后选定hek293-fcγriib和仅加抗人cd3抗体作为检测试剂。
[0081] 实施例3生物活性检测方法的验证1、专属性验证以pdl1/vegf双抗样品、pdl1/ox40空白buffer为对照样品,和pdl1/ox40双抗样品(后期工艺样品,纯度为98.3%)一起进行生物学活性检测,考察优化的方法的专属性。
[0082]
接受标准:pdl1/vegf双抗样品和pdl1/ox40空白buffer应无特异性s型曲线,无量效关系,而pdl1/ox40双抗样品有特异性s型曲线。
[0083]
结果如图1所示,pdl1/vegf双抗样品(组2)和pdl1/ox40空白buffer(组3)无特异性s型曲线,而pdl1/ox40双抗样品(组1)有特异性s型曲线,专属性符合可接受标准。
[0084]
2、准确性验证分别对64%,80%,100%,125%,156%活性效价水平的供试品(后期工艺样品,纯度为98.3%)重复进行细胞活性检测,每个效价水平分别独立测定3次。
[0085]
可接受标准:每个效价水平相对效价测定值的相对偏倚应在
±
20%范围内;每个效价水平的相对效价(回收率)的质量标准范围在70%-130%之间。相对活性(%)=参比品ec
50
/样品ec
50
×
100%。回收率(%)=相对活性测定值/相对活性理论值
×
100%。
[0086]
结果:结果如表4和表5,回收率均在80%-120%范围内,相对偏倚在
±
20%范围内,相对准确度符合可接受标准。
[0087][0087]
3、精密度验证不同检测人员,分别在不同日期对64%,80%,100%,125%,156%活性效价水平的供试品重复进行生物学活性检测,每个效价水平分别独立测定 3 次。
[0088]
可接受标准:以每个效价水平测得的相对效价的几何标准偏差(gsd)或几何变异系数(%gcv)来评价中间精密度。每个效价水平相对效价测定值的几何变异系数(%gcv)不大于20.0。
[0089]
结果如表6所示,几何变异系数(%gcv)不大于 10.0,具有较高的精密度。
[0090]
4、线性验证以效价理论值的对数(横坐标)对其相应的效价测定值的对数(纵坐标)作图,采用最小二乘法进行线性回归。
[0091]
可接受标准:回归方程的斜率应在0.70-1.40范围内;直线回归方程的相关系数应不低于 0.95。
[0092]
结果:效价理论值对数值与测定值对数值的直线回归方程如图2所示,拟合的直线回归方程为y=1.0145x-0.0079,回归方程的斜率为1.0145,相关系数为 0.95。
[0093]
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1