一种局域表面等离子体共振生物传感装置的制作方法
1.本发明涉及生物传感技术领域,特别涉及一种局域表面等离子体共振生物传感装置。
背景技术:
2.表面等离子共振成像(spri)是一种成熟的无标记生物传感技术,具有公认的性能和准确性。现有的spri生物传感器通常采用kretschmann配置设计和制造,该配置由薄金属金膜涂层玻璃棱镜组成,使用后发现存在两大问题,(1)测量方法精度有限,一方面当测量光强变化时其灵敏度并不在共振发生的角度,令其灵敏度下降,另一方面方面如果是测量角度变化又涉及测量转角的精度限制,而测量激光的相位又因共振发生消光效应令信号减弱;(2)成像效果强差人意,现有的spr成像系统一般使用全反射式光路,入射角和反射角的角度都很大,而一般摄像机和光学镜头都是平面成像,成像的景深有限,所以spr成像生物传感器也就最多32个通道,导致生物传感通道的数量受限。
技术实现要素:
3.本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种局域表面等离子体共振生物传感装置,可提高测量精度与成像效果。
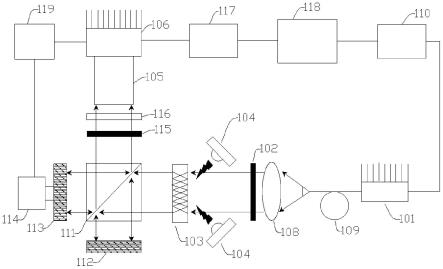
4.根据本发明实施例的一种局域表面等离子体共振生物传感装置,包括:激光源,用于输出探测激光;第一线性偏振器,设置于所述激光源的前方,用于使所述探测激光线性偏振;等离子体微阵列生物芯片,设置于所述第一线性偏振器的前方以接收所述线性偏振后的探测激光,所述等离子体微阵列生物芯片包括透明基底以及设置在所述透明基底中部的光波导阵列和微流体通道,所述光波导阵列的光波导侧表面上具有氮化钛纳米立方体;光热激发组件,用于输出光波并作用于所述等离子体微阵列生物芯片的光波导阵列;光学干涉组件,设置于所述等离子体微阵列生物芯片的前方,用于将所述等离子体微阵列生物芯片透射出的激光生成满足干涉条件的双光束;远心镜头,设置于所述光学干涉组件的输出侧,用于所述双光束的聚焦;成像芯片,设置于所述远心镜头的尾部,用于获取双光束干涉而成的激光散斑图像。
5.根据本发明实施例的局域表面等离子体共振生物传感装置,至少具有如下有益效果:
6.通过采用激光作为激发源,作用于等离子体微阵列生物芯片上的氮化钛纳米立方体,在局部表面等离子体共振时产生表面增强弹性散射,lspr相位得到了放大,同时伴有光热激发组件提高氮化钛纳米立方体附近的局部温度,增强了靶-受体相互作用的特异性,并由光学干涉组件、远心镜头、成像芯片获取双重增强后的激光散斑图像,利用激光散斑对局部折射率变化的敏感性来解析出更为精准的相位。
7.根据本发明的一些实施例,所述激光源与所述第一线性偏振器之间设置有准直单元。
8.根据本发明的一些实施例,所述准直单元为平凸透镜,所述激光源的输出端连接有单模光纤,所述单模光纤的出口位于所述平凸透镜的焦点位置。
9.根据本发明的一些实施例,所述激光源为单模640nm激光二极管,所述单模640nm激光二极管的外壳连接有第一温度传感器和第一热电冷却器,所述第一温度传感器、第一热电冷却器分别与第一温度控制器电性连接。
10.根据本发明的一些实施例,所述光热激发组件为发光二极管。
11.根据本发明的一些实施例,所述光学干涉组件包括分光棱镜、第一反射镜、第二反射镜,所述分光棱镜的入光面正对所述等离子体微阵列生物芯片,所述第一反射镜、第二反射镜分别位于所述分光棱镜的第一干涉端口、第二干涉端口。
12.根据本发明的一些实施例,所述第一反射镜设置于可手动微调距离的活动支架上,所述第二反射镜设置于压电陶瓷移相器上。
13.根据本发明的一些实施例,所述光学干涉组件与所述远心镜头之间设置有第二线性偏振器,所述第二线性偏振器的偏振方向相对所述第一线性偏振器的偏振方向旋转90度。
14.根据本发明的一些实施例,所述远心镜头与所述第二线性偏振器之间设置有窄通激光滤波片。
15.根据本发明的一些实施例,所述成像芯片的外壳连接有第二温度传感器和第二热电冷却器,所述第二温度传感器、第二热电冷却器分别与第二温度控制器电性连接。
16.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
17.下面结合附图和实施例对本发明做进一步的说明,其中:
18.图1为本发明实施例的局域表面等离子体共振生物传感装置原理示意图;
19.图2为本发明实施例的局域表面等离子体共振生物传感装置内部结构示意图;
20.图3为本发明实施例的局域表面等离子体共振生物传感装置外形图;
21.图4a、图4b分别是单模激光二极管在8小时周期内记录的温度波形图、温度变化分布图;
22.图5a、图5b分别是cmos成像芯片在8小时周期内记录的温度波形图、温度变化分布图;
23.图6是感兴趣区域中700*700像素转换为灰度的原始强度图;
24.图7是在充满蒸馏水的感兴趣区域中的700*700像素转换为灰度的相位图;
25.图8是填充有1%氯化钠溶液的感兴趣区域中700*700像素转换为灰度的相位图;
26.图9是选择的像素历史,随着折射率从蒸馏水变为1%nacl溶液,有和没有led光泵浦;
27.图10为选择的像素相位记录,使用光波导阵列监测的生物素(100ug/ml)-链霉亲和素(1nm)生化反应;
28.图11是选择的像素历史记录,在有和没有光泵浦的条件下检测的生物素-链霉亲和素生化(100ug/ml生物素和1nm链霉亲和素)反应;
29.图12是部分嵌入pmma基板中用于fdtd计算的45纳米氮化钛纳米立方体(tinc)的几何模型;
30.图13是45纳米氮化钛纳米立方体(tinc)的远场散射图案和相同的45纳米tinc的远场散射图。
31.附图标号:
32.激光源101、第一线性偏振器102、等离子体微阵列生物芯片103、光热激发组件104、远心镜头105、成像芯片106、亚光黑色阳极氧化铝外壳107、准直单元108、单模光纤109、第一温度控制器110、分光棱镜111、第一反射镜112、第二反射镜113、压电陶瓷移相器114、第二线性偏振器115、窄通激光滤波片116、第二温度控制器117、相性直流电源118、mcu单片机119。
具体实施方式
33.下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
34.在本发明的描述中,需要理解的是,涉及到方位描述,例如上、下等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
35.在本发明的描述中,多个指的是两个以上。如果有描述到第一、第二只是用于区分技术特征为目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量或者隐含指明所指示的技术特征的先后关系。
36.本发明的描述中,除非另有明确的限定,设置、安装、连接等词语应做广义理解,所属技术领域技术人员可以结合技术方案的具体内容合理确定上述词语在本发明中的具体含义。
37.参照图图1、图2所示,为本发明实施例的一种局域表面等离子体共振生物传感装置,包括:激光源101、第一线性偏振器102、等离子体微阵列生物芯片103、光热激发组件104、光学干涉组件、远心镜头105、成像芯片106等主要组成构件。
38.其中,激光源101用于输出探测激光;第一线性偏振器102设置于激光源101的前方,用于使探测激光线性偏振,具体在本实施例中是相对光轴旋转45度;
39.等离子体微阵列生物芯片103设置于第一线性偏振器102的前方以接收线性偏振后的探测激光,等离子体微阵列生物芯片103包括透明基底以及设置在透明基底中部的光波导阵列和微流体通道,光波导阵列的光波导侧表面上具有氮化钛纳米立方体,具体结构示意图参见cn202010931465.4一种局域表面等离子体激元共振生物芯片103、其制造方法、包含其的生物传感系统及其应用,可知使用氮化钛纳米材料代替金材料,不但保证了分辨率同时还显著降低了材料成本,氮化钛可以减少涉及的化学物质的数量,提高了检测精度;
40.光热激发组件104用于输出光波并作用于等离子体微阵列生物芯片103的光波导阵列,可以诱导热等离子体效应,增强了靶-受体相互作用的特异性;
41.光学干涉组件设置于等离子体微阵列生物芯片103的前方,用于将等离子体微阵
列生物芯片103透射出的激光生成满足干涉条件的双光束;远心镜头105,设置于光学干涉组件的输出侧,用于双光束的聚焦;成像芯片106,设置于远心镜头105的尾部,用于获取双光束干涉而成的激光散斑图像。
42.本实施例通过采用激光作为激发源,作用于等离子体微阵列生物芯片103上的氮化钛纳米立方体,在局部表面等离子体共振时产生表面增强弹性散射,lspr相位得到了放大,同时伴有光热激发组件104提高氮化钛纳米立方体附近的局部温度,增强了靶-受体相互作用的特异性,并由光学干涉组件、远心镜头105、成像芯片106获取双重增强后的激光散斑图像,利用激光散斑对局部折射率变化的敏感性来解析出更为精准的相位。
43.由于激光束对自由对流中的空气湍流很敏感,因此,如图3所述,上述组件接安装于亚光黑色阳极氧化铝外壳107中,并在生物传感测量中与环境气流分离,从而提高提高系统的稳定性。
44.如图1、图2所示,在本发明的一些实施例中,激光源101与第一线性偏振器102之间设置有准直单元108,可将发散的激光进行准直处理。
45.具体的,在本发明的一些实施例中,准直单元108为平凸透镜,激光源101的输出端连接有单模光纤109,单模光纤109的纤芯直径为3.5微米,单模光纤109的出口位于平凸透镜的焦点位置,使激光准直成高斯光束进行探测。
46.此外,在本发明的一些实施例中,激光源101为单模640nm激光二极管,光功率180mw,单模640nm激光二极管的外壳连接有第一温度传感器和第一热电冷却器,第一温度传感器、第一热电冷却器分别与第一温度控制器110电性连接,第一温度传感器实时检测单模640nm激光二极管的温度信号,并反馈给第一温度传感器,第一温度传感器通过调节第一热电冷却器的输出功率来控制单模640nm激光二极管的温度,温度稳定在25℃
±
0.001℃,如图4a、图4b所示,分别是单模激光二极管在8小时周期内记录的温度波形图、温度变化分布图,稳定的温度控制便于实现激光输出的光强保持一致。
47.在本发明的一些实施例中,光热激发组件104为发光二极管,如图1所示,本实施中的发光二极管为两个,输出的光波波长为590nm,半高全宽(fwhm)为20nm,总光输出高达1.2w,两个发光二极管分别从等离子体微阵列生物芯片103的两个方向照射,来诱导热等离子体效应,相比直接使用激光发射器的照射优势在于:氮化钛纳米立方体的大小和团聚会影响光热效应的吸收波长,如果使用单一波长的激光就有可能偏离最佳的光热吸收波长,但发光二极管led的辐射波段比较宽,对氮化钛和染料激发的包容度比较好。可以理解的是,光热激发组件104也可以由其他现有宽波段的光源替代。
48.如图1、图2所示,在本发明的一些实施例中,光学干涉组件包括分光棱镜111、第一反射镜112、第二反射镜113,分光棱镜111、第一反射镜112、第二反射镜113构成一个迈克尔逊干涉仪,分光棱镜111的入光面正对等离子体微阵列生物芯片103,第一反射镜112、第二反射镜113分别位于分光棱镜111的第一干涉端口、第二干涉端口,其中,分光棱镜111具有50:50分束器,一半反射、另一半透射,利用带有用于640nm波长的抗反射涂层来实现,第一反射镜112、第二反射镜113的表面平整度为入射波长1/10。需要指出的是,迈克尔逊干涉仪仅作为光学干涉组件的一种实施方式,其他现有能实现相同功能的光学干涉组件也适用于本技术方案。
49.在本发明的一些实施例中,第一反射镜112设置于可手动微调距离的活动支架上,
微调其位置,以后锁定以实现机械稳定性,第二反射镜113设置于压电陶瓷移相器114上,压电陶瓷移相器114(pzt)由一个由16位数模(dac)转换器驱动的高压功率放大器控制,pzt压电陶瓷移相器114的总行程范围为5微米,当激光在迈克尔逊干涉仪中来回传播时,总光程差为10微米的两倍。由16位dac驱动的pzt的理论分辨率为10,000/65,536,约为0.15nm,由于探头波长为640nm,因此弧度分辨率按0.15/640计算,约为1.5x10-3弧度。
50.在本发明的一些实施例中,光学干涉组件与远心镜头105之间设置有第二线性偏振器115,第二线性偏振器115的偏振方向相对第一线性偏振器102的偏振方向旋转90度,这样做是基于等离子体微阵列生物芯片103的透明基底与光波导阵列是pmma聚合物,由pmma聚合物在3d打印上的双折射引起的额外相位延迟,实施交叉偏振器对有助于增强干涉对比度。
51.进一步,在本发明的一些实施例中,远心镜头105与第二线性偏振器115之间设置有窄通激光滤波片116,窄通激光滤波片116为中心波长为在640nm的10nm fwhm带通滤光片,可以阻挡非探测光束进入相机。
52.如图1所示,在本发明的一些实施例中,成像芯片106的外壳连接有第二温度传感器和第二热电冷却器,第二温度传感器、第二热电冷却器分别与第二温度控制器117电性连接,第二温度传感器实时检测cmos成像芯片106的温度信号,并反馈给第二温度控制器117,第二温度控制器117通过调节第二热电冷却器的输出功率来控制cmos成像芯片106的温度,温度稳定在20摄氏度,标准偏差小于0.001摄氏度,持续8小时,参见图5a、图5b分别是cmos成像芯片106在8小时周期内记录的温度波形图、温度变化分布图。需要说明的是,cmos成像芯片106的温度在运行过程中会迅速升高,我们发现最大温差达到10摄氏度,室温为25摄氏度。这种温度增量会引起cmos芯片的热机械变形,并且由于我们的理论分辨率在此范围内,因此cmos芯片必须进行热稳定以达到最佳稳定性。cmos芯片记录了在探测激光束照射下装饰在pmma波导上的氮化钛纳米粒子的弹性散射,弹性散射的激光经过光学干涉组件、远心镜头105后,在成像芯片106的图像平面上产生激光散斑,并由cmos相机数字化。由于我们是通过tinc测量等离子体增强弹性散射的相变,因此该测量与具有薄金属金膜的传统spri生物传感器观察到的衰减全反射完全不同,通过fdtd运算表明氮化钛纳米方体在蛋白质壳和偶极子的共同作用下会发生明显的表面增强弹性散射(sees)效果。
53.此外,本技术方案还配套设置有相性直流电源118和mcu单片机119,相性直流电源118分别为与第一温度控制器110、第二温度控制器117提供工作电压,mcu单片机119一方面用于解析cmos成像芯片106的激光散斑信号,mcu单片机119采用移相算法实时解析激光散斑图像的相位,另一方面还用于控制压电陶瓷移相器114(pzt)的工作。
54.接下来,为本技术方案的部分测试过程与发现,在测试前,需要通过蠕动泵往等离子体微阵列生物芯片103上的微流体通道输送待测试的溶液。
55.图6是等离子体微阵列生物芯片103上感兴趣区域中700*700像素转换为灰度的原始强度图,感兴趣区域(roi)为3平方毫米,光波导位于每个直径为500um的圆的中心,等离子体微阵列生物芯片103的roi中共有4*4个光波导。
56.当生物芯片103充满蒸馏水时,roi的相位图如图7所示;
57.当生物芯片103充满1%氯化钠(nacl)溶液时,roi的相位图如图8所示;
58.为了进一步证明光热激发组件104(泵浦探针)的放大效果,将浓度为1%nacl溶液
注入生物芯片103的微流体通道,并打开两个590nm高功率led发射器以产生光热放大,具有和不具有led发射的选定像素历史如图9所示。经计算,1%nacl溶液引起的最大相变为0.78弧度,由于1%nacl溶液在20摄氏度时的折射率约为n=1.33172+1.4
×
10-3
×
1,即1.33312。蒸馏水的折射率在20摄氏度时约为1.33300,折射率变化为1.2
×
10-4
折射率单位(riu)。由于测得的最大相位变化为0.78弧度,理论相位分辨率为1.5
×
10-3弧度。我们的局域表面等离子体共振生物传感装置的理论折射率分辨率(rir)估计为1.9
×
10-7riu,与传统的spri成像生物传感器一样好。
59.对于生物传感应用,以上展示了生物素-链霉亲和素相互作用的性能,生物素-链霉亲和素相互作用被称为自然界中最强的非共价相互作用之一,它是验证我们新型生物传感器的生物传感性能的理想对象。此外,已知生物素通过钛-氧键合对氮化钛200(tin200)表面具有高亲和力。因此,预计我们的局域表面等离子体共振生物传感装置将通过测量再现生物素-链霉亲和素结合动力学。roi中的选定像素的历史显示在图10,使用光波导阵列监测的生物素(100ug/ml)-链霉亲和素(1nm)生化反应;首先,将磷酸盐缓冲盐水(pbs)以10ul/min的流速注入生物芯片103中(数据未显示)。然后以相同的速率将pbs缓冲液中的100ug/ml生物素溶液注入生物芯片103中(如箭头1所示)。8分钟后,再次以相同流速注入pbs缓冲液以冲走任何未吸收的生物素分子(如箭头2所示)。然后,pbs缓冲液中的1nm链霉亲和素以相同的速率流入生物素功能化的生物芯片103(如箭头3所示)。4分钟后,停止蠕动泵,两个发光二极管led完全打开(如箭头4所示),链霉亲和素与氮化钛纳米立方体上的生物素反应。12分钟后,led熄灭(如箭头5所示)。再次注入pbs缓冲液以冲洗未结合的链霉亲和素(如箭头6所示)。相变由局域表面等离子体共振生物传感装置测量,分别为具有和不具有led放大功能,如图11所示。由于1nm链霉亲和素在led泵浦下产生约0.25弧度变化。假设局域表面等离子体共振生物传感装置的相位分辨率为1.5
×
10-3弧度,局域表面等离子体共振生物传感装置对生物素-链霉亲和素的理论检测限估计为6pm,这优于现有32通道spri生物传感器的规格,检测限为10pm。
60.综合以上实验结果,可以确信激光散斑成像结合光学干涉相位测量是无标记lspr生物传感的有效途径。
61.为了进一步了解tinc的lspr产生的激光散斑的起源,如图12所示,为本实施例的氮化钛纳米立方体的模型,它由一个尺寸为45nm的tin纳米立方体组成,部分嵌入pmma基板中。tin纳米立方体上方的折射率定义为水的1.3330。探测激光束在y方向偏振,整个模型的尺寸为0.8x0.8x0.8微米(即xyz方向上的800nm),空间分辨率为2nm,模拟运行时间配置为640nm入射波长的100个周期,这样做是为了确保离散傅里叶变换(dft)监视器收集足够的周期用于现场数据处理。近远场转换是基于以下步骤计算的,(1)近表面被定义为监控器以捕获所需方向的出射辐射,(2)使用脉冲源运行模拟以允许meep包在监视器上累积dft场,(3)任何所需点的远场散射强度和相位由meep包计算。
62.45nmtinc在0.45mm距离处的远场散射强度如图13为带有圆形标记的细曲线。由于tinc的存在,640nm入射波的波前发生了畸变。在垂直于xy平面的z方向上,60度和120度方向的坡印廷矢量小于90度的坡印廷矢量。因此,强度波动是预期的,因为每个区域的定向能量通量不同,这是实验中观察到的激光散斑的根本原因,如图6所示。
63.为了更清楚的了解tinc上发生的生化相互作用如何改变激光散斑,本实施例在测
试时特意将纳米立方体几何结构上方的材料更改为蛋白质(n=1.5500),并重新计算了相同距离处的远场散射强度,如图13中的实线曲线所示。7.10,000个偶极子靠近tinc放置。很明显,在存在蛋白质壳和偶极子的情况下,tinc的远场散射模式与前一种情况有很大不同。对于90度附近垂直方向的测量,坡印廷矢量强度从0.65变为0.50,降低了20%以上。这是记录强度的显著变化,光学相位测量的变化也是如此。因此,通过fdtd计算,在640nm入射波长处的弹性散射因近场偶极子泵向45nmtinc的存在而增强。
64.从而可以得出,(1)观察到的远场激光散斑是由于tinc结构的局部表面等离子体共振产生的表面增强弹性散射(sees)。
65.(2)远场激光散斑对纳米表面发生的折射率变化很敏感,因此伴随的激光散斑相变可有效测量近场偶极子泵浦在氮化钛纳米立方体上发生的近场生化反应。
66.同样重要的是要说明生物芯片上有多个tinc,因此观察到的散射是多个tinc的组合。因此,每个相机像素的初始相位是随机的,并且观察到激光散斑,并且只能通过算法从多个帧中检索像素级相位值。
67.上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1