一种扶芳参芪口服液HPLC-UV指纹图谱测定方法及测得的指纹图谱
一种扶芳参芪口服液hplc-uv指纹图谱测定方法及测得的指纹图谱
技术领域
1.本发明涉及分析检测技术领域,具体涉及一种扶芳参芪口服液hplc-uv指纹 图谱测定方法及测得的指纹图谱。
背景技术:
2.扶芳参芪口服液是广西中医药大学的名老中医黄英儒教授献方,由广西中医 药大学制药厂独家研发生产的otc中成药,连续3版《中国药典》收录品种,具 有益气补血,健脾养心等功效,临床上用于治疗气血不足,心脾两虚引起的神疲 乏力,少言懒语,头昏眼花,津伤口渴及失眠等症。该制剂为黄芪、扶芳藤和人 参三味药材制备而成的复方制剂。目前扶芳参芪口服液的质量控制方法除了原标 准对人参和扶芳藤的薄层鉴别及运用薄层色谱扫描法对黄芪甲苷成分的含量测 定外,文献报道的也大多是通过hplc-elsd法对该制剂中皂苷类成分的含量测定, 对制剂中黄芪、扶芳藤中其它成分的研究和报道较少。复方制剂成分复杂,仅通 过对制剂中皂苷类成分的测定来控制其制剂质量的方法未达到制剂质量控制的 目的[6]。扶芳参芪口服液毒副作用小,安全性高。产品产销30年来,因生产工 艺成熟,质量稳定,疗效确切,不良反应极少而被临床广泛应用,需要更加全面 控制扶芳参芪口服液的质量。
[0003]
因此,本发明用hplc-uv指纹图谱方法研究扶芳参芪口服液,为其质量控制 提供了更全面的信息。
技术实现要素:
[0004]
本发明的目的在于提出一种扶芳参芪口服液hplc-uv指纹图谱测定方法及测 得的指纹图谱,采用hplc-uv法建立了扶芳参芪口服液定性指纹图谱的测定方法, 为扶芳参芪口服液的质量控制提供新的实验依据。
[0005]
本发明的技术方案是这样实现的:
[0006]
本发明提供一种扶芳参芪口服液hplc-uv指纹图谱测定方法,采用hplc-uv 测定扶芳参芪口服液的指纹图谱,共生成12个共有特征峰,从左至右依次编号, 第6号峰为毛蕊异黄酮葡萄糖苷。
[0007]
作为本发明的进一步改进,包括以下步骤:
[0008]
s1.供试品溶液的制备:精密量取扶芳参芪口服液,置分液漏斗中,加入水 饱和正丁醇,振摇萃取,合并水饱和正丁醇液并完全转移至另一锥形瓶中,加入 氨试剂超声,水浴蒸干,残渣加甲醇适量使溶解,移至容量瓶中,加甲醇至刻度, 摇匀,离心,过滤,取续滤液,即得;
[0009]
s2.色谱条件:采用c18色谱柱;流动相a相为乙腈,b相为0.1-0.3% 的磷酸溶液,采用梯度洗脱,检测波长:250-270nm;进样量2-5μl;柱温20-30℃; 流速0.5-1.5ml/min;
[0010]
s3.分别精密吸取对照品溶液和供试品溶液,注入高效液相色谱仪,按照步 骤s2所述色谱条件测定,即得。
[0011]
作为本发明的进一步改进,步骤s1中所述萃取次数为3次。
[0012]
作为本发明的进一步改进,所述扶芳参芪口服液与水饱和正丁醇三次的萃取 液的体积比为15∶15-25∶15-25∶5-15。
[0013]
作为本发明的进一步改进,步骤s1中所述氨试剂为浓氨水溶液,浓度为 25-28wt%。
[0014]
作为本发明的进一步改进,步骤s2中所述色谱柱的规格为250mm
×
4.6mm, 粒径为5μm。
[0015]
作为本发明的进一步改进,步骤s2中所述色谱条件为采用c18色 谱柱;流动相a相为乙腈,b相为0.2%的磷酸溶液,检测波长:254nm;进样量 5μl;柱温25℃;流速1ml/min。
[0016]
作为本发明的进一步改进,步骤s2中所述梯度洗脱条件为:
[0017]
时间/min乙腈/%0.2%磷酸/%01585101585201882303070505050
[0018]
本发明进一步保护一种上述扶芳参芪口服液hplc-uv指纹图谱测定方法测得 的扶芳参芪口服液hplc-uv指纹图谱。
[0019]
作为本发明的进一步改进,共生成12个共有特征峰,从左至右依次编号, 第6号峰为毛蕊异黄酮葡萄糖苷。
[0020]
本发明具有如下有益效果:本发明以扶芳参芪口服液为研究对象,采用 hplc-uv法对扶芳参芪口服液进行定性指纹图谱研究,为扶芳参芪口服液的全面 质量控制提供方法和依据,采用流动相:乙腈-磷酸(0.2%);采用梯度洗脱的方 法;柱温:25℃;波长:254nm;分析时间50min;sunfirec18色谱柱(250mm
×ꢀ
4.6mm,5μm);进样量5μl,流速1min/ml。
[0021]
通过应用hplc-uv法对11批扶芳参芪口服液进行指纹图谱测定,以毛蕊异 黄酮葡萄糖苷的色谱峰为参照峰,建立了扶芳参芪口服液的指纹图谱共有模式。 通过对11批扶芳参芪口服液指纹图谱进行分析,共生成12个共有峰;将各味药 材图谱、样品图谱进行对比,确定了各共有峰的归属。对11个批次的扶芳参芪 口服液的指纹图谱的数据进行处理分析,结果显示11批次样品的指纹图谱的相 似度均在0.9以上。本发明采用hplc-uv法建立了扶芳参芪口服液定性指纹图谱 的测定方法,为扶芳参芪口服液的质量控制提供新的实验依据。
附图说明
[0022]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例 或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的 附图仅仅是
本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造 性劳动性的前提下,还可以根据这些附图获得其他的附图。
[0023]
图1为水饱和正丁醇萃取hplc色谱图;
[0024]
图2为乙酸乙酯萃取hplc色谱图;
[0025]
图3为水饱和正丁醇萃取1次hplc色谱图;
[0026]
图4为水饱和正丁醇萃取2次hplc色谱图;
[0027]
图5为水饱和正丁醇萃取3次hplc色谱图;
[0028]
图6为流动相体系为甲醇-水体系的hplc色谱图;
[0029]
图7为流动相体系为甲醇-0.1%磷酸水溶液体系的hplc色谱图;
[0030]
图8为流动相体系为甲醇-0.2%磷酸水溶液体系的hplc色谱图;
[0031]
图9为流动相体系为乙腈-水体系的hplc色谱图;
[0032]
图10为流动相体系为乙腈-0.1%磷酸水溶液体系的hplc色谱图;
[0033]
图11为流动相体系为乙腈-0.2%磷酸水溶液体系的hplc色谱图;
[0034]
图12为柱温为25℃下的色谱图;
[0035]
图13为柱温为30℃下的色谱图;
[0036]
图14为柱温35℃下的色谱图;
[0037]
图15为zorbax sb-aq(4.6
×
250mm 5-micron)柱hplc色谱图;
[0038]
图16为zorbax sb-c18(4.6
×
250mm 5-micron)柱hplc色谱图;
[0039]
图17为c18(4.6
×
250mm 5μm)柱hplc色谱图;
[0040]
图18为流速0.8ml/min下的色谱图;
[0041]
图19为流速1ml/min下的色谱图;
[0042]
图20为流速1.2ml/min下的色谱图;
[0043]
图21为扶芳参芪口服液3d图谱;
[0044]
图22为254nm波长hplc色谱图;
[0045]
图23为254nm波长hplc色谱图;
[0046]
图24为280nm波长hplc色谱图;
[0047]
图25为310nm波长hplc色谱图;
[0048]
图26为360nm波长hplc色谱图;
[0049]
图27为扶芳参芪口服液hplc色谱图;
[0050]
图28为精密度1号hplc色谱图;
[0051]
图29为精密度2号hplc色谱图;
[0052]
图30为精密度3号hplc色谱图;
[0053]
图31为精密度4号hplc色谱图;
[0054]
图32为精密度5号hplc色谱图;
[0055]
图33为精密度6号hplc色谱图;
[0056]
图34为稳定性0h hplc色谱图;
[0057]
图35为稳定性2h hplc色谱图;
[0058]
图36为稳定性4h hplc色谱图;
[0059]
图37为稳定性8h hplc色谱图;
[0060]
图38为稳定性12h hplc色谱图;
[0061]
图39为稳定性24h hplc色谱图;
[0062]
图40为重复性1号hplc色谱图;
[0063]
图41为重复性2号hplc色谱图;
[0064]
图42为重复性3号hplc色谱图;
[0065]
图43为重复性4号hplc色谱图;
[0066]
图44为重复性5号hplc色谱图;
[0067]
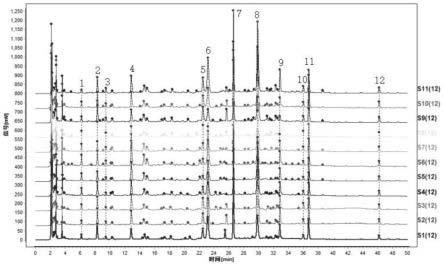
图45为重复性6号hplc色谱图;
[0068]
图46为11批扶芳参芪口服液hplc指纹图谱叠加图;
[0069]
图47为扶芳参芪口服液hplc指纹图谱共有模式;
[0070]
图48为空白溶剂hplc指纹图谱;
[0071]
图49为毛蕊异黄酮葡萄糖苷色谱图;
[0072]
图50为扶芳参芪口服液色谱图;
[0073]
图51为样品与对照品毛蕊异黄酮葡萄糖苷重叠图;
[0074]
图52为扶芳参芪口服液供试品hplc色谱图;
[0075]
图53为扶芳藤药材供试品hplc色谱图;
[0076]
图54为黄芪药材供试品hplc色谱图;
[0077]
图55为人参药材供试品hplc色谱图。
具体实施方式
[0078]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述 的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实 施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施 例,都属于本发明保护的范围。
[0079]
本发明实施例所用的仪器如表1:
[0080]
表1
[0081]
[0082][0083]
本发明实施例所用的材料如下:
[0084]
人参为五加科植物人参panax g inseng c.a.m ey.的栽培品的干燥根;黄 芪为豆科植物蒙古黄芪astragalus membranaceus(fisch.) bge.var.mongholicus(bge.)hsiao或膜荚黄芪astragalus membranaceus (fisch.)bge.的干燥根;扶芳藤为卫矛科植物扶芳藤euonymus fortunei(tufcz.)hand-m azz.的干燥茎、叶,均由广西中医学院制药厂提供。扶芳参芪口 服液各批号成品为广西中医学院制药厂提供,见表2。
[0085]
表2
[0086][0087][0088]
实施例1
[0089]
本实施例提供一种扶芳参芪口服液hplc-uv指纹图谱测定方法,包括以下步 骤:
[0090]
s1.供试品溶液的制备:精密量取扶芳参芪口服液15ml,置分液漏斗中,分 别加入
水饱和正丁醇20ml、20ml、10ml,振摇萃取3次,合并水饱和正丁醇 液并完全转移至另一锥形瓶中,加入1ml氨试剂超声5min,水浴蒸干,残渣加 甲醇适量使溶解,移至5ml容量瓶中,加甲醇至刻度,摇匀,离心,用0.45μm 微孔滤膜滤过,取续滤液,即得;
[0091]
s2.色谱条件:采用c18色谱柱(250mm
×
4.6mm,粒径为5μm); 流动相a相为乙腈,b相为0.2%的磷酸溶液,检测波长:254nm;进样量5μl; 柱温25℃;流速1ml/min;
[0092]
所述梯度洗脱条件为:
[0093]
时间/min乙腈/%0.2%磷酸/%01585101585201882303070505050
[0094]
s3.分别精密吸取对照品溶液和供试品溶液,注入高效液相色谱仪,按照步 骤s2所述色谱条件测定,即得。
[0095]
实施例2提取方法考察
[0096]
精密量取扶芳参芪口服液15ml(批号20190701)3份,加入50ml水饱和 正丁醇,分别采用萃取,超声,回流三种提取方法进行提取,提取时间30min。 分别加入1ml氨试液超声5min,水浴蒸干,残渣加甲醇适量使溶解,转移至5 ml容量瓶中,加甲醇至刻度,摇匀,离心,用0.45μm微孔滤膜滤过,取续滤液, 既得。
[0097]
分别精密吸取3份供试品溶液5μl,注入高效液相色谱仪测定,记录其峰面 积。
[0098]
实验结果显示:供试品为口服液,含糖量较多,超声和回流法无法准确定量, 因此本发明采用萃取法。
[0099]
实施例3提取溶剂考察
[0100]
精密量取扶芳参芪口服液15ml(批号20190701)2份,置于分液漏斗中, 分别加入乙酸乙酯、水饱和正丁醇50ml进行萃取,将上层溶液完全转移至另一 锥形瓶中,分别加入1ml氨试液超声5min,水浴蒸干,残渣加甲醇适量使溶解, 转移至5ml容量瓶中,加甲醇至刻度,摇匀,离心,用0.45μm微孔滤膜滤过, 取续滤液,即得。
[0101]
分别精密吸取2份供试品溶液5μl,注入高效液相色谱仪测定,记录其峰面 积。结果见图1,图2。
[0102]
由图1,图2表明,当提取溶剂为水饱和正丁醇时,扶芳参芪口服液的出峰 较多、色谱峰峰高更高,故选用水饱和正丁醇萃取。
[0103]
实施例4萃取次数考察
[0104]
精密量取扶芳参芪口服液15ml(批号20190701)3份,第一份置于分液漏 斗中,加入50ml水饱和正丁醇萃取1次;第二份分别加入25ml、25ml水饱 和正丁醇于分液漏斗中共萃取2次;第三份分别加入20ml、20ml、10ml水饱 和正丁醇于分液漏斗中共萃取3次,将上层溶液完全转移至另一锥形瓶中,三份 试样分别加入1ml氨试液超声5min,水浴蒸干,残渣加甲醇适量使溶解,转移 至5ml容量瓶中,加甲醇至刻度,摇匀,离心,用0.45μm微孔滤膜滤过,取 续滤液,即得。
[0105]
分别精密吸取制得供试品溶液5μl,注入高效液相色谱仪测定,记录其峰面 积。结
果见图3,图4,图5,表3。
[0106]
表3
[0107][0108]
实验结果表明,当水饱和正丁醇提取次数为3次时,各色谱峰的峰面积均比 提取次数为1次、2次较高,故确定水饱和正丁醇萃取次数为3次。
[0109]
实施例5色谱条件的确定
[0110]
1、流动相选择
[0111]
本发明考察了甲醇-水体系、甲醇-磷酸水溶液(0.1%、0.2%)体系、乙腈
ꢀ‑
水体系、乙腈-磷酸水溶液(0.1%、0.2%)体系,结果得到乙腈-0.2%磷酸水 溶液体系可使各目标成分达到较好的分离,得到的色谱图峰形较好,故选择乙腈
ꢀ‑
0.2%磷酸水溶液体系进行分析。结果见图6-11。
[0112]
2、柱温的考察
[0113]
本发明考察了25℃、30℃、35℃不同柱温下的色谱图,结果表明25℃ 时目标色谱峰分离度较好,峰形尖锐,故选择柱温为25℃。结果见图12-14。
[0114]
3、色谱柱的选择
[0115]
本发明分别考察了在相同色谱条件下,不同色谱柱的分离效果。选用色谱柱 为(1)zorbax sb-aq(4.6
×
250mm5-micron),(2)zorbax sb-c18(4.6
×ꢀ
250mm 5-micron),(3)c18(4.6
×
250mm 5μm),在同一色谱条件下, 对同一供试品溶液进行分析。结果显示使用c18(4.6
×
250mm 5μm) 柱各成分的分离度、峰形都较好,故选择c18柱。结果见图15-17。
[0116]
4、不同流速的考察
[0117]
本发明考察了0.8ml/min、1.0ml/min和1.2ml/min不同流速下的色谱图, 结果表明1.0ml/min流速下的色谱峰分离度、得到的峰形较好,故选择流速为 1.0ml/min。结果见图18-20。
[0118]
5、波长的考察
[0119]
本发明采用hplc-uv指纹图谱方法研究扶芳参芪口服液中非皂苷类成分,这 些成分主要来自扶芳藤药材。经采用dad检测器进行全波长扫描,得到扶芳参芪 口服液的3d图谱,其3d图谱见图21,且选择5个波长进行进一步的详细比较, 其色谱图见图22-26。不同波长下的色谱图比较得,在254nm下扶芳参芪口服液 中扶芳藤药材对应的成分出峰较多,且紫外吸收较好,因此确定波长为254nm
[0120]
综上所述,确定本发明色谱条件为:采用c18色谱柱(250mm
×
4.6 mm,5μm);流动相乙腈(a)-0.2%磷酸(b),检测波长:254nm;进样量5μl; 柱温25℃;流速1ml/min。为提高指纹图谱的分离度和峰形,对流动相梯度进 行调整,最终确定洗脱梯度见表4。
[0121]
表4梯度洗脱流动相比例
[0122]
时间/min乙腈/%0.2%磷酸/%01585101585201882303070505050
[0123]
实施例6精密度试验
[0124]
精密量取扶芳参芪口服液(批号20190701),按照实施例1中步骤s1的方法 制备供试品溶液,在步骤s2中的色谱条件下,连续进样6次,测定hplc色谱图, 分别记录精密性1-6号,以6号峰(毛蕊异黄酮葡萄糖苷)的保留时间和色谱峰 面积为参照,记录共有峰的保留时间和峰面积,计算得到除毛蕊异黄酮葡萄糖苷 外11个共有峰的相对保留时间rsd在0.08%-0.11%之间,相对峰面积rsd在 0.13%-1.21%之间,结果表明仪器精密度较好,并符合指纹图谱测定的相关要求 和规定。结果见图28-33、表5、表6。
[0125]
表5共有峰精密度实验-相对保留时间(n=6)
[0126][0127][0128]
表6共有峰精密度实验-相对峰面积(n=6)
[0129]
峰数123456rsd%10.05350.05310.05330.05360.05320.05300.4320.25430.25350.25200.25420.24850.24721.2130.07470.07310.07340.07460.07520.07511.19
40.33410.33380.33440.33510.33440.33560.2050.30150.29980.29990.30030.29870.30260.4661.00001.00001.00001.00001.00001.00000.0071.15671.15391.15721.15841.15551.15670.1381.70711.70921.70311.70651.70441.70530.1390.32940.32810.32830.32900.32890.32850.14100.09960.09870.09860.09810.09840.09910.54110.05350.05310.05330.05360.05320.05300.43120.25430.25350.25200.25420.24850.24721.21
[0130]
实施例7稳定性试验
[0131]
精密量取扶芳参芪口服液(批号20190701)15ml,按照实施例1中步骤s1 的方法制备供试品溶液,在步骤s2中的色谱条件下,分别在0h、2h、4h、8h、 12h、24h测定,分别记录稳定性1-6号,以9号峰(毛蕊异黄酮葡萄糖苷)的 保留时间和色谱峰面积为参照,记录共有峰保留时间及峰面积,计算得到除毛蕊 异黄酮葡萄糖苷外11个共有峰的相对保留时间rsd在0.36%-1.91%之间,相对峰 面积rsd在0.52%-2.97%之间,结果表明扶芳参芪口服液在24h内稳定,符合指 纹图谱测定的相关要求和规定。见图34-39,表7-8。
[0132]
表7共有峰稳定性实验-相对保留时间(n=6)
[0133][0134][0135]
表8共有峰稳定性实验-相对峰面积(n=6)
[0136]
峰数0h2h4h8h12h24hrsd%10.05300.05480.05490.05540.05530.05491.61
20.24070.24130.24200.24020.23930.23860.5230.07870.07900.08100.07980.07930.07881.1140.33060.33550.33750.33170.33080.33170.8550.29540.29670.29410.29230.29800.29550.6661.00001.00001.00001.00001.00001.00000.0071.16141.15781.19321.15781.15771.15711.2381.61991.63121.72981.66181.70001.67072.4890.34140.33910.34200.32980.33560.33481.37100.10060.10040.10030.09480.09930.09952.22110.39770.39770.39610.38330.39020.39381.42120.11080.11290.11020.10430.10570.10832.97
[0137]
实施例8重复性试验
[0138]
精密量取扶芳参芪口服液(批号20190701)6份,各约15ml,按照实施例 1中步骤s1的方法制备供试品溶液,在步骤s2中的色谱条件下,以6号峰(毛 蕊异黄酮葡萄糖苷)的保留时间和色谱峰面积为参照,记录共有峰保留时间及峰 面积,计算得到除毛蕊异黄酮葡萄糖苷外11个共有峰的相对保留时间rsd在 0.01%-0.07%之间,相对峰面积rsd在0.05%-1.10%之间,结果表明该方法重复性 良好,符合指纹图谱的要求。图40-45,表9-10。
[0139]
表9共有峰重复性性实验-相对保留时间(n=6)
[0140]
峰数123456rsd%10.26620.26650.26640.26650.26650.26650.0420.35910.35960.35940.35970.35980.35970.0730.40880.40910.40910.40930.40920.40880.0440.55660.55690.55690.55730.55740.55740.0650.97060.97050.97070.97070.97060.97060.0161.00001.00001.00001.00001.00001.00000.0071.14571.14581.14591.14591.14611.14630.0281.28511.28511.28541.28561.28591.28610.0391.41281.41301.41311.41301.41341.41370.02101.54881.54891.54911.54921.54961.55010.03111.57921.57941.57951.57951.57991.58030.03121.98721.98791.98841.98851.98911.98950.04
[0141]
表10共有峰重复性实验-相对峰面积(n=6)
[0142][0143][0144]
实施例9
[0145]
1、扶芳参芪口服液指纹图谱测定
[0146]
精密量取11批扶芳参芪口服液各15ml,按照实施例1中步骤s1的方法制 备供试品溶液,在步骤s2中的色谱条件下,记录各样品的色谱图。
[0147]
2、扶芳参芪口服液指纹图谱的建立
[0148]
以测定的11批扶芳参芪口服液样品的hplc色谱图为基础,采用《中药色谱 指纹图谱相似度评价》(2012.130723版)对测得的各样品指纹图谱进行分析,结 果见图46。建立扶芳参芪口服液的hplc指纹图谱共有模式,共生成12个共有特 征峰,结果见图47。其中6号峰分离度较好,色谱响应值较高,保留时间适宜, 故选择其为参照峰。
[0149]
3、空白试验
[0150]
在实施例1步骤s2中的色谱条件下,精密量取甲醇5μl,注入高效液相色 谱中,结果表明,试剂对样品无杂质干扰。(见图48)。
[0151]
4、对照品hplc图谱测定及特征峰归属分析
[0152]
精密量取毛蕊异黄酮葡萄糖苷对照品溶液,在实施例1步骤s2中的色谱条 件测定分析并记录色谱图,并与样品指纹图谱中共有峰进行对比,结果显示指纹 图谱共有模式中6号特征峰的保留时间与毛蕊异黄酮葡萄糖苷对照品的保留时间 一致,因此确认扶芳参芪口服液图谱的6号峰为毛蕊异黄酮葡萄糖苷。结果见图 49-51。
[0153]
5、主要药材hplc图谱测定及特征峰归属
[0154]
分别取黄芪、扶芳藤药材适量,均按工艺提取,按照实施例1中步骤s1的 方法制备供试品溶液,记录各样品的色谱图。将主要药材指纹图谱与对照图谱进 行对比,对扶芳参
芪口服液指纹图谱中共有峰进行药材归属,确认指纹图谱1、4、 6、9、11、12号峰是黄芪药材成分,2、3、4、5、7、10号峰是扶芳藤药材成分, 4、11号峰是人参药材成分。结果见图52-55。
[0155]
6、共有峰分析
[0156]
通过对11批样品色谱图进行分析,选择重复性好,特征明显的色谱峰为共 有峰,共标出12个共有峰,在样品图谱中选择峰面积相对较大,保留时间居中 且稳定性好的6号峰(毛蕊异黄酮葡萄糖苷)为参照峰,分别计算得到除毛蕊异 黄酮葡萄糖苷外其余11个峰的相对峰面积和相对保留时间。11批样品的相对保 留时间的rsd均小于0.77%,符合相关规定,相对峰面积的rsd最小为23.87%、 最大为62.92%,这可能与制剂的原药材产地不同或者制剂生产过程中产生的差异 有关。详细结果见表11-12。
[0157]
表11相对峰面积
[0158][0159][0160]
表12相对保留时间
[0161]
编号12345678910111210.2650.3550.4050.5470.9701.0001.1401.2771.4011.5351.5661.97120.2670.3590.4080.5560.9711.0001.1471.2861.4141.5501.5801.99030.2690.3610.4110.5580.9701.0001.1521.2921.4451.5821.6112.00240.2660.3570.4070.5640.9671.0001.1521.2951.4271.5641.5962.01150.2660.3580.4080.5560.9691.0001.1461.2871.4151.5501.5821.99160.2680.3600.4090.5560.9701.0001.1451.2861.4121.5471.5781.98770.2670.3580.4080.5550.9711.0001.1471.2861.4151.5501.5811.99180.2680.3590.4090.5570.9721.0001.1481.2881.4151.5561.5851.99290.2670.3590.4090.5570.9721.0001.1471.2871.4161.5511.5821.993100.2680.3600.4090.5560.9731.0001.1521.2911.4181.5541.5851.995110.2660.3590.4090.5570.9681.0001.1471.2881.4161.5521.5831.994rsd0.440.450.370.700.180.000.310.350.770.750.710.49
[0162]
7、相似度分析
[0163]
根据《中药色谱指纹图谱相似度评价》(2012.130723版)对11批次扶芳参 芪口服液的指纹图谱在检测数据进行处理计算,结果显示,11个批次扶芳参芪口 服液的相似度均在0.9以上,相似性良好,符合指纹图谱的分析要求。结果见表 13-14。
[0164]
表13扶芳参芪口服液相似度计算原始数据表
[0165][0166]
表14 11批扶芳参芪口服液相似度评价结果
[0167]
样品相似度样品相似度201709010.954201801040.989201709040.995201801050.913201710010.997201902010.962201711030.994201903030.986201801010.971201907010.989201801020.947
ꢀꢀ
[0168]
本发明通过对提取方法(超声法、回流法、萃取法)、提取溶剂(乙酸乙酯、 水饱和正丁醇)、提取次数(1、2、3)等的考察,选择最合适的提取方法。最终 确定采用最佳的提取方法为萃取法、提取溶剂为水饱和正丁醇、提取次数为3次。 通过对不同流动相体系(甲醇-水体系、甲醇-磷酸水溶液(0.1%、0.2%)体系、 乙腈-水体系、乙腈-磷酸水溶液(0.1%、0.2%)体系);不同柱温(25℃、30℃、 35℃);不同色谱柱((1)zorbax sb-aq(4.6
×
250mm 5-micron)、(2)zorbaxsb-c18(4.6
×
250mm 5-micron)、(3)c18(4.6
×
250mm 5μm)); 不同流速(0.8ml/min、1.0ml/min、1.2ml/min)等的考察,最终确定色谱条 件为乙腈-0.2%磷酸水溶液体系、柱温25℃,c18色谱柱,流速1ml/min。 经采用dad检测器进行扫描,在254nm下扶芳参芪口服液中扶芳藤药材对应的成 分出峰较多,紫外吸收较好,因此波长选取254nm。
[0169]
本发明经过方法学考察验证结果显示,精密度、重复性、稳定性良好,均符 合指纹图谱测定的相关要求和规定。最后建立了扶芳参芪口服液hplc指纹图谱 的共有模式图谱,通过对照品和相关药材,确定了12个共有峰,其中1、4、6、 9、11、12号峰是黄芪药材成分,2、3、4、5、7、10号峰是扶芳藤药材成分,4、 11号峰是人参药材成分,但目前仅确定6号峰的化学成分为毛蕊异黄酮葡萄糖 苷,其它共有峰的化学成分有待进一步研究。11批扶芳参芪口服液的12个共有 峰相对保留时间较为稳定,但不同批次的相对峰面积差异过大,可能与制
剂中药 材产地不同或者在加工生产过程中造成的差异有关。
[0170]
关于扶芳参芪口服液质量控制研究主要集中在皂苷类成分,这些皂苷类成分 主要来自处方中的黄芪和人参两味药材;而有关扶芳参芪口服液中扶芳藤药材的 特征成分研究报道很少。本发明尝试用hplc-uv指纹图谱方法研究扶芳参芪口服 液中非皂苷类成分,选用了11个不同批次的扶芳参芪口服液确定了12个共有峰, 其中有6个特征峰归属于扶芳藤药材。建立的指纹图谱相似度高于0.9,该方法 准确可靠,可为建立更全面的扶芳参芪口服液质量控制方法提供参考。但由于时 间有限,本发明仅建立了扶芳参芪口服液指纹图谱测定方法,并通过与药材图谱 进行比对确定了共有峰的归属药材,但目前只确定了一个共有峰的化学成分,其 它共有峰的化学成分,有待进一步研究。
[0171]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明 的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的 保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1