基于生物芯片的小分子多联检试剂盒及其制备方法、检测方法与流程
1.本发明属于传感和免疫分析技术领域,特别涉及基于nano spr生物芯片的小分子多联检试剂盒及其制备方法、检测方法。
背景技术:
2.等离子体纳米孔阵列(nanospr),由于其具有独特的三维结构,不同于平面模型的spr效应,也不同于金属纳米颗粒的lspr效应,可以同时支持spr与lspr两种模式。纳米孔阵列生物传感器的等离子共振效应可以直接入射到纳米孔金属结构,表面光场立即激发,因此不需要复杂的光路和大型光学仪器的支持。nanospr纳米孔阵列生物传感器保留了传统spr传感器的实时、无需标记、无背景干扰、高分辨率等诸多优点。nanospr传感器也保留了lspr传感器在性能改造上的优势,通过对纳米孔阵列的孔径、深度、形状、周期以及表面金属的类型、厚度等参数的调节,选择出可以捕捉到存在lspr最强信号的高品质芯片,无需大型光谱仪也可以得到更强的信号。
3.基于上述优点,nanospr生物传感器的检测能力能够满足生物分子传感检测的实际需求,广泛应用于生物医药检测、药物分析、食品安全、环境检测和细胞生物学等领域。抗生素是由微生物(包括细菌、真菌、放线菌属)或高等动植物在生活过程中所产生的具有抗病原体或其他活性的一类次级代谢产物,抗生素被广泛应用,可能会造成抗生素在动物源性食品中的残留,抗生素有多种分类,例如,磺胺类、氟喹诺酮、β-内酰胺类抗生素、头孢氨苄、林可霉素、替米考星-泰乐菌素、地塞米松、氯霉素、四环素、庆大霉素、氟苯尼考、红霉素、链霉素、苯甲酸、新霉素、金霉素、土霉素、沙星类、孔雀石绿或结晶紫。毒素是由各种生物(动物、植物、微生物)产生的有毒物质,指生物来源并不可自复制的有毒化学物质,例如,黄曲霉毒素m1、黄曲霉毒素b1或玉米赤霉烯酮。
4.氟苯尼考(florfenicol)属于氯霉素类广谱抗菌药,主要用于治疗鱼、猪、牛及家禽的细菌性感染病的防治,具有抗菌广谱、吸收好,体内分布广、安全高效等特点。氟苯尼考在安全性和有效性方面比氯霉素和甲砜霉素有明显的优势,已在养殖业中大规模使用。恩诺沙星(enrofloxaicn)是近年来迅速发展起来的一类动物专用的广谱抗生素。在化学结构上,本类药物属于吡酮酸衍生物,抑制细菌dna螺旋酶,抗菌谱广、高效、低毒、组织穿透能力强,抗菌作用是磺胺类的近千倍,可广泛用于动物细菌性疾病和支原体感染方面的防治。然而,随着畜禽养殖业的发展,氟苯尼考、恩诺沙星的滥用导致其在畜禽体内产生了巨大潜在危害,危害公众健康,我国发布的gb 31650-2019《食品安全国家标准食品中兽药最大残留限量》中规定氟苯尼考、恩诺沙星在不同动物组织中的残留限量。
5.现有技术中,针对氟苯尼考或恩诺沙星的检测方法包括液质联用法、酶联免疫法、试纸条法等,但不同的小分子检测缓冲液可能不通用,因此检测不同的分子需要用不同的缓冲液稀释样本,分别进行检测,耗时耗力。因此,目前还没有基于nano spr生物芯片并且可以同时实现氟苯尼考和恩诺沙星多联检或其他抗生素小分子的多联检技术。
技术实现要素:
6.针对以上现有技术的不足,本发明提供了基于生物芯片的小分子多联检试剂盒,所述试剂盒中仅含有一种检测缓冲液,即可同时用于稀释含有氟苯尼考和恩诺沙星的样本,用于多种抗生素小分子的同时检测,省时省力。
7.本发明的另一目的在于提供上述基于生物芯片的小分子多联检试剂盒的制备方法。
8.本发明的另一目的在于提供利用上述基于生物芯片的小分子多联检试剂盒的检测方法。
9.上述发明目的通过以下技术方案予以实现。
10.基于生物芯片的小分子多联检试剂盒,所述试剂盒中包含纳米金颗粒标记抗体、多联检芯片板和检测缓冲液;
11.所述纳米金颗粒标记抗体包含被纳米金颗粒标记的氟苯尼考抗体和恩诺沙星抗体;所述多联检芯片板的若干个检测孔中同时包被有氟苯尼考抗原和恩诺沙星抗原;所述检测缓冲液由10~40mm磷酸缓冲液、0.05~0.5wt%的表面活性剂s17组成。
12.本发明的检测缓冲液仅由磷酸缓冲液和表面活性剂s17组成即可,无需再额外添加其他缓冲液(如tris溶液)或促反应试剂(如peg2w、peg6k、nacl、edta、pvp等)。检测缓冲液体系简单且可用于稀释含不同抗原的样本,利于多种抗生素小分子的同时检测。
13.优选的,所述检测缓冲液由30mm磷酸缓冲液、0.05wt%的表面活性剂s17组成。
14.优选的,纳米金颗粒标记氟苯尼考抗体中氟苯尼考抗体:金颗粒的用量比为4μl:1.5ml,纳米金颗粒标记恩诺沙星抗体中恩诺沙星抗体:金颗粒的用量比为6μl:1.5ml。
15.优选的,所述试剂盒还包括所述纳米金颗粒标记抗体的复溶缓冲液,所述复溶缓冲液包括:25mm ph9.0 tris溶液、0.05wt%聚乙二醇20000、0.4wt%蔗糖、3wt%海藻糖、2wt%甘露醇。
16.优选的,所述多联检芯片板的其他检测孔中还包被有除氟苯尼考和恩诺沙星以外的其他小分子抗原,所述试剂盒中还含有与所述其他小分子抗原种类相对应的纳米金颗粒标记抗体。
17.本发明所述小分子多联检试剂盒是利用包括有不同抗原的芯片板(可由nanospr芯片与无底的96孔板制作而成)进行检测,待测样品中的小分子与芯片板表面相应的抗原竞争结合相应的纳米金颗粒标记抗体,当待测样品中没有小分子时,纳米金颗粒标记抗体与芯片板表面抗原反应产生较大的反应信号,当待测样品中有小分子时,纳米金颗粒标记抗体与待测样品的小分子结合,而不与芯片板表面抗原反应从而产生较小或没有反应信号。
18.所述其他小分子可包含小分子抗生素类、毒素类中的一种或多种;所述小分子抗生素类包括磺胺类、氟喹诺酮、β-内酰胺类抗生素、头孢氨苄、林可霉素、替米考星-泰乐菌素、地塞米松、氯霉素、四环素、庆大霉素、氟苯尼考、红霉素、链霉素、苯甲酸、新霉素、金霉素、土霉素、沙星类、孔雀石绿或结晶紫中的一种或多种;所述毒素类包含黄曲霉毒素m1、b1或玉米赤霉烯酮中的一种或多种。故本发明可实现8联检、16联检、192联检或更多联检。
19.优选的,所述检测缓冲液中磷酸缓冲液的ph为7.5。
20.本发明还提供所述的基于生物芯片的小分子多联检试剂盒的制备方法,包括:
21.多联检芯片板的制备:将nanospr芯片与无底微孔板组装,获得纳米等离子共振传感检测板;所述检测板的每个微孔依次用超纯水、无水乙醇进行清洗,氮气吹干;在若干个所述微孔中加入氟苯尼考抗原和恩诺沙星抗原,用微孔板封口膜封闭后于4℃过夜,即获得所述多联检芯片板;
22.纳米金颗粒标记抗体的制备:取两组相同体积的金颗粒溶液,向两组中分别加入tris溶液,分别混匀;再向第一组中加入氟苯尼考抗体,向第二组中加入恩诺沙星抗体,两组分别混匀,静置;两组再分别加入牛血清白蛋白混匀,静置,冷冻离心,去上清后取沉淀,即获得所述纳米金颗粒标记抗体;其中,第一组所述氟苯尼考抗体:金颗粒溶液的用量比为4μl:1.5ml,所述恩诺沙星抗体:金颗粒溶液的用量比为6μl:1.5ml。
23.优选的,所述金颗粒标记抗体的制备过程中,向第一组、第二组中加入的tris溶液分别是ph=9.0的4μl、6μl的0.1m tris溶液。
24.本发明还提供所述的基于生物芯片的小分子多联检试剂盒的检测方法,包括如下步骤:
25.s1.标准曲线的制备:向所述多联检芯片板的检测孔中分别加入既含有氟苯尼考又含有恩诺沙星的不同浓度梯度溶液,并在波长500-700nm的范围内检测全光谱起点,然后在氟苯尼考抗原+恩诺沙星抗原的检测孔中加入纳米金颗粒标记的氟苯尼考抗体、恩诺沙星抗体,常温孵育10min后在波长500-700nm的范围内检测全光谱终点,由终点反应值减去起点反应值的方法处理数据后,可同时获得氟苯尼考的标准曲线和恩诺沙星的标准曲线;
26.s2.样品前处理:取已经匀浆的鸡蛋试样加入乙腈,振荡混匀,加入氯化钠、无水硫酸钠,涡旋混合,离心5min,取上清液加入无水硫酸镁、n-丙基乙二胺,涡旋混合,离心5min,取上清液,吹干,加入所述检测缓冲液复溶,即为待测样品溶液;
27.s3.样品检测:向所述多联检芯片板的检测孔中分别加入s2制备的样品,并在波长500-700nm的范围内检测全光谱起点,然后在氟苯尼考抗原+恩诺沙星抗原的检测孔中加入纳米金颗粒标记的氟苯尼考抗体、恩诺沙星抗体,常温孵育10min后在波长500-700nm的范围内检测全光谱终点,由终点反应值减去起点反应值的方法处理数据后,可获得样品检测信号,将样品检测信号代入s1的标准曲线公式中即可分别获得样品中氟苯尼考和恩诺沙星的含量。
28.优选的,步骤s1中所述不同浓度梯度溶液为:氟苯尼考12.8ng/ml+恩诺沙星51.2ng/ml,氟苯尼考3.2ng/ml+恩诺沙星12.8ng/ml,氟苯尼考0.8ng/ml+恩诺沙星3.2ng/ml,氟苯尼考0.2ng/ml+恩诺沙星0.8ng/ml,氟苯尼考0.05ng/ml+恩诺沙星0.2ng/ml,氟苯尼考0ng/ml+恩诺沙星0ng/ml。
29.优选的,步骤s1和步骤s3中加入的纳米金颗粒标记的氟苯尼考抗体、恩诺沙星抗体均是经过复溶缓冲液复溶后再加入的,所述复溶缓冲液包括:25mm ph=9.0tris溶液、0.05wt%聚乙二醇20000、0.4wt%蔗糖、3wt%海藻糖、2wt%甘露醇。所述复溶缓冲液中tris浓度和ph可增加金颗粒的稳定性和分散性,使得金颗粒分散的更均匀,peg2w利于金颗粒的进一步分散,海藻糖在缓冲液体系中起到了保护金颗粒表面的抗体以降低抗体的降解速度的作用。本发明所提出的复溶缓冲液可使金颗粒复溶后更加的稳定,不易受外界影响导致金颗粒聚集。
30.与现有技术相比,本发明的有益之处在于:本发明通过检测缓冲液及其与检测体
系中的其他试剂的配合优化,可以利用一种检测缓冲液即能够同时检测氟苯尼考和恩诺沙星小分子,省时省力。本发明仅在10min内即可同时检测氟苯尼考和恩诺沙星小分子,且检测限分别低至氟苯尼考0.05ng/ml,恩诺沙星0.2ng/ml。
附图说明
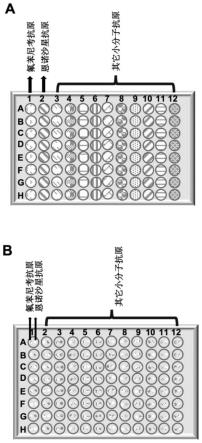
31.图1为具体实施方式中在所述检测板的微孔上包被氟苯尼考抗原、恩诺沙星抗原或其它小分子抗原形成多联检芯片板的示意图,其中图1a为优化检测体系及特异性和非特异性检测所用到的多联检芯片板,图1b为线性检测和样品检测所用到的多联检芯片板。
32.图2为实施例1中纳米金颗粒标记氟苯尼考抗体(第一组)的优化结果。
33.图3为实施例2中氟苯尼考基础缓冲液的优化结果;其中,pb6.0kb为ph 6.0的磷酸缓冲液空白对照样品,pb6.0为ph 6.0的磷酸缓冲液加入1ppb氟苯尼考小分子样品,其它样品名称的标注类似;还有tris6.36kb表示ph 6.36的tris缓冲液空白对照样品,tris6.36表示ph 6.36的tris缓冲液加入1ppb氟苯尼考小分子样品,其它样品名称的标注类似。
34.图4为实施例2中氟苯尼考表活种类的优化结果;其中,0.05%tw20 kb为30mm(ph=7.5)磷酸缓冲液加入0.05wt%tw20空白对照样品,0.05%tw20为30mm(ph=7.5)磷酸缓冲液加入0.05wt%tw20缓冲液以及1ppb氟苯尼考小分子样品,其它样品名称的标注类似。
35.图5为实施例3中在多联检芯片板上包被氟苯尼考抗原(a)和恩诺沙星抗原(b)的检测孔中分别加入不同浓度混合样品1,以检测本发明方法的检测特异性结果。
36.图6为实施例4中在多联检芯片板上包被氟苯尼考抗原(a)和恩诺沙星抗原(b)的芯片孔中分别加入不同浓度混合样品2和混合样品3,以检测本发明方法的检测非特异性结果。
37.图7为实施例3和4中在多联检芯片板上包被氟苯尼考抗原和恩诺沙星抗原的芯片孔中分别加入不同浓度混合样品1、2、3,氟苯尼考小分子样品和恩诺沙星小分子样品进行多联检测结果。
38.图8为实施例5中在多联检芯片板上的一个孔中既包被氟苯尼考抗原(a)又包被恩诺沙星抗原(b)的芯片孔中分别加入不同浓度既有氟苯尼考小分子又有恩诺沙星小分子样品,说明本发明可以实现多联检检测。
39.图9为实施例6中在多联检芯片板上的一个孔中既包被氟苯尼考抗原(a)又包被恩诺沙星抗原(b)的芯片孔中分别加入不同浓度既有氟苯尼考小分子又有恩诺沙星小分子样品,产生的梯度反应说明该多联检可以做半定量或定性检测。
40.图10为实施例6中在多联检芯片板上的一个孔中既包被氟苯尼考抗原又包被恩诺沙星抗原的芯片孔中分别加入不同浓度既有氟苯尼考小分子又有恩诺沙星小分子样品,该结果梯度明显说明该多联检可以做半定量或定性检测。
41.图11为实施例6中在多联检芯片板上的一个孔中既包被氟苯尼考抗原又包被恩诺沙星抗原的芯片孔中加入不同浓度氟苯尼考小分子样品做标准曲线,其公式为y=0.06268+0.30944/(1+(x/0.7275)^0.57985),r2为0.998,说明线性关系好说明该多联检可以做半定量或定性检测。
42.图12为实施例6中在多联检芯片板上的一个孔中既包被氟苯尼考抗原又包被恩诺沙星抗原的芯片孔中加入不同浓度恩诺沙星小分子样品做标准曲线,其公式为y=0.00221
+0.35911/(1+(x/12.02093)^0.44687),r2为0.999,说明线性关系好说明该多联检可以做半定量或定性检测。
具体实施方式
43.下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动条件下所获得的所有其它实施例,都属于本发明保护的范围。
44.本发明具体实施方式中提供一种基于生物芯片的小分子多联检试剂盒,所述试剂盒中包含有纳米金颗粒标记抗体、多联检芯片板和检测缓冲液;
45.所述纳米金颗粒标记抗体包含小分子抗生素类、毒素类中的一种或多种;所述小分子抗生素类包括磺胺类、氟喹诺酮、β-内酰胺类抗生素、头孢氨苄、林可霉素、替米考星-泰乐菌素、地塞米松、氯霉素、四环素、庆大霉素、红霉素、链霉素、苯甲酸、新霉素、金霉素、土霉素、沙星类、孔雀石绿或结晶紫中的一种或多种;所述毒素类包含黄曲霉毒素m1、b1或玉米赤霉烯酮中的一种或多种;
46.所述多联检芯片板中包被有抗原,所述抗原的种类与所述纳米金颗粒标记抗体的种类对应。
47.所述多联检芯片板的检测器,包括光谱仪、酶标仪、显微镜等光学检测器件。
48.所述纳米金颗粒采用现有方法制备或市售购买获得,以下实施例中均采用同样的纳米金颗粒。具体的,本发明采用的纳米金颗粒的粒径为35nm。
49.具体的,所述的小分子多联检试剂盒的制备方法,包括:
50.(1)多联检芯片板的制备:
51.利用光刻技术制作锥形纳米柱石英基板模具,然后将紫外光固化聚合物(例如noa61、noa68t等)均匀地涂抹在模具上,用紫外光进行固化处理后,剥离固化物获得芯片基底。然后通过电子束蒸发在芯片基底依次沉积肽、银和金,即获得nano spr芯片;
52.以下实施例中均采用同样的nano spr芯片;
53.再将nanospr芯片贴在无底96孔板底部,即完成纳米等离子共振传感检测板的组装;
54.所述检测板的每个检测孔依次用超纯水、无水乙醇进行清洗,氮气吹干;在检测孔中分别加入氟苯尼考抗原或恩诺沙星抗原或其他小分子抗原中的一种或多种,具体示意图如图1所示,再用检测孔板封口膜封闭后于4℃过夜,即获得多联检芯片板;
55.如图1所示,对集成有纳米等离子共振生物芯片的检测孔板上固定氟苯尼考、恩诺沙星抗原或其它小分子抗原,可实现8联检、16联检、192联检或更多联检。
56.(2)纳米金颗粒标记抗体的制备:将8个离心管等分为两组,两组均加入1.5ml金颗粒溶液,再向第一组和第二组分别加入4μl、6μl0.1m tris(ph=9.0)溶液,混匀;再向第一组的4管中分别加入1μl、2μl、4μl、6μl的0.89μg/ml氟苯尼考抗体,向第二组的4管中加入1μl、2μl、4μl、6μl的0.89μg/ml恩诺沙星抗体,每管分别混匀,静置;两组再分别加入150μl 10wt%牛血清白蛋白混匀封闭,静置,冷冻离心,去上清后取沉淀,即获得纳米金颗粒标记抗体。
57.(3)所述检测缓冲液:包括10~40mm磷酸缓冲液、0.05~0.5wt%质量浓度的表面
活性剂s17。
58.利用上述小分子多联检试剂盒对氟苯尼考抗原和恩诺沙星抗原的检测方法,包括如下步骤:
59.s1.标准曲线的制备:向所述多联检芯片板,即一个检测孔中既包被氟苯尼考抗原又包被恩诺沙星抗原的检测孔中分别加入既含有氟苯尼考又含有恩诺沙星小分子的梯度溶液(上述梯度溶液对应的氟苯尼考+恩诺沙星的浓度分别为氟苯尼考12.8ng/ml+恩诺沙星51.2ng/ml,氟苯尼考3.2ng/ml+恩诺沙星12.8ng/ml,氟苯尼考0.8ng/ml+恩诺沙星3.2ng/ml,氟苯尼考0.2ng/ml+恩诺沙星0.8ng/ml,氟苯尼考0.05ng/ml+恩诺沙星0.2ng/ml,氟苯尼考0ng/ml+恩诺沙星0ng/ml),并在波长500-700nm的范围内检测全光谱起点,然后在同一个检测孔中既包被氟苯尼考抗原又包被恩诺沙星抗原的检测孔中同时加入试剂盒中纳米金颗粒标记的氟苯尼考抗体和纳米金颗粒标记的恩诺沙星抗体(上述步骤(2)中制备获得)。常温孵育10min后在波长500-700nm的范围内检测全光谱终点。由终点反应值减去起点反应值的方法处理数据后,可同时获得氟苯尼考的标准曲线和恩诺沙星的标准曲线,其公式分别为
60.氟苯尼考y=0.06268+0.30944/(1+(x/0.7275)^0.57985),r2为0.998;
61.恩诺沙星y=0.00221+0.35911/(1+(x/12.02093)^0.44687),r2为0.999;
62.检测限分别低至氟苯尼考0.05ng/ml,恩诺沙星0.2ng/ml。
63.s2.样品前处理:取已经匀浆的鸡蛋试样并加入乙腈,振荡混匀,加入氯化钠、无水硫酸钠,涡旋混合,离心5min,取上清液加入无水硫酸镁、n-丙基乙二胺,涡旋混合,离心5min,取上清液,吹干,加入所述检测缓冲液复溶,即为待测样品溶液;
64.s3.样品检测:向所述多联检芯片板,即一个检测孔中既包被氟苯尼考抗原又包被恩诺沙星抗原的检测孔中分别加入s2制备的样品,并在波长500-700nm的范围内检测全光谱起点,然后在同一个检测孔中既包被氟苯尼考抗原又包被恩诺沙星抗原的检测孔中同时加入试剂盒中纳米金颗粒标记的氟苯尼考抗体和纳米金颗粒标记的恩诺沙星抗体(上述步骤(2)中制备获得)。常温孵育10min后在波长500-700nm的范围内检测全光谱终点。由终点反应值减去起点反应值的方法处理数据后,可获得样品检测信号,将样品检测信号代入标准曲线公式中即可同时获得样品中氟苯尼考和恩诺沙星的含量,从而实现半定量检测;
65.步骤s1和步骤s3中加入的纳米金颗粒标记的氟苯尼考抗体、纳米金颗粒标记的恩诺沙星抗体均是经过含25mm tris(ph=9.0)、0.05wt%peg2w(聚乙二醇20000)、0.4wt%蔗糖、3wt%海藻糖、2wt%甘露醇的缓冲液复溶后使用。
66.实施例1纳米金颗粒标记抗体的制备与优化
67.取8个相同的离心管分为两组(每组4个),两组均加入1.5ml金颗粒溶液,再向第一组离心管中加入4μl 0.1m tris(ph=9.0)溶液,混匀,再在第一组的4管中分别加入1μl、2μl、4μl、6μl的0.89μg/ml氟苯尼考抗体;在第二组的离心管中加入6μl 0.1m tris(ph=9.0)溶液,混匀,再在第二组的4管中分别加入1μl、2μl、4μl、6μl的0.89μg/ml恩诺沙星抗体,混匀、静置;每管中均加入150ul、10wt%的牛血清白蛋白混匀封闭,静置;冷冻离心,去上清后取沉淀待用。
68.检测过程:在上述制备的纳米金颗粒标记的氟苯尼考抗体、纳米金颗粒标记的恩诺沙星抗体沉淀中分别加入600μl复溶缓冲液(25mm ph=9.0tris溶液、0.05wt%聚乙二醇
20000、0.4wt%蔗糖、3wt%海藻糖、2wt%甘露醇),混匀待用。
69.将以上制备的多联检芯片板用pbs磷酸缓冲液润洗2次后,在包被氟苯尼考抗原的芯片孔中分别加入pbs磷酸缓冲液溶解的1ppb氟苯尼考小分子和不加氟苯尼考小分子空白对照样品,用普通酶标仪测全光谱的起点(500nm-700nm),然后分别加入7μl上述纳米金颗粒标记的不同体积氟苯尼考抗体(1μl、2μl、4μl、6μl),混匀后在37℃、700rpm条件下孵育10min,然后检测全光谱终点(500nm-700nm)。金颗粒标记恩诺沙星抗体的优化检测过程与上述金颗粒标记氟苯尼考抗体的优化检测过程一样:将制备的多联检芯片板用pbs磷酸缓冲液润洗2次后,在包被恩诺沙星抗原的芯片孔中分别加入pbs缓冲液溶解的1ppb恩诺沙星小分子和不加恩诺沙星小分子空白对照样品,用普通酶标仪测全光谱的起点(500nm-700nm),然后分别加入7μl上述纳米金颗粒标记的不同体积恩诺沙星抗体(1μl、2μl、4μl、6μl),混匀后在37℃、700rpm条件下孵育10min,然后检测全光谱终点(500nm-700nm)。
70.以上纳米金颗粒标记氟苯尼考抗体(第一组)的优化分组实验见下表。
[0071][0072]
上述实验结果如图2所示,在第一组中,当金颗粒与4μl氟苯尼考抗体结合时,空白
样品与加入1ppb氟苯尼考小分子的样品可以明显的区分开,因此,选择在1.5ml金颗粒中加入4μl氟苯尼考抗体作为后续的氟苯尼考检测条件。同理,发明人发现当1.5ml金颗粒与6μl恩诺沙星抗体结合时,空白样品与加入1ppb恩诺沙星小分子的样品可以明显的区分开,因此,选择在1.5ml金颗粒中加入6μl恩诺沙星抗体作为后续的恩诺沙星检测条件(图略)。
[0073]
本实施例还考察了两组向金颗粒溶液中加入tris溶液的用量,发现往氟苯尼考抗体所在的第一组加入4μl 0.1m tris(ph=9.0)溶液,往恩诺沙星抗体所在的第二组加入6μl 0.1m tris(ph=9.0)溶液,使ph值在最佳条件,利于纳米金颗粒与氟苯尼考抗体或恩诺沙星抗体的结合,最终制备的纳米金颗粒标记的氟苯尼考抗体、纳米金颗粒标记的恩诺沙星抗体稳定且不发生聚集。
[0074]
实施例2多联检缓冲液的优化
[0075]
将以上制备的多联检芯片板用pb磷酸缓冲液润洗2次后,在包被氟苯尼考抗原的芯片孔中分别加入30mm的pb缓冲液(ph为6.0、6.5、7.0、7.5、8.0)、tris缓冲液(ph为6.36、7.33、8.33)溶解的1ppb氟苯尼考小分子(分别记为pb6.0、pb6.5等五组)和不加氟苯尼考小分子对照样品(分别记为pb6.0kb、pb6.5kb等五组),用普通酶标仪测全光谱的起点(500nm-700nm),然后分别加入7μl纳米金颗粒标记氟苯尼考抗体,混匀后在37℃、700rpm条件下孵育10min,然后检测全光谱终点(500nm-700nm)。在优化好的基础缓冲液分别加入相同质量浓度、不同种类的表活剂(吐温20,曲拉通、s9、s17),然后在基础缓冲液中优化不同浓度表活(0.01wt%、0.05wt%、0.1wt%、0.2wt%、0.5wt%),在此基础缓冲液中加入不同的促反应试剂(如peg2w、peg6k、nacl、edta、pvp等)对氟苯尼考的缓冲液进行优化。恩诺沙星的缓冲液优化方法同上。
[0076]
缓冲液的优化结果如图3所示,在30mm pb(ph=7.5)缓冲液条件下,空白对照与含有1ppb氟苯尼考小分子样品的反应值有明显的区别,此时空白反应值最大,且tris缓冲液在不同ph的空白反应值均没有pb缓冲液空白反应值大,因此,选择30mm pb(ph=7.5)缓冲液为基础缓冲液进行进一步的优化。表活种类优化结果如图4所示,在基础缓冲液条件下,分别加入相同质量浓度比(0.05wt%)的不同种类的表面活性剂,0.05wt%s17的空白对照反应值最大,且空白对照与含有1ppb氟苯尼考小分子样品的反应值有明显的区别,因此,选择30mm pb(ph=7.5)、0.05wt%s17缓冲液(记作pbs17磷酸缓冲液)作为基础缓冲液进一步优化。然后在基础缓冲液中优化不同浓度表活s17(0.01wt%、0.05wt%、0.1wt%、0.2wt%、0.5wt%),结果显示,0.05wt%s17的空白对照反应值最大,且空白对照与含有1ppb氟苯尼考小分子样品的反应值有明显的区别(图略)。当在基础缓冲液中加入不同种类的促反应试剂(如peg2w、peg6k、nacl、edta、pvp等)对反应结果并没有促进效果(图略),且此时空白对照反应值足够满足实验要求,因此,选择优化后的30mm pb(ph=7.5)、0.05wt%s17缓冲液(pbs17磷酸缓冲液)对氟苯尼考进行后续的检测实验。恩诺沙星的缓冲液优化方法与氟苯尼考缓冲液的优化方法相同。结果显示,在30mm pb(ph=7.5)0.05wt%s17缓冲液中,恩诺沙星空白对照反应值最大且与氟苯尼考的空白对照反应值相近,空白对照与含有1ppb恩诺沙星小分子样品的反应值有明显的区别,因此,选择优化后的30mm pb(ph=7.5)、0.05wt%s17缓冲液(pbs 17磷酸缓冲液)对恩诺沙星进行后续的检测实验。
[0077]
实施例3多联检小分子特异性检测
[0078]
将以上制备的多联检芯片板用pbs17磷酸缓冲液润洗2次后,在包被氟苯尼考、恩
诺沙星抗原的芯片孔中分别加入不同浓度0.05~10ng/ml混合溶液1(浓度为1.8ng/ml氟苯尼考、7.2ng/ml恩诺沙星、10ng/ml磺胺、10ng/ml孔雀石绿、10ng/ml氯霉素的母液进行6倍稀释,即浓度分别为1.8ng/ml氟苯尼考+7.2ng/ml恩诺沙星+10ng/ml磺胺+10ng/ml孔雀石绿+10ng/ml氯霉素,0.3ng/ml氟苯尼考+1.2ng/ml恩诺沙星+1.7ng/ml磺胺+1.7ng/ml孔雀石绿+1.7ng/ml氯霉素,0.05ng/ml氟苯尼考+0.2ng/ml恩诺沙星+0.3ng/ml磺胺+0.3ng/ml孔雀石绿+0.3ng/ml氯霉素,0ng/ml氟苯尼考+0ng/ml恩诺沙星+0ng/ml磺胺+0ng/ml孔雀石绿+0ng/ml氯霉素),用普通酶标仪测全光谱的起点(500nm-700nm),分别加入7μl氟苯尼考、恩诺沙星抗体标记的金颗粒,混匀后在37℃、700rpm条件下孵育10min,然后检测全光谱终点(500nm-700nm)。
[0079]
采用全光谱终点减去全光谱起点的方法分析数据。如图5a,b和图7具有梯度反应说明该多联检检测特异性好。
[0080]
实施例4多联检小分子非特异性检测
[0081]
将多联检芯片板用pbs17磷酸缓冲液润洗2次后,在包被氟苯尼考、恩诺沙星抗原的芯片孔中分别加入不同浓度0.2~10ng/ml混合溶液2(浓度为7.2ng/ml恩诺沙星、10ng/ml磺胺、10ng/ml孔雀石绿、10ng/ml氯霉素的母液进行6倍稀释,即浓度分别为7.2ng/ml恩诺沙星+10ng/ml磺胺+10ng/ml孔雀石绿+10ng/ml氯霉素,1.2ng/ml恩诺沙星+1.7ng/ml磺胺+1.7ng/ml孔雀石绿+1.7ng/ml氯霉素,0.2ng/ml恩诺沙星+0.3ng/ml磺胺+0.3ng/ml孔雀石绿+0.3ng/ml氯霉素,0ng/ml恩诺沙星+0ng/ml磺胺+0ng/ml孔雀石绿+0ng/ml氯霉素)和0.05~10ng/ml混合溶液3(浓度为1.8ng/ml氟苯尼考、10ng/ml磺胺、10ng/ml孔雀石绿、10ng/ml氯霉素的母液进行6倍稀释,即浓度分别为1.8ng/ml氟苯尼考+10ng/ml磺胺+10ng/ml孔雀石绿+10ng/ml氯霉素,0.3ng/ml氟苯尼考+1.7ng/ml磺胺+1.7ng/ml孔雀石绿+1.7ng/ml氯霉素,0.05ng/ml氟苯尼考+0.3ng/ml磺胺+0.3ng/ml孔雀石绿+0.3ng/ml氯霉素,0ng/ml氟苯尼考+0ng/ml磺胺+0ng/ml孔雀石绿+0ng/ml氯霉素)用普通酶标仪测全光谱的起点(500nm-700nm),分别加入7μl氟苯尼考、恩诺沙星抗体标记的金颗粒,混匀后在37℃、700rpm条件下孵育10min,然后检测全光谱终点(500nm-700nm)。
[0082]
如图6a,b和图7所示,在包被氟苯尼考、恩诺沙星抗原芯片表面分别加入不含氟苯尼考、恩诺沙星的混合样品,均没有反应,说明该多联检没有非特异性结合。
[0083]
实施例5多联检小分子线性检测
[0084]
将多联检芯片板,即一个检测孔中既包被氟苯尼考抗原又包被恩诺沙星抗原的检测孔用pbs17磷酸缓冲液润洗2次后,在既包被氟苯尼考抗原又包被恩诺沙星抗原的一个检测孔中分别加入不同浓度的0.05~7.2ng/ml既含有氟苯尼考又含有恩诺沙星小分子溶液(氟苯尼考1.8ng/ml,恩诺沙星7.2ng/ml的母液进行6倍稀释,即浓度分别为1.8ng/ml氟苯尼考+7.2ng/ml恩诺沙星,0.3ng/ml氟苯尼考+1.2ng/ml恩诺沙星,0.05ng/ml氟苯尼考+0.2ng/ml恩诺沙星,0ng/ml氟苯尼考+0ng/ml恩诺沙星),用光谱仪测全光谱的起点(500nm-700nm),同时加入7μl氟苯尼考抗体标记的金颗粒和7μl恩诺沙星抗体标记的金颗粒,混匀后在37℃、700rpm条件下孵育10min,然后检测全光谱终点(500nm-700nm)。采用全光谱终点减去全光谱起点的方法分析数据。
[0085]
结果如图8a,b所示,分别为氟苯尼考(a)和恩诺沙星(b)小分子的线性检测,其氟苯尼考的检测曲线与氟苯尼考的特异性实验(图5a)相似,说明氟苯尼考的特异性检测好,
也说明了氟苯尼考的重复性好;恩诺沙星的检测曲线与恩诺沙星的特异性实验(图5b)相近,说明恩诺沙星的特异性检测好,也说明了恩诺沙星的重复性好,同时也说明氟苯尼考和恩诺沙星的线性检测良好,可以实现多联检芯片板的线性检测。
[0086]
实施例6多联检小分子半定量或定性检测
[0087]
将多联检芯片板,即一个检测孔中既包被氟苯尼考抗原又包被恩诺沙星抗原的检测孔用pbs17磷酸缓冲液润洗2次后,在既包被氟苯尼考抗原又包被恩诺沙星抗原的一个检测孔中分别加入不同浓度的0.05~51.2ng/m既含有氟苯尼考又含有恩诺沙星的溶液(氟苯尼考12.8ng/ml,恩诺沙星51.2ng/ml的母液进行4倍稀释,浓度分别为氟苯尼考12.8ng/ml+恩诺沙星51.2ng/ml,氟苯尼考3.2ng/ml+恩诺沙星12.8ng/ml,氟苯尼考0.8ng/ml+恩诺沙星3.2ng/ml,氟苯尼考0.2ng/ml+恩诺沙星0.8ng/ml,氟苯尼考0.05ng/ml+恩诺沙星0.2ng/ml,氟苯尼考0ng/ml+恩诺沙星0ng/ml),用光谱仪测全光谱的起点(500nm-700nm),同时加入7μl氟苯尼考抗体标记的金颗粒和7μl恩诺沙星抗体标记的金颗粒,混匀后在37℃、700rpm条件下孵育10min,然后检测全光谱终点(500nm-700nm)。
[0088]
结果如图9a、b所示,分别为氟苯尼考(a)和恩诺沙星(b)的标准曲线检测图,即为终点减去起点的全波长图谱,由图可知其曲线分布均匀。由图10所示,为双波长相减600-575nm所得的氟苯尼考和恩诺沙星小分子检测的柱状图,并对其进行曲线拟合同时获得氟苯尼考的标准曲线和恩诺沙星的标准曲线,其公式分别为y=0.06268+0.30944/(1+(x/0.7275)^0.57985),r2为0.998(图11);y=0.00221+0.35911/(1+(x/12.02093)^0.44687),r2为0.999(图12),由此可得本发明的多联检芯片板,即一个芯片孔中包被多种抗原可同时半定量或定性检测多种小分子化合物。
[0089]
应用例1实际样品的加标检测
[0090]
将5个阴性鸡蛋样品打碎混匀随机分为a、b、c平行的三组(每组10g),每组中同时加入氟苯尼考和恩诺沙星标准母液,使样品中既含有氟苯尼考又含有恩诺沙星。具体的,a组中加入20μg/kg氟苯尼考和50μg/kg恩诺沙星样品;b组中加入10μg/kg氟苯尼考和20μg/kg恩诺沙星;c组中加入5μg/kg氟苯尼考和10μg/kg恩诺沙星样品。
[0091]
样品的前处理:
[0092]
称取10g已经匀浆的鸡蛋试样并加入20ml乙腈,振荡混匀,加入4g氯化钠,6g无水硫酸钠,涡旋混合,5000rpm/min离心5min。取4ml上清液至新的离心管中,加入600mg无水硫酸镁,200mg n-丙基乙二胺,涡旋混合0.5min,5000rpm/min离心5min。取2ml上清液,氮气吹干,加入400μl检测缓冲液(30mm pb缓冲液、0.05wt%质量浓度的表面活性剂s17)复溶,即为待测样品溶液。
[0093]
实际样品的检测:
[0094]
将多联检芯片板,既包被氟苯尼考抗原又包被恩诺沙星抗原的检测孔用pbs17磷酸缓冲液润洗2次后,在一个既包被氟苯尼考抗原又包被恩诺沙星抗原的检测孔中分别加入空白样品,a组鸡蛋含有20μg/kg氟苯尼考和50μg/kg恩诺沙星样品;b组鸡蛋含有10μg/kg氟苯尼考和20μg/kg恩诺沙星;c组鸡蛋含有5μg/kg氟苯尼考和10μg/kg恩诺沙星样品,用光谱仪测全光谱的起点,同时加入试剂盒中7μl纳米金颗粒标记的氟苯尼考抗体和7μl纳米金颗粒标记的恩诺沙星抗体(上述步骤(2)中制备获得),混匀后在37℃、700rpm条件下孵育10min,然后检测全光谱终点。采用全光谱终点减去全光谱起点的方法分析数据。
[0095]
检测结果如下表所示,获得样品回收率范围为101%~107%,说明本发明的联检芯片板即一个芯片孔中包被多种抗原适用于样品的多联检测。
[0096][0097]
以上具体实施方式详细描述了本发明的实施,但是,本发明并不限于上述实施方式中的具体细节。在本发明的权利要求书和技术构思范围内,可以对本发明的技术方案进行多种简单改型和改变,这些简单变型均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1