基于碳三氮四纳米片的SERS生物传感器及其制备方法和应用
基于碳三氮四纳米片的sers生物传感器及其制备方法和应用
技术领域
1.本发明涉及纳米生物技术领域,尤其涉及一种基于碳三氮四纳米片的sers 生物传感器及其制备方法和应用。
背景技术:
2.癌症的早期发现是提高治愈率的关键。相比于传统的检测技术,sers由于 其独特的指纹、非破坏性数据采集和单分子水平的灵敏度,已成为检测生物标 记物的主要策略之一。
3.为此,现有技术中提出了一类基于贵金属纳米粒子(au,ag等)的sers 基生物传感器,这类sers基生物传感器具有高灵敏度和高通量,且其sers一 般发生在贵金属纳米粒子表面,从而能够直接对待测物进行检测,因此引起了 广泛关注。
4.但是,这类sers基生物传感器的基底和探针均需大量贵金属制成,不仅制 备成本高,且其贵金属免疫基底一般需要利用电子束、离子束、光刻蚀和电沉 积等工艺制备贵金属层(如ag层),制备工艺复杂不易操作,导致制备的基底 形貌可控性差,进而导致sers基生物传感器稳定性差且生物相容性差,进而影 响sers基生物传感器的检测效果。
5.为此,本发明提供一种基于碳三氮四纳米片的sers生物传感器及其制备方 法和应用。
技术实现要素:
6.为了解决上述现有技术中的不足,本发明提供一种基于碳三氮四纳米片的 sers生物传感器及其制备方法和应用。本发明将磁性纳米二硫化钼与碳三氮四 纳米片结合,制作了一种可用于肿瘤标志物检测的sers生物传感器。
7.本发明的一种基于碳三氮四纳米片的sers生物传感器及其制备方法和应 用是通过以下技术方案实现的:
8.本发明的第一个目的是提供一种基于碳三氮四纳米片的sers生物传感器, 由免疫探针、免疫基底和糖蛋白125抗原组成;
9.所述免疫探针由功能化标记的磁性纳米二硫化钼上链接糖蛋白125抗体获 得,且所述磁性纳米二硫化钼的直径为100~1000nm;
10.所述免疫基底由碳三氮四纳米片上链接所述糖蛋白125抗体获得,且所述 碳三氮四纳米片直径为50~300nm;
11.且所述免疫探针和所述免疫基底上糖蛋白125抗体与所述糖蛋白125抗原 与之间特异性结合,形成三明治结构的sers生物传感器。
12.进一步地,所述功能化标记的磁性纳米二硫化钼由以下步骤获得:
13.采用拉曼分子标记磁性纳米二硫化钼,即获得所述功能化标记的磁性纳米 二硫化钼;
14.所述拉曼分子为罗丹明6g、亚甲基蓝和结晶紫中的任意一种,且所述拉曼 分子与
所述磁性纳米二硫化钼的用量比为1~3mmol:10g。
15.进一步地,所述磁性纳米二硫化钼的制备方法如下:
16.将钼酸盐、硫源和四氧化三铁均匀分散于溶剂b中,并于180~220℃的温 度下水热反应6~12h,冷却至室温后,洗涤干燥,获得获得二硫化钼包覆四氧化 三铁的磁性纳米二硫化钼。
17.进一步地,所述钼酸盐为钼酸钠或钼酸铵;
18.所述硫源为硫代乙酰胺或硫脲;
19.所述钼酸盐与硫源和四氧化三铁(232)的摩尔比为1.5~2:10:0.06~0.55;
20.所述钼酸盐与溶剂b的用量比为0.15~0.2mol:1l。
21.进一步地,所述活化后的碳三氮四纳米片碳三氮四纳米片由以下步骤获得:
22.s1,将碳三氮四粉末加入至浓盐酸中,经超声处理后,于70~90℃下反应 8~20h,获得酸化后的碳三氮四;
23.其中,所述碳三氮四粉末与浓盐酸的用量比为2~3mg:1~2ml;
24.s2,将酸化后的碳三氮四于超声作用下分散于水溶剂中,随后进行离心处 理,所得上清液即为碳三氮四纳米片溶液;
25.其中,所述水溶剂与所述碳三氮四粉末的用量比为1~2mg:1~1.5ml;
26.s3,将所述碳三氮四纳米片溶液与亚胺化合物均匀分散于磷酸缓冲盐溶液 中,并于36~38℃的温度下反应1~3h,获得活化后的碳三氮四纳米片溶液;
27.其中,所述亚胺化合物为n-羟基琥珀酰亚胺或1-(3-二甲基氨基丙基)-3-乙 基碳二亚胺。
28.进一步地,所述糖蛋白125抗体与所述活化后的碳三氮四纳米片溶液的用 量比为0.002~0.006mg:1~1.5ml。
29.本发明的第二个目的是提供一种上述sers生物传感器的制备方法,包括以 下步骤:
30.步骤1,制备免疫探针:
31.向功能化标记的磁性纳米二硫化钼中加入糖蛋白125抗体后进行孵育处理 a,以在拉曼分子标记后的磁性纳米二硫化钼上链接糖蛋白125抗体,获得所述 免疫探针;
32.步骤2,制备免疫基底:
33.将碳三氮四纳米片活化后,加入糖蛋白125抗体进行孵育处理b,以在活化 后的碳三氮四纳米片上链接糖蛋白125抗体,获得免疫基底;
34.步骤3,制备三明治结构的sers生物传感器:
35.将免疫基底分散于磷酸盐缓冲溶液a中以形成免疫基底溶液,随后加入糖 蛋白125抗原进行孵育处理c,获得混合溶液a;
36.将免疫探针分散于磷酸盐缓冲溶液b中以形成免疫探针溶液,随后,将免 疫探针溶液加入至混合溶液a中进行孵育处理d,获得sers生物传感器。
37.进一步地,所述糖蛋白125抗体与所述功能化标记的磁性纳米二硫化钼的 质量比为2~6:1000;
38.所述免疫基底与所述磷酸盐缓冲溶液a的用量比为1~2mg:1~1.5ml;
39.所述免疫探针与所述磷酸盐缓冲溶液b的用量比为10mg:1~1.5ml;
40.所述糖蛋白125抗原与免疫基底溶液的用量比为0.002~0.006mg:1~1.5ml;
41.所述免疫探针溶液与所述混合溶液a的用量比为1~1.5ml:1~1.5ml;
42.所述糖蛋白125抗原的浓度为80~120iu/ml。
43.进一步地,所述孵育处理a的处理温度为3~5℃,处理时间为1.5~2.5h;
44.所述孵育处理b的处理温度为3~5℃,处理时间为1.5~2.5h;
45.所述孵育处理c的处理温度为36~38℃,培养时间为1~3h;
46.所述孵育处理d的孵化温度为36~38℃,孵化时间为1~3h。
47.本发明的第三个目的是提供一种上述sers生物传感器在肿瘤标志物检测 中的应用。
48.本发明与现有技术相比,具有以下有益效果:
49.本发明的sers生物传感器由免疫探针、免疫基底和糖蛋白125抗原组成, 其中,免疫探针由功能化标记的磁性纳米二硫化钼上链接糖蛋白125抗体获得, 免疫基底由活化后的碳三氮四纳米片上链接所述糖蛋白125抗体获得,制备工 艺简单易操作,且活化后的g-c3n4纳米片具有更大表面积和更多活性电子,表 现出改善的拉曼散射性能,并且碳三氮四与二硫化钼具有非常匹配的交错能带 结构,具有协同化学增强作用,极大地促进了化学增强效应,引起了更多的电 荷转移过程导致极化率增大,显著地放大了标记分子的拉曼信号,进而能够引 起优异的sers活性,从而使本发明的sers免疫传感器具有良好的生物相容性 且检测效率大大提高。
50.本发明通过在二硫化钼制备过程中引入少量磁性粒子四氧化三铁,以使二 硫化钼中包裹有四氧化三铁,进而促进二硫化钼纳米片的堆叠和自组装成花状, 暴露出更高的比表面积和活性位点,有利于分子吸附。且本发明制备的sers 免疫传感器中,碳三氮四纳米片和磁性纳米二硫化钼的协同化学增强作用,引 起了更多的电荷转移过程导致极化率增大,sers信号提高,进而能够引起优异 的sers活性。
51.本发明制备的sers免疫传感器具有良好的生物相容性,再加上磁性四氧化 三铁的引入实现了基底和探针的双循环利用。同时,凭借上述两种半导体的高 载流子迁移率,该免疫传感器还具有卓越的光催化性能,有利于抗原、抗体和 拉曼分子的快速降解。
附图说明
52.图1为实施例1制备的免疫探针的扫描电子显微镜照片;
53.图2为实施例2制备的免疫探针的扫描电子显微镜照片;
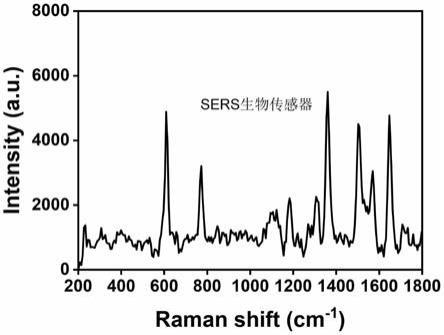
54.图3为实施例3制备的免疫探针的扫描电子显微镜照片;
55.图4为实施例1制备的免疫基底的扫描电子显微镜照片;
56.图5为实施例1制备的sers生物传感器的扫描电子显微镜照片;
57.图6为实施例1制备的免疫探针和免疫基底对罗丹明6g的拉曼检测结果;
58.图7为实施例2制备的免疫探针对罗丹明6g的拉曼检测结果;
59.图8为实施例3制备的免疫探针对罗丹明6g的拉曼检测结果;
60.图9为实施例1制备的sers生物传感器对血清中糖蛋白125的拉曼检测结 果。
具体实施方式
61.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清 楚、完整地描述。
62.本发明提供一种基于碳三氮四纳米片的sers生物传感器,由由免疫探针、 免疫基底和糖蛋白125抗原组成,且其制备方法如下:
63.步骤1,制备免疫探针:
64.1.1制备磁性纳米二硫化钼
65.需要说明的是,本发明优选磁性花状纳米二硫化钼作为磁性纳米二硫化钼, 可选的,本发明采用以下步骤制得磁性花状纳米二硫化钼:
66.1.1.1制备四氧化三铁:
67.将铁源、稳定剂和表面活性剂依次均匀分散于溶剂a中,并于200℃的温 度下水热反应10h,获得四氧化三铁小颗粒;
68.本发明不限制铁源的具体类型,只要能够提供fe即可,比如可选自七水合 硫酸亚铁、四水合二氯化铁和六水氯化铁中的任意一种。
69.本发明不限制稳定剂的具体类型,只要能够防止颗粒间的团聚即可,如可 选自乙酸钠、柠檬酸钠和醋酸钠中的任意一种。
70.本发明不限制表面活性剂的具体类型,只要能够防止颗粒间的团聚即可。
71.本发明溶液a的具体类型,只要能够与铁源、稳定剂和表面活性剂形成均 匀的溶液或悬浮液即可。
72.本发明不限制铁源、稳定剂和表面活性剂在溶剂a中的分散方式,只要能 将铁源、稳定剂和表面活性剂均匀分散于溶剂a中即可。
73.1.1.2水热合成:
74.将钼酸盐、硫源和四氧化三铁小颗粒均匀分散于溶剂b中,并于180~220℃ 的温度下水热反应6~12h,冷却至室温后,洗涤干燥,获得二硫化钼包覆四氧化 三铁的磁性纳米二硫化钼;
75.本发明不限制钼酸盐的具体类型,只要能够提供钼离子即可,如可选自钼 酸钠或钼酸铵。
76.本发明不限制硫源的具体类型,只要能够提供s即可,如可选自硫代乙酰 胺或硫脲。
77.本发明本发明不限制溶液b的具体类型,只要能够与钼酸盐、硫源和四氧 化三铁形成均匀的溶液或悬浮液即可。
78.本发明不限制钼酸盐、硫源和四氧化三铁在溶剂b中的分散方式,只要能 将钼酸盐、硫源和四氧化三铁均匀分散于溶剂b中即可。
79.本发明不限制洗涤处理的具体方式,只要能够将产物表面杂质(如未反应 完全的物质)进行除去即可。
80.本发明不限制干燥处理的具体方式,只要能够去除产物表面残留的溶剂即 可。
81.1.2标记磁性纳米二硫化钼
82.为了便于标记,本发明将磁性纳米二硫化钼配制成溶液后再进行标记:上 述获得的磁性纳米二硫化钼粉末在超声下均匀溶解在去离子水中,以配制成浓 度为5~15mg/ml
的磁性纳米二硫化钼溶液。
83.将拉曼分子与磁性纳米二硫化钼溶液混合后进行培养处理a,随后,加入 亚胺化合物的磷酸缓冲盐溶液进行培养处理b,磁性分离处理后,将其均匀分散 于磷酸缓冲盐水溶液中,获得罗丹明6g标记的磁性纳米二硫化钼溶液;
84.需要说明的是,本发明不限制拉曼分子的具体类型,只要能够对磁性纳米 二硫化钼探针进行标记即可,如:可选自罗丹明6g、亚甲基蓝和结晶紫中的任 意一种,也可选择其他散射截面较大的拉曼分子。
85.本发明不限制拉曼分子标记磁性纳米二硫化钼的具体方式,只要能够实现 标记即可。
86.本发明为了便于对标记后的磁性纳米二硫化钼进行后续处理,在进行培养 处理b之前,还通过磁性分离清洗3次,以除去培养处理a过程中未结合的拉 曼分子。其中,需要说明的,在磁性分离清洗过程中,四氧化三铁赋予了二硫 化钼纳米花良好的磁性,可以用磁铁将磁性纳米二硫化钼牢牢吸附在试管壁上, 将试管中的溶液洗出来,再加入去离子水,重复上述操作。
87.本发明不限制培养处理b后的具体磁性分离方式,只要能够实现去除未吸 附在磁性纳米二硫化钼上的拉曼分子即可。可选的,本实施例中,采用磁铁吸 附的方式,将磁性纳米二硫化钼上的拉曼分子进行磁性分离,获得磁性处理后 的混合物料a。
88.本发明不限制培养处理b的具体方式,只要能够实现拉曼分子对磁性二氧 化钼纳米花进行标记,以进行后续sers检测即可。优选的,本发明以n-羟基 琥珀酰亚胺的磷酸缓冲盐溶液作为亚胺化合物的磷酸缓冲盐溶液,磷酸缓冲盐 溶液具有盐平衡、可调整的适宜ph缓冲作用。
89.1.3制备免疫探针
90.向上述拉曼分子的标记磁性纳米二硫化钼溶液中加入糖蛋白125抗体,进 行孵育处理a,然后加入牛血清蛋白封闭溶液,混合均匀后进行培养处理c,获 得免疫探针;
91.需要说明的是,本发明不限制孵育处理a的具体方式,只要能够实现将抗体 链接与磁性纳米二硫化钼上,以进行后续免疫反应即可。
92.为了提高牛血清蛋白封闭溶液对探针上非特异性吸附位点的封闭效果,本 发明在进行培养处理c前,还对孵育处理a后的磁性纳米二硫化钼溶液进行了 磁性分离处理,以除去多余的糖蛋白125抗体,获得混合物料b。
93.本发明不限制培养处理c的具体方式,只要能够实现将免疫探针上非特异 性吸附位点进行封闭即可。
94.1.4制备免疫探针溶液
95.将上述获得的免疫探针分散于磷酸缓冲盐溶液中,获得免疫探针溶液;
96.需要说明的是,为了提高探针的检测效果,本发明在将免疫探针分散于磷 酸缓冲盐溶液前,通过n-羟基琥珀酰亚胺的磷酸缓冲盐溶液,进行冲洗,并通 过磁铁磁性收集二硫化钼纳米花,清洗多次以将多余的牛血清蛋白进行去除, 然后将其溶解于磷酸缓冲盐溶液中,获得免疫探针溶液。
97.还需要说明的是,本发明中采用磷酸缓冲盐溶液配制免疫探针溶液的作用 为:起溶解保护试剂的作用;原因是磷酸盐缓冲液具有盐平衡、可调整的适宜 ph缓冲作用。一般
不能用其他材料代替,例如蒸馏水不具有盐平衡作用,可以 破坏生物蛋白的结构及生物特性;生理盐水不具有调整ph的作用,对完整的、 具有活性的物质不能保证其在最适条件下参与生物反应,所以使用磷酸盐缓冲 溶液是首选。
98.步骤2,制备免疫基底
99.2.1制备碳三氮四纳米片
100.本发明不限制碳三氮四纳米片的具体制备方法,只要能够获得直径为 50~300nm的碳三氮四纳米片即可。可选的,采用以下步骤获得碳三氮四纳米片:
101.按照碳三氮四粉末与浓盐酸2~3mg:1~2ml的用量比,将碳三氮四粉末添 加到浓盐酸中,于800w的超声功率下超声1~3h。然后,将混合溶液于70~90℃ 下反应8~20h。之后,该混合物用大量的去离子水进行洗涤至洗涤液呈中性,以 去除多余的盐酸,获得酸化后的碳三氮四。按照水溶剂与碳三氮四粉末 1~2mg:1~1.5ml的用量比,将酸化后的碳三氮四在超声作用(超声功率为800w, 超声时间为5~10min)下被分散到去离子水中。分散的碳三氮四在 2500~3500r/min的转速下离心5~20min,未剥落的大块碳三氮四下沉在试管壁底 部,质子化的碳三氮四纳米片被留在上清液中,上清液即为获得碳三氮四纳米 片溶液。
102.2.2制备免疫基底溶液
103.2.2.1活化碳三氮四:
104.将上述碳三氮四纳米片溶液与亚胺化合物均匀分散于磷酸缓冲盐溶液中, 并于36~38℃的温度下反应1~3h,以实现对碳三氮四纳米片进行活化,进而提 高蛋白质的偶联效率,获得活化后的碳三氮四纳米片溶液;
105.需要说明的是,本发明不限制碳三氮四纳米片溶液与亚胺化合物在磷酸缓 冲盐溶液中的具体分散方式,只要能够通过亚胺化合物实现对碳三氮四纳米片 的活化以提高蛋白质的偶联效率即可。
106.2.2.2形成免疫基底:
107.将糖蛋白125抗体与活化后的碳三氮四纳米片溶液混合后,进行孵化处理b, 固液分离,获得的固体组分即为免疫基底;
108.需要说明的是,本发明不限制步骤2.2.2中孵化处理b的具体方式,只要能 够实现将抗体链接在碳三氮四底上以进行后续免疫反应即可。
109.为了提高牛血清蛋白的处理效果,本发明在向混合物料c中加入牛血清蛋 白前,还对混合物料c进行了离心处理,以除去混合物料c中多余的糖蛋白125 抗体。
110.本发明不限制固液分离的具体方式,可选的,本实施例采用离心的方式进 行分离,并且通过对孵化处理b后产物离心洗涤两次,以除去过量的牛血清蛋 白,获得免疫基底。
111.2.2.3制备免疫基底溶液
112.将免疫基底在超声作用下溶解于磷酸缓冲盐溶液中,获得碳三氮四免疫基 底溶液;
113.需要说明的是,上述超声作用的超声功率为800w,超声时间为5~10min。
114.步骤3,制备三明治结构的sers生物传感器
115.将糖蛋白125抗原加入至上述碳三氮四免疫基底溶液中,进行孵育处理c, 获得混
合溶液a;
116.将免疫探针加入至混合溶液a中,混合后进行孵育处理d,通过抗原和抗 体将免疫基底和免疫探针结合形成三明治结构,进而获得sers生物传感器;
117.需要说明的是,本发明不限制孵育处理c的具体方式,只要能够将抗原链接 在碳三氮四基底上以进行后续免疫反应即可。
118.本发明为了避免溶液中未被获得抗原影响后续处理,还采用磷酸盐缓冲溶 液对孵育处理c获得的固体组分(固体组分沉在试管壁上,未链接上的抗原在 溶液中被吸走了)进行多次离心清洗处理,以去除未被捕获的抗原。
119.本发明不限制孵育处理d的具体方式,只要能够实现将抗原链接在碳三氮 四基底上以进行后续免疫反应即可。
120.需要说明的是,本实施例制备的具有三明治结构的sers生物传感器保存在 1ml磷酸盐缓冲溶液以备后续sers检测。且本实施例制备的具有三明治结构 的sers生物传感器进行完sers检测后,用可见光模拟器对免疫结构进行催化, 基于二硫化钼纳米花和碳三氮四纳米片良好的光催化活性可以降解拉曼分子、 抗原和抗体。催化完成后,采用磁铁分离和收集免疫探针和免疫基底,继续进 行后续肿瘤标志物检测。如此反复,实现可循环的免疫检测。
121.实施例1
122.本实施例提供一种基于碳三氮四纳米片的sers生物传感器,且本实施例的 基于碳三氮四纳米片的sers生物传感器的制备方法如下:
123.步骤1,制备免疫探针:
124.1.1制备磁性纳米二硫化钼
125.1.1.1制备四氧化三铁:
126.本实施例中,以六水氯化铁作为铁源;以乙酸钠作为稳定剂;以聚乙二醇 作为表面活性剂;以乙二醇为溶剂a;
127.将1.35g六水氯化铁加入至溶剂a中,随后在800w的超声功率下超声10min, 以溶解六水氯化铁,再依次加入3.6g乙酸钠和1g聚乙二醇后,再次于800w的 超声功率下超声10min,随后以300~500r/min的搅拌速率搅拌30min,以实现将 铁源、乙酸钠和聚乙二醇均匀分散于乙二醇中,然后于200℃的温度下水热反应 10h,获得四氧化三铁小颗粒。
128.1.1.2水热合成:
129.本实施例中,以钼酸铵作为钼酸盐,以硫脲作为硫源,以去离子水为溶剂b;
130.且本实施例以超声的方式进行分散处理,将0.35g钼酸铵、0.76g硫脲和 15.7mg上述四氧化三铁小颗粒加入至10ml去离子水中,于800w的超声功率 或功率下,超声10min,以将钼酸盐、硫源和四氧化三铁小颗粒均匀分散于溶剂 b中;随后将其于200℃的温度下水热反应10h,冷却至室温后,以无水乙醇和 去离子水依次洗涤3次,实现对产物表面杂质的去除;然后于60℃下干燥处理 6~12h,以去除产物表面残留的溶剂,即获得磁性纳米二硫化钼。
131.1.2标记磁性纳米二硫化钼
132.本实施例中,配制的磁性纳米二硫化钼溶液浓度为10mg/ml;且以罗丹明 6g作为拉曼分子;本实施例中,称取200μl的浓度为10mmol/l的罗丹明6g, 与1ml的浓度为10mg/ml
的磁性纳米二硫化钼溶液,并采用超声的方式的进行 标记处理,且超声的功率为800w,超声时间为3min,随后于室温下处理12h, 以完成培养处理a,以实现罗丹明6g分子与磁性纳米二硫化钼之间进行结合, 获得标记后的磁性纳米二硫化钼。
133.对标记后的磁性纳米二硫化钼进行磁性分离清洗3次,以除去培养处理a 过程中未结合的罗丹明6g分子。其中,需要说明的,在磁性分离清洗过程中, 四氧化三铁赋予了二硫化钼纳米花良好的磁性,可以用磁铁将磁性纳米二硫化 钼牢牢吸附在试管壁上,以将磁性纳米二硫化钼上的罗丹明6g分子进行磁性分 离,将试管中的溶液洗出来,再加入去离子水,重复上述操作3次,获得磁性 处理后的标记磁性纳米二硫化钼,即混合物料a。因为罗丹明6g溶液是红色的, 当试管中的溶液没有成透明状时即可认为清洗完成。
134.然后,以n-羟基琥珀酰亚胺的磷酸缓冲盐溶液作为亚胺化合物的磷酸缓冲 盐溶液,磷酸缓冲盐溶液具有盐平衡、可调整的适宜ph缓冲作用。称取1ml 浓度为0.02mol/l的n-羟基琥珀酰亚胺,并加入上述获得混合物料a分散均匀, 随后于37℃的培养温度下培养1h,完成培养处理b,以提高蛋白质的偶联效率, 获得罗丹明6g标记磁性纳米二硫化钼溶液。
135.1.3制备免疫探针
136.本实施例中,称取20μl的浓度为0.2mg/ml的糖蛋白125抗体加入至上述罗丹 明6g标记磁性纳米二硫化钼溶液中,混匀后于4℃的温度下反应2h,完成孵育处 理a,以实现将抗体链接与磁性纳米二硫化钼上;然后进行磁性分离处理,以除 去多余的糖蛋白125抗体,获得混合物料b;随后,称取10μl的质量浓度为3%的 牛血清蛋白封闭溶液加入至上述混合物料b中,混匀后于37℃的温度下反应1h, 完成培养处理c,以实现将免疫探针上非特异性吸附位点进行封闭,获得免疫探 针。
137.1.4制备免疫探针溶液
138.本实施例中,通过浓度为0.02mol/l的n-羟基琥珀酰亚胺的磷酸缓冲盐溶 液对上述免疫探针进行冲洗,并通过磁铁磁性收集二硫化钼纳米花,清洗4次, 以将多余的牛血清蛋白进行去除,然后将其溶解于1ml的磷酸缓冲盐溶液中, 获得免疫探针溶液,以提高探针的检测效果。
139.本实施例中采用磷酸缓冲盐溶液配制免疫探针溶液的作用为:起溶解保护 试剂的作用;原因是磷酸盐缓冲液具有盐平衡、可调整的适宜ph缓冲作用。一 般不能用其他材料代替,例如蒸馏水不具有盐平衡作用,可以破坏生物蛋白的 结构及生物特性;生理盐水不具有调整ph的作用,对完整的、具有活性的物质 不能保证其在最适条件下参与生物反应,所以使用磷酸盐缓冲溶液是首选。
140.步骤2,制备免疫基底
141.2.1制备碳三氮四纳米片
142.本发明采用以下步骤获得碳三氮四纳米片:
143.将25mg碳三氮四粉末添加到15ml的浓盐酸中,于800w的超声功率下超 声2h。然后,将混合溶液转移进25ml反应釜中,80℃下反应12h。之后,该混 合物用大量的去离子水进行洗涤至洗涤液呈中性,以去除多余的盐酸。酸化后 的碳三氮四在超声作用(超声功率为800w,超声时间为5~10min)下被分散到 5ml的去离子水中。分散的碳三氮四在3000r/min的转速下离心10min,未剥落 的大块碳三氮四下沉在试管壁底部,质子化的碳三氮四纳
米片被留在上清液中, 上清液即为获得碳三氮四纳米片溶液,获得直径为50~300nm的碳三氮四纳米片。
144.2.2制备免疫基底溶液
145.2.2.1活化碳三氮四:
146.采用超声的方式进行分散,以n-羟基琥珀酰亚胺磷酸缓冲盐溶液作为亚胺 化合物的磷酸缓冲盐溶液,称取1ml浓度为0.02mol/l的n-羟基琥珀酰亚胺的 磷酸缓冲盐溶液,并加入上述2.1获得的碳三氮四溶液,于800w的超声功率下 超声3min分散均匀,并于37℃的温度下反应1h,以实现对碳三氮四纳米片进 行活化,进而提高蛋白质的偶联效率,获得活化后的碳三氮四纳米片溶液。
147.2.2.2形成免疫基底:
148.称取20μl的浓度为0.2mg/ml的糖蛋白125抗体加入至上述1ml活化后的 碳三氮四纳米片溶液中,混匀后于4℃的培养温度下培养2h,获得混合物料c; 随后以8000r/min的速率对混合物料c离心处理10min,以除去混合物料c中多 余的糖蛋白125抗体;然后加入10μl质量浓度为3%的牛血清蛋白磷酸盐缓冲 溶液,随后于室温下孵化1h,以实现将抗体链接在碳三氮四底上,完成孵化处 理b;然后采用离心的方式对孵化处理b后的产物进行分离,并且通过对孵化 处理b后产物离心洗涤两次,以除去过量的牛血清蛋白,获得浓度为1~2mg/ml 的免疫基底。
149.2.2.3制备免疫基底溶液
150.将上述免疫基底于800w的超声功率下超声5~10min以溶解于1ml的磷酸 缓冲盐溶液中,获得碳三氮四免疫基底溶液。
151.步骤3,制备三明治结构的sers生物传感器
152.称取10~30μl的初始浓度为100iu/ml的糖蛋白125抗原加入至1ml上述 碳三氮四免疫基底溶液中,并于37℃的孵化温度下孵化2h,以将糖蛋白125抗 原链接在碳三氮四基底上,以实现孵育处理c;随后,采用磷酸盐缓冲溶液对孵 育处理c获得的固体组分(固体组分沉在试管壁上,未链接上的抗原在溶液中 被吸走了)进行以8000r/min的速率离心10min,以去除未被捕获的抗原,获得 混合溶液a;然后,称取0.5~1.5ml上述免疫探针溶液加入至上述混合溶液a 中,并于37℃的培养温度下培养2h,完成孵育处理d,以基于抗原与抗体之间 的特异性免疫反应,形成具有三明治结构的sers生物传感器。
153.需要说明的是,本实施例制备的具有三明治结构的sers生物传感器保存在 1ml磷酸盐缓冲溶液以备后续sers检测。且本实施例制备的具有三明治结构 的sers生物传感器进行完sers检测后,用可见光模拟器对免疫结构进行催化, 基于二硫化钼纳米花和碳三氮四纳米片良好的光催化活性可以降解拉曼分子、 抗原和抗体。催化完成后,采用磁铁分离和收集免疫探针和免疫基底,继续进 行后续肿瘤标志物检测。如此反复,实现可循环的免疫检测。
154.实施例2
155.本实施例提供一种基于碳三氮四纳米片的sers生物传感器,且其制备方法 与实施例1的区别仅在于:
156.本实施例步骤1中,四氧化三铁颗粒的用量为62.8mg。
157.实施例3
158.本实施例提供一种基于碳三氮四纳米片的sers生物传感器,且其制备方法 与实施例1的区别仅在于:
159.本实施例步骤1中,四氧化三铁颗粒的用量为125.6mg。
160.实施例4
161.本实施例提供一种基于碳三氮四纳米片的sers生物传感器,且其制备方法 与实施例1的区别仅在于:
162.本实施例步骤1.1.1中:以七水合硫酸亚铁作为铁源,以柠檬酸钠作为稳定 剂;
163.本实施例步骤1.1.2中:
164.以钼酸钠为钼酸盐,以硫代乙酰胺为硫源,且钼酸盐与硫源和四氧化三铁 的摩尔比为1.5:10:0.55;
165.且水热反应的温度为180℃,反应时间为12h;
166.本实施例步骤1.2中:
167.以亚甲基蓝作为拉曼分子,且拉曼分子与磁性纳米二硫化钼的用量比为 1mmol:10g;
168.培养处理a的处理温度为20℃,处理时间为14h;
169.培养处理b的处理温度为36℃,处理时间为2h。
170.本实施例步骤1.3中:
171.糖蛋白125抗体与罗丹明6g标记磁性纳米二硫化钼的质量比为2:1000,即 取10μl的浓度为0.2mg/ml的糖蛋白125抗体加入至1ml罗丹明6g标记磁性 纳米二硫化钼溶液中;
172.孵育处理a的处理温度为3℃,处理时间为2.5h;
173.培养处理c的处理温度为36℃,处理时间为2h。
174.本实施例步骤1.4中:
175.二硫化钼纳米花免疫探针与磷酸盐缓冲溶液的用量比为10mg:1.5ml。
176.本实施例步骤2.1中:
177.碳三氮四粉末与浓盐酸的用量比为2mg:1ml,且酸化时的温度为70℃反应 20h;
178.水溶剂与碳三氮四粉末的用量比为1~2mg:1~1.5ml。
179.本实施例步骤2.2.1中:
180.活化处理的温度为36℃,处理时间为2h;
181.本实施例步骤2.2.2中:
182.糖蛋白125抗体与活化后的碳三氮四纳米片溶液的用量比为 0.0026mg:1.5ml;
183.孵育处理b的处理温度为3℃,处理时间为2.5h;
184.本实施例步骤2.2.3中:
185.免疫基底与磷酸盐缓冲溶液的用量比为1mg:1.5ml;
186.本实施例步骤3中:
187.糖蛋白125抗原的浓度为80iu/ml,且糖蛋白125抗原与免疫基底溶液的 用量比为0.002mg:1.5ml;
188.孵育处理c的处理温度为36℃,培养时间为3h;
189.免疫探针溶液与混合溶液a的用量比为1.5ml:1.5ml;
190.孵育处理d的孵化温度为36℃,孵化时间为3h;
191.且各个步骤中使用的磷酸缓冲盐溶液均采用浓度为0.07mol/l的1-(3-二甲 基氨基丙基)-3-乙基碳二亚胺的磷酸缓冲盐溶液。
192.实施例5
193.本实施例提供一种基于碳三氮四纳米片的sers生物传感器,且其制备方法 与实施例1的区别仅在于:
194.本实施例步骤1.1.1中:以四水合二氯化铁作为铁源,以醋酸钠作为稳定剂。
195.本实施例步骤1.1.2中:以钼酸钠为钼酸盐,且钼酸盐与硫源和四氧化三铁 的摩尔比为2:10:0.06;水热反应的温度为220℃,反应时间为8h;
196.本实施例步骤1.2中:
197.以结晶紫作为拉曼分子,且拉曼分子与磁性纳米二硫化钼的用量比为 3mmol:10g;
198.培养处理a的处理温度为25℃,处理时间为8h;
199.培养处理b的处理温度为38℃,处理时间为0.5h。
200.本实施例步骤1.3中:
201.糖蛋白125抗体与罗丹明6g标记磁性纳米二硫化钼的质量比为6:1000,即 取30μl的浓度为0.2mg/ml的糖蛋白125抗体加入至1ml罗丹明6g标记磁性 纳米二硫化钼溶液中;
202.孵育处理a的处理温度为5℃,处理时间为1.5h;
203.培养处理c的处理温度为38℃,处理时间为0.5h。
204.本实施例步骤1.4中:
205.二硫化钼纳米花免疫探针与磷酸盐缓冲溶液的用量比为10mg:1.3ml。
206.本实施例步骤2.1中:
207.碳三氮四粉末与浓盐酸的用量比为3mg:2ml,且酸化时的温度为90℃反应 8h;
208.水溶剂与碳三氮四粉末的用量比为2mg:1ml。
209.本实施例步骤2.2.1中:
210.活化处理的温度为38℃,处理时间为0.5h;
211.本实施例步骤2.2.2中:
212.糖蛋白125抗体与活化后的碳三氮四纳米片溶液的用量比为0.006mg:1.3ml;
213.孵育处理b的处理温度为5℃,处理时间为1.5h;
214.本实施例步骤2.2.3中:
215.免疫基底与磷酸盐缓冲溶液的用量比为2mg:1.3ml;
216.本实施例步骤3中:
217.糖蛋白125抗原的浓度为120iu/ml,且糖蛋白125抗原与免疫基底溶液的 用量比为0.006mg:1.3ml;
218.孵育处理c的处理温度为38℃,培养时间为1h;
219.免疫探针溶液与混合溶液a的用量比为1.3ml:1.3ml;
220.孵育处理d的孵化温度为38℃,孵化时间为1h;
221.且各个步骤中使用的磷酸缓冲盐溶液均采用浓度为0.09mol/l的1-(3-二甲 基氨基丙基)-3-乙基碳二亚胺的磷酸缓冲盐溶液。
222.试验部分
223.(一)扫描电子显微镜测试
224.本发明分别对实施例1、实施例2和实施例3中制备的免疫探针,以及实施 例1制备的免疫基底和sers生物传感器均进行了扫描电子显微镜测试,其结果 分别如图1-5所示。
225.图1为实施例1制备的免疫探针的扫描电子显微镜照片,可以看出,实施 例1制备的免疫探针中,二硫化钼纳米片生长在四氧化三铁颗粒表面。由于加 入的四氧化三铁颗粒较少,有很多单独存在的二硫化钼。
226.图2为实施例2制备的免疫探针的扫描电子显微镜照片,可以看出,实施 例2制备的免疫探针中,随着加入的四氧化三铁颗粒变多,更多的二硫化钼纳 米花形成了。
227.图3为实施例3制备的免疫探针的扫描电子显微镜照片,可以看出,实施例3 制备的免疫探针中,随着四氧化三铁颗粒的继续增多,四氧化三铁颗粒镶嵌进 二硫化钼纳米片里。
228.图4为实施例1制备的免疫基底的扫描电子显微镜照片,可以看出,实施例1 制备的免疫基底中,碳三氮四酸化后变小变薄了,具有更大的表面积。
229.图5为实施例1制备的sers生物传感器的扫描电子显微镜照片,可以看出, 实施例1制备的sers生物传感器中,由于糖蛋白125抗原和抗体的特异性反应, 磁性纳米二硫化钼和碳三氮四纳米片紧密地结合在了一起。
230.(二)拉曼测试
231.本发明分别对实施例1、实施例2和实施例3中制备的免疫探针和免疫基 底,以及实施例1制备的sers生物传感器均于532nm激光下进行了对罗丹明 6g的拉曼检测,且测试分别如图6-9所示。
232.图6为实施例1制备的免疫探针和免疫基底对罗丹明6g的拉曼检测结果, 可以看出,实施例1制备免疫探针和免疫基底都对罗丹明6g有良好的拉曼增强 效果,其在1360cm-1
处的拉曼信号强度分别达到6913和5041。
233.图7为实施例2制备的免疫探针对罗丹明6g的拉曼检测结果,可以看出, 实施例2制备的免疫探针对罗丹明6g有良好的拉曼增强效果,其在1360cm-1
处 的拉曼信号强度达到8246。
234.图8为实施例3制备的免疫探针对罗丹明6g的拉曼检测结果,可以看出, 实施例3制备的免疫探针对罗丹明6g有sers增强效果,其在1360cm-1
处的 拉曼信号强度达到6959。
235.图9为实施例1制备的sers生物传感器对血清中糖蛋白125的拉曼检测结 果,可以看出,实施例1制备的sers生物传感器可以实现血清中糖蛋白125 的超灵敏检测。
236.显然,上述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。 基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所 获得的所有其他实施例,都属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1