一种基于黑磷纳米片的SERS生物传感器及其制备方法和应用
一种基于黑磷纳米片的sers生物传感器及其制备方法和应用
技术领域
1.本发明涉及纳米生物技术领域,尤其涉及一种基于黑磷纳米片的sers生物传感器及其制备方法和应用。
背景技术:
2.表面增强拉曼散射(sers)技术由于检测灵敏度高、信号输出稳定以及操作流程简易,而在现有的多种癌症免疫分析方法中脱颖而出。
3.现有技术中,主要采用如au,ag等贵金属纳米粒子制备sers基免疫传感器,这类sers基免疫传感器的免疫基底由电沉积制备的多孔金基底辅助生长的三维多孔银构成,并通过离子溅射镀膜法在银层表面喷镀金膜来保护银层不受氧化,其免疫基底的制备工艺复杂,不易操作,采用的原料价格昂贵,且制备的基底还存在生物相容性差导致其检测效果差等缺陷,不利于sers基免疫传感器的发展应用。而且,这类sers基免疫传感器由于贵金属的存在,在光激发下,贵金属的电磁热点会产生局部热效应,进而会使生物分子或蛋白质变性以及附近组织凝固,影响了sers基免疫传感器的检测效果。
4.为此,本发明提供一种基于黑磷纳米片的sers生物传感器及其制备方法和应用。
技术实现要素:
5.为了解决上述现有技术中的不足,本发明提供一种基于黑磷纳米片的sers生物传感器及其制备方法和应用。
6.本发明的一种基于黑磷纳米片的sers生物传感器及其制备方法和应用是通过以下技术方案实现的:
7.本发明的第一个目的是提供一种基于黑磷纳米片的sers生物传感器,由免疫探针、免疫基底和待测抗原组成;
8.所述免疫探针由磁性二硫化钼纳米花上链接所述待测抗原对应的抗体获得;
9.所述免疫基底由黑磷纳米片上链接所述待测抗原对应的抗体获得;
10.且所述待测抗原与所述免疫探针和所述免疫基底之间特异性结合,形成三明治结构。
11.进一步地,所述磁性二硫化钼纳米花的直径为200~1000nm;所述黑磷纳米片直径为200~5000nm。
12.进一步地,所述待测抗原为psa肿瘤标志物、ca72-4肿瘤标志物、ca19-9、ca50和铁蛋白中的任意一种。
13.进一步地,所述磁性纳米二硫化钼的制备方法如下:
14.将钼酸盐、硫源和四氧化三铁均匀分散于水溶剂中,并于180~220℃的温度下水热反应6~12h,冷却至室温后,洗涤干燥,获得磁性纳米二硫化钼;
15.所述钼酸盐为钼酸钠或钼酸铵;
16.所述硫源为硫代乙酰胺或硫脲;
17.所述钼酸盐与硫源和四氧化三铁的摩尔比为2.5~5:5~11:0.25~0.9;
18.所述钼酸盐与溶剂b的用量比为0.15~0.2mol:1l。
19.进一步地,所述免疫探针由以下步骤获得:
20.以拉曼分子标记磁性二硫化钼纳米花,获得拉曼分子标记的磁性二硫化钼纳米花;在拉曼分子标记的磁性二硫化钼纳米花上链接所述待测抗原相对应的抗体,随后,通过封闭剂a封闭磁性二硫化钼纳米花表面非特异性吸附位点,获得免疫探针;
21.所述拉曼分子为罗丹明r6g、亚甲基蓝、4-巯基苯甲酸、2-萘硫醇中的任意一种;
22.所述封闭剂a为牛血清蛋白、酪蛋白和明胶中的任意一种。
23.进一步地,所述免疫基底由以下步骤获得:
24.在黑磷纳米片上链接所述待测抗原相对应的抗体,并通过封闭剂b封闭黑磷纳米片上非特异性吸附位点,获得黑磷纳米片免疫基底;
25.所述封闭剂b为牛血清蛋白、酪蛋白和明胶中的任意一种。
26.本发明的第二个目的是提供一种上述sers生物传感器的制备方法,包括以下步骤:
27.步骤1,将所述免疫基底均匀分散于磷酸盐缓冲溶液中,获得免疫基底溶液;
28.步骤2,将所述待测抗原加入至所述免疫基底溶液中,进行孵化处理a,获得混合溶液a,随向混合溶液a中加入免疫探针,混合后进行孵化处理b,获得sers生物传感器。
29.进一步地,所述免疫基底为溶液形式,且其浓度为3~7mg/ml;
30.所述免疫基底与所述磷酸盐缓冲溶液的体积比为0.5~1.5:1;
31.所述待测抗原的浓度为5~20μg/ml,且所述待测抗原与所述免疫基底溶液的体积比为1~3:100;
32.所述免疫探针为溶液形式,且其浓度为5~15mg/ml;
33.所述免疫探针与所述混合溶液a的体积比为0.5~1.5:1。
34.进一步地,所述孵化处理a的孵化温度为4℃,孵化时间为12h;
35.所述孵化处理b的培养温度为37℃,培养时间为1h。
36.本发明的第三个目的是提供一种上述sers生物传感器在肿瘤标志物检测中的应用。
37.本发明与现有技术相比,具有以下有益效果:
38.本发明的sers生物传感器由免疫探针、免疫基底和待测抗原组成;免疫探针由磁性二硫化钼纳米花上链接待测抗原对应的抗体获得;免疫基底以黑磷纳米片为基质,通过在其上链接待测抗原对应的抗体以形成免疫基底,制备工艺简单易操作,且制备原料价格不高。并且,其带隙在0.5-2ev范围内,与免疫探针上的磁性二硫化钼纳米花之间具有非常匹配的交错能带结构,极大地促进了化学增强效应,显著地放大了标记分子的拉曼信号,使得本发明的sers免疫传感器具有良好的生物相容性,很好的解决了传统的贵金属传感器会使生物分子或蛋白质变性以及附近组织凝固等问题。
39.本发明免疫传感器中的二硫化钼和黑磷两种半导体的具有高载流子迁移率,且使得本发明的免疫传感器还具有卓越的光催化性能,有利于抗原、抗体和拉曼分子的快速降解。同时,本发明通过在二硫化钼制备过程中加入一定量的四氧化三铁,不仅能够实现对纳米二硫化钼形貌的改善,增强其对待测物质的吸附效果,提高其检测效果,同时有利于采用
外部磁铁即可以实现免疫探针和免疫基底有效分离和双循环使用。
40.本发明制备的sers免疫传感器,通过保存在磷酸盐缓冲溶液中以备后续sers检测。在进行完sers检测后,用可见光模拟器对免疫结构进行照射,可以基于二硫化钼纳米花和黑磷纳米片良好的光催化活性降解拉曼分子、抗原和抗体。最后,采用磁铁将免疫探针和免疫基底进行分离收集,用于后续肿瘤标志物检测。如此反复,实现可循环免疫检测。
41.本发明制备的基于黑磷纳米片的sers生物传感器,凭借其强大的sers增强,卓越的生物相容性和光催化活性,可用于肿瘤标志物的超灵敏、可循环检测。
附图说明
42.图1为实施例1制备的免疫探针的扫描电子显微镜照片;
43.图2为实施例2制备的免疫探针的扫描电子显微镜照片;
44.图3为实施例3制备的花免疫探针的扫描电子显微镜照片;
45.图4为实施例1制备的免疫基底的扫描电子显微镜照片;
46.图5为实施例2制备的免疫基底的扫描电子显微镜照片;
47.图6为实施例3制备的免疫基底的扫描电子显微镜照片;
48.图7为实施例1制备的sers生物传感器的扫描电子显微镜照片;
49.图8为实施例1制备的花免疫探针和免疫基底对罗丹明6g的拉曼检测结果;
50.图9为实施例2制备的免疫探针对罗丹明6g的拉曼检测结果;
51.图10为实施例3制备的纳米花免疫探针对罗丹明6g的拉曼检测结果;
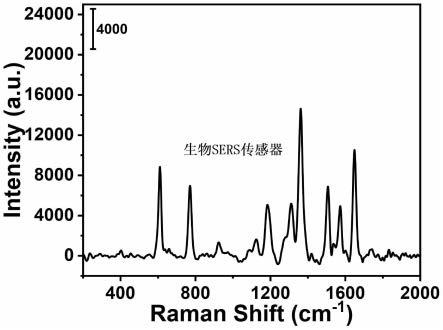
52.图11为实施例1制备的sers生物传感器对血清中铁蛋白的拉曼检测结果。
具体实施方式
53.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。
54.实施例1
55.本实施例提供一种基于黑磷纳米片的sers生物传感器,由免疫探针、免疫基底和待测抗原组成;
56.所述免疫探针由磁性二硫化钼纳米花上链接所述待测抗原对应的抗体获得;
57.所述免疫基底由黑磷纳米片上链接所述待测抗原对应的抗体获得;
58.且所述待测抗原与所述免疫探针和所述免疫基底之间特异性结合,形成三明治结构。
59.本发明中的待测抗原可根据实际需求进行选择,比如:要研究前列腺相关疾病,可以选择psa肿瘤标志物;要检测胃癌,可选择ca72-4肿瘤标志物;要检测肠癌,可选择ca19-9;要检测消化系统疾病,则可选择ca50。铁蛋白是一种壳状载体蛋白,在增殖,血管生成,免疫抑制和铁递送中起作用。许多癌症患者血清中的铁蛋白水平较高,这与侵袭性疾病和不良临床结果非常相关。此外,铁蛋白在肿瘤相关巨噬细胞中高度表达,这些巨噬细胞近年来被认为在肿瘤检测进展和治疗抵抗中具有关键作用。这些特征表明铁蛋白可能成为癌症治疗的有吸引力的靶标,因此,本实施例选择铁蛋白抗原作为检测对象,则本实施例的sers生物传感器由免疫探针、免疫基底和铁蛋白抗原组成,且所述免疫探针由磁性二硫化钼纳米
花上链接铁蛋白抗体获得;所述免疫基底由黑磷纳米片上链接铁蛋白抗体获得。
60.且本实施例的基于黑磷纳米片的sers生物传感器的制备方法如下:
61.步骤1,将免疫基底均匀分散于磷酸盐缓冲溶液中,获得免疫基底溶液;
62.需要说明的是,本发明以磷酸盐缓冲溶液作为溶剂,不仅能够溶解保护免疫基底且其具有盐平衡、可调整的适宜ph缓冲作用,能够保证生物活性物质维持其完整的特性。
63.本发明不限制免疫基底的具体制备方法,只要能够在黑磷纳米片上有链接铁蛋白抗体,使得制备的免疫基底通过其上的铁蛋白抗体与铁蛋白抗原之间能够进行特异性免疫反应即可。本实施例中,按照5mg:1ml的用量比,将1ml的5mg/l免疫基底分散于在1ml磷酸盐缓冲溶液中,获得免疫基底溶液。
64.步骤2,将铁蛋白抗原加入至免疫基底溶液中,进行孵化处理a,获得混合溶液a,随向混合溶液a中加入免疫探针,混合后进行孵化处理b,获得sers生物传感器;
65.需要说明的是,本发明不限制本发明不限制孵化处理a的具体工艺,只要能够使免疫基底溶液中黑鳞纳米片上链接的铁蛋白抗体充分捕获铁蛋白抗原,进而便于与后续加入的免疫探针形成三明治免疫结构的sers生物传感器即可。可选的,本实施例中,称取20μl的5μg/ml铁蛋白抗原,加入至上述1ml的免疫基底溶液中,并于37℃的孵化温度下孵化2h,获得混合溶液a。本发明不限制本发明不限制孵化处理b的具体工艺,只要能够使免疫探针中磁性二硫化钼纳米花上链接的铁蛋白抗体,与免疫基底上特异性免疫结合的铁蛋白抗原之间通过特异性免疫结合,形成三明治免疫结构的sers生物传感器即可。可选的,本实施例中,向上述混合溶液a中加入3~9mg免疫探针,随后于37℃下培养2小时。
66.还需要说明的是,为了避免铁蛋白抗原与免疫基底结合的不充分,使得后续加入的免疫探针无法有效与免疫基底上特异性免疫结合的铁蛋白抗原之间通过特异性免疫结合,本实施例在加入免疫探针前,还用磷酸盐缓冲溶液清洗去除未被捕获的抗原。
67.本实施例中,还需要说明的是,上述免疫基底采用以下步骤制得免疫基底:
68.s1,制备黑磷纳米片
69.将黑磷研磨粉均匀分散于溶剂a中,并排出溶液中溶解的氧气,随后进行超声处理,实现剥离黑磷纳米片,即获得黑磷纳米片溶液;
70.其中,采用的溶剂a可选自n-甲基吡咯烷酮、n,n-二甲基甲酰胺、过氧化羟基异丙苯和水中任意一种,只要能够在超声波辅助下,使得溶剂分子能破坏块状黑磷层与层之间的范德华力,从而得到大量且稳定分散的少层黑磷纳米片溶液即可。本实施例中,优选n-甲基吡咯烷酮作为溶剂,不仅有利于大规模超声少层黑磷纳米片分散液,还能在剥离过程中阻止黑磷的氧化。
71.本发明不限制排出溶液中溶解的氧气的具体方式,只要能够将溶液中溶解的氧气排出即可。可选的,本实施例中,采用氩气鼓泡的方式,排出液体中溶解的氧气,其具体操作为:将连接在氩气钢瓶的橡胶管插入到盛放黑磷溶液的大试管中,采用惰性气体氩气鼓泡来除氧,氩气的流速为80ml/h,鼓泡时间为1h。处理至气泡均匀且稳定冒出时,可认为氧气排出完全。
72.本发明不限制s1超声处理的具体工艺,只要能够实现将从黑磷研磨粉上剥离获得黑磷纳米片,获得组分均一的黑磷纳米片溶液即可。可选的,本实施例中,按照1mg:1ml的用量比,将40mg黑磷研磨粉加入至40mln-甲基吡咯烷酮中,并采用300w的超声功率,于4~6℃
的温度下,超声4h,随后于2500r/min的转速下离心处理20min,除去未剥离的黑磷晶体,以获得的上清液作为组分均一的黑磷纳米片溶液。
73.s2,在黑磷纳米片上连接铁蛋白抗体
74.将铁蛋白抗体与黑磷纳米片溶液混合后,进行孵化处理c,获得混合溶液b;向所述混合溶液b中加入牛血清蛋白以封闭黑磷纳米片上非特异性吸附位点,获得黑磷纳米片免疫基底;
75.需要说明的是,本发明不限制孵化处理c的具体方法,只要能够将铁蛋白抗体链接于黑磷纳米片上以形成免疫基底即可。可选的,本实施例中,称取20μl的浓度为0.2mg/ml的铁蛋白抗体加入至1ml上述黑磷纳米片溶液中,混匀后于4℃的培养温度下培养12h,获得培养处理后的黑磷纳米片溶液。
76.本发明为了能够封闭黑磷纳米片上的非特异性吸附位点,本发明首先采用磷酸盐缓冲溶液对培养处理后的黑磷纳米片溶液中的产物进行洗涤,且对链接了抗体的黑磷纳米片进行洗涤时,先通过离心对黑磷纳米片溶液进行固液分离,将溶液去除后得到黑磷纳米片固体,然后用磷酸盐缓冲溶液清洗黑磷纳米片固体2-3次至洗涤液均一且澄清,最后将其分散在1ml的磷酸盐缓冲溶液中。随后,向洗涤处理后的黑磷纳米片溶液中加入3wt%牛血清蛋白后,在37℃下孵化处理1h,然后以2500r/min的离心速率离心,然后采用磷酸盐缓冲溶液清洗去除多余的牛血清蛋白,以封闭非特异性吸附位点,获得黑磷纳米片免疫基底。
77.本实施例中,还需要说明的是,所述免疫探针通过以下步骤制得:
78.s1,在磁性二硫化钼纳米花上链接铁蛋白抗体:
79.以拉曼分子标记磁性二硫化钼纳米花,随后加入铁蛋白抗体进行孵化处理d,获得混合溶液c;
80.需要说明的是,由于血清中的生物成分复杂,并且其散射截面较小,使得基于sers技术直接对癌症标志物进行特异性检测存在较大困难。本发明采用拉曼分子标记间接检测策略,开发了一种非金属的三明治免疫传感器用于检测血清中的铁蛋白。上述拉曼分子可选自罗丹明r6g、亚甲基蓝、4-巯基苯甲酸、2-萘硫醇中任意一种。发明人考虑到罗丹明r6g与本发明使用的激发波长为532nm的光谱仪非常适配,为了得到更准确的检测结果,罗丹明r6g为本发明的sers标记的最佳选择,且本实施例中采用罗丹明r6g的作用是作为免疫传感器的sers标记,其拉曼信号强度间接反应铁蛋白的含量。
81.且本发明不限制罗丹明r6g标记磁性二硫化钼纳米花的具体方式,只要能够实现标记即可。由于免疫反应需要在溶液中进行,因此,本发明在溶液状态下标记磁性二硫化钼纳米花。可选的,本实施例中,称取20mg磁性二硫化钼纳米花将其均匀分散于1ml去离子水中,获得磁性二硫化钼纳米花溶液;随后,向上述磁性二硫化钼纳米花溶液中加入200μl的浓度为10-2
mol/l的罗丹明r6g,并采用室温搅拌的方式的进行标记处理,且搅拌的速率为200r/min,搅拌时间为12h。
82.为了避免孵化处理d加入的多余铁蛋白抗体影响后续处理,本发明还对混合溶液c进行了以下处理:将磁铁靠近盛放磁性二硫化钼纳米花免疫探针溶液的试管周围,由于附着在二硫化钼纳米花上的四氧化三铁与外部磁铁的相互吸引,成功构筑的二硫化钼纳米花免疫探针被快速吸到靠近磁性的试管壁上。这时用移液枪将试管中的溶液吸出,然后加入4-5毫升的去离子水振荡清洗,接着再利用磁铁和移液枪将液体去除,重复该过程5-6次直
到多余的铁蛋白被全部去除,溶液呈现透明澄清状态。
83.s2,封闭磁性二硫化钼纳米花表面非特异性吸附位点:
84.向混合溶液c中加入牛血清蛋白进行孵化处理e,以封闭磁性二硫化钼纳米花表面裸露的位置,获得磁性二硫化钼纳米花免疫探针;
85.本发明为了便于对标记后的磁性二硫化钼纳米花进行后续处理,在进行孵化处理e之前,还通过磁性收集对罗丹明6g标记后的磁性二硫化钼纳米花进行清洗,并将清洗后获得的产物均匀分散于1ml的磷酸盐缓冲溶液后,获得磁性二硫化钼纳米花溶液,再向磁性二硫化钼纳米花溶液加入铁蛋白抗体进行孵化处理。其中,磁性收集具体采用以下步骤进行:采用铷钕铁硼长方形强力磁铁(50*30*10毫米)进行清洗处理。利用罗丹明6g对磁性二硫化钼纳米花进行标记以制备免疫探针。为了免疫检测的准确性,多余的罗丹明6g分子需要被清洗去除。具体的实施过程如下:将磁铁靠近盛放罗丹明6g标记了的磁性二硫化钼纳米花溶液的试管。由于附着在二硫化钼纳花上的四氧化三铁与外部磁铁的相互吸引,成功标记的二硫化钼纳米花快被快速吸到靠近磁性的试管壁上。这时用移液枪将试管中的溶液吸出,然后加入4-5毫升的去离子水振荡清洗,接着再利用磁铁和移液枪将液体去除,重复该过程5-6次直到多余罗丹明6g分子被全部去除,溶液呈现透明澄清状态。
86.本发明不限制孵化处理e的具体方式,只要能够使铁蛋白抗体紧密锚定在标记后的磁性二硫化钼表面,便于后续捕获铁蛋白抗原,进而形成sers生物传感器即可。可选的,本实施例中,向去除多余铁蛋白抗体后的磁性二硫化钼纳米花溶液中加入3wt%牛血清蛋白,以封闭样品表面裸露的位置,并于37℃的培养温度下培养1h,获得磁性二硫化钼纳米花免疫探针。
87.还需要说明的是,本实施例中上述磁性花状二硫化钼均具有四氧化三铁包覆二硫化钼结构,且其通过以下步骤获得:
88.将铁源和螯合剂均匀分散于溶剂a中,并于180℃的温度下水热反应1.5h,获得四氧化三铁小颗粒;将钼酸盐、硫源和四氧化三铁小颗粒,按照钼酸盐与硫源和四氧化三铁2.5~5:5~11:0.25~0.9的摩尔比均匀分散于溶剂b中,并于200℃的温度下水热反应20h,冷却至室温后,将产品洗涤3遍并且在80℃下干燥8~12h,获得具有四氧化三铁包覆二硫化钼结构的磁性二硫化钼纳米花;
89.其中,本发明不限制铁源的具体类型,只要能够提供fe即可,可选自氯化铁、硝酸铁、亚铁氰化钾和七水硫酸亚铁中的任意一种。可选的,本发明以氯化铁作为铁源,并称取0.54g备用。
90.本发明不限制螯合剂的具体类型,只要能够与三价铁离子螯合生成红褐色的氢氧化铁,并在高温高压的条件,最终生成黑色的四氧化三铁即可。本发明的螯合剂可选自三乙醇胺、乙二醇和乙二胺中的任意一种。可选的,本实施例中,以三乙醇胺为螯合剂。
91.本发明溶液a的具体类型,只要能够与铁源与三乙醇胺形成均匀的溶液或悬浮液即可。可选的,本实施例中,以去离子水为溶剂a。
92.本发明不限制铁源与三乙醇胺在溶剂a中的分散方式,只要能将铁源与三乙醇胺均匀分撒与溶剂a中即可。可选的,本发明以搅拌的方式进行分散处理,将0.78g氯化铁与4ml三乙醇胺以800r/min的搅拌速率搅拌30min。
93.本发明不限制钼酸盐的具体类型,只要能够提供钼离子即可,可选自钼酸铵、钼酸
钙和钼酸钠中的任意一种。可选的,本实施例以钼酸钠作为钼酸盐,并称取0.78g备用。
94.本发明不限制硫源的具体类型,只要能够提供s即可,可选自硫脲、硫代乙酰胺、硫氰酸钾、二硫化碳和硫磺中的任意一种。可选的,本实施例以硫脲作为硫源,并称取0.6g备用。
95.本发明溶液b的具体类型,只要能够与钼酸盐、硫源和四氧化三铁形成均匀的溶液或悬浮液即可。可选的,本实施例中,以去离子水为溶剂b,并称取40ml备用。
96.本发明不限制钼酸盐、硫源和四氧化三铁在溶剂b中的分散方式,只要能将钼酸盐、硫源和四氧化三铁均匀分散于溶剂b中即可。可选的,本发明以搅拌的方式进行分散处理,将0.78g钼酸钠、0.6g硫脲和0.13g上述四氧化三铁小颗粒置于40ml以去离子水中,以800r/min的搅拌速率搅拌1h。
97.实施例2
98.本实施例提供一种基于黑磷纳米片的sers生物传感器,且本实施例的基于黑磷纳米片的sers生物传感器的制备方法与实施例1的区别仅在于:
99.本实施例在制备磁性二硫化钼纳米花时:
100.氯化铁的用量为0.78g,钼酸钠的用量为0.52g,硫脲的用量为0.4g,四氧化三铁小颗粒0.195g。
101.本实施例在制备免疫探针时:
102.罗丹明6g的用量为100μl,磁性二硫化钼纳米花的用量为0.5ml;
103.铁蛋白抗体的用量为10μl。
104.本实施例在制备免疫基底时:
105.铁蛋白抗体的用量为10μl;黑磷纳米片溶液的用量为0.5ml。
106.本实施例在制备sers生物传感器时:
107.铁蛋白抗原的用量为10μl;
108.磁性二硫化钼纳米花免疫探针的用量为0.5ml。
109.实施例3
110.本实施例提供一种基于黑磷纳米片的sers生物传感器,且且本实施例的基于黑磷纳米片的sers生物传感器的制备方法与实施例1的区别仅在于:
111.本实施例在制备磁性二硫化钼纳米花时:
112.氯化铁的用量为0.27g,三乙醇胺的用量为2ml;
113.钼酸钠的用量为1.04g,硫脲的用量为0.8g,四氧化三铁小颗粒0.065g。
114.本实施例在制备免疫探针时:
115.罗丹明6g的用量为300μl,磁性二硫化钼纳米花的用量为1.5ml;
116.铁蛋白抗体的用量为30μl。
117.本实施例在制备免疫基底时:
118.铁蛋白抗体的用量为30μl;黑磷纳米片溶液的用量为1.5ml。
119.本实施例在制备sers生物传感器时:
120.铁蛋白抗原的用量为30μl;
121.磁性二硫化钼纳米花免疫探针的用量为1.5ml。
122.实施例4
123.本实施例提供一种基于黑磷纳米片的sers生物传感器,且其制备方法与实施例1的区别仅在于:
124.本实施例在制备四氧化三铁时:以七水合硫酸亚铁作为铁源,以柠檬酸钠作为稳定剂;
125.本实施例在制备磁性纳米二硫化钼时:以钼酸铵为钼酸盐,以硫代乙酰胺为硫源,且钼酸盐与硫源和四氧化三铁的摩尔比为2.5:5:0.25;
126.水热反应的温度为180℃,反应时间为12h;
127.本实施例在制备免疫探针时:
128.以亚甲基蓝作为拉曼分子。
129.实施例5
130.本实施例提供一种基于黑磷纳米片的sers生物传感器,且其制备方法与实施例1的区别仅在于:
131.本实施例在制备四氧化三铁时:以亚铁氰化钾作为铁源,以柠檬酸钠作为螯合剂;
132.本实施例在制备磁性纳米二硫化钼时:以钼酸铵为钼酸盐,以硫代乙酰胺为硫源,且钼酸盐与硫源和四氧化三铁的摩尔比为5:11:0.9;
133.水热反应的温度为220℃,反应时间为6h。
134.试验部分
135.(一)扫描电子显微镜测试
136.本发明分别对实施例1、实施例2和实施例3中制备的磁性二硫化钼纳米花免疫探针和黑磷纳米片免疫基底,以及实施例1制备的sers生物传感器均进行了扫描电子显微镜测试,其结果分别如图1-7所示。
137.图1为实施例1制备的磁性二硫化钼纳米花免疫探针的扫描电子显微镜照片,可以看出,实施例1制备的磁性二硫化钼纳米花免疫探针中,二硫化钼由具有尖刺边缘的二维纳米片自组装形成。同时,还观察出,极小的四氧化三铁颗粒随机装饰在花瓣表面。
138.图2为实施例2制备的磁性二硫化钼纳米花免疫探针的扫描电子显微镜照片,可以看出,实施例2制备的磁性二硫化钼纳米花免疫探针中,大量的四氧化三铁颗粒覆盖在二硫化钼纳米花表面。
139.图3为实施例3制备的磁性二硫化钼纳米花免疫探针的扫描电子显微镜照片,可以看出,实施例3制备的磁性二硫化钼纳米花免疫探针中,二硫化钼由具有尖刺边缘的二维纳米片自组装形成。同时,极少量的四氧化三铁颗粒覆盖在二硫化钼表面。
140.图4为实施例1制备的黑磷纳米片免疫基底的扫描电子显微镜照片,可以看出,实施例1制备的免疫基底中,黑磷纳米片表面光滑且平坦,为生物分子提供丰富的附着位点。
141.图5为实施例2制备的黑磷纳米片免疫基底的扫描电子显微镜照片,可以看出,实施例2制备的免疫基底中,黑磷纳米片横向尺寸较大,呈块体结构。
142.图6为实施例3制备的黑磷纳米片免疫基底的扫描电子显微镜照片,可以看出,实施例3制备的免疫基底中,黑磷纳米片横向尺寸较小,呈薄片结构。
143.图7为实施例1制备的sers生物传感器的扫描电子显微镜照片,可以看出,实施例1制备的sers生物传感器中,由于铁蛋白抗原和抗体的特异性反应,磁性二硫化钼纳米花和黑磷纳米片紧密地结合在了一起。
144.(二)拉曼测试
145.发明分别对实施例1、实施例2和实施例3中制备的磁性二硫化钼纳米花免疫探针和黑磷纳米片免疫基底,以及实施例1制备的sers生物传感器均进行了进行了对罗丹明6g的拉曼检测,且测试分别如图8-11所示。
146.本发明的拉曼检测方法按照。仪器为:532nm拉曼光谱仪(qe pro,ocean optics),激光功率为1mw,积分时间为10s。按照reusable dual-functional sers sensor based on gold nanoflowers-modified red phosphorus nanoplates for ultrasensitive immunoassay and degradation of ca19-9(doi:10.1016/j.bios.2022.114148)和intrinsic raman signal of polymer matrix induced quantitative multiphase sers analysis based on stretched pdms film with anchoredag nanoparticles/au nanowires(doi:10.1016/j.cej.2019.122710)等论文进行测试。
147.图8为实施例1制备的磁性二硫化钼纳米花免疫探针和黑磷纳米片免疫基底对罗丹明6g的拉曼检测结果,可以看出,实施例1制备磁性二硫化钼纳米花免疫探针和黑磷纳米片免疫基底都对罗丹明6g有良好的拉曼增强效果,其在1360cm-1
处的拉曼信号强度分别达到8295和5493。
148.图9为实施例2制备的磁性二硫化钼纳米花免疫探针对罗丹明6g的拉曼检测结果,可以看出,实施例2制备的磁性二硫化钼纳米花免疫探针对罗丹明6g有良好的拉曼增强效果,其在1360cm-1
处的拉曼信号强度达到3706。
149.图10为实施例3制备的磁性二硫化钼纳米花免疫探针对罗丹明6g的拉曼检测结果,可以看出,实施例3制备的磁性二硫化钼纳米花免疫探针对罗丹明6g有sers增强效果,其在1360cm-1
处的拉曼信号强度达到6483。
150.图11为实施例1制备的sers生物传感器对血清中铁蛋白的拉曼检测结果,可以看出,实施例1制备的sers生物传感器可以实现血清中铁蛋白的超灵敏检测。
151.显然,上述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1