一种直接靶板微滴生长装置及其使用方法
1.本发明涉及检测技术领域,具体为一种直接靶板微滴生长装置及其使用方法。
背景技术:
2.基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,maldi-tof ms)是一种软电离质谱技术,具有快速、稳定、灵敏、准确、分辨率高和成本低等特点。临床微生物实验室引入maldi-tof ms,当前主要用于细菌和真菌的快速鉴定。其鉴定原理为:激光照射微生物样品与基质形成的共结晶,基质吸收激光能量后使微生物样品所含的生物分子(主要是蛋白质)发生电离,带电生物分子在高压电场的作用下获能、加速、聚焦,其到达tof分析器的时间与质量成正比,以质荷比(m/z)为横坐标、离子峰为纵坐标形成特异性的生物分子指纹图谱,通过与图谱库比对,匹配出鉴定结果。maldi-tof ms进行微生物鉴定仅需3~5分钟,而传统的生化鉴定卡则需数小时至十几小时不等。
3.感染性疾病能否得到及时有效的治疗,不仅取决于致病微生物的鉴定速度,更受限于药敏检测速度。当前,微生物药敏检测方法主要有:体外抗菌药物敏感试验(antimicrobial susceptibility testing,ast)、聚合酶链式反应(polymerase chain reaction,pcr)、maldi-tof ms和基于maldi-tof ms的直接靶板微滴生长法(direct-on-target microdroplet growth assay,dot-mga)。ast是国际标准化组织(international organization for standardization,iso)、临床和实验室标准化研究所(clinical and laboratory standards institute,clsi)和欧洲抗菌药物敏感试验委员会(european committee on antimicrobial susceptibility testing,eucast)推荐的参考方法,在体外测试药物的杀菌或抑菌能力,包括扩散法、稀释法、抗生素浓度梯度法和自动化仪器法等,优点是能够检出未知机制耐药,缺点是耗时较长,通常在第二天才能获得药敏结果,并且无法分辨微生物纯度。pcr通过使用特异性引物快速检测特定的耐药基因,缺点是无法检出未知基因或未知机制耐药,耐药基因与耐药表型有时并不一致。maldi-tof ms药敏检测分为三大类。(1)直接快速检测特定耐药机制的相关生物分子,如碳青霉烯酶、β-内酰胺酶等,缺点是无法检出未知机制耐药。(2)对比与待测菌株共孵育前后的抗生素maldi-tof ms指纹图谱,指纹图谱的变化说明水解酶的产生,优点是能够检出各种水解酶耐药,缺点是操作步骤繁琐,无法检出非水解酶耐药。(3)基于maldi-tof ms的dot-mga,能够在一个平台上同时完成微生物的快速鉴定和ast,兼具二者的优点,规避了传统ast无法分辨待测微生物纯度的缺点。
4.现有技术中,rapid detection of antibiotic resistance by maldi-tof mass spectrometry using a novel direct-on-target microdroplet growth assay.clin microbiol infect,2018 24(7):738-743,首次采用基于maldi-tof ms的dot-mga快速检测了24株肺炎克雷伯菌和24株铜绿假单胞菌对美罗培南的耐药性。具体操作步骤如下:
5.(1)挑取新鲜菌落配制0.5麦氏浊度待测菌悬液,用camhb肉汤,1:100稀释至1
×
106cfu/ml。
6.(2)用camhb肉汤溶解美罗培南,并调节其浓度至4μg/ml。
7.(3)将稀释后的菌液与美罗培南溶液等体积混合于一次性maldi-tof ms靶板的亲水性靶环内,形成微滴。药敏环内微滴的菌液终浓度为5
×
105cfu/ml,美罗培南溶液终浓度为2μg/ml。同时,设置生长对照环,即等体积稀释后的菌液和不含药物的camhb肉汤,微滴的菌液终浓度亦为5
×
105cfu/ml。实验中测试了5种不同体积的微滴,包括2μl、4μl、6μl、8μl和10μl。
8.(4)将靶板置于配属的塑料转运盒(布鲁克道尔顿公司)内,盒子的底部加入4ml水,充当湿盒以防微滴在孵育过程中蒸发,36℃、空气中孵育。肺炎克雷伯菌,孵育3小时、4小时和18小时;铜绿假单胞菌,孵育4小时、5小时和18小时。
9.(5)将低尘擦拭纸巾(kimtech science,金佰利公司,美国佐治亚州罗斯威尔)折叠后,从底部侧方“轻触”微滴,利用毛细管效应快速除去液体,避免肉汤成分干扰分析。随后,进行标准化的maldi-tof ms操作。
10.(6)使用maldi biotyper 3.1软件(布鲁克道尔顿公司)鉴定各靶环内的微生物种属。生长对照环内,种属鉴定成功(评分≥1.7),测试有效。药敏环内,种属鉴定成功(评分≥1.7),为耐药菌株;反之,为非耐药菌株。
11.结果显示:
①
6μl的微滴对肺炎克雷伯菌和铜绿假单胞菌均达到最佳测定性能;
②
6μl的微滴体系下,肺炎克雷伯菌孵育4小时,生长对照环内的检出率为100%;
③
6μl的微滴体系下,铜绿假单胞菌孵育4小时的检出率只有54.2%,5小时的检出率提高至83.3%;
④
细菌直接在靶板上孵育生长、使用低尘擦拭纸巾“轻触”微滴去除肉汤、截留菌体,是确保测试有效的必要条件;
⑤
靶板外孵育后再以微滴的形式转移到靶板上,立即去除肉汤,生长对照环内无法检出;再次短时间孵育(15~60分钟)后去除肉汤,生长对照环内的检出率与孵育时间成正比。分析原因,dot-mga的maldi-tof ms评分很可能与靶环内表面的菌膜形成量密切相关,而与微滴内悬浮的菌体量无关。
12.rapid simultaneous testing of multiple antibiotics by the maldi-tof ms direct-on-target microdroplet growth assay.diagnostics,2021 11(10):1803,采用基于maldi-tof ms的dot-mga快速批量检测肠杆菌目细菌对24种常用抗生素的耐药性,并对具体操作步骤做出如下改进:
13.(1)将100μl 5
×
105cfu/ml的各待测菌菌液加入含有干燥抗生素的微量滴定板小孔内,室温、300rpm震荡5分钟,以确保抗生素完全溶解。
14.(2)从各孔中转移6μl含有抗生素的待测菌菌液至一次性maldi-tof ms靶板的亲水性靶环内,形成微滴。同时,设置等体积的、不含抗生素的生长对照环。
15.(3)将靶板置于配属的塑料转运盒内,盒子的底部加入4ml水,充当湿盒以防微滴在孵育过程中蒸发,36℃、空气中孵育6小时、8小时和18小时。
16.(4)将低尘擦拭纸巾折叠后,从顶部“轻触”微滴,利用毛细管效应快速除去液体,避免肉汤成分干扰分析。随后,进行标准化的maldi-tof ms操作。
17.(5)生长对照环内,种属鉴定成功(评分≥1.7),测试有效。药敏环内,种属鉴定成功(评分≥1.7),为耐药菌株;反之,为非耐药菌株。根据每种抗生素的1至2个浓度折点,判断待测菌株的敏感(s)、中介(i)或耐药(r)。
18.微量滴定板各孔中剩余94μl含有抗生素的待测菌菌液,置于36℃、空气中孵育18小时,作为微量肉汤稀释法ast,用以评估dot-mga准确性。结果显示:该体系下6小时和8小时生长对照环内的检出率均为100%,但是,18小时对照环内的检出率只有75.2%。作者分析原因时指出,可能是由于实验中所用的简易塑料盒不利于长时间控制湿度,微滴中水分的蒸发干扰了待测菌的生长和maldi-tof ms检测。因而,有必要改进湿度控制装置。
19.综上所述,dot-mga的应用前景十分宽广,但是,目前,仍存在诸多不足之处:
20.1.孵育过程中,湿度控制不佳,微滴水分易蒸发,干扰待测菌的生长和maldi-tof ms检测。
21.2.相邻靶环之间无物理分隔,微滴体积受限,并且操作和移动过程中相邻微滴易混融。
22.3.“低尘擦拭纸巾轻触法”去除肉汤的方式,技巧性很高,相邻靶环之间有交叉污染的风险。
23.4.dot-mga的maldi-tof ms评分依赖靶环内表面的菌膜形成量。
24.5.难以实现高通量和自动化检测,有待进一步的优化和标准化。
技术实现要素:
25.本发明所要解决的技术问题在于:解决孵育过程中微滴水分易蒸发,微滴体积受限,相邻微滴易混融,去除肉汤的方式易引起相邻靶环之间的交叉污染,不利于高通量和自动化检测的问题。
26.为解决上述技术问题,本发明提供如下技术方案:
27.一种直接靶板微滴生长装置,包括:
28.底座,包括靶板托槽和环形水槽,所述环形水槽围绕所述靶板托槽;
29.靶板,位于所述靶板托槽内,且所述靶板的一侧面设置有多个疏水环;
30.密封垫,与所述底座和所述靶板的一侧面贴合,所述密封垫包括与所述环形水槽对应的多个第一水槽孔和与多个所述疏水环对应的多个第一疏水孔;
31.孔槽板,位于所述密封垫之上,包括与多个所述第一水槽孔对应的多个第二水槽孔和与多个所述第一疏水孔对应的多个第二疏水孔,使所述环形水槽、多个所述第一水槽孔和多个所述第二水槽孔组成水槽孔,使多个所述疏水环、多个所述第一疏水孔和多个所述第二疏水孔组成加样孔;
32.顶盖,位于所述孔槽板之上,与所述底座卡合,且与所述孔槽板的顶部和所述底座的四周具有缝隙,便于空气疏通。
33.优点:(1)通过设置环形水槽和顶盖,能够有效防止微滴水分蒸发。(2)通过设置密封垫,实现所用靶板上多个相邻疏水环之间的物理分离,彻底解决相邻微滴易混融的问题。(3)通过密封垫、孔槽板、底座和所用靶板的叠加,形成加样孔,增大微滴的加样体积,有利于高通量、自动化加样和吸去各加样孔内的液体,使其能够在使用或不使用离心设备的情况下,在所用靶板的多个疏水环内表面,加速或自然形成菌膜,避免相邻多个疏水环之间的交叉污染,缩短检测时间,提高工作效率。
34.在本发明的一实施例中,所述底座还包括:
35.底座板,所述环形水槽和所述靶板托槽位于所述底座板上,且两者并不连通;
36.多个弹性按键,位于所述靶板托槽的凸边上;
37.多个固定柱,其一端分别固定在所述底座板的四角位置上。
38.在本发明的一实施例中,所述靶板包括靶板本体,所述靶板包括靶板本体,多个所述疏水环覆在所述靶板本体的一侧面,且所述靶板本体的数量与所述靶板托槽的数量相同。
39.在本发明的一实施例中,所述密封垫还包括:
40.密封垫本体,多个所述第一水槽孔和多个所述第一疏水孔穿透所述密封垫本体,且所述密封垫本体的一侧面与所述底座和设置有多个所述疏水环的靶板表面贴合;
41.多个第一密封孔,分别位于所述密封垫本体的四角位置上。
42.在本发明的一实施例中,多个第一疏水孔的内壁上覆盖着疏水性涂层。
43.在本发明的一实施例中,所述孔槽板还包括:
44.孔槽板本体,多个所述第二水槽孔和多个所述第二疏水孔穿透所述孔槽板本体;
45.多个第二密封孔,分别位于所述孔槽板本体的四角位置上。
46.在本发明的一实施例中,多个所述第二疏水孔的内壁上覆盖着疏水性涂层。
47.在本发明的一实施例中,所述直接靶板微滴生长装置还包括多个固定件,所述固定柱的另一端依次穿过所述第一密封孔和所述第二密封孔后,所述固定件与所述固定柱的另一端固定连接。
48.在本发明的一实施例中,所述密封垫材质为塑料、橡胶或硅胶其中的一种。
49.本发明还提供一种直接靶板微滴生长装置的使用方法,包括以下步骤:
50.将所述靶板放入所述靶板托槽内;
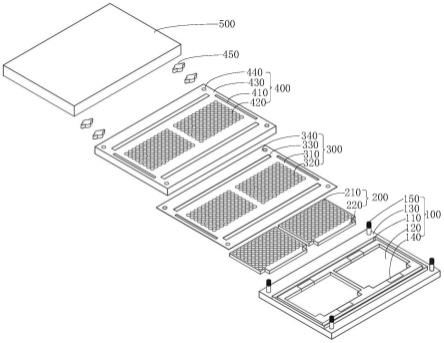
51.将所述密封垫和所述孔槽板依次放置在所述底座之上并固定连接,使所述环形水槽、多个所述第一水槽孔和多个所述第二水槽孔组成所述水槽孔,使多个所述疏水环、多个所述第一疏水孔和多个所述第二疏水孔组成所述加样孔;
52.将待测菌的菌液加入所述加样孔内;
53.向所述水槽孔内加入适量的无菌蒸馏水;
54.将所述顶盖与所述底座卡合,进行培养;
55.将培养完成后,将所述加样孔内的菌体离心至所述疏水环的内表面,加速形成菌膜;
56.快速吸去所述加样孔内的液体,并对其进行基质辅助激光解吸电离飞行时间质谱操作,分析鉴定和药敏结果。
57.与现有技术相比,本发明的有益效果是:
58.(1)能够更好地控制检测条件,彻底解决微滴水分易蒸发、微滴体积受限、相邻微滴易混融、去除肉汤的方式不佳容易引起相邻靶环之间交叉污染的问题。
59.(2)能够根据所用靶板的不同规格,对靶板托槽、第一疏水孔和第二疏水孔,做出相应修改,以满足高通量和自动化检测的需求。
60.(3)进一步缩短孵育和检测时间,有望彻底颠覆现有的微生物鉴定和药敏体系,提供更加快速和精准的检测信息,帮助临床医生在感染性疾病的诊断和治疗中抢得先机。
附图说明
61.图1为本发明的实施例的一种直接靶板微滴生长装置示意图。
62.图2为本发明的实施例的底座示意图。
63.图3为本发明的实施例的密封垫示意图。
64.图4为本发明的实施例的一种直接靶板微滴生长装置的使用方法流程图。
65.图5(a)和(b)为本发明实施例的肺炎克雷伯菌的耐药菌株和敏感菌株鉴定示意图。
66.图5(c)和(d)为本发明实施例的大肠埃希菌的耐药菌株和敏感菌株鉴定示意图。
67.图5(e)和(f)为本发明实施例的铜绿假单胞菌的耐药菌株和敏感菌株鉴定示意图。
68.图5(g)和(h)为本发明实施例的金黄色葡萄球菌的耐药菌株和敏感菌株鉴定示意图。
具体实施方式
69.为便于本领域技术人员理解本发明技术方案,现结合说明书附图对本发明技术方案做进一步的说明。
70.术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本技术的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
71.请参阅图1所示,本发明提供一种直接靶板微滴生长装置,包括底座100、靶板200、密封垫300、孔槽板400和顶盖500。其中,底座100包括靶板托槽120和环形水槽130,环形水槽120围绕所述靶板托槽130。靶板200位于靶板托槽120内,且靶板200的一侧面设置有多个疏水环210。密封垫300与底座100和靶板200的一侧面贴合,密封垫300包括与环形水槽130对应的多个第一水槽孔310和与多个疏水环210对应的多个第一疏水孔320。孔槽板400位于密封垫300之上,包括与多个第一水槽孔310对应的第二水槽孔410和与多个第一疏水孔320对应的多个第二疏水孔420,使环形水槽130、多个第一水槽孔310和多个第二水槽孔410组成水槽孔,使多个疏水环210、多个第一疏水孔320和多个第二疏水孔420组成加样孔。顶盖500位于孔槽板400之上,与底座100卡合,且与孔槽板400的顶部和底座100的四周具有缝隙,便于空气流通。
72.请参阅图1和图2所示,在本发明的一实施例中,底座100还包括底座板130、多个弹性按键140和固定柱150。其中,靶板托槽120和环形水槽130位于底座板130上,且靶板托槽120与环形水槽130并不连通。多个弹性按键140位于靶板托槽120的凸边上,常态下,多个弹性按键140与靶板托槽120的凸边处于同一水平位置,当需要更换靶板200时,按下按键140,此时按键140的水平位置低于靶板托槽120的凸边的水平位置,使更换靶板的200具有更好着力点,便于从靶板托槽120中取出靶板200。当完成新的靶板200替换后,其弹性按键140自动恢复与靶板托槽120的凸边保持同一水平面。其中,当靶板200卡合在靶板托槽120后,与靶板托槽120的凸边处于同一水平面。固定柱150的数量为多个,在本实施例中,为4个,分别固定在底座板130的四角上。其中,对底座板130的尺寸不限制,对靶板托槽120的数量也不
限制,其固定柱150例如为螺柱。在本实施例中,靶板托槽120的数量为2个。
73.请参阅图1所示,在本发明的一实施例中,靶板200还包括靶板本体220,多个疏水环210覆在靶板本体220的一侧面上。靶板本体220位于靶板托槽120内,其形状与靶板托槽120相同,且靶板本体220的数量与靶板托槽120的数量相同,但每个靶板本体220上的疏水环210的数量不定,根据靶板本体220的尺寸而定。
74.请参阅图1和图3所示,在本发明的一实施例中,密封垫300还包括密封垫本体330和第一密封孔340,多个第一水槽孔310和多个第一疏水孔320穿透密封垫本体330。当靶板200卡合在靶板托槽120后,密封垫300的一侧面与底座100和靶板200贴合,且多个第一水槽孔310与环形水槽130位置对应,当向多个第一水槽孔310内倒入蒸馏水时,其蒸馏水能进入环形水槽120内。多个第一疏水孔320与多个疏水环210的位置对应,当向多个第一疏水孔320滴入待测菌的菌液时,其菌液也能进入多个疏水环210内表面。第一密封孔340的数量为多个,在本实施例中为4个,分别位于密封垫本体330的四角位置上。其中,多个第一疏水孔320的内壁覆盖着疏水性涂层。密封垫300的材质具有一定弹性的天然或人工合成材料,在本实施例中例如为塑料、橡胶或硅胶的一种,通过与靶板200带有多个疏水环210的一侧面贴合,使相邻的疏水环210之间形成物理分隔,彻底解决微滴体积受限,混融和污染的问题。
75.请参阅图1所示,在本发明的一实施例中,孔槽板400还包括孔槽板本体430和第二密封孔440,其多个第二水槽孔410和多个第二疏水孔420穿透孔槽板本体430。孔槽板本体430与密封垫300的另一侧面贴合,其多个第二水槽孔410与环形水槽110和多个第一水槽孔310的位置对应,多个第二疏水孔420与多个疏水环210和多个第一疏水孔320的位置对应。第二密封孔440的数量为多个,在本实施例中为4个,分别位于孔槽板本体430的四角位置上。所述的直接靶板微滴生长装置还包括固定件450,使用时,固定柱150的一端依次穿过第一密封孔340和第二密封孔440后,固定件450套设在固定柱150上,将底座100、靶板200、密封垫300和孔槽板400固定连接,此时,多个第二水槽孔410与环形水槽110和多个第一水槽孔310形成多个底部连通的水槽孔,使用时,向水槽孔内增加适量的无菌蒸馏水,保持直接靶板微滴生长装置内部环境的湿度。多个第二疏水孔420与多个疏水环210和多个第一疏水孔320形成多个加样孔,通过多个疏水孔的叠加,使加样孔具有疏水性的内壁和一定的深度,较大体积的待测菌液加入加样孔后,即使不借助离心设备,也可以在疏水环210的内表面直接形成菌膜,缩短检测时间。其中,多个第一疏水孔320和多个第二疏水孔420的内壁覆盖着疏水性涂层,便于在疏水环210上形成菌膜,固定件450在本实施例中,例如为螺母。顶盖500一侧内凹,与底座100卡合,且与孔槽板400的顶部和底座100的四周具有缝隙,便于空气疏通,确保培养过程中菌体对氧气的需求。
76.请参阅图1和4所示,本发明还提供一种直接靶板微滴生长装置的方法,包括以下步骤:
77.s100,将所述靶板放入所述靶板托槽内。
78.s200,将所述密封垫和所述孔槽板依次放置在所述底座之上并固定连接,使所述环形水槽、多个所述第一水槽孔和多个所述第二水槽孔组成所述水槽孔,使多个所述疏水环、多个所述第一疏水孔和多个所述第二疏水孔组成所述加样孔。
79.三者通过固定柱150和固定件450将底座100、靶板200、密封垫300和孔槽板400固定连接,形成一个整体。
80.s300,将待测菌的菌液加入所述加样孔内。
81.其中,待测菌的菌液含有或不含有抗生素,。加样孔内可以分类为药敏孔或生长对照孔,抗生素的浓度根据药敏需求设置。
82.s400,向所述水槽孔内加入适量的无菌蒸馏水。
83.其中,加入的蒸馏水不溢出水槽孔。
84.s500,将所述顶盖与所述底座卡合,进行培养。
85.其中,本装置应在温箱内培养至所需时长。
86.s600,将培养完成后,将所述加样孔内的菌体离心至所述疏水环的内表面,加速形成菌膜。
87.其中,借助平板水平离心机将加样孔内的菌体离心至疏水环210内的靶板200的表面,形成菌膜;也可以不离心,仅利用加样孔内待测菌液的较大体积和细菌的黏附生长特性,在疏水环210内的靶板200的表面,直接形成菌膜,缩短检测时间。
88.s700,快速吸去所述加样孔内的液体,并对其进行基质辅助激光解吸电离飞行时间质谱操作,分析鉴定和药敏结果。
89.其中,可以通过自动化仪器或者手工使用移液器,快速吸去加样孔内的菌液,避免肉汤成分干扰分析。
90.请参阅图5(a)至图5(h)所示,在本发明的一实施例中,图5(a)和(b)为肺炎克雷伯菌的耐药菌株和敏感菌株鉴定示意图,图5(c)和(d)为大肠埃希菌的耐药菌株和敏感菌株鉴定示意图,图5(e)和(f)为铜绿假单胞菌的耐药菌株和敏感菌株鉴定示意图,图5(g)和(h)为金黄色葡萄球菌的耐药菌株和敏感菌株鉴定示意图。鉴定各加样孔内的微生物种属,生长对照孔内,种属鉴定成功(评分≥1.7),测试有效。药敏孔内,种属鉴定成功(评分≥1.7),为耐药菌株;反之,为非耐药菌株。
91.对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内,不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
92.以上所述实施例仅表示发明的实施方式,本发明的保护范围不仅局限于上述实施例,对于本领域的技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1