一种同时测定白酒中多种难挥发性呈味物质的方法与流程
1.本发明属于白酒分析检测技术领域,特别涉及一种同时测定白酒中多种难挥发性呈味物质的方法。
背景技术:
2.白酒风味是决定其品质的重要因素,目前主要针对白酒中挥发性香气物质的研究较多。但白酒作为固态发酵蒸馏的产物,同样存在某些非挥发性物质。据文献报道,非挥发性物质的存在对于白酒的风格特征同样产生重要的作用,
①
作为潜在的重要呈味物质,构成了白酒口感的丰富性和复杂性;
②
与挥发性物质产生相互作用,调节挥发性物质的挥发性能,改变并协调白酒的香气结构,如对放香强度与香气持久性产生调节作用;
③
独特和重要的生物活性功能和效果。
3.有机酸类物质作为白酒的重要风味物质,其中有机酸的种类和含量不仅影响白酒发酵过程微生物的生长与繁殖,亦影响酯类香气物质的合成。但在白酒生产中关注较多的难挥发性有机酸是酒体或酿造过程中以乳酸、乙酸、丁酸、己酸为主的比例及量化关系,通常以气相色谱或气相色谱质谱联用技术检测为主;同样,其他难挥发性有机酸因难以被气化,并且即使使用酯化衍生处理,有些亦无法被有效解析。因此,现阶段主要采用高效液相色谱法及离子色谱法进行白酒中难挥发性有机酸的定性定量分析。
4.白酒中氨基酸对其呈味亦有重要影响,白酒中生物胺与氨基酸也有一定联系,生物胺作为一类含氮的脂肪族、芳香族或杂环类化合物,主要通过氨基酸的脱羧或醛与酮的胺化及转氨基作用产生,对动植物和微生物活性细胞有重要的生理作用。目前,针对白酒中氨基酸分析多采用氨基酸自动分析仪进行检测。
5.目前,尚未建立一种能同时测定白酒中难挥发性有机酸、氨基酸、生物胺等多种呈味物质的检测方法。
技术实现要素:
6.本发明目的在于提供一种可以同时检测白酒中多种难挥发性呈味物质的方法。
7.一方面,本发明提供了一种同时测定白酒中多种难挥发性呈味物质的方法,其特征在于,包括如下步骤:
8.(1)取样;
9.(2)离心;
10.(3)过滤;
11.(4)采用超高效液相色谱串联高分辨质谱技术对过滤后的白酒样品进行分析;所述超高效液相色谱所用的色谱柱为:hypersil gold c18柱(150mm
×
2.1mm,1.9μm);
12.其中,所述方法不包括采用氮吹或者采用其他方式除乙醇步骤;所述呈味物质包括有机酸、生物胺、氨基酸中的至少一种。
13.在现有技术公开的对白酒样品中的组分进行检测分析的方法中,大多数会采取氮
吹或者采取其他方式去除白酒样品中乙醇对检测结果的干扰,以达到对白酒样品中各组分更好的检测效果,而本发明在力求提供一种前处理方法简单、快捷,且能够实现白酒样品中多种痕量呈味物质及衍生产物的快速、精准同时检测时发现,当选择对白酒样品的前处理方法选择包括采用氮吹或者其他方式除乙醇步骤,会对白酒样品中的目标呈味物质的检测有不同程度的负面影响,而当不进行氮吹或者不进行其他方式除乙醇的步骤,而是直接对白酒样品进行高速离心、膜过滤的前处理方法时,却可以更好的实现白酒样品中的多种痕量呈味物质的检测分析。
14.而对于本发明所构建的检测方法中,当选择hypersil gold c18柱(150mm
×
2.1mm, 1.9μm)作为检测分析用的色谱柱时,才可以更好的实现白酒样品中待测组分的检测分析。
15.在一些实施方案中,所述步骤(1)中的取样体积为:2-3ml。
16.在一些实施方案中,取样后置于离心管内。
17.在一些实施方案中,所述步骤(2)中,所述离心包括:对步骤(1)中所取白酒样品进行高速离心;所述离心的条件为:在9000~12000rpm离心5~15min;优选地,所述离心的条件为:10000rpm离心10min。
18.在一些实施方案中,所述步骤(3)中,所述过滤包括:通过0.22μm水系pes针筒式过滤膜对离心后的白酒样品进行过滤。
19.在一些实施方案中,所述步骤(4)中,所述超高效液相色谱的条件为:色谱柱柱温为 30~50℃,进样量为1~5μl,流速0.1~0.3ml/min,分析时间为16~19min,采用梯度洗脱模式;优选地,所述超高效液相色谱条件为:色谱柱柱温为40℃,进样量为2μl,流速为 0.2ml/min,分析时间为16min,采用梯度洗脱模式。
20.在一些实施方案中,采用0.1%甲酸水溶液(a)和甲醇(b)作为流动相。
21.在一些实施方案中,采用如下梯度洗脱程序进行洗脱:
[0022][0023][0024]
在一些实施方案中,所述步骤(4)中,高分辨质谱的离子源条件为:采用加热电喷雾电离源;鞘气流量:20~50arb;辅助气流量:5~20arb;喷雾电压:
±
3.2kv;离子源温度:330-370℃;毛细管温度:300-350℃。
[0025]
在一些实施方案中,高分辨质谱仪离子源条件为:采用加热电喷雾电离源;鞘气流量: 40arb;辅助气流量:10arb;喷雾电压:
±
3.2kv;离子源温度:350℃;毛细管温度: 320
℃。
[0026]
在一些实施方案中,所述步骤(4)中,高分辨质谱的扫描条件为:采用全扫描/数据依赖性二级扫描的正负离子同时扫描采集模式;一级扫描范围为m/z 50.0~400.0da;一级扫描分辨率:70000;agc target:1e6;maximum it:30ms;二级扫描分辨率:17500;agctarget:5e4;maximum it:50ms;归一化碰撞能量:10、20、30ev。
[0027]
在一些实施方案中,所述有机酸包括:l-酒石酸、l-苹果酸、没食子酸、阿魏酸、儿茶素、咖啡酸、木犀草素、绿原酸、对香豆酸、2,3-二羟基丙酸、柠檬酸中的至少一种。
[0028]
在一些实施方案中,所述氨基酸包括:l-丙氨酸、l-精氨酸、l-胱氨酸、l-天冬氨酸、 l-谷氨酸、甘氨酸、l-组氨酸、l-赖氨酸、l-甲硫氨酸、l-苯丙氨酸、l-脯氨酸、l-丝氨酸、l-苏氨酸、l-酪氨酸、l-缬氨酸、l-瓜氨酸、l-色氨酸中的至少一种。
[0029]
在一些实施方案中,所述生物胺包括:β-苯乙胺、酪胺、色胺、吡咯烷中的至少一种。
[0030]
在一些实施方案中,所述方法还包括:采用外标法以及xcalibur 4.1软件对所得到的白酒样品中的待测组分进行定量分析。
[0031]
在一些实施方案中,所述方法还包括如下步骤:
[0032]
1)配制待测组分的标准储备液;
[0033]
2)配制待测组分的混合标准工作系列溶液;
[0034]
3)仪器分析:取步骤2)配制的所述待测组分的混合标准工作系列溶液,用超高效液相色谱串联高分辨质谱技术进行测定;
[0035]
4)待测组分含量计算:通过超高效液相色谱串联高分辨质谱仪匹配的定性定量分析 xcalibur 4.1软件处理步骤3)测定分析所得到的数据。
[0036]
在一些实施方案中,所述步骤2)包括:分别移取步骤1)中的待测组分储备液,以超纯水为试剂,配制成:0.05、0.1、0.2、0.5、1.0、2.0、5.0、10.0、15.0、20.0、30.0μmol/l 氨基酸标准系列溶液;2.0、5.0、10.0、20.0、50.0、100.0、200.0μg/l的生物胺标准系列溶液;10.0、20.0、50.0、100.0、200.0、500.0μg/l的难挥发性有机酸标准系列溶液。
[0037]
在一些实施方案中,所述步骤4)包括:以所述待测组分的混合标准工作溶液系列浓度为横坐标,以相应待测组分的色谱峰面积为纵坐标,绘制标准曲线,拟合得到待测组分的标准工作曲线;将白酒样品中各待测组分的色谱峰面积相关数据代入所述标准工作曲线,计算,得到白酒样品中各待测组分的含量。
[0038]
综上所述,本技术具有以下有益技术效果:
[0039]
(1)本发明利用超高效液相色谱串联高分辨质谱技术建立了一种可以同时测定白酒中多种呈味物质及衍生产物的方法,所述方法前处理操作简单,无需除去白酒样品中的乙醇,且前处理过程无有机溶剂参与,具备操作简单,实验成本低,分析时间短,且检测准确度高、重现性好等优点。同时,可用于各种酒精度较高且待测成分含量极少的白酒样品的定性定量分析。
[0040]
(2)本发明所提供的方法适用性强,可适合任何白酒样品,样品用量少,且分析时间短,仅需16min便可完成白酒样品中多组分分析。
[0041]
(3)本发明所构建的方法具有良好的回收率、精密度及稳定;同时,本发明所采取的前处理方法对白酒样品中待测组分的损失较低;同时,涉及多组分化合物的线性关系良
好,即r2>0.990;同时各组分化合物定量限低,可满足实际白酒样品的相关化合物分析需求。
附图说明
[0042]
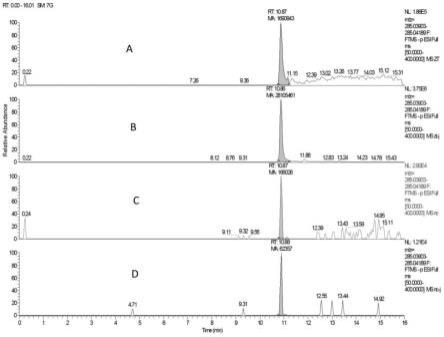
图1为本发明实施例及对比例中对白酒样品进行包括氮吹除乙醇步骤与不经过氮吹除乙醇步骤两种处理方式下待测组分木犀草素的色谱对比图;其中,图1(a)为进行包括氮吹除乙醇步骤,而后进行离心、膜过滤所得到的白酒样品中木犀草素的色谱图;图1(b)为添加标准混合溶液的进行包括氮吹除乙醇步骤,而后进行离心、膜过滤所得到的白酒样品中木犀草素的色谱图;图1(c)为不进行氮吹除乙醇步骤,直接对白酒样品进行离心、膜过滤所得到的白酒样品中木犀草素的色谱图;图1(d)为添加标准混合溶液的不进行氮吹除乙醇步骤,直接对白酒样品进行离心、膜过滤所得到的白酒样品中木犀草素的色谱图;
[0043]
图2为本发明实施例及对比例中对白酒样品进行包括氮吹除乙醇步骤与不经过氮吹除乙醇步骤两种处理方式下待测组分β-苯乙胺的色谱对比图;其中,图2(a)为进行包括氮吹除乙醇步骤,而后进行离心、膜过滤所得到的白酒样品中β-苯乙胺的色谱图;图1(b)为添加标准混合溶液的进行包括氮吹除乙醇步骤,而后进行离心、膜过滤所得到的白酒样品中β-苯乙胺的色谱图;图2(c)为不进行氮吹除乙醇步骤,直接对白酒样品进行离心、膜过滤所得到的白酒样品中β-苯乙胺的色谱图,图2(d)为添加标准混合溶液的不进行氮吹除乙醇步骤,直接对白酒样品进行离心、膜过滤所得到的白酒样品中β-苯乙胺的色谱图;
[0044]
图3为是本发明实施例及对比例中对白酒样品进行包括氮吹除乙醇步骤与不经过氮吹除乙醇步骤两种处理方式下待测组分l-苏氨酸的色谱对比图;其中,图3(a)为进行包括氮吹除乙醇步骤,而后进行离心、膜过滤所得到的白酒样品中l-苏氨酸的色谱图;图3(b) 为添加标准混合溶液的进行包括氮吹除乙醇步骤,而后进行离心、膜过滤所得到的白酒样品中l-苏氨酸的色谱图;图3(c)为不进行氮吹除乙醇步骤,直接对白酒样品进行离心、膜过滤所得到的白酒样品中l-苏氨酸的色谱图;图3(d)为添加标准混合溶液的不进行氮吹除乙醇步骤,直接对白酒样品进行离心、膜过滤所得到的白酒样品中l-苏氨酸的色谱图;
[0045]
图4为本发明实施例及对比例中不同液相色谱柱下待测组分色谱对比图;其中,图4 (a)为hypersil gold c18(100mm
×
2.1mm,1.9μm)色谱柱条件下待测组分柠檬酸的色谱图;图4(b)为hypersil gold c18(150mm
×
2.1mm,1.9μm)色谱柱条件下待测组分柠檬酸的色谱图;图4(c)为accucore aq(150mm
×
2.1mm,2.6μm)色谱柱条件下待测组分柠檬酸的色谱图;
[0046]
图5为本发明实施例及对比例不同流动相条件下待测组分的色谱对比图;其中,图5 (a)为0.1%甲酸水溶液-甲醇流动相洗脱体系条件下待测组分吡咯烷的色谱图;图5(b) 为1mmol/l乙酸铵溶液(0.1%甲酸)-甲醇流动相洗脱体系条件下待测组分吡咯烷的色谱图;
[0047]
图6-图11为本发明实施例所得到的白酒样品中32种待测组分的分子离子提取色谱图,其中
[0048]
图6为本发明实施例所得到的对白酒样品中的待测组分吡咯烷、β-苯乙胺、酪胺、色胺的分子离子提取色谱图;
[0049]
图7为本发明实施例所得到的白酒样品中的待测组分l-丙氨酸、l-精氨酸、l-天冬
氨酸、l-胱氨酸、l-谷氨酸、甘氨酸、l-组氨酸的分子离子提取色谱图;
[0050]
图8为本发明实施例所得到的白酒样品中的待测组分l-赖氨酸、l-甲硫氨酸、l-苯丙氨酸、l-脯氨酸、l-丝氨酸、l-苏氨酸、l-酪氨酸的分子离子提取色谱图;
[0051]
图9为本发明实施例白酒样品中的待测组分l-缬氨酸、l-瓜氨酸、l-色氨酸的分子离子提取色谱图;
[0052]
图10为本发明实施例所得到的白酒样品中的待测组分l-酒石酸、l-苹果酸、没食子酸、阿魏酸、儿茶素、咖啡酸、木犀草素、绿原酸的分子离子提取色谱图;
[0053]
图11为本发明实施例所得到的白酒样品中的待测组分对香豆酸、柠檬酸、2,3-二羟基丙酸的分子离子提取色谱图;
[0054]
图12为本发明实施例及对比例不同流动相洗脱程序条件下待测组分吡咯烷的色谱对比图。
具体实施方式
[0055]
以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。
[0056]
本发明实施例中所使用的试剂以及设备信息如下:
[0057]
甲醇购于德国merck公司;甲酸购于美国fisher公司;15种氨基酸混标:2.5mmol/l的 l-丙氨酸、l-精氨酸、l-天冬氨酸、l-谷氨酸、甘氨酸、l-组氨酸、l-赖氨酸、l-甲硫氨酸、l-苯丙氨酸、l-脯氨酸、l-丝氨酸、l-苏氨酸、l-酪氨酸、l-缬氨酸以及1.25mmol/l 的l-胱氨酸和98.0%的l-瓜氨酸购于merck公司;2,3-二羟基丙酸(96.03%)购于上海麦克林生化科技有限公司;β-苯乙胺(98.6%)、酪胺(98.9%)、吡咯烷(98.5%)购于德国 dr.ehrenstorfer gmbh公司;l-色氨酸(99.04%)、色胺(98.4%)和l-酒石酸(99.2%)、l
‑ꢀ
苹果酸(99.8%)、没食子酸(99.1%)、阿魏酸(99.9%)、儿茶素(99.7%)、咖啡酸 (99.4%)、木犀草素(98.6%)、绿原酸(99.4%)、对香豆酸(99.9%)、柠檬酸(98.9%)标准品均购于上海源叶生物科技有限公司。
[0058]
所使用的超高效液相色谱串联高分辨质谱仪购自thermo fisher scientific;qt-1旋涡混合器购自上海琪特分析仪器有限公司;hc-3518高速离心机购自安徽中科中佳科学仪器公司;raykolauto eva氮吹仪购自睿科集团股份有限公司;ar2140万分之一分析天平购自梅特勒-托利多仪器(上海)有限公司;艾科普超纯水机购自美国millipore公司。
[0059]
本发明实施例中待测组分的标准溶液配制方法如下:
[0060]
以超纯水为试剂,分别用浓度为100μmol/l(胱氨酸为50μmol/l)、5.0μg/ml和 10.0μg/ml的17种氨基酸、4种生物胺以及11种难挥发性有机酸混合标准储备液配制成氨基酸标准系列溶液为0.05、0.1、0.2、0.5、1.0、2.0、5.0、10.0、15.0、20.0、30.0μ mol/l,生物胺标准系列溶液为2.0、5.0、10.0、20.0、50.0、100.0、200.0μg/l,难挥发性有机酸标准系列溶液为10.0、20.0、50.0、100.0、200.0、500.0μg/l的3大类32种待测组分混合标准工作系列溶液。
[0061]
实施例1一种同时检测白酒中多种难挥发性呈味物质及衍生产物的方法
[0062]
s1取样:准确移取2ml白酒样品于15ml离心管内;
[0063]
s2离心:将混匀后的白酒样品在10000rpm条件下,离心10min;
[0064]
s3过滤:通过0.22μm水系pes针筒式过滤膜,收集滤液于2.0ml液相进样小瓶中待测;
[0065]
s4上机检测:超高效液相色谱串联高分辨质谱仪分析。
[0066]
步骤s4中所使用的超高效液相色谱仪的条件为:选用hypersil gold c18(150mm
×ꢀ
2.1mm,1.9μm)色谱柱;采用0.1%甲酸水溶液(a)和甲醇(b)为流动相,柱温为 40℃,进样量为2μl,流速0.2ml/min,分析时间为16min,并按下述表1的梯度洗脱程序进行梯度洗脱:
[0067]
表1梯度洗脱程序
[0068][0069]
步骤s4中的高分辨质谱仪离子源条件:加热电喷雾电离源;鞘气流量:40arb;辅助气流量:10arb;喷雾电压:
±
3.2kv;离子源温度:350℃;毛细管温度:320℃。
[0070]
步骤s4中的高分辨质谱仪扫描条件:采用全扫描/数据依赖性二级扫描的正负离子同时扫描采集模式;一级扫描范围为m/z 50.0~400.0da;一级扫描分辨率70000;自动增益控制进入轨道阱中的离子数(agc target):1e6;最大注入时间(maximum it):30ms;二级扫描分辨率:17500;agc target:5e4;maximum it:50ms;归一化碰撞能量:10、20、30 ev。
[0071]
采用上述方法对白酒样品中的组分进行分析的色谱结果如图6-图11所示,所得到的白酒样品中的各待测组分化合物信息及高分辨质谱参数见下述表2:
[0072]
表2白酒样品中各待测组分化合物信息及高分辨质谱参数
[0073]
[0074][0075]
通过上述方法对白酒样品中的组分进行分析,最终得到17种氨基酸,包括:l-丙氨酸、l-精氨酸、l-胱氨酸、l-天冬氨酸、l-谷氨酸、甘氨酸、l-组氨酸、l-赖氨酸、l-甲硫氨酸、l-苯丙氨酸、l-脯氨酸、l-丝氨酸、l-苏氨酸、l-酪氨酸、l-缬氨酸、l-瓜氨酸、l
‑ꢀ
色氨酸;4种生物胺,包括:β-苯乙胺、酪胺、色胺、吡咯烷;11种难挥发性有机酸,包括:l-酒石酸、l-苹果酸、没食子酸、阿魏酸、儿茶素、咖啡酸、木犀草素、绿原酸、对香豆酸、2,3-二羟基丙酸、柠檬酸。
[0076]
s5采用外标法以及xcalibur 4.1软件对所得到的白酒样品中的待测组分进行定量分析,具体如下:
[0077]
(1)各待测组分标准储备液配制:将17种氨基酸、4种生物胺以及11种难挥发性有机酸等待测组分按照类别分别用超纯水配制成浓度为100μmol/l(l-胱氨酸为50μmol/l)、 5.0μg/ml和10.0μg/ml的混合标准储备液,贮存于4℃下备用;
[0078]
(2)待测组分混合标准工作系列溶液配制:分别移取步骤(1)中待测组分储备液,以超纯水为试剂,配制成:氨基酸标准系列溶液为0.05、0.1、0.2、0.5、1.0、2.0、5.0、 10.0、15.0、20.0、30.0μmol/l,生物胺标准系列溶液为2.0、5.0、10.0、20.0、50.0、100.0、200.0μg/l;难挥发性有机酸标准系列溶液为10.0、20.0、50.0、100.0、200.0、500.0 μg/l的3大类共32种待测组分混合标准工作系列溶液;
[0079]
(3)仪器分析:取步骤(2)配制的待测组分混合标准工作系列溶液,用超高效液相色谱串联高分辨质谱仪在步骤s4所使用的条件下进行测定;
[0080]
(4)待测组分含量计算:通过超高效液相色谱串联高分辨质谱仪匹配的定性定量分析 xcalibur 4.1软件处理得到的上述数据,以待测组分标准工作溶液系列浓度为横坐标(x),相应待测组分色谱峰面积为纵坐标(y),绘制标准曲线,拟合所得相关线性回归方程,即待测组分的标准工作曲线;将白酒样品经上述前处理之后通过超高效液相色谱串联高分辨质谱仪分析,利用待测组分标准工作曲线计算,即得到白酒样品中各待测组分的含
量。
[0081]
实施例2关于本发明所构建的检测方法的线性范围和检出限及定量限
[0082]
各待测组分混合标准工作系列溶液在上述实施例1的条件下进行测定,采用实施例1中的外标法进行定量。以各待测组分的浓度为横坐标(x)、定量离子的色谱峰面积为纵坐标 (y),绘制标准曲线,即得到相关线性回归方程;以信噪比(s/n)为3计算得到各待测组分的检出限(lod),信噪比(s/n)为10计算得定量限(loq),所得到的各待测组分标准工作系列溶液的线性方程、检出限和定量限结果如下述表3所示:
[0083]
表3各待测组分标准工作系列溶液的线性方程、检出限和定量限
[0084][0085][0086]
根据上述表3结果,17种氨基酸、4种生物胺以及11种难挥发性有机酸等待测组分标准工作系列溶液的线性关系良好(r2>0.99),且各待测组分的检出限、定量限值相对较低,本发明可满足后续白酒中待测组分的定量分析以及低含量组分的测定。
[0087]
实施例3关于本发明所构建的检测方法的回收率和精密度
[0088]
根据各待测组分的定量限loq,在白酒样品中分别加入3个不同浓度的待测组分标
准溶液,将白酒样品配制成加标样品,按上述实施例1的方法进行前处理,利用超高效液相色谱串联高分辨质谱仪进行分析,每个加标水平做3次平行,每个平行重复测定6次,计算平均回收率,以验证本发明所构建的检测方法的准确度、精密度及稳定性,所得到的分析结果具体如下述表4所示:
[0089]
表4各待测组分测定方法的回收率和精密度
[0090][0091][0092]
根据上述表4结果,对于3种不同的加标水平,其平均回收率在71.92%~117.45%范围内,且相对标准偏差(rsd)在0.46%~5.48%之间。可见,本发明所构建的对白酒中多
种呈味物质及衍生产物待测组分进行的检测的方法具有良好的回收率、精密度及稳定性,同时,本发明所采取的前处理方法对白酒样品中待测组分的损失较低。
[0093]
对比例1探究前处理方法的不同对检测结果的影响
[0094]
该对比例与实施例1中所使用的前处理方法不同的是,该对比例包括在对白酒样品进行高速离心步骤之前还包括对白酒样品进行氮吹除醇,其他条件及步骤与实施例1均相同;该对比实验具体设置如下:
[0095]
a:对白酒样品先进行氮吹除乙醇步骤,而后进行离心、膜过滤,对所得到的白酒样品上机检测;
[0096]
b:对白酒样品不进行氮吹除乙醇步骤,直接进行离心、膜过滤,对所得到的白酒样品上机检测,该组的实验步骤具体同实施例1;
[0097]
c:在白酒样品中添加标准混合溶液,先进行氮吹除乙醇步骤,而后进行离心、膜过滤,对所得到的白酒样品上机检测;
[0098]
d:在白酒样品中添加标准混合溶液,直接进行离心、膜过滤,对所得到的白酒样品上机检测;
[0099]
上述所设置的对比例实验中,a与实施例1不同之处在于,对白酒样品进行离心之前还包括对白酒样品进行氮吹除醇步骤,其他与实施例1均相同;b与实施例1完全相同;c与实施例1的不同之处在于在白酒样品中添加标准混合溶液后进行氮吹除醇步骤;d与实施例 1的不同之处在于在白酒样品中添加标准混合溶液,其余与实施例1均相同。对通过上述四种预处理方法所得到的白酒样品进行上机检测,采用与实施例1完全相同的液相色谱以及质谱条件,得到各组白酒样品中待测组分的色谱图。
[0100]
需要说明的是,上述前处理方法是经过实验摸索后,对于该条件下所有待测组分分析效果最好的前处理方法。
[0101]
现以白酒样品中的待测组分木犀草素为例,结果如图1所示,与先采用氮吹除乙醇步骤进行处理的前处理方式相比,直接经高速离心、膜过滤处理后的白酒样品中的待测组分木犀草素的色谱峰响应值明显较高;同时,经添加木犀草素标准溶液的氮吹除乙醇样品中其色谱峰响应值低于未添加标准溶液样品,说明氮吹除乙醇前处理方式不利于白酒样品中待测组分木犀草素含量的测定,采用氮吹除乙醇对检测结果有不利影响;以白酒样品中的待测组分β-苯乙胺为例,得到的色谱结果如图2所示,对添加β-苯乙胺标准溶液的包括氮吹除乙醇步骤与不包括氮吹除乙醇步骤的两种前处理方式对白酒样品中待测组分β-苯乙胺的色谱峰响应值差异不明显,即不采用氮吹除乙醇以消除乙醇的干扰,采用本发明所构建的方法同样可以实现白酒样品中多种组分的检测;以白酒样品中的待测组分l-苏氨酸而言(如图3所示),在白酒样品中是否添加其标准溶液的两种前处理方式样品中l-苏氨酸色谱峰响应值差异不明显,即不采用氮吹除乙醇以消除乙醇的干扰,采用本发明所构建的方法液可以实现白酒样品中多种组分的检测。
[0102]
即,虽然在对白酒样品中的组分进行检测分析的方法中,大多数会采取氮吹或者其他方式去除白酒样品中乙醇对检测结果的干扰,以达到对白酒样品中各组分更好的检测效果,而本发明在力求提供一种前处理方法简单、快捷,且能够实现白酒样品中多种痕量呈味物质及衍生产物的快速、精准同时检测时发现,当选择对白酒样品的前处理方法选择包括采用氮吹或者其他方式除乙醇步骤,会对白酒样品中的呈味物质检测有不同程度的影
响,而当不进行氮吹或者其他方式除乙醇的步骤,而是直接对白酒样品进行高速离心、膜过滤的前处理方法,却可以更好的实现白酒样品中的多种痕量呈味物质的检测分析。
[0103]
对比例2探究选择不同的仪器参数色谱柱对检测结果的影响
[0104]
该对比例考察了hypersil gold c18(100mm
×
2.1mm,1.9μm)、hypersil gold c18 (150mm
×
2.1mm,1.9μm)、accucore aq(150mm
×
2.1mm,2.6μm)三种液相色谱柱对白酒样品中32种待测组分的分离效果的影响,在该对比例实验中,除液相色谱柱的选择不一样,其余条件均与实施例1相同。
[0105]
需要说明的是,选择上述液相色谱柱是经过实验摸索后,对于该条件下所有待测组分分析效果最佳的液相色谱柱。具体以待测组分柠檬酸为例,如图4所示,白酒样品经前处理后上机分析发现,采用hypersil gold c18(100mm
×
2.1mm,1.9μm)与accucore aq(150 mm
×
2.1mm,2.6μm)色谱柱分离柠檬酸的色谱峰宽度较大,且出现了明显的拖尾现象;但经hypersil gold c18(150mm
×
2.1mm,1.9μm)色谱柱分离柠檬酸色谱峰明显优于其他两种色谱柱。即,在本发明所构建的对白酒样品进行检测的方法中,采用hypersil goldc18(150mm
×
2.1mm,1.9μm)色谱柱却可以较好实现白酒样品中32种组分的分离。
[0106]
对比例3探究不同的流动相洗脱体系对检测结果的影响
[0107]
该对比例考察了0.1%甲酸水溶液-甲醇、1mmol/l乙酸铵溶液(含0.1%甲酸)-甲醇两种不同的流动相洗脱体系对采用本发明所构建的检测方法对白酒样品中32种待测组分的分离效果的影响,在该对比例实验中,除流动相洗脱体系不一样,其余条件均与实施例1相同。
[0108]
需要说明的是,上述前流动相洗脱体系是经过实验摸索后,对于该条件下所有待测组分分析效果最优的流动相洗脱体系。具体以吡咯烷为例,如图5所示,,通过在0.1%甲酸水溶液-甲醇流动相洗脱体系下吡咯烷色谱峰响应值明显高于以1mmol/l乙酸铵溶液(含0.1%甲酸)-甲醇为流动相洗脱体系,即,在本发明所构建的对白酒样品进行检测的方法中,采用 0.1%甲酸水溶液-甲醇流动相洗脱体系可以较好实现白酒样品中32种组分的分离。
[0109]
对比例4探究不同梯度洗脱程序下对待测组分分离的影响
[0110]
该对比例考察了不同梯度洗脱程序下待测组分分离情况,在该对比例实验中,除洗脱程序不一样,其余条件均与实施例1相同,该对比例的不同梯度洗脱程序参数详见表5,洗脱程序1即为本发明实施例1用的洗脱程序,洗脱程序2与洗脱程序1不同之处在于不同时间节点有机相的比例不同,洗脱程序3与洗脱程序1不同之处,流速不同。
[0111]
该对比例结果表明,选择怎样的洗脱程序会对白酒样品中不同组分物质的分离检测效果有明显的,且不同的洗脱程序会对检测效果产生怎样的影响是不可预测的。需要说明的是,上述本发明实施例中的前流动相洗脱程序是经过实验摸索后,对于该条件下本发明中所有待测组分分析效果最优的流动相洗脱程序。具体以吡咯烷为例,如图12所示,通过洗脱程序 1下吡咯烷色谱峰响应值明显高于洗脱程序2,同时,在洗脱程序3下吡咯烷色谱峰保留时间早于洗脱程序1,说明吡咯烷在洗脱程序3下尚未完全保留于液相色谱柱内后被流动相所洗脱,即,在本发明所构建的对白酒样品进行检测的方法中,采用梯度洗脱程序1可以较好实现白酒样品中32种组分的分离。
[0112]
表5不同梯度洗脱程序参数表
[0113][0114][0115]
对比例5探究不同的分子离子峰对待测组分分析的影响
[0116]
该对比例考察了白酒样品中17种氨基酸、4种生物胺以及11种难挥发性有机酸等待测组分以常见的2种分子离子峰对其分析的影响,按上述实施例1的方法进行前处理,利用超高效液相色谱串联高分辨质谱仪进行分析:
[0117]
1、分子离子峰1:[m+h]+形式;
[0118]
2、分子离子峰2:[m+h]-形式;
[0119]
通过不同待测组分的分子离子峰响应得出,通过本发明所构建的检测方法对白酒样品中的17种氨基酸、4种生物胺以及11种难挥发性有机酸进行检测分析,17种氨基酸和4种生物胺的分子离子峰在[m+h]+形式下响应最高,11种难挥发性有机酸的分子离子峰在[m+h]
‑ꢀ
形式下响应最高,各待测组分化合物信息及高分辨质谱参数详见表2,其分子离子提取色谱图见图6-11。
[0120]
可以理解,本发明是通过一些实施例进行描述的,本领域技术人员知悉的,在不脱离本发明的精神和范围的情况下,可以对这些特征和实施例进行各种改变或等效替换。另外,在本发明的教导下,可以对这些特征和实施例进行修改以适应具体的情况及材料而不会脱离本发明的精神和范围。因此,本发明不受此处所公开的具体实施例的限制,所有落入本技术的权利要求范围内的实施例都属于本发明所保护的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1