生物标志物在制备肿瘤诊断产品中的应用
1.本发明涉及生物标志物在制备肿瘤诊断产品中的应用,属于肿瘤医药领域。
背景技术:
2.众所周知,肿瘤已成为威胁我国人民生命健康的首要原因,据2022年国家癌症中心发布的全国癌症报告显示,2000-2016年间,我国整体癌症粗发病率和粗死亡率仍持续上升,反映出我国癌症实际负担沉重。肿瘤治疗关键在于是否能做到早发现、早诊断,以便采取相应的治疗措施,目前肿瘤只有争取早期治疗,才有可能被彻底治愈,如果肿瘤发展到中、晚期,肿瘤组织扩大或已发生转移,即使采取了各种治疗手段也很根治;相反,如果在早期或相对早期以及发生转移之前就能发现肿瘤并及时给予合理治疗,相当部分的病人能取得满意的治疗效果,甚至可达到根治效果。
3.目前肿瘤诊断的方法分为5级:
①
临床诊断:根据临床症状、体征以及影像学检查,参考疾病发展规律做出的推测诊断;
②
手术诊断:经手术或各种内镜检查,仅以肉眼看到的肿物而做出的判断,未经病理学证实;
③
理化诊断:在临床上符合癌症表现,并有理化检查阳性结果支持,如x线、b超、ct和mri核磁共振检查,或癌胚抗原、甲胎蛋白测定等;
④
细胞病理学诊断:根据各种脱落细胞、穿刺细胞检查而做出的诊断;
⑤
组织病理学诊断:经粗针穿刺后获得的组织,制成病理切片,进行病理分析后得到的诊断。在这5级中,其诊断的可靠性依次增加,以第五级最为理想。但上述方法无法实现对肿瘤的早发现和早诊断,更多的是在肿瘤发展到一定程度后,甚至患者出现严重的病状体征,此时往往会错失最佳治疗时期,使后期治疗处于极大的被动状态,并且,诊断效果较好的病理学诊断需要穿刺取细胞或组织切片,对患者的精神和身体存在较大损害和消极影响。
4.由于肿瘤发生、发展的机制十分复杂,相关研究存在很多不足,严重阻碍了对于肿瘤的诊断和治疗新手段的开发。代谢是影响肿瘤发生发展的关键因素,肿瘤在发生发展的过程中会出现肿瘤细胞代谢模式的改变,这被称为“代谢重编程”。作为肿瘤的重要特征之一,代谢重编程满足了肿瘤细胞的三个关键需求:持续增长所需的能量,充足的用于合成核酸、蛋白质、脂类的生物大分子,以及氧化还原稳态的维持。只有更全面系统地了解和认识肿瘤代谢的机理,才能找到针对肿瘤代谢的生物标志物,才能突破目前我们在肿瘤诊断方面研究的瓶颈,真正从代谢异常这个角度实现对肿瘤的早期诊断。
5.肿瘤细胞中,代谢酶基因的突变或表达水平的变化,会导致细胞内代谢产物含量发生显著改变,这种“经典”代谢重编程在肿瘤演进中发挥关键作用。然而,近年来越来越多的证据表明,一些代谢酶和代谢小分子也可以通过非代谢途径依赖的“非经典”功能参与到肿瘤细胞的各个重要的生命过程中,从而促进肿瘤的发生发展。瓦博格效应是肿瘤细胞的重要代谢特征,它是指即使在氧气充足的情况下,肿瘤细胞仍主要通过糖酵解获得能量的现象。作为糖酵解的逆反应,糖异生是指生物体将多种非糖物质转变成葡萄糖或糖原的过程。果糖-1,6-二磷酸酶(fructose-1,6-bisphosphatase,fbp1)是糖异生的限速酶,它可以催化果糖-1,6-二磷酸水解为果糖-6-磷酸。代谢酶fbp1不仅能够通过促进糖异生并阻遏糖
酵解来发挥抑制肿瘤的功能,同时它还具有多样的亚细胞定位,并可以通过非经典功能抑制肿瘤的发生发展。此外,有研究发现,肿瘤细胞中端粒酶的表达及活性都呈上调趋势,以此来保证肿瘤细胞的端粒长度及其不断增殖的能力。端粒酶逆转录酶(telomerase reverse tranase,tert)是端粒酶中具有生物活性作用的催化亚基,对端粒酶维持端粒长度起重要作用,tert高表达和高活性与众多恶性肿瘤的发生、发展呈正相关,并且与恶性肿瘤的预后不良有关,抑制tert活性则抑制肿瘤的发展。虽然研究记载了fbp1和tert在肿瘤发生发展中的作用,但其作用的分子机制还不清楚,无法确定对肿瘤做早期诊断的生物标志物。
技术实现要素:
6.本发明要解决的技术问题是,提供用于制备肿瘤早期诊断产品的生物标志物,通过检测生物标志物的表达水平,可以对受试者患肿瘤的情况进行早期诊断。
7.本发明提供了生物标志物在制备肿瘤诊断产品中的应用,所述生物标志物为fbp1 s124 o-糖基化、fbp1 s170磷酸化、tert s227磷酸化和tert t1039磷酸化的一种或多种;
8.其中,fbp1 s124 o-糖基化指的是fbp1的氨基酸序列124位发生o-糖基化,fbp1 s170磷酸化指的是fbp1氨基酸序列170位磷酸化,tert s227磷酸化指的是tert的227位磷酸化,tert t1039磷酸化指的是tert的1039位磷酸化;fbp1的ncbi序列号:np_000498.2,tert的ncbi序列号:np_937983.2。
9.所述产品包括检测样品中生物标志物表达水平的试剂。
10.所述试剂包括第一抗体和第二抗体。
11.所述第一抗体为fbp1 s124 o-糖基化抗体fbp1 s124 o-glcnac、fbp1 s170磷酸化抗体fbp1 ps170、tert s227磷酸化抗体tert ps227或tert t1039磷酸化抗体tert pt1039。
12.所述第二抗体为与第一抗体同源且带有辣根过氧化酶标记的抗体。
13.所述产品的检测方法为elisa或western blot。
14.所述样品为静脉外周血、癌旁组织或肿瘤组织。采集静脉外周血后,需于冰上静置15min,再经3500rpm离心15min得到血清或者血浆,进行检测或-80℃保存,未能即时检测的样品均需要保存在-80℃,检测时置于冰上解冻。
15.所述产品主要为试剂盒。试剂盒包括检测生物标志物表达水平的试剂,以及选自下组的一种或多种物质:容器、使用说明书、阳性对照物、阴性对照物、缓冲剂、助剂或溶剂。其中,使用说明书记载了如何采用试剂盒进行检测,和如何利用检测结果对肿瘤发展进行判断、对治疗方案进行选择。试剂盒的组分可以水介质的形式或以冻干的形式来包装。
16.所述诊断产品可应用于以下肿瘤疾病早期、中期或晚期的诊断:口腔癌、口咽癌、鼻咽癌、呼吸系统癌症、泌尿生殖系统癌症、胃肠癌、中枢或周围神经系统组织癌、内分泌或神经内分泌系统癌症或造血系统癌症、胶质瘤、肉瘤、上皮癌、淋巴瘤、黑素瘤、纤维瘤、脑脊膜瘤、脑癌、肾癌、胆道系统癌症、嗜铬细胞瘤、胰岛细胞癌、利-弗劳梅尼瘤、甲状腺癌、甲状旁腺癌、垂体瘤、肾上腺瘤、骨源性肉瘤肿瘤、神经内分泌系统肿瘤、乳腺癌、肺癌、头颈癌、前列腺癌、食管癌、气管癌、肝癌、膀胱癌、胃癌、胰腺癌、卵巢癌、子宫癌、宫颈癌、睾丸癌、结肠癌、直肠癌或皮肤癌。
17.与现有技术相比,本发明的有益效果是:
18.1、本发明基于肿瘤代谢的机理,找到了针对肿瘤代谢的生物标志物,通过检测生物标志物表达水平可以实现肿瘤的早期诊断;
19.2、样品采集静脉外周血即可完成检测,极大降低了受试者的心理负担和身体损伤。
附图说明
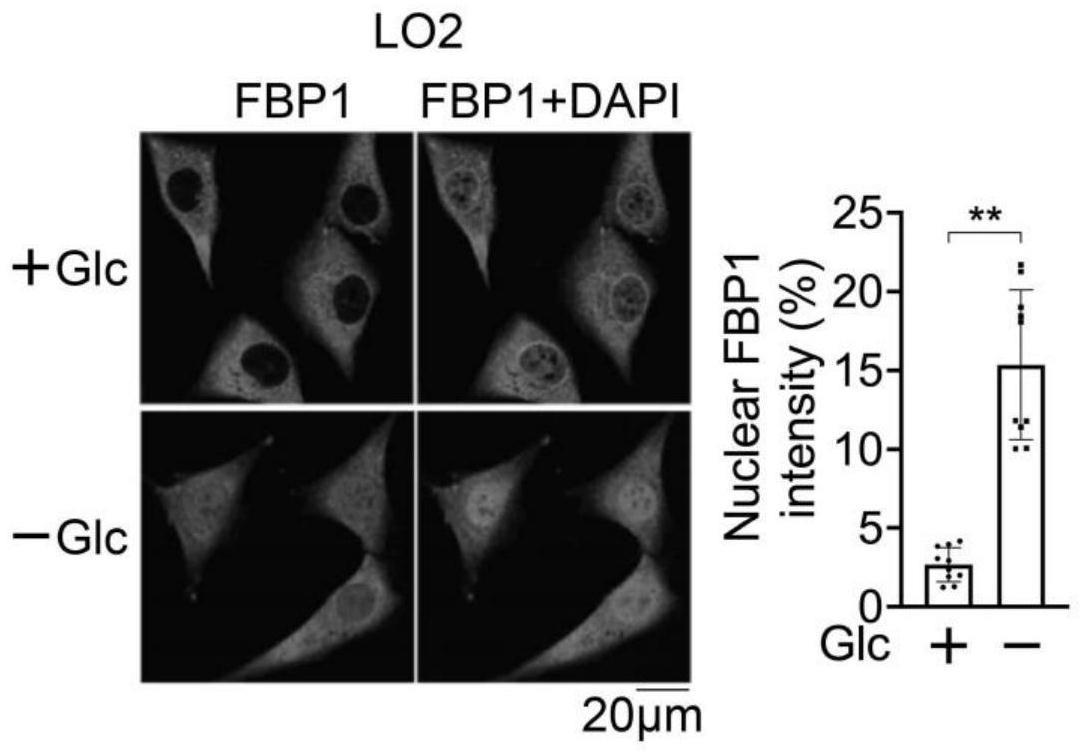
20.图1为对lo2细胞进行有或无葡萄糖的处理的情况下,免疫荧光(左侧)和fbp1的核分布强度如图所示(右侧);
21.图2为分别对lo2和thle-2细胞进行有或无葡萄糖的处理情况下,免疫沉淀分析细胞质和细胞核fbp1表达情况(左侧),使用微管蛋白作为标志物;不同组分中fbp1丰度分析(右侧),**p《0.001经双尾学生t检验;
22.图3为免疫沉淀分析哪种抑制剂可阻断fbp1的核易位;其中,jnks,c-jun n端激酶;perk,蛋白激酶rna样内质网激酶;mapk/apk2,丝裂原活化蛋白激酶,使用微管蛋白作为标志物;
23.图4为放射自显影和免疫沉淀分析,在体外,perk磷酸化fbp1 s170的情况;
24.图5为免疫沉淀分析敲除perk1/2情况下,fbp1 s170的磷酸化改变情况,使用微管蛋白作为标志物;
25.图6为对lo2细胞进行无葡萄糖处理的情况下,免疫荧光(左侧)和fbp1的核分布强度(右侧),**p《0.001经双尾学生t检验;
26.图7为免疫印迹分析,在有或无葡萄糖处理的情况下,细胞核内fbp1表达情况;
27.图8为链霉亲和素下拉实验和免疫沉淀分析,在无葡萄糖处理的情况下,sfd标记的输入蛋白表达情况,使用微管蛋白作为标志物;
28.图9为免疫沉淀分析,在有或无葡萄糖处理的情况下,fbp1蛋白的表达情况,使用微管蛋白作为标志物;
29.图10为免疫印迹分析,在表达或不表达输入蛋白a3和有或无葡萄糖处理的情况下,细胞核内fbp1表达情况,使用微管蛋白作为标志物;
30.图11为分别对lo2和huh7细胞进行有或无葡萄糖的处理的情况下,免疫荧光和fbp1的核分布强度(左侧),**p《0.001经双尾学生t检验;fbp1表达情况(右侧),使用微管蛋白作为标志物;
31.图12为ogt敲低的huh7细胞在有或无葡萄糖的处理情况下,免疫荧光和fbp1的核分布强度(左侧),**p《0.001经双尾学生t检验;免疫印迹分析,细胞核内fbp1表达情况(右侧),使用微管蛋白作为标志物;
32.图13为有无myc-ogt表达的lo2细胞在有或无葡萄糖处理的情况下,免疫荧光和fbp1的核分布强度(左侧),**p《0.001经双尾学生t检验;免疫印迹分析,细胞核内fbp1表达情况(右侧),使用微管蛋白作为标志物;
33.图14为放射自显影和免疫沉淀分析,ogt与fbp1的结合情况;
34.图15为对huh7细胞进行无葡萄糖处理的情况下,免疫荧光(左侧)和rfbp1的核分布强度(右侧),**p《0.001经双尾学生t检验;
35.图16为免疫沉淀和免疫印迹分析,在有或无葡萄糖处理的情况下,细胞核内fbp1的表达情况,使用微管蛋白作为标志物;
36.图17为免疫沉淀和考马斯亮蓝实验分析,lo2和huh7细胞分别在有或无葡萄糖处理的情况下,fbp1与ppara的结合情况;
37.图18为免疫沉淀分析,lo2和huh7细胞分别在有或无葡萄糖处理的情况下,rfbp1与ppara的结合情况;
38.图19为免疫沉淀分析,在无葡萄糖处理的情况下,fbp1与ppara的结合情况,使用微管蛋白作为标志物;
39.图20为免疫沉淀和免疫印迹分析,在无葡萄糖处理的情况下,fbp1与ppara的结合情况以及细胞核中fbp1的表达情况,使用微管蛋白作为标志物;
40.图21为质谱和免疫印迹分别分析,在有或无葡萄糖处理的情况下,ppre荧光素酶及rfbp1的表达情况,使用微管蛋白作为标志物,**p《0.001经双尾学生t检验;
41.图22为pcr实验分析,在有或无葡萄糖处理的情况下,fbp1的在rna水平的表达情况,***p《0.0001经双尾学生t检验;
42.图23为细胞耗氧率(ocr)检测;
43.图24为质谱和免疫印迹分别分析,在有或无葡萄糖处理的情况下,13c2-柠檬酸和13c2-琥珀酸的表达量及fbp1的表达情况,使用微管蛋白作为标志物;
44.图25为免疫沉淀和免疫印迹分析,在有或无葡萄糖处理的情况下,rfbp1与组蛋白3的结合情况,使用微管蛋白作为标志物;
45.图26为分子动力学模拟分析fbp1(左侧)和免疫着色分析fbp1磷酸化组蛋白3t11的情况;
46.图27为磷酸化的组蛋白t11与fbp1 c129的三维空间构图分析(左侧)和免疫着色分析在perk1的介导下,fbp1磷酸化组蛋白3t11的情况;
47.图28为chip检验分析,在有或无葡萄糖处理的情况下,rfbp1的表达情况,***p《0.0001经双尾学生t检验;
48.图29为小鼠肿瘤大小检测结果,***p《0.0001经双尾学生t检验;
49.图30为小鼠肿瘤样本的免疫组化实验;
50.图31为人肝癌样本的免疫组化实验(左侧)及指示的ihc染色评分统计图(右侧),***p《0.0001经双尾学生t检验;
51.图32为人肝癌样本的免疫组化实验(左侧)及相关性分析(右侧);
52.图33为fbp1 s170磷酸化水平和ogt表达水平的生存曲线;
53.图34为将tert蛋白ip下来,与细菌纯化的fbp1蛋白共孵育,用tert s227磷酸化抗体去检测fbp1是否将tert s227位磷酸化修饰去除(左侧图);将fbp1蛋白敲除表达,检测细胞裂解液中tert s227的磷酸化水平(右侧图);
54.图35为过表达fbp1后8周左右,qfish检测端粒长度(左侧图);β-半乳糖苷酶染色检测过表达fbp1的细胞衰老情况(右侧图)。
55.图36为人肝癌样本的免疫组化实验(左侧)及相关性分析(右侧)。
56.图37为tert s227磷酸化水平的生存曲线。
具体实施方式
57.为了使本发明目的、技术方案更加清楚明白,下面结合附图,对本发明作进一步详细说明。下述实施例中所述实验方法,如无特殊说明,均为常规方法;实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行;所述试剂和材料,如无特殊说明,均可从商业途径获得。
58.本发明肿瘤诊断产品为试剂盒,试剂盒中包含检测fbp1 s124 o-糖基化、fbp1 s170磷酸化、tert s227磷酸化和tert t1039磷酸化的表达水平的试剂,每种试剂均包括第一抗体和第二抗体,第一抗体为fbp1 s124 o-糖基化抗体fbp1 s124 o-glcnac、fbp1 s170磷酸化抗体fbp1 ps170、tert s227磷酸化抗体tert ps227或tert t1039磷酸化抗体tert pt1039,第二抗体为与第一抗体同源且带有辣根过氧化酶标记的抗体。
59.试剂盒还包括容器、使用说明书、阳性对照物、阴性对照物、缓冲剂、助剂和溶剂。其中,使用说明书记载了如何采用试剂盒进行检测,和如何利用检测结果对肿瘤发展进行判断、对治疗方案进行选择。试剂盒的组分可以水介质的形式包装。
60.该试剂盒可应用于以下肿瘤疾病早期、中期或晚期的诊断:口腔癌、口咽癌、鼻咽癌、呼吸系统癌症、泌尿生殖系统癌症、胃肠癌、中枢或周围神经系统组织癌、内分泌或神经内分泌系统癌症或造血系统癌症、胶质瘤、肉瘤、上皮癌、淋巴瘤、黑素瘤、纤维瘤、脑脊膜瘤、脑癌、肾癌、胆道系统癌症、嗜铬细胞瘤、胰岛细胞癌、利-弗劳梅尼瘤、甲状腺癌、甲状旁腺癌、垂体瘤、肾上腺瘤、骨源性肉瘤肿瘤、神经内分泌系统肿瘤、乳腺癌、肺癌、头颈癌、前列腺癌、食管癌、气管癌、肝癌、膀胱癌、胃癌、胰腺癌、卵巢癌、子宫癌、宫颈癌、睾丸癌、结肠癌、直肠癌或皮肤癌。
61.试剂盒的检测方法为western blot。
62.western blot,即蛋白免疫印迹实验,是一种常用于研究中分离和鉴定蛋白质的技术。它利用sds-聚丙烯酰胺凝胶电泳(sds-page)来分离指定样品中包含的各种蛋白质,然后将分离的蛋白质转移到硝酸纤维素或pvdf膜上,接下来将膜与对感目标蛋白质的特异抗体一起孵育。在洗膜过程中,未结合的抗体被洗掉,只留下与目标蛋白质结合的抗体,最后通过显影胶片或荧光扫描来检测结合的抗体。由于抗体仅与目标蛋白质结合,因此一般只能看到一条清晰的带,条带的粗细对应于蛋白质量。通过分析特定反应的位置和强度,可以获得目标蛋白在给定细胞或组织匀浆中的表达信息。由于凝胶电泳的高分辨率和免疫的强特异性和高灵敏度,western印迹分析可检测低至1ng的靶蛋白。该方法广泛应用于分子生物学、生物化学、免疫遗传学等分子生物学领域。具体检测步骤如下:
63.1.准备样品
64.1)采集样品:采集静脉外周血,于冰上静置15min,经3500rpm离心15min得到血清,进行检测。
65.2)制冰,准备冰盒;
66.配制细胞裂解液:根据细胞数量确定所需裂解液:50ul/六孔板一孔;
67.裂解液配方:100ul碧云天裂解液+1ul蛋白酶抑制剂混合物+1ul pmsf。
68.3)按实验需要准备好细胞:去掉培养基,1
×
pbs洗3次(去掉培养基中的血清),每个孔(6孔板)加入适量的裂解液。迅速用细胞刮刮下细胞并转移至1.5ml管中,置于冰上20min,振荡混合后,再置冰上10min。
69.4)12,000g,4℃离心15min,收集上清至另一1.5ml管。
70.5)取2.5ul样品加22.5ul三蒸水稀释,用于bca法测蛋白浓度。
71.6)其余样品加5
×
loading buffer(按2.5mlbuffer/10ml蛋白)用95℃煮10分钟,期间振荡一次。
72.7)直接上样跑胶或者分装-80℃长期保存。
73.2.sds-page聚丙烯酰胺凝胶电泳
74.1)制备分离胶(5ml/gel)。
75.2)小心注入分离胶,留2cm左右的空间(制胶架红色边框下缘)给浓缩胶,顶层覆盖去离子水,静置约30分钟。
76.3)制备浓缩胶(2ml/gel)。
77.4)将浓缩胶注入分离胶上端,注意避免气泡。
78.5)插入梳子,待浓缩胶凝固(胶与梳子之间有明显的分界,加上分离胶的凝固时间要大于2h),用双蒸水将孔洗净,去除凝胶碎片,然后用滤纸吸干水。
79.6)将胶放入电泳槽,上下槽均加入1
×
电泳缓冲液(反复使用不要超过3次)。
80.7)上样:marker孔中取5ul prestained marker加入适量1
×
上样buffer,使得总体积与sample孔一样。sample上样量一般为15-25μl,先用heating block 95℃煮5-10分钟,期间振荡一次,然后快速离心再上样跑胶;在没有load sample的孔中加入等体积的1
×
上样buffer。
81.8)电泳:开始为恒压60-80v,当跑过浓缩胶后,将电流加大到100-120v,电泳时间根据目标蛋白的大小及marker的位置确定,一般为目标蛋白跑到分离胶的三分之二的位置即可。
82.3.膜转移
83.1)切胶,按marker指示和目的条带的位置切胶(注意将胶切角做记号),将洗脱的胶浸入转膜缓冲液中15分钟。
84.2)pvdf膜做好记号后先浸入甲醇中1分钟,再连同4张3mm滤纸和海绵浸入转移缓冲液中15分钟。
85.3)制备“夹心饼”:
86.依次按如下顺序:纤维垫
‑‑
滤纸—pvdf膜—凝胶—滤纸
‑‑
纤维垫;
87.注意:每加一种物品都要对齐,确保没有气泡。
88.4)转膜:转膜时间根据1)确定
89.pvdf膜一边接正极(红色),凝胶一边接负极(黑色)。
90.4.膜封闭和抗体孵育
91.1)转膜以后,用10ml的1
×
tbs室温洗膜10分钟。
92.2)5ml奶粉封闭液室温孵育2h或者4℃平缓摇动过夜。由于奶粉较为难溶,因此要提前至少1h配置。
93.3)10ml的tbs/t洗膜3次,每次5分钟。
94.4)加入5ml一抗稀释缓冲液(抗体根据说明稀释),室温2hrs或者4℃平缓摇动过夜,回收一抗,按5ul/ml一抗液加入叠氮钠(可抑制细菌生长)4℃保存(不常用的抗体可-20℃长期保存),可重复使用。
95.5)10ml的tbs/t洗膜3次,每次5分钟。
96.6)加入二抗(一般为1:2000稀释),室温平缓摇动1h。
97.7)10ml的tbs/t洗膜3次,每次5分钟。
98.5.显影,定影(或荧光标记的二抗孵育后,直接扫描荧光)
99.1)显色步骤:先铺保鲜膜,在吸水纸上再铺上保鲜膜;分别将水、显影液(颜色变深则不能用)和定影液倒入各自的盘中。2.5ml ecl-a和2.5ml ecl-b混合,避光。将ecl混合液、膜等拿入暗房。关好门,反锁,拉回布。ecl混合液倒入小盒中,膜用吸水纸稍微吸干放入ecl混合液中室温摇动5min(使得ecl均匀的铺过膜),吸水纸吸干后置于保鲜膜上,膜面朝下包好置于夹子上,剪好x-film(注意手只能拿x-film的边缘)放于膜上,剪角一边为marker(注意:取胶片时要把灯光调到最小,且不要对着灯光,应背着灯光),根据条带的亮度来调整曝光时间,一般可先曝光2min,观察条带的深度,再确定最佳的曝光时间。
100.2)显影,定影:取出x-film置于显影液中一定时间后(视目的条带强度与背景而定),水洗一次再置于定影液中定影5min以上。
101.最终得到目的蛋白在pvdf膜上的条带,通过与蛋白marker的大小比较可判断目的蛋白的大小和位置(fbp1蛋白大小37kd,tert蛋白大小127kd),然后与对照相比,可得到目的蛋白表达变化的结果。
102.检测结果诊断分析:与参考水平相比,fbp1 s124 o-糖基化水平升高,fbp1 s170磷酸化水平降低,tert s227磷酸化水平升高或tert s1039磷酸化水平升高,出现任意一种情况,则受试者具有侵袭性癌症、侵袭性癌症进展期或具有不良预后。
103.本发明生物标志物通过以下研究得到:
104.1、材料和方法
105.使用材料:
106.(1)细胞种类:
107.thle-2(人肝永生化细胞)来自atcc;lo2(人正常肝细胞)、huh7细胞(人肝癌细胞株)来自中国科学院细胞库。
108.(2)无胸腺裸鼠是balb/c无胸腺裸鼠。
109.(3)病人样本:
110.样本组织从浙江大学第一附属医院、青岛大学附属医院获得。对人肝癌组织标本及癌旁组织进行ihc染色,比较肿瘤和正常组织样本的蛋白表达情况。根据阳性细胞百分比和染色强度对组织切片染色进行定量评分。
111.(4)基因敲降所用shrna序列如下:
112.fbp1:5
’‑
ccttgatggatcttccaacat-3’。
113.(5)qrt-pcr所用引物序列:
114.acaa25
’‑
ctgctccgaggtgtgtttgta-3
’5’‑
ggcagcaaattcagacaagtca-3’acad85
’‑
ctcattgccgtgagaggactga-3
’5’‑
ccagaggctctccaaactgctt-3’etfdh5
’‑
cccgggataaggacaagag-3
’5’‑
catctgcttcttctgcaaacc-3’acox15
’‑
tctgtctgggccgctgtcactc-3
’5’‑
cctaggaggcagcctcaggacg-3’gapdh5
’‑
agccacatcgctcagacac-3
’5’‑
gcccaatacgaccaatcc-3’115.试验方法:
116.(1)蛋白质的水平检测:
117.首先在细胞中提取蛋白质,然后用相应的抗体与蛋白质发生抗原抗体反应并通过底物显色确定特异性目的蛋白的表达与作用情况。
118.用于本发明的蛋白水平的检测系统包括:免疫沉淀、免疫印迹测定。
119.所用抗体:tubulin(sc-8035)、normal mouse igg(sc-2025)、normal rabbit igg(sc-2027)、gst(sc-138)购自santa cruz biotechnology(santa cruz,ca);fbp1(12842-1-ap)购自proteintech;[γ-32p]atp购自perkinelmer;ki67(ab9260)购自millipore;myc tag(ab9106)、ogt(ab177941for wb)、importinα3(ab6039)、cpt1a(ab234111)、pparα(ab227074)(for wb)、ffbp1(ab196556)(for if and wb)、lamin b1(ab56986)、biotin(ab53494)、histone h3(ab18521)、histone h3 pt3(ab78351)、histone h3 ps10(ab183626)、histone h3 ps28(ab215532)和igg heavy chain(hrp)(ab99702)购自abcam;o-glcnac(#9875)、hif1α(#3716)、mapk/apk2 pt222(#3316)、mapk/apk2(#3042)、c-jun(#9165)、c-jun ps73(#9164)、histone h3 pt11(#9764)、perk(#3192)、eif2α(#9722)、eif2αps51(#9721)、myc-tag(#2276)、cleaved parp(asp214)(#9541)购自cell signaling technology(danvers,ma);anti-pcna(#610665)购自bd biosciences(bedford,ma)。
[0120]
(2)免疫荧光检测与分析
[0121]
将经过处理之后细胞固定,并用1:100的稀释度的一抗、荧光染料偶联的二抗和dapi进行孵育。获得细胞的免疫荧光显微图像,并使用ix81共聚焦显微镜系统(olympus america)观察拍照。最后将获取的图像用image j(national institutes of health)进行荧光强度分析。
[0122]
所用抗体:fbp1(ab196556for if)购自abcam。
[0123]
(3)细胞耗氧率(ocr)检测
[0124]
运用seahorse xf24细胞外流量分析仪(seahorse bioscience)以ocr的形式测量细胞外氧耗。在实验前将3
×
104细胞进行铺板,之后在不同时间点记录线粒体呼吸。依次注射寡霉素、fccp、抗霉素a等化合物,测定基础呼吸、氧化磷酸化的耗氧率、质子渗漏、最大耗氧量、呼吸潜力等。
[0125]
(4)体外激酶实验
[0126]
将纯化的perk1与不同的细菌纯化的heart或gst-fbp1(200ng)蛋白在25℃的激酶缓冲液(50mm tris-hcl,ph 7.5;100mm kcl;50mmmgcl2,1mm na3vo4,1mm dtt;5%甘油;0.5mm atp和10μci[γ-32p]atp)中孵育1h。然后加入sds
–
page上样缓冲液并加热至100℃持续5min来终止反应。最后将混合物进行sds
–
page或放射自显影分析。
[0127]
(5)荧光素酶测定分析
[0128]
用荧光素酶检测系统检测细胞裂解物中的ppre荧光素酶活性。首先将24孔板中表达fbp1重组的huh7或lo2细胞转染0.1μg 3xppre驱动的荧光素酶报告蛋白和0.075μgβ-半乳糖苷酶。在转染24小时后,将细胞于无葡萄糖的培养基中培养6h,检测细胞裂解液中荧光素酶和β-半乳糖苷酶的活性。
[0129]
(6)小鼠肿瘤样品获取与分析:
[0130]
将100万个重组fbp1突变体的huh7细胞或huh7细胞用含33%基质的20μl dmem培养基吹悬,注射到6周龄雄性balb/c裸鼠的肝脏中(n=6/组)。动物在注射后28天被实施安
乐死并检查肿瘤的生长情况。
[0131]
通过手术解剖出肝脏中的肿瘤组织,用4%甲醛固定,石蜡包埋。通过h&e染色、免疫组织化学染色进行组织学分析确定肿瘤的形成和表型。肿瘤体积计算公式为:v=1/2a2b(v,体积;a,最短的直径;b,最长的直径)。
[0132]
所用抗体:fbp1(ab109020)(for ihc)购自abcam。
[0133]
2、结果与分析
[0134]
(1)缺糖条件下可促进lo2和thle-2细胞中fbp1的入核。
[0135]
lo2细胞在有无葡萄糖的条件下处理2小时,用dapi或者fbp1的抗体做免疫荧光(左侧)及荧光强度差异性分析(右侧)。如图1所示,缺失葡萄糖2小时后,fbp1在核内有分布,且该荧光强度与正常葡萄糖处理不入核的结果有差异。
[0136]
lo2细胞和thle-2细胞在有无葡萄糖的条件下处理2小时,做核质分离实验(左侧)及相对应的含量分析(右侧)。如图2所示,两种细胞在缺失葡萄糖2小时后,核组分中均含有fbp1蛋白,该含量与正常葡萄糖处理的结果有差异。
[0137]
(2)在缺糖情况下,perk磷酸化fbp1 s170位点,并促进其入核。
[0138]
lo2细胞分别在有无perk的抑制剂gsk2656157(10μm),jnks的抑制剂sp600125(20μm)以及p38的抑制剂sb203580(10μm)预处理30分钟。在这之后分别在有无葡萄糖的条件下处理2小时,做核质分离实验。如图3所示,gsk2656157抑制了缺糖刺激下fbp1在核内的分布。
[0139]
纯化的野生型flag/streptavidin-perk1或者flag/streptavidin-perk1 k622a在32p-atp存在下,与纯化的野生型his-fbpa1或者his-fbp1 s170a进行孵育,并进行放射自显影和免疫印迹分析。如图4所示,野生型的perk1使得fbp1磷酸化,而fbp1的k622a突变阻断了这种磷酸化。
[0140]
在perk1/2基因敲除或未敲除的mef细胞中,在有无葡萄糖的条件下处理2小时,用fbp1抗体进行免疫沉淀和免疫印迹分析。如图5所示,只有在perk1/2基因未敲除的mef细胞中才能使得fbp1 s170位点发生磷酸化。
[0141]
lo2野生型flag-fbp1以及flag-fbp1 s170a、nls突变缺糖处理2小时,进行免疫荧光(左侧)以及flag-fbp1的核内分布荧光强度检测(右侧)。如图6所示,葡萄糖剥夺处理后fbp1在核内有分布的现象在s170a以及nls突变的lo2细胞中消失,且与之对应的野生型lo2细胞核内fbp1的荧光强度与这两种突变细胞有差异。
[0142]
用lo2野生型flag-fbp1细胞分别与flag-fbp1 s170a(左侧)、nls(右侧)突变细胞在葡萄糖剥夺的情况下处理2小时,做核质分离实验。如图7所示,在葡萄糖剥夺情况下只有野生型fbp1会出现在核组分中,而s170a以及nls突变则抑制了fbp1的入核。
[0143]
(3)fbp1与importinα3结合,促进其入核。
[0144]
表达sfb标签的各个importin蛋白的lo2细胞用葡萄糖剥夺处理2小时,进行链霉亲和素下拉试验。如图8所示,importinα3能与内源的fbp1结合。
[0145]
表达野生型flag-fbp1或者flag-fbp1 s170a、nls突变的lo2细胞做葡萄糖剥夺处理2小时,用抗flag抗体进行免疫沉淀分析。如图9所示,野生型fbp1与importinα3有结合,但s170a以及nls突变会抑制这种结合。
[0146]
有或者无剥夺葡萄糖处理有或者无敲降importinα3的lo2细胞2小时,进行核质分
离实验。如图10所示,敲降importinα3会抑制fbp1在剥夺葡萄糖情况下入核的现象。
[0147]
(4)相同条件下的葡萄糖剥夺并不会使肝癌细胞系的fbp1入核以及肝癌细胞中的fbp1呈现高o-糖基化修饰。
[0148]
分别对lo2和huh7细胞进行葡萄糖剥夺2小时的处理,使用抗fbp11抗体进行免疫荧光分析和dapi染色(左上)以及相对应的fbp1的核分布荧光强度测量(左下);分别在lo2和huh7细胞中表达flag标签的fbp1,对它们进行葡萄糖剥夺0、1、4小时的处理后,用抗flag抗体进行免疫沉淀分析(右侧)。如图11所示,葡萄糖剥夺2小时可以使lo2细胞中的fbp1入核,但相同条件下,不能使huh7细胞中的fbp1入核,该条件下,lo2和huh7细胞核内的fbp1的荧光强度存在差异(左侧);在葡萄糖剥的时间段里,lo2细胞中的fbp1s170位点持续磷酸化,而相比与lo2细胞,huh7细胞中的fbp1则呈现高o-糖基化修饰(右侧)。
[0149]
(5)在肝癌细胞huh7中,o糖基化转移酶(ogt)被敲低后,fbp1可响应葡萄糖剥夺入核。
[0150]
在huh7细胞中,通过核质分离免疫印记与免疫荧光分析,如图12所示,敲低ogt显著促进了fbp1在葡萄糖剥夺条件下的入核。
[0151]
(6)在正常肝细胞lo2中,过表达o糖基化转移酶(ogt),可抑制葡萄糖剥夺下的fbp1的入核。
[0152]
在lo2细胞中分别过表达empty vector与myc-ogt,随后分别在有无葡萄糖的情况下处理2h,通过核质分离与免疫荧光分析,结果如图12所示,过表达ogt显著抑制了fbp1在葡萄糖剥夺条件下的入核,而表达空载的细胞中fbp1没有入核。
[0153]
(7)体外o糖基化实验,fbp1在s124位点发生o糖基化。
[0154]
通过体外pull down实验、免疫印记实验,如图14所示,ogt可以催化野生型fbp1 s124位点发生o糖基化,而不能催化fbp1 s124a突变蛋白。
[0155]
(8)在肝癌细胞huh7中,fbp1 s124a突变后可以响应葡萄糖剥夺后入核。
[0156]
用稳定表达flag-fbp1 s124a或flag-fbp1的细胞系缺糖处理2h后,做免疫荧光实验,结果如图15所示,稳定表达突变型flag-fbp1 s124a的细胞中fbp1入核,而野生型细胞中fbp1没有入核。
[0157]
同时,核质分离后免疫印迹分析的结果同样表明,flag-fbp1 s124a在响应葡糖糖剥夺后入核,而fbp1 s170a以及双位点突变s124a/s170a均不会入核。
[0158]
(9)在正常肝细胞中,fbp1响应葡萄糖剥夺后入核,与pparα结合。
[0159]
表达野生型flag-fbp1的lo2和huh7细胞做缺糖处理2小时。用flag抗体做免疫沉淀分析,免疫沉淀得的细胞进一步经sds-page分离并做考马斯亮蓝染色处理。分离细胞核成分,做免疫印迹分析。如图17所示,在做缺糖处理后,lo2细胞中的fbp1可以免疫沉淀得到一疑似pparα的蛋白条带,而huh7细胞则无。该蛋白条带经后续质谱检测,鉴定为pparα。
[0160]
经fbp1 shrna敲降fbp1后,表达重构的野生型flag-rfbp1的lo2和huh7细胞缺糖处理2小时。用flag抗体做免疫沉淀分析,并做免疫印迹分析。如图18所示,lo2细胞中的fbp1可免疫沉淀得到pparα,而huh7细胞则不可。
[0161]
(10)fbp1 112-142肽段以及v131位点对于其和pparα的结合至关重要。
[0162]
表达全长野生型flag-fbp1以及不同肽段缺失或者不同位点突变的flag-fbp1的lo2细胞做缺糖处理2小时。用flag抗体做免疫沉淀分析,并做免疫印迹分析。如图19所示,
除112-142肽段缺失以及v131位点突变的flag-fbp1无法免疫沉淀到pparα,其余肽段缺失或者位点突变均可无法免疫沉淀得pparα。
[0163]
经fbp1 shrna敲降fbp1后,表达重构的野生型flag-rfbp1、flag-rfbp1 s124a突变、flag-rfbp1 s124a/s170a突变、flag-rfbp1 s124a/v31a突变的huh7细胞做缺糖处理2小时。用flag抗体做免疫沉淀分析,并做免疫印迹分析。分离细胞核成分,做免疫印迹分析。如图20所示,fbp1 s124a突变可以增加s170位点磷酸化水平,并增加蛋白入核与pparα结合。在fbp1 s124a突变的基础上,加入s170a突变,使s170位点无法磷酸化,并影响蛋白入核。在fbp1 s124a突变的基础上,加入v131a突变,使蛋白入核后无法结合pparα。
[0164]
(11)在肝癌细胞huh7中,o糖基化位点突变fbp1-s124a入核后,与pparα结合,抑制了其转录活性。
[0165]
经fbp1 shrna敲降fbp1后,表达重构的野生型flag-rfbp1、flag-rfbp1 s124a突变、flag-rfbp1 s124a/s170a突变、flag-rfbp1 s124a/v31a突变,同时表达一个含有β-半乳糖苷酶和ppre驱动的荧光素酶报告基团的huh7细胞做低糖(0.5mm)处理12小时。测定ppre驱动的荧光素酶的活性。如图21所示,低糖处理增加ppre驱动的荧光素酶的活性,fbp1 s124a突变无法增加荧光素酶的活性,而在fbp1 s124a突变的基础上加上s170a或者v131a突变则不影响荧光素酶活性的增加。
[0166]
经fbp1 shrna敲降fbp1后,表达重构的野生型flag-rfbp1、flag-rfbp1 s124a突变、flag-rfbp1 s124a/s170a突变、flag-rfbp1 s124a/v31a突变的huh7细胞做低糖(0.5mm)处理12小时。使用qpcr技术检测acaa2,acad8,etfdh,acox1基因的mrna表达水平。如图22所示,低糖处理增加上述基因的mrna表达水平,fbp1 s124a突变无法增加上述基因的mrna表达水平,而在fbp1 s124a突变的基础上加上s170a或者v131a突变则不影响上述基因mrna表达水平的增加。
[0167]
(12)在肝癌细胞huh7中,o糖基化位点突变fbp1-s124a入核后,减少了细胞氧气消耗速率(ocr)。
[0168]
经fbp1 shrna敲降fbp1后,表达重构的野生型flag-rfbp1、flag-rfbp1 s124a突变、flag-rfbp1 s124a/s170a突变、flag-rfbp1 s124a/v31a突变的huh7细胞进行实时氧消耗率测定。如图23所示,fbp1 s124a突变降低细胞的基础氧消耗率以及fccp诱导的最大氧消耗率,而在fbp1 s124a突变的基础上加上s170a或者v131a突变则不影响。
[0169]
经fbp1 shrna敲降fbp1后,表达重构的野生型flag-rfbp1、flag-rfbp1 s124a突变、flag-rfbp1 s124a/s170a突变、flag-rfbp1 s124a/v31a突变的huh7细胞用
13
c-油酸标记并做缺糖处理2小时。如图24所示,缺糖处理增加细胞中
13
c-枸橼酸和
13
c-琥珀酸的含量,fbp1 s124a突变无法增加增加细胞中
13
c-枸橼酸和
13
c-琥珀酸的含量,而在fbp1 s124a突变的基础上加上s170a或者v131a突变则不影响增加细胞中
13
c-枸橼酸和
13
c-琥珀酸含量的增加。
[0170]
(13)fbp1入核后结合histone h3。
[0171]
如图25所示,在正常肝细胞中,葡萄糖剥夺能够诱导fbp1与histone h3结合。并且这种结合并不受fbp1的代谢酶活性的影响。
[0172]
(14)fbp1入核后能够导致histone h3的t11位点的去磷酸化。
[0173]
分子动力学模拟分析wt-fbp1以及s170磷酸化的fbp1,结果显示,s170位点的磷酸
化能够改变fbp1的构象,体外磷酸酶实验表明在perk存在的情况下,原核纯化的fbp1-wt和fbp1-g260r,能够使h3 pt11肽段去磷酸化。
[0174]
如图27所示,分子动力学模拟分析结果显示histone h3 pt11肽段能够结合至s170位点磷酸化的fbp1催化结构域上。并且p t11在空间结构上与c129邻近。右侧的体外磷酸酶实验则表明,fbp1-c129s不再具备histone h3的t11位点的去磷酸化能力。
[0175]
(15)fbp1在基因启动子区域使h3 pt11去磷酸化。
[0176]
用h3 pt11抗体的染色质免疫沉淀实验结果表明,在huh7细胞中,与fbp1 wt相比,fbp1 s124a能够大大削弱葡萄糖剥夺所诱导的acaa2和acad8启动子区域的h3 pt11的富集,而其他点突变则与wt无明显差异。
[0177]
(16)fbp1蛋白磷酸酶活性不足促进肿瘤的发生发展。
[0178]
huh7细胞以及表达fbp1 s124a突变fbp1 s124a/s170a突变fbp1 s124a/v131a fbp1 s124a/c129s,皮下注射无胸腺小鼠,28天后检测肿瘤大小(如图29)下方为肿瘤体积大小的统计结果。
[0179]
肿瘤组织做冰冻切片,做如图30所示的相应抗体的ihc染色,结果发现,表达fbp1 s124a的肿瘤组织中cpt1a呈现低表达,而在表达双突变fbp1 s124a/s170a,s124a/v131a,or s124a/c129s的肿瘤组织中cpt1a恢复高表达。
[0180]
(17)fbp1的s170磷酸化以及o糖基化与肝癌患者的预后相关。
[0181]
用免疫组化的方式对比临床样本肝癌组织以及癌旁组织中ogt,fbp1,fbp1 s170以及cpt1a的蛋白水平,图31结果显示,与正常肝组织相比,癌旁组织中的ogt以及cpt1a蛋白水平呈现低表达,而fbp1 s170位点的磷酸化水平呈现高表达。用40例肝癌组织样本(男性33例,女性7例)分别做ogt,fbp1 s170位点磷酸化,相关性分析结果表明fbp1 s170磷酸化与cpt1a和ogt的蛋白水平均呈现负相关(图32右侧)。
[0182]
在90例肝癌患者(男性73例,女性17例)样本中,分别把在其中的60例患者的样本中,分别把fbp1 s170磷酸化水平和ogt水平分为高表达和低表达,绘制总体生存时间kaplan-meier图,结果如图33所示,fbp1 s170磷酸化水平与肝癌患者的良好预后呈正相关,而ogt与与肝癌患者的良好预后呈负相关。
[0183]
正常肝细胞细胞质中的fbp1可以发挥蛋白磷酸酶的功能,去磷酸化tert蛋白s227位的磷酸化修饰,抑制tert蛋白的核转位及酶活,诱导肿瘤细胞的衰老,从而达到抑制肿瘤细胞生长的目的。而在肿瘤细胞中,低表达的fbp1并不能有效去除在tert蛋白s227位的磷酸化修饰,tert蛋白入核后充分发挥其端粒延长功能,保证了肿瘤细胞的持续增殖。同时,在能量应激的条件下,正常肝细胞中活化的perk1可以磷酸化fbp1并诱导其进入细胞核,细胞核易位的fbp1抑制pparα介导的脂肪酸氧化相关基因的转录。而在肝癌细胞中,高水平的糖基转移酶ogt抑制了fbp1在能量应激条件下向细胞核的转运及其非经典功能,同时也促进肝癌的发生发展。
[0184]
fbp1可以通过代谢酶功能和非经典功能两个方面协同抑制肿瘤的发生发展。而在肝癌细胞中,低表达的fbp1并不能有效去除在tert蛋白s227位的磷酸化修饰,并且高水平的糖基转移酶ogt抑制了fbp1在能量应激条件下向细胞核的转运及其非经典功能,导致fbp1无法发挥最大的抑制肿瘤的效能。
[0185]
因此,增加fbp1表达,特异性阻断ogt对fbp1磷酸化的负调控作用,促进fbp1的细
胞核易位并使其能够发挥非经典功能来抑制肿瘤的发生发展,在不影响fbp1的糖异生代谢酶功能的同时,最大限度地激活其非经典功能,可以使fbp1可以发挥其最大的抑制肿瘤的功效。该发明将为靶向脂质代谢重编程的抗肿瘤药物研发和肿瘤的早期诊断提供新的思路和有效方案。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1