一种奶茶样品茶多酚含量检测方法与流程
1.本发明涉及茶类饮料中茶多酚的检测方法,具体涉及一种奶茶样品茶多酚含量检测方法。
背景技术:
2.我国国家标准gb/t 21733-2008茶饮料中对茶类饮料中茶多酚含量检测方法作出了规定,给出了较浑浊的样液的试液制备方法,该试液制备方法具体地,先用95%乙醇作为蛋白质沉淀剂来沉淀样品中的蛋白质,再用慢速定量滤纸过滤去除蛋白质沉淀,得到的滤液即为试液,用分光光度计法测定该试液的吸光度,就能计算得到样液中茶多酚的含量。从市售的奶茶制品中取出的奶茶样品属于国标中规定的浑浊的样液,但市售的奶茶制品中除了添加乳制品(包括但不限于牛奶、奶粉、炼乳、奶油中的一种或多种)和茶汤以外,还会添加其它食品添加剂,如乳化剂、稳定剂等,导致使用国标中给出的方法用95%的乙醇沉淀蛋白,蛋白沉淀不完全,沉淀后过滤得到的滤液浑浊度高,影响测定结果的准确性。另外,由于奶茶制品中的茶多酚会和蛋白质产生结合,当使用国标中的试液制备方法对奶茶样品蛋白质进行沉淀时,已与蛋白质结合的茶多酚也会和蛋白质一起被沉淀,导致过滤后得到的试液中茶多酚的含量低于奶茶样品中实际的茶多酚含量,这也会影响测定结果的准确性。
技术实现要素:
3.本发明的目的在于,提供一种奶茶样品茶多酚含量检测方法,制得的试液中茶多酚含量高,用于检测奶茶样品的茶多酚含量,准确性高。
4.现有研究表明,牛奶中乳球蛋白与茶多酚中egc的结合强度随温度升高而增大,温度升高也有利于牛奶中β-酪蛋白与茶多酚中egcg结合。发明人经试验发现,从常温状态开始,随着温度逐渐升高,测得奶茶样品中茶多酚的含量会减少,这表明确如上述研究所述,温度越高,奶茶样品中的蛋白质(包括现有研究中的乳球蛋白和β-酪蛋白)与茶多酚(包括现有研究中的egc和egcg)的结合强度越强,茶多酚与蛋白质结合后和蛋白质一起被蛋白质沉淀剂沉淀,随温度升高,被沉淀的茶多酚逐渐增加,使检测试液中的茶多酚含量减少。然而发明人发现,随着温度继续升高,茶多酚含量反而会增加,到达一定温度后又再次减少,不同的奶茶样品,茶多酚含量达到最大时的温度基本落在60℃左右。据此,本发明给出如下技术方案:
5.提供一种奶茶样品茶多酚含量检测方法,包括试液制备步骤和茶多酚检测步骤,茶多酚检测步骤使用试液制备步骤制备得到的试液进行检测,试液制备包括以下步骤:取奶茶样品装入容器中,用58~62℃水浴加热8~10min,加热完毕后,立即往样品中加入蛋白质沉淀剂,边加入边摇匀,静置至沉淀不再增加,然后:
6.用滤纸过滤得到澄清滤液作为试液,沉淀的蛋白质留在滤纸上,茶多酚则留存在滤液中;或进行离心,取上清液作为试液。
7.进一步地,加入的蛋白质沉淀剂体积为奶茶样品体积的2~3倍。
8.进一步地,试液制备步骤加入的蛋白质沉淀剂温度<15℃,以使蛋白质沉淀剂和样品的混合温度≤25℃。
9.进一步地,试液制备步骤采用的滤纸具体为定性滤纸。
10.进一步地,试液制备步骤中,离心具体是在3000r/min的转速下离心10min。
11.进一步地,试液制备步骤采用的蛋白质沉淀剂具体为乙醇、乙腈和丙酮当中的任一种。
12.进一步地,试液制备步骤采用的蛋白质沉淀剂为乙醇,用滤纸过滤具体地,过滤一次后,在留有蛋白质沉淀的滤纸上,再用4~6ml乙醇对滤纸上的沉淀进行洗涤,重复洗涤2~3次,用于洗涤的乙醇溶液温度为58~62℃。
13.进一步地,试液制备步骤中,加入蛋白质沉淀剂后,还加入用于促进沉淀的促进剂,充分摇匀后静置。
14.进一步地,试液制备步骤中,所述促进剂具体为盐酸溶液或氯化钾固体。
15.有益效果:在58~62℃对奶茶样品加热8~10min,再加入蛋白质沉淀剂沉淀蛋白质,得到的试液中茶多酚含量高,用于检测奶茶样品的茶多酚含量,相比现有的检测方法,测定结果更接近实际奶茶样品的茶多酚含量,准确性高。
具体实施方式
16.以下结合具体实施方式对本发明创造作进一步详细说明。
17.一、探究加热温度对奶茶样品中茶多酚含量的影响
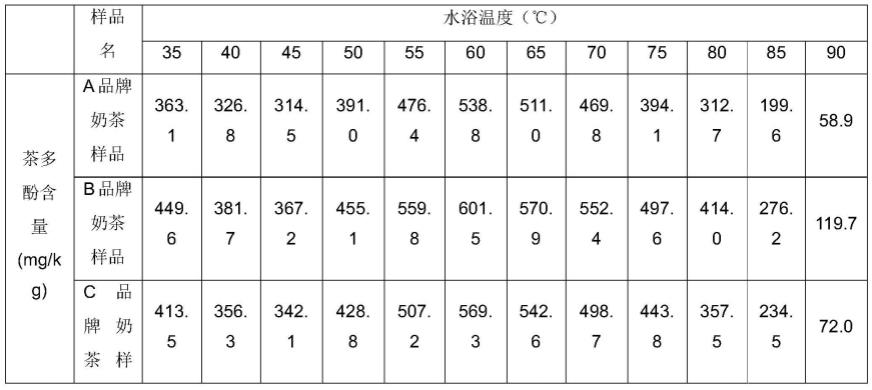
18.(1)为探究水浴加热温度对奶茶样品中茶多酚含量的影响,选取5种不同品牌的奶茶饮料,分别记为a、b、c、d、e品牌,对每种奶茶样品按以下步骤进行第一个实验:
19.s1、准备12个烧瓶,分别称取10g(奶茶的密度大约为1g/ml,根据体积计算公式v=m/ρ,奶茶的质量约等于其体积)奶茶样品装入各烧瓶中,然后分别把各烧瓶置于35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃、90℃水浴锅中加热9min,加热完毕后,对应各烧瓶中样品的温度,立即往各烧瓶中加入20ml一定温度的无水乙醇和1g氯化钾,以使无水乙醇和样品的混合温度下降到25℃,边加入边摇匀,然后静置至沉淀不再增加,就使用定性滤纸进行过滤,得到的澄清滤液作为试液,共获得12份试液。
20.s2、准备12个25ml容量瓶,分别从步骤s1获得的每份试液中称取2g,装入相应的容量瓶中,然后往每个容量瓶中加入4ml蒸馏水、5ml酒石酸亚铁,充分摇匀后,用ph7.5的磷酸缓冲液定容至刻度。用10mm比色皿,在波长540处,以试剂空白作参比,测得试液显色后的吸光度a1。
21.s3、另外准备12个25ml容量瓶,分别从步骤s1获得的每份试液中称取2g,装入相应的容量瓶中,然后往每个容量瓶中加入4ml蒸馏水,再用ph7.5的磷酸缓冲液定容至刻度。用10mm比色皿,在波长540处,以试剂空白作参比,测得试液底色的吸光度a2。
22.s4、把步骤s2测得的a1和步骤s3测得的a2代入下式中计算各奶茶样品中茶多酚的含量:
[0023][0024]
式中:
[0025]
x——奶茶样品中茶多酚的含量,单位为mg/kg;
[0026]
1.957——用10mm比色皿,当吸光度等于0.50时,1ml茶汤中茶多酚的含量相当于1.957mg;
[0027]
k——稀释倍数;
[0028]
m——用于测定吸光度称取的试液质量,单位为g,本实施例为2g。
[0029]
计算得到5种奶茶样品茶多酚含量如下表1所示:
[0030]
表1
[0031][0032][0033]
现有研究表明,牛奶中乳球蛋白与茶多酚中egc的结合强度随温度升高而增大,温度升高也有利于牛奶中β-酪蛋白与茶多酚中egcg结合,且茶多酚中egcg更易与变性蛋白结合,且结合强度增大。
[0034]
本次实验结果表明,随着水浴温度逐渐升高,在35~45℃范围内,各品牌奶茶样品中茶多酚含量逐渐减少,这表明在该温度范围内,确如现有研究所述,温度越高,奶茶样品中的蛋白质(包括现有研究中的乳球蛋白和β-酪蛋白)与茶多酚(包括现有研究中的egc和egcg)结合强度越强,茶多酚与蛋白质结合后和蛋白质一起被蛋白质沉淀剂沉淀,随温度升高,被沉淀的茶多酚逐渐增加,使检测试液中的茶多酚含量减少。然而,在50~60℃范围内,随温度升高,各品牌奶茶样品中茶多酚含量回升,并在水浴温度60℃情况下达到茶多酚含量最大值。推测在50~60℃范围内,随温度升高,茶多酚和蛋白质的结合强度逐渐减弱,使得与蛋白质一起沉淀的茶多酚逐渐减少,因此检测试液中的茶多酚含量逐渐增加。在65~90℃范围内,随温度升高,茶多酚含量再次呈现下降趋势,且随温度升高,茶多酚含量降幅逐渐增大,这也印证了现有研究中的结论,即温度越高,奶茶样品中的蛋白质(包括现有研
究中的乳球蛋白和β-酪蛋白)与茶多酚(包括现有研究中的egc和egcg)两者的结合强度越强。
[0035]
(2)由于实验(1)中,对奶茶样品进行不同的水浴加热温度并非连续的数值,为进一步确定能使奶茶样品茶多酚含量达到最大的适宜加热温度,对上述各品牌奶茶样品按以下步骤进行第二个实验:
[0036]
s1、准备11个烧瓶,分别称取10g奶茶样品装入各烧瓶中,然后分别把各烧瓶置于55℃、56℃、57℃、58℃、59℃、60℃、61℃、62℃、63℃、64℃、65℃水浴锅中加热9min,加热完毕后,对应各烧瓶中样品的温度,立即往各烧瓶中加入20ml一定温度的无水乙醇和1g氯化钾,以使无水乙醇和样品的混合温度下降到25℃,边加入边摇匀,然后静置至沉淀不再增加,就使用定性滤纸进行过滤,得到的澄清滤液作为试液,共获得11份试液。
[0037]
s2、准备11个25ml容量瓶,分别从步骤s1获得的每份试液中称取2g,装入相应的容量瓶中,然后往每个容量瓶中加入4ml蒸馏水、5ml酒石酸亚铁,充分摇匀后,用ph7.5的磷酸缓冲液定容至刻度。用10mm比色皿,在波长540处,以试剂空白作参比,测得试液显色后的吸光度a1。
[0038]
s3、另外准备11个25ml容量瓶,分别从步骤s1获得的每份试液中称取2g,装入相应的容量瓶中,然后往每个容量瓶中加入4ml蒸馏水,用ph7.5的磷酸缓冲液定容至刻度。用10mm比色皿,在波长540处,以试剂空白作参比,测得试液底色的吸光度a2。
[0039]
s4、把步骤s2测得的a1和步骤s3测得的a2代入下式中计算各奶茶样品中茶多酚的含量:
[0040][0041]
式中:
[0042]
x——奶茶样品中茶多酚的含量,单位为mg/kg;
[0043]
1.957——用10mm比色皿,当吸光度等于0.50时,1ml茶汤中茶多酚的含量相当于1.957mg;
[0044]
k——稀释倍数;
[0045]
m——用于测定吸光度称取的试液质量,单位为g,本实施例为2g。
[0046]
计算得到5种奶茶样品茶多酚含量如下表2所示:
[0047]
表2
[0048][0049][0050]
结果显示,5种品牌的奶茶样品在水浴温度58~62℃范围内出现茶多酚含量最大值。结合前后两个实验结果,可知:随温度升高,在50~62℃范围内,各品牌奶茶样品中的茶多酚含量基本呈上升趋势,并在58~62℃趋于平稳,温度升高至63℃以后,即在63~90℃这个实验范围内,茶多酚含量呈现下降趋势。表明随温度升高,在50~62℃范围内,茶多酚和蛋白质的结合强度逐渐减弱,两者的结合强度在58~62℃基本保持不变,在63~90℃范围内,茶多酚和蛋白质的结合强度逐渐增强。
[0051]
二、上述一(1)和(2)的实验结果显示各品牌奶茶样品中的茶多酚含量在50~62℃范围内,各品牌奶茶样品中的茶多酚含量基本呈上升趋势,并在58~62℃趋于平稳,温度升高至63℃以后,即在63~90℃这个实验范围内,茶多酚含量呈现下降趋势,本发明给出以下实施例:
[0052]
实施例1
[0053]
一种奶茶样品茶多酚含量检测方法,包括以下步骤:
[0054]
试液制备:称取10g奶茶样品装入烧瓶中,用62℃水浴加热8min,加热完毕后,立即往样品中加入20ml温度为6℃的95%乙醇溶液作为蛋白质沉淀剂,并加入2g氯化钾固体作为促进蛋白质沉淀的促进剂,边加入边摇匀,往样品中加入乙醇溶液并摇匀后,乙醇溶液和样品的混合温度为24.67℃,静置15min后沉淀不再增加,然后使用定性滤纸进行过滤,得到的澄清滤液作为试液,沉淀的蛋白质留在滤纸上,茶多酚则留存在滤液中。
[0055]
茶多酚检测:使用gb/t 21733-2008附录a第3.2节的方法进行检测,具体步骤如下:
[0056]
(1)从上述试液制备步骤得到的试液中称取2g装入25ml容量瓶中,往试液中加入4ml蒸馏水、5ml酒石酸亚铁,充分摇匀后用ph7.5的磷酸缓冲液定容至刻度。用10mm比色皿,在波长540nm处,以试剂空白作参比,测得试液显色后的吸光度a1;
[0057]
(2)从上述试液制备步骤得到的试液中称取2g装入25ml容量瓶中,往试液中加入4ml蒸馏水,用ph7.5的磷酸缓冲液定容至刻度。用10mm比色皿,在波长540nm处,以试剂空白作参比,测得试液底色的吸光度a2。
[0058]
(3)把步骤(1)测得的吸光度a1和步骤(2)测得的吸光度a2代入下式中计算奶茶样品中茶多酚的含量:
[0059][0060]
式中:
[0061]
x——奶茶样品中茶多酚的含量,单位为mg/kg;
[0062]
1.957——用10mm比色皿,当吸光度等于0.50时,1ml茶汤中茶多酚的含量相当于1.957mg;
[0063]
k——稀释倍数;
[0064]
m——用于测定吸光度称取的试液质量,单位为g,本实施例为2g。
[0065]
实施例2
[0066]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,加入的乙醇溶液温度为3℃,乙醇溶液和样品的混合温度为22.67℃。
[0067]
实施例3
[0068]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,加入的乙醇溶液温度为10℃,乙醇溶液和样品的混合温度为27.3℃。
[0069]
实施例4
[0070]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,加入的乙醇溶液温度为16℃,乙醇溶液和样品的混合温度为31.3℃。
[0071]
实施例5
[0072]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,加入的乙醇溶液温度为20℃,乙醇溶液和样品的混合温度为34℃。
[0073]
实施例6
[0074]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,加入的乙醇溶液温度为26℃,乙醇溶液和样品的混合温度为38℃。
[0075]
实施例7
[0076]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,不使用乙醇作为蛋白质沉淀剂,也没有加入促进剂,改为加入30ml 12℃的乙腈作为蛋白质沉淀剂,乙腈和样品的混合温度为24.5℃。
[0077]
实施例8
[0078]
本实施例与实施例7基本相同,不同之处在于,试液制备步骤中,加入的乙腈温度为8℃,乙腈和样品的混合温度为21.5℃。
[0079]
实施例9
[0080]
本实施例与实施例7基本相同,不同之处在于,试液制备步骤中,加入的乙腈温度为16℃,乙腈和样品的混合温度为27.5℃。
[0081]
实施例10
[0082]
本实施例与实施例7基本相同,不同之处在于,试液制备步骤中,加入的乙腈温度为20℃,乙腈和样品的混合温度为30.5℃。
[0083]
实施例11
[0084]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,不使用乙醇作为蛋白质沉淀剂,也不使用氯化钾固体作为促进剂,改为加入25ml10.2℃的丙酮作为蛋白质沉淀剂,加入0.7ml1%(v/v)的盐酸作为促进剂,丙酮和样品的混合温度为25℃。
[0085]
实施例12
[0086]
本实施例与实施例11基本相同,不同之处在于,试液制备步骤中,加入的丙酮温度为5℃,丙酮和样品的混合温度为21.3℃。
[0087]
实施例13
[0088]
本实施例与实施例11基本相同,不同之处在于,试液制备步骤中,加入的丙酮温度为16℃,丙酮和样品的混合温度为29.1℃。
[0089]
实施例14
[0090]
本实施例与实施例11基本相同,不同之处在于,试液制备步骤中,加入的丙酮温度为20℃,丙酮和样品的混合温度为32℃。
[0091]
实施例15
[0092]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,加入的乙醇溶液体积为10ml,温度为﹣12℃,加入的氯化钾固体为1g,则乙醇溶液和样品的混合温度为25℃。
[0093]
实施例16
[0094]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,加入的乙醇溶液体积为30ml,温度为12℃,乙醇溶液和样品的混合温度为24.5℃。
[0095]
实施例17
[0096]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,加入的乙醇溶液体积为40ml,温度为15℃,乙醇溶液和样品的混合温度为24.4℃。
[0097]
实施例18
[0098]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,加入的乙醇溶液体积为50ml,温度为17℃,乙醇溶液和样品的混合温度为24.5℃。
[0099]
实施例19
[0100]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,加热完毕后,立即往样品中加入20ml温度为6℃的蒸馏水,充分摇匀后蒸馏水和样品的混合温度为24.67℃,然后再加入10ml温度为25℃的95%乙醇溶液。
[0101]
实施例20
[0102]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,水浴加热的温度为58℃,加热时间为10min,加入的乙醇溶液温度为8℃,乙醇溶液和样品的混合温度为24.67℃。
[0103]
实施例21
[0104]
本实施例与实施例20基本相同,不同之处在于,试液制备步骤中,加入的乙醇溶液体积为30ml,温度为14℃,乙醇溶液和样品的混合温度为25℃。
[0105]
实施例22
[0106]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,使用无水乙醇作为蛋白质沉淀剂。
[0107]
实施例23
[0108]
本实施例与实施例22基本相同,不同之处在于,试液制备步骤中,使用的加入的无水乙醇体积为10ml,温度为﹣12℃,加入的氯化钾固体为1g,无水乙醇和样品的混合温度为25℃。
[0109]
实施例24
[0110]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,使用定性滤纸进行一次过滤后,在留有蛋白质沉淀的滤纸上,使用6ml 62℃的75%乙醇溶液对滤纸上的沉淀进行洗涤,重复洗涤3次,洗涤液经滤纸过滤后合并到第一次过滤得到的滤液中,该合并的滤液即为试液。
[0111]
实施例25
[0112]
本实施例与实施例24基本相同,不同之处在于,试液制备步骤中,使用4ml 58℃的95%乙醇溶液对滤纸上的沉淀进行洗涤,重复洗涤2次。
[0113]
实施例26
[0114]
本实施例与实施例1基本相同,不同之处在于,试液制备步骤中,往样品中加入乙醇溶液并摇匀后,把加入乙醇溶液的样品转移到离心管中,静置15min后沉淀不再增加,就把离心管放入离心机中以3000r/min的转速离心10min,取上清液作为试液。
[0115]
实施例1使用滤纸对静置沉淀的样品进行过滤,由于滤纸滤孔较小,过滤速度慢,耗时较长。本实施例不使用滤纸过滤,改为对静置沉淀的样品进行离心,耗时较实施例1短,利于提高检测效率。
[0116]
对比例1
[0117]
本对比例与实施例1的不同之处在于,试液制备步骤使用gb/t 21733-2008附录a第3.1.2节提供的方法来制备试液,具体地:
[0118]
称取10g奶茶样品装入烧瓶中,加入6ml95%乙醇溶液,充分摇匀后静置至沉淀不再增加,然后使用慢速定量滤纸进行过滤,得到的澄清滤液作为进行茶多酚检测的试液。
[0119]
对比例2
[0120]
本对比例与对比例1基本相同,不同之处在于,试液制备步骤中,加入的乙醇溶液体积为20ml。
[0121]
对比例3
[0122]
本对比例与实施例1基本相同,不同之处在于,试液制备步骤中,在进行水浴加热之前就往样品中加入乙醇溶液,具体地,取20ml95%的乙醇溶液,置于62℃水浴锅中进行预热,预热后立即加入装有10g奶茶样品的烧瓶中,混合均匀,然后立即对加了乙醇溶液的样品进行62℃水浴加热8min。
[0123]
对比例4
[0124]
本对比例与实施例1基本相同,不同之处在于,试液制备步骤中,水浴加热时间为
11min。
[0125]
对比例5
[0126]
本对比例与实施例20基本相同,不同之处在于,试液制备步骤中,水浴加热时间为7min。
[0127]
三、比较各实施例的和对比例的检测方法
[0128]
使用本发明实施例1~26和对比例1~5提供的方法对上述a品牌奶茶样品的茶多酚含量进行检测,每种方法平行测定3次,并计算标准偏差和相对标准偏差,检测结果如下表3所示:
[0129]
表3
[0130]
[0131]
[0132]
[0133][0134]
结果表明:
[0135]
(1)对于同一份奶茶样品,与使用对比例1的方法(即gb/t 21733-2008附录a第3.1.2节提供的方法)测得的茶多酚含量相比,使用本发明实施例1~26的方法测得的茶多酚含量较高,标准偏差和相对标准偏差更小,表明本发明实施例1~26提供的方法有较好的精密度。
[0136]
(2)实施例2~6的方法都与实施例1基本相同,区别仅在于对添加的乙醇溶液温度作出了改变。其中,实施例2的乙醇溶液温度比实施例1低3℃,使得乙醇溶液和样品的混合温度比实施例1低2℃,其测得的茶多酚含量与实施例1较为接近。实施例3~6的乙醇溶液温度都比实施例1高,其中,实施例3的乙醇溶液温度比实施例1高4℃,使得乙醇溶液和样品的混合温度比实施例1高2.63℃,其测得的茶多酚含量略低于实施例1,但差异不显著,从实施例4~6的茶多酚含量检测结果可以发现,在实验范围内,实施例中乙醇溶液的温度越高,乙
醇溶液和样品的混合温度也越高,结果测得的茶多酚含量就越少。由于实施例中边加入乙醇溶液边摇匀,因此可以忽略乙醇溶液本身温度对样品的茶多酚含量的影响,表明乙醇溶液和样品的混合温度会影响样品中茶多酚含量,在实验范围内,当乙醇溶液和样品的混合温度低于27℃摄氏度,样品中的茶多酚含量可以保持一个较高的水平。
[0137]
实施例7与实施例1的方法基本相同,区别在于实施例7使用30ml 12℃的乙腈作为蛋白质沉淀剂,乙腈和样品的混合温度为24.5℃,其测得的茶多酚含量与实施例1较为接近。实施例8的乙腈温度比实施例7低4℃,乙腈和样品的混合温度比实施例7低3℃,其测得的茶多酚含量与实施例7和实施例1较为接近。而在实施例9和10中,乙腈和样品的混合温度都比高于实施例7,都高于27℃,两个实施例测得的茶多酚都低于实施例7。
[0138]
实施例11与实施例1的方法基本相同,区别在于实施例11使用25ml 10.2℃的丙酮作为蛋白质沉淀剂,丙酮和样品的混合温度为25℃,其测得的茶多酚含量与实施例1较为接近。实施例12的乙腈温度比实施例11低5.2℃,丙酮和样品的混合温度比实施例11低3.7℃,其测得的茶多酚含量与实施例11和实施例1较为接近。而在实施例13和14中,乙腈和样品的混合温度都比高于实施例7,都高于27℃,两个实施例测得的茶多酚都低于实施例7。
[0139]
综合实施例1~14的结果可以看出,对于不同的蛋白质沉淀剂,当其温度改变,导致蛋白质沉淀剂与样品的混合温度发生变化时,特别是温度升高时,都会影响样品中茶多酚含量,在实验范围内,当蛋白质沉淀剂和样品的混合温度低于27℃摄氏度,样品中的茶多酚含量可以保持一个较高的水平。故本发明优选使样品和不同蛋白质沉淀剂的混合温度都保持在27℃以内,更优选地,使样品和蛋白质沉淀剂的混合温度≤25℃
[0140]
(3)对比例2与对比例1的方法基本相同,都是没有对奶茶样品进行水浴加热,直接往奶茶样品中加入乙醇溶液,即乙醇溶液和奶茶样品均为常温下(25℃)。对比例2添加的乙醇溶液体积与实施例1相同,其测得的茶多酚含量为363.9mg/kg。本发明实施例1奶茶样品在62℃下水浴加热8min,虽然在加热结束后,加入的乙醇溶液使得奶茶样品和乙醇溶液的混合温度立刻降回到与对比例2相同的温度(25℃),但使用实施例1的方法测得的平均茶多酚含量为541.77,远大于对比例2测得的茶多酚含量。
[0141]
上文一、探究加热温度对奶茶样品中茶多酚含量的影响的实验结果已说明了,随着水浴温度逐渐升高,在35~45℃和范围内,奶茶样品中的蛋白质与茶多酚的结合强度逐渐增强,在50~62℃范围内,茶多酚和蛋白质的结合强度逐渐减弱,两者的结合强度在58~62℃基本保持不变,温度升高至63℃以后,在63~90℃的实验范围内,茶多酚和蛋白质的结合强度逐渐增强。据此,发明人推测,对比例2奶茶样品中茶多酚和蛋白质在常温状态下容易产生结合,当茶多酚和蛋白质处于结合状态时,即使往奶茶样品中加入乙醇溶液,降低了茶多酚和蛋白质的浓度,这两者也仍然会保持原有的结合状态,这种结合的强度无法被加入的乙醇溶液减弱,因此奶茶样品中大部分茶多酚会随蛋白质一起被乙醇沉淀,降低了滤液中的茶多酚含量,使测得的结果偏低。而本发明实施例1在62℃的水浴加热条件下,奶茶样品中茶多酚和蛋白质两者的结合强度弱于对比例2奶茶样品中这两者的结合强度,不易发生结合,在该基础上,加入乙醇溶液降低奶茶样品中茶多酚和蛋白质的浓度,能使茶多酚和蛋白质之间维持在较弱的结合强度,因此奶茶样品中的茶多酚不易随蛋白质一起被乙醇沉淀,能大量留存在滤液中,同时,加入乙醇溶液后奶茶样品的温度立刻降回到25℃,可以减小样品中茶多酚发生氧化的几率,使最终测得的茶多酚含量高于对比例1。
[0142]
(4)实施例15~18的方法都与实施例1基本相同,区别在于,在令乙醇溶液和样品混合温度接近实施例1(24.67℃)的基础上,对乙醇溶液的体积作出了改变。其中,实施例15添加的乙醇溶液体积比实施例1少10ml,测得的茶多酚含量比实施例1少了约49.07mg/kg,实施例16添加的乙醇溶液体积比实施例1多10ml,测得的茶多酚含量与实施例1较为接近,略低于实施例1,这表明确如上述(2)中发明人推测的那样,乙醇溶液可以降低奶茶样品中茶多酚和蛋白质的浓度,从而使茶多酚和蛋白质维持在较弱的结合强度,理由如下:实施例15添加的乙醇溶液体积较实施例1和16少,因此,在实施例15中茶多酚和蛋白质这两者的浓度降幅小于实施例1和16,相应地,实施例15中茶多酚和蛋白质这两者的结合强度高于实施例1和16中这两者的结合强度,但仍弱于这两者在对比例1中的和在对比例2中的结合强度,故实施例15最终测得的茶多酚含量小于实施例1的和实施例16测得的茶多酚含量,但大于对比例2测得的茶多酚含量。
[0143]
实施例17添加的乙醇溶液体积比实施例1多20ml,测得的茶多酚含量略小于实施例1,实施例18添加的乙醇溶液体积比实施例1多30ml,测得的茶多酚含量小于实施例17,结合实施例1和16,可以看出,随着乙醇溶液体积增加,测得茶多酚含量呈现下降的趋势,这是因稀释度增加产生了误差,但这个趋势在一定范围内不显著,如本发明实施例在20~30ml的范围内(即奶茶样品体积的2~3倍)。综合考虑误差和试剂成本,本发明优选的蛋白质沉淀剂添加量为奶茶样品体积的2~3倍,最优选为奶茶样品体积的2倍。
[0144]
(5)实施例19对样品加热完毕后,立即往样品中加入20ml 6℃的蒸馏水,然后才加入常温的(即25℃的)乙醇溶液,该蒸馏水起到了与实施例1中乙醇溶液相同的作用,即a.降低样品中茶多酚和蛋白质的浓度,使茶多酚和蛋白质之间维持在弱的结合强度;b.迅速降低样品温度,减少样品中茶多酚发生氧化的几率。但既加入蒸馏水又加入乙醇溶液,相当于对样品进行了二次稀释,会使测量结果产生一定误差,导致测得的茶多酚略低于实施例1。
[0145]
(6)实施例20和实施例21的方法与实施例1基本相同,区别在于这两个实施例对奶茶样品进行水浴加热的温度都是58℃,且实施例21添加的乙醇溶液体积比实施例1多10ml。其中,实施例20测得的茶多酚含量略高于实施例1,实施例21测得的茶多酚含量与实施例1较为接近。
[0146]
(7)实施例22和实施例23都是使用无水乙醇作为蛋白质沉淀剂。其中,实施例22添加的无水乙醇体积与实施例1的乙醇溶液体积相同,实施例23添加的蛋白质沉淀剂体积与实施例15相同,都是比实施例1少10ml,但实施例15使用的蛋白质溶剂是95%乙醇溶液,实施例23使用的蛋白质沉淀剂是无水乙醇,使用实施例23的方法测得的茶多酚含量高于实施例15。这可能是由于实施例23添加的无水乙醇沉淀蛋白质的速度大于实施例15的乙醇溶液,与实施例15相比,实施例23的无水乙醇能在蛋白质与茶多酚结合之前快速把蛋白质沉淀下来,减小了蛋白质与茶多酚结合的机会,从而提高了滤液中的茶多酚含量。
[0147]
(8)实施例24和25使用乙醇溶液对滤纸上的沉淀进行洗涤,能把附着在沉淀表面的茶多酚洗涤下来,随洗涤液一起穿过滤网合并到第一次过滤得到的滤液中作为试液,因此测得的茶多酚含量略高于实施例1。
[0148]
(9)对比例3在进行水浴加热之前就往样品中加入预热好的乙醇溶液,其测得的茶多酚含量比实施例1少了约77mg/kg,且标准偏差和相对标准偏差也较实施例1大。出现该结果的原因为:a.奶茶样品中原本就存在与蛋白质结合在一起的茶多酚,此状态下往奶茶样
品中加入预热好的乙醇溶液,奶茶样品中这些茶多酚可能还没与蛋白质分离就随蛋白质一起被乙醇沉淀,沉淀的蛋白质凝聚在一起包裹住这部分茶多酚,此时再对奶茶样品进行加热,这部分茶多酚也很难与凝聚的蛋白质分离,因此留存在滤液中的茶多酚含量仍然远小于奶茶样品中实际的茶多酚含量。b.根据本领域普通技术知识,乙醇容易挥发,在高温状态下挥发速度还比常温状态下更快。对比例3往样品中加入乙醇溶液后在62℃下水浴加热,虽然温度升高能使乙醇沉淀蛋白质的速度加快,但在加热过程中乙醇会大量挥发,使样品中的乙醇含量减少,而乙醇在对比例3中系作为蛋白质沉淀剂,其含量较小势必会导致蛋白质沉淀量下降,因此,若要把样品中的蛋白质完全沉淀,还需要继续添加乙醇来弥补在加热过程中挥发掉的量。c.在水浴加热之前就添加到样品中的乙醇溶液,不能像实施例1的乙醇溶液那样起到使奶茶样品温度下降的作用。对比例3添加有乙醇溶液的奶茶样品在加热完毕后,在一段时间内仍然会保持较高的温度,在未使用其它冷却手段的情况,样品降温速度缓慢,这个过程中,会有部分茶多酚发生氧化。
[0149]
(10)对比例4水浴加热的时间比实施例1多了3min,其测得的茶多酚含量却降低了。对比例5水浴加热的时间比实施例20少了3min,其测得的茶多酚含量也降低了,且产生的标准偏差更大。据此可以看出,茶多酚的含量与水浴加热的时间有关,本发明优选采用8~10min的加热时间。
[0150]
四、回收实验
[0151]
(1)称取250mg茶多酚标准品装入25ml容量瓶中,加入蒸馏水定容,然后摇匀至茶多酚标准品全部溶解,则配制成10mg/ml的茶多酚溶液,准备3个10ml容量瓶,分别往各容量瓶中加入0.25ml、0.5ml、0.75ml的茶多酚溶液,分别加入蒸馏水定容,配制成2.5mg/ml、5.0mg/ml、7.5mg/ml的茶多酚标准溶液。
[0152]
(2)使用上述a、b和c三个品牌的奶茶样品,每个样品都按实施例1提供的方法进行三组回收实验,每组重复6次实验。其中,第一组回收实验的试液制备步骤中,往奶茶样品中加入1ml步骤(1)配制的2.5mg/ml茶多酚标准溶液,混合均匀后再进行水浴加热;第二组回收实验的试液制备步骤中,往奶茶样品中加入1ml步骤(1)配制的5mg/ml茶多酚标准溶液,混合均匀后再进行水浴加热;第三组回收实验的试液制备步骤中,往奶茶样品中加入1ml步骤(1)配制的7.5mg/ml茶多酚标准溶液,混合均匀后再进行水浴加热。记录各样品每组回收实验每次实际测算得到的茶多酚含量(即实测值),把实测值代入到回收率计算公式中计算每次的回收率,再把每组的六次回收率加起来计算平均回收率,实验结果如下表4所示:
[0153]
表4
[0154][0155][0156]
结果显示,本发明实施例1提供的方法对不同样品的回收率均在95%~105%范围内,且相对标准偏差较小,表明本发明实施例提供的方法,用于检测奶茶样品的茶多酚含量
准确性高。
[0157]
如上所述仅为本发明创造的实施方式,不以此限定专利保护范围。本领域技术人员在本发明创造的基础上作出非实质性的变化或替换,仍落入专利保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1