分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法与流程
1.本发明涉及疫苗检测技术领域,具体涉及一种分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法。
背景技术:
2.乙型肝炎病毒(hepatitis b virus,hbv)是乙型肝炎的病原体,主要经输血、静脉注射药品、性行为和母婴垂直传播。在已知的引起病毒性肝炎的病原体中,由hbv所引起的乙型肝炎是一种流行久远、传播广泛、危害严重的传染性疾病。该病发病徐缓,部分患者可转为慢性,少数可导致肝硬化和肝癌。hbv在全世界均有流行,据统计目前全球有20多亿人感染过hbv,其中约有2.4亿慢性hbv感染者,其中,患有慢性乙型肝炎的人群罹患原发性肝细胞癌的相对危险性比普通人群至少增加300倍。因此,hbv防治已成为人民健康与传染病控制中的首要问题。
3.乙型肝炎尚无有效治疗手段,免疫接种是预防乙型肝炎最有效的手段,其分为主动免疫和被动免疫。前者即接种乙肝疫苗,刺激机体产生保护性抗体,这种免疫预防作用持久,适用于所有易感染人群;后者即注射乙肝免疫球蛋白(hbig),这种免疫主要用于接触后的紧急和暂时性预防,如母婴阻断。因此,注射乙肝疫苗对于提高人群对乙肝的整体免疫水平发挥了重要作用。
4.乙肝疫苗分为血源乙肝疫苗和重组乙肝疫苗。较血源乙肝疫苗相比,乙肝基因工程疫苗自获得生产文号投入大量生产以来,免疫接种后更安全可靠。基因工程乙肝疫苗在乙肝计划免疫中日益发挥着重要作用,成为控制乙肝流行的主要疫苗。因此,为确保乙肝疫苗的安全有效、质量可控,对乙肝疫苗的表征分析和质量控制提出了新的要求和挑战。
5.毛细管等电聚焦(cief)技术最早是根据平板等电聚焦电泳(ief)的原理建立。它是将带有两性基团的样品、载体两性电解质、缓冲剂和辅助添加剂的混合物注入毛细管内,当在毛细管两端加上直流电压时,载体两性电解质可以在管内形成一定范围的ph梯度,样品组分依据其所带电性向阴极或阳极泳动,柱内ph值与该组分的等电点(pi)相同时,溶质分子的净电荷为零,宏观上该组分将聚集在该点不再进一步迁移,达到使复杂样品中各组分分离的目的。但传统的cief技术使用单点检测器,即使所有样品在到达检测器前已经完成分离,也要等到所有聚焦区带都通过检测器后才能结束分离检测。从形成ph梯度到样品聚焦完成通常只需要5min,而聚焦区带依次通过检测器却需要10-40min。由于传统的cief技术使用单点紫外吸收和荧光检测器,不仅增加了额外的分析时间,并且移动过程会导致分离谱带展宽而影响分离度和分辨率,还可能导致蛋白质沉淀;进而使得cief技术重现性差。
6.全柱成像毛细管等电聚焦电泳(icief)技术是一项相对较新的技术,一直处于商业化状态。近年来,该技术已广泛应用于蛋白质药物和疫苗开发领域,逐渐成为制药行业测量治疗蛋白电荷异质性的重要工具。在icief中,整个毛细管内的等电聚焦(ief)过程由运
行在280nm的全柱检测系统在线监测。与传统的毛细管等电聚焦电泳(cief)相比,icief技术可以同时记录抗体样品的各种带电变异体,而不影响分离分辨率。此外,icief方法的分析时间快,通常在10分钟以下。
7.一般来说,基于毛细管电泳(ce)的方法已经越来越多地应用于各种不同类型的蛋白质的分析,然而对于大颗粒,如病毒样颗粒(vlp),则应用有限。icief技术在vlp和一般生物颗粒表征中的应用已被报道,但尚未发现其应用于表征乙肝表面抗原(hbsag)。
技术实现要素:
8.为解决上述技术问题,本发明的目的在于提供一种基于全柱成像毛细管等电聚焦电泳(icief)技术的乙肝疫苗的分析方法,该分析方法分析时间短,具有较好的稳定性和重现性,能够高效快速地检测分析乙肝疫苗相关产品。
9.为达到上述目的,本发明提供一种分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法,其包括如下步骤:
10.配制上样溶液:将乙肝表面抗原病毒样颗粒样品溶液、甲基纤维素溶液、两性电解质载体、等电点标记物、尿素和亚氨基二乙酸(ida)溶解于水中,得到上样溶液;其中,所述两性电解质载体为ph 3-10两性电解质载体;所述亚氨基二乙酸在上样溶液中的摩尔浓度为10-20mmol/l;
11.上机分析:采用全柱成像毛细管等电聚焦电泳测试仪对所述上样溶液进行等电聚焦,聚焦完成后得到等电聚焦图谱。
12.全柱成像毛细管等电聚焦电泳(icief)是一种将毛细管等电聚焦电泳与全柱成像技术相结合的新型电泳系统,它结合了毛细管电泳自动分离检测、可定量分析和成像技术的双重优势。icief可对整个毛细管柱进行实时扫描,克服了常规毛细管聚焦电泳技术谱带展宽变形的问题。icief在分析重组生物技术产品,尤其在高度糖基化等复杂样品电荷异质性分析的准确性、重复性和分辨率较平板胶等电聚焦(ief)和毛细管等点聚焦(cief)具有明显的优势,更有利于重组生物技术药物的质量控制和稳定性研究。
13.本发明选用ph 3-10两性电解质载体,使样品峰峰型呈正态分布,提高了本发明分析方法的准确度和稳定性。尽管乙肝表面抗原病毒样颗粒性质偏酸,等电点偏低,但选用ph更低的两性电解质载体(例如ph 2.5-5)使得峰型偏态分布,而且会使样品峰左移,靠近检测窗边缘,有可能会造成逃逸现象,影响准确度;此外,加入窄ph范围的两性电解质载体(例如ph 2.5-5)使得主峰吸光值降低。
14.本发明还在上样溶液中添加了亚氨基二乙酸(ida),乙肝表面抗原病毒样颗粒样品酸性趋势较强,等电点偏低,因此,本发明加入亚氨基二乙酸作为阳极占位剂,防止测试过程中样品峰逃逸,确保出峰;此外,加入亚氨基二乙酸并未影响样品峰的分离度。
15.本发明的分析方法,依据不同电荷变异体的等电点(pi)特征进行测定,分析结果不受干扰,提高了电荷异质性分析的准确性和重复性,通常能在几分钟内完成测定,所需时间大大缩短,可实现高通量检测。本发明的分析方法可以监测工艺优化过程中关键质量属性变化情况,可以对制剂进行筛选,监测疫苗产品的批次间差异。
16.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,所述两性电解质载体在上样溶液中的体积百分比为3-4vol%。
17.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,上样溶液中乙肝表面抗原病毒样颗粒的质量浓度为4-6μg/ml,更优选为5μg/ml。
18.在本发明的分析方法中,适宜的蛋白浓度会使分析结果具有较好的灵敏度,并获得低丰度电荷异质体的精确定量。如果蛋白浓度过高会导致毛细管中蛋白质聚集、析出,甚至吸附于毛细管,电泳图谱上出现尖峰信号,导致分析方法重复性变差。
19.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,所述尿素在上样溶液中的摩尔浓度为3-5mol/l,更优选为4mol/l。
20.在配制上样溶液时,本发明加入了适量尿素作为助溶剂,增加蛋白质(乙肝表面抗原病毒样颗粒)溶解度,能够改善电泳分离的选择性,抑制蛋白沉淀、管壁吸附,提高分离效率。
21.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,所述等电点标记物包括pi 4.05等电点标记物和pi 5.85等电点标记物。
22.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,所述pi 4.05等电点标记物和所述pi 5.85等电点标记物在上样溶液中的体积百分比分别为0.5-1vol%。
23.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,上样溶液中甲基纤维素的质量百分比为0.3-0.4wt%。甲基纤维素在本发明中起到表面活性剂的作用。
24.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,所述甲基纤维素溶液中甲基纤维素的质量百分比为1wt%。
25.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,等电聚焦条件包括:聚焦电压为3000v,聚焦时间为3-5min。
26.在本发明的分析方法中,聚焦时间也是icief实验过程中的重要参数之一,聚焦为动态过程,理论上蛋白质到达其等电点位置不再移动,谱图表现为峰形固定。本发明的分析方法中3-5min内即已完成异构体的聚焦分离,延长聚焦时间对等电点计算并没有显著影响。本发明的该分析方能够快速分析检测乙肝疫苗中乙肝表面抗原病毒样颗粒,单次进样分析时间短,并能够实时观察整个聚焦过程。
27.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,等电聚焦前还进行预聚焦,预聚焦电压为1500v,预聚焦时间为1min。
28.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,等电聚焦温度为8-10℃。
29.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,该方法还包括:在上机分析前,对配制的溶液10000r/min离心3min,取离心上清液作为所述上样溶液。
30.上述分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法中,优选地,具体包括如下步骤:
31.配制上样溶液:称取2.5μl乙肝表面抗原病毒样颗粒(hbsag vlp)样品溶液(浓度2-8μg/ml)、30-40μl的1wt%甲基纤维素(mc)溶液、0.5-1μl的pi 4.05等电点标记物、0.5-1μl的pi 5.85等电点标记物、3-4μl的ph 3-10两性电解质载体、尿素、亚氨基二乙酸(ida)、
去离子水配成终体积为100μl的混合液,其中,尿素浓度为2-6mol/l,亚氨基二乙酸浓度为5-20mmol/l;将混合液涡旋混匀,10000r/min离心3min,取上清液,得到上样溶液;
32.上机分析:将制得的上样溶液加入到96孔板中,放入全柱成像毛细管等电聚焦电泳(icief)测试仪,编辑相应程序,通过毛细管等电聚焦电泳仪施加高压电场,设置电泳参数:预聚焦:电压1500v,时间1min;聚焦:电压3000v,时间3-5min;在一定的聚焦时间内得到等电聚焦图谱。
33.本发明提供的技术方案,具有如下有益效果:
34.本发明的分析方法通过对乙肝表面抗原病毒样颗粒浓度、尿素浓度、以及两性电解质的实验研究,并添加亚氨基二乙酸,建立了一种良好、快速的乙肝疫苗测试分析方法。该方法每次进样分析时间短,所需样品量小,测得的乙肝表面抗原病毒样颗粒的pi值准确度高,并能够实时观察整个聚焦过程;此外,该方法对于制剂的选择、产品稳定性的检测、监测产品的批次间差异等起到至关重要的作用。
附图说明
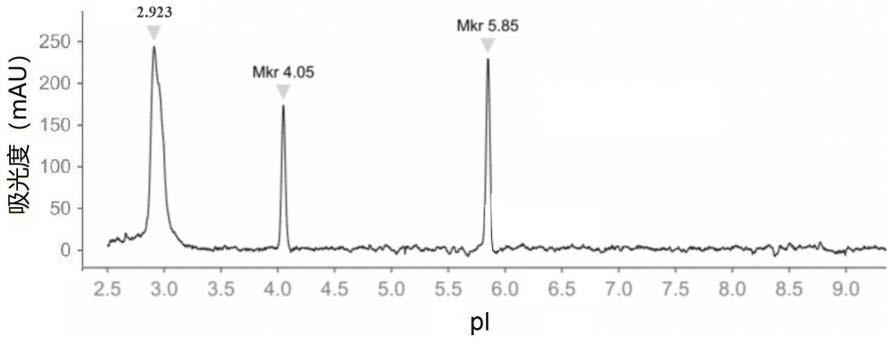
35.图1为实施例1得到的全柱成像毛细管等电聚焦电泳图谱;
36.图2为对比例1得到的全柱成像毛细管等电聚焦电泳图谱;
37.图3为对比例2得到的全柱成像毛细管等电聚焦电泳图谱;
38.图4为对比例3得到的全柱成像毛细管等电聚焦电泳图谱;
39.图5为对比例4得到的全柱成像毛细管等电聚焦电泳图谱;
40.图6为对比例5得到的全柱成像毛细管等电聚焦电泳图谱;
41.图7为对比例6得到的全柱成像毛细管等电聚焦电泳图谱;
42.图8为对比例7得到的全柱成像毛细管等电聚焦电泳图谱;
43.图9为验证例得到的全柱成像毛细管等电聚焦电泳图谱。
具体实施方式
44.为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。
45.本发明中缩略语和关键术语定义如下:
46.hbv:乙型肝炎病毒;
47.icief:全柱成像毛细管等电聚焦电泳;
48.cief:毛细管等电聚焦电泳;
49.vlp:病毒样颗粒;
50.hbsag:乙肝表面抗原;
51.mc:甲基纤维素;
52.pi marker:等电点标记物;
53.ida:亚氨基二乙酸。
54.本发明实施例中所使用的原料及试剂如下:
55.乙肝表面抗原病毒样颗粒样品溶液:提取自北京生物制品研究所有限责任公司生产的乙肝疫苗;
56.pi 4.05等电点标记物(marker pi 4.05):货号046-029供应商protein simple公司;
57.pi 5.85等电点标记物(marker pi 5.85):货号046-030供应商protein simple公司;
58.1%甲基纤维素:货号101876,供应商protein simple公司;
59.ph 3-10两性电解质载体(pharmalyte ph3-10):货号17045601,供应商ge公司;
60.ph 2.5-5两性电解质载体(pharmalyte ph2.5-5):货号17045101,供应商ge公司。
61.下面结合具体实施例和附图描述本发明。
62.实施例1
63.本实施例提供一种分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法,包括如下步骤:
64.配制上样溶液:将2.5μl乙肝表面抗原病毒样颗粒样品溶液、35μl的1wt%甲基纤维素溶液、1μl的pi 4.05等电点标记物、1μl的pi 5.85等电点标记物、4μl的ph 3-10两性电解质载体,40μl的尿素溶液,10μl的亚氨基二乙酸溶液和6.5μl超纯水配成终体积为100μl的混合液,涡旋混匀,10000r/min离心3min,取上清液,得到上样溶液;其中,得到的上样溶液中乙肝表面抗原病毒样颗粒的浓度为5μg/ml,尿素的浓度为4mol/l,亚氨基二乙酸的浓度为20mmol/l;
65.上机分析:将制得的上样溶液加入到96孔板中,放入全柱成像毛细管等电聚焦电泳(icief)测试仪,设置电泳参数:预聚焦:电压1500v,时间1min;聚焦:电压3000v,时间3min,温度10℃;进行等电聚焦,聚焦完成得到全柱成像毛细管等电聚焦电泳图谱,图谱如图1所示。
66.由图1可知,本实施例得到的等电聚焦电泳图谱中样品峰呈正态分布,底部无杂峰,峰型良好。此外,本发明通过优化上样溶液组分,有效的缩短了乙肝表面抗原病毒样颗粒样品的检测分析时间,3min即完成聚焦。
67.对比例1
68.本对比例提供一种分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法,该方法与实施例1相同,区别仅在于,上样溶液中的乙肝表面抗原病毒样颗粒浓度为2μg/ml。
69.本对比例测得的全柱成像毛细管等电聚焦电泳图谱如图2所示。
70.对比例2
71.本对比例提供一种分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法,该方法与实施例1相同,区别仅在于,上样溶液中的乙肝表面抗原病毒样颗粒浓度为10μg/ml。
72.本对比例测得的全柱成像毛细管等电聚焦电泳图谱如图3所示。
73.由图2和图3可知,上样溶液中,蛋白浓度(即乙肝表面抗原病毒样颗粒浓度)较低导致信号强度弱,蛋白浓度过高则会使蛋白聚集析出,从而导致重现性差。
74.对比例3
75.本对比例提供一种分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法,该方法与实施例1相同,区别仅在于,上样溶液中尿素的浓度为2mol/l。
76.本对比例测得的全柱成像毛细管等电聚焦电泳图谱如图4所示。
77.对比例4
78.本对比例提供一种分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法,该方法与实施例1相同,区别仅在于,上样溶液中尿素的浓度为6mol/l。
79.本对比例测得的全柱成像毛细管等电聚焦电泳图谱如图5所示。
80.由图4和图5可知,上样溶液中尿素浓度较低会使主峰出现劈叉现象,导致重现性差;尿素浓度过高会使得峰高降低。
81.对比例5
82.本对比例提供一种分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法,该方法与实施例1相同,区别仅在于,两性电解质载体为1μl的ph 3-10两性电解质载体和3μl的ph 2.5-5两性电解质载体。
83.本对比例测得的全柱成像毛细管等电聚焦电泳图谱如图6所示。
84.对比例6
85.本对比例提供一种分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法,该方法与实施例1相同,区别仅在于,两性电解质载体为2μl的ph 3-10两性电解质载体和2μl的ph 2.5-5两性电解质载体。
86.本对比例测得的全柱成像毛细管等电聚焦电泳图谱如图7所示。
87.由图6和图7可知,采用窄范围两性电解质载体(ph 2.5-5)得到的样品峰的峰型呈偏态分布,而且样品峰过于靠近检测窗边缘。
88.对比例7
89.本对比例提供一种分析乙肝表面抗原病毒样颗粒的全柱成像毛细管等电聚焦电泳的方法,该方法与实施例1相同,区别仅在于,上样溶液中不添加亚氨基二乙酸(ida)。
90.本对比例测得的全柱成像毛细管等电聚焦电泳图谱如图8所示,聚焦后未检测到样品峰。
91.验证例
92.采用实施例1方法重复测试三次,所得全柱成像毛细管等电聚焦电泳图如图9所示。图中样品峰峰形良好,各个出峰位置接近,由此可知,本发明的方法具有良好的准确度和重现性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1