光电化学适配体传感器及其制备方法和应用
1.本发明属于新型纳米功能材料与光电传感技术领域,涉及一种光电化学适配体传感器及其制备方法和应用,尤其涉及一种基于离子液体合成er-mof@aunps复合材料构建黄曲霉毒素b1光电化学适配体传感器的方法及应用的方法及应用。
背景技术:
2.真菌毒素是由丝状真菌在高温高湿环境下产生的次级代谢产物,农作物在种植、收获、加工、运输和储存过程中易受到真菌侵染,从而进入人体内造成严重的肾毒性、致癌性、致畸性等危害。真菌毒素的种类繁多,主要包括黄曲霉毒素、赭曲霉毒素、伏马菌素、玉米赤霉烯酮,其中黄曲霉毒素b1(afb1)被国际癌症研究机构归类为i组致癌物。
3.传统检测afb1的方法主要包括高性能液相色谱、酶联免疫分析法和液相色谱与质谱联用等。虽然这些方法具有高选择性,但它们需要昂贵的仪器、训练有素的专业人员和繁琐的程序。为了克服以上缺点,亟需设计一种简单快捷有效、灵敏度高和选择性高的光电化学适配体检测方法。
4.光电化学传感器通常是通过使用光作为激发源,光电流作为检测信号,其背景信号低、灵敏度高、成本低,因而被广泛用于dna生物传感、免疫传感、细胞分析等领域。虽然光电化学传感器的研究取得了长足发展,但仍面临以下诸多困境:(1)光电活性材料具有较大的能带间隙;(2)光电转换效率不高。因此,通过选择合适的光电活性材料和实现信号放大策略从而提高光电化学传感器的灵敏度是一种有效的解决方法。
技术实现要素:
5.为了改善现有的光电传感器检测真菌毒素技术存在的问题,本发明提供了一种基于er-mof@aunps复合材料构建的光电化学适配体传感器及其制备方法和应用,实现了对黄曲霉毒素b1的灵敏、特异、高效检测。
6.为实现上述发明目的,本发明采用如下技术方案:
7.本发明提供一种式i所示结构的化合物:
[0008][0009]
本发明还提供如式i所示结构的化合物的制备方法,包括将化合物2与碱一起反应,制备得到上述如式i所示结构的化合物;
[0010]
所述化合物2具有如下结构:
[0011][0012]
根据本发明的实施方案,所述化合物2与碱的摩尔比为1:(1~10),示例性为1:1、1:3、1:5、1:9、1:10。
[0013]
根据本发明的实施方案,所述碱可以选自koh、naoh。
[0014]
根据本发明的实施方案,所述制备方法可以在溶剂存在下进行。例如,所述的溶剂可以选自乙醇和水,优选为乙醇和水的混合溶剂。示例性地,乙醇和水的体积比为(1~5):1,示例性为1:1、2:1、4:1、5:1。
[0015]
根据本发明的实施方案,所述制备方法还包括待反应结束后,从反应后的混合物中分离得到固体产物的步骤。例如,将反应液倒入水中,抽滤、用水洗涤,收集滤饼,得到式i所示结构的化合物。
[0016]
优选地,所述式i化合物的合成路线如下:
[0017][0018]
根据本发明的实施方案,所述化合物2由如下方法制备得到,包括:将化合物1和4-溴甲基苯甲酸甲酯进行反应,得到所述化合物2;
[0019]
所述化合物1具有如下结构:
[0020][0021]
根据本发明的一个实施方式,上述反应可以在溶剂如有机溶剂的存在下进行。例如,所述的有机溶剂可以选自乙腈。
[0022]
根据本发明的实施方案,所述化合物1与4-溴甲基苯甲酸甲酯的摩尔比为1:(1~5),示例性为1:1、1:2、1:5。
[0023]
根据本发明的实施方案,所述制备方法还包括待反应结束后,从反应后的混合物中分离得到固体产物的步骤。例如,将反应液倒入无水乙醚中,抽滤、用无水乙醚洗涤,收集滤饼,得到化合物2。
[0024]
优选地,所述化合物2的合成路线如下:
[0025][0026]
根据本发明的实施方案,所述化合物1由如下方法制备得到,包括:将菲醌、4-(咪唑-1-基)苯甲醛、5-氨基间苯二甲酸甲酯与硫代吗啉反应,得到化合物1。
[0027]
优选地,所述菲醌、4-(咪唑-1-基)苯甲醛、5-氨基间苯二甲酸甲酯与硫代吗啉的反应摩尔比为1:1:(2~4),示例性为1:1:2、1:1:3、1:1:4。
[0028]
优选地,所述化合物1的制备方法可以在溶剂如有机溶剂的存在下进行。例如,所述的有机溶剂可以选自冰醋酸。
[0029]
优选地,所述化合物1的制备方法可以在催化剂的存在下进行。优选地,所述催化剂与菲醌的摩尔比为1:(10~50),示例性为1:10、1:20、1:50。
[0030]
例如,所述催化剂可以选自乙酸铵。
[0031]
优选地,所述制备方法还包括加入碱进行中和。例如,所述碱为氨水。
[0032]
优选地,所述制备方法还包括待反应结束后,从反应后的混合物中分离得到产物的步骤。例如,用二氯甲烷萃取,收集有机层液体。进一步地,所述制备方法还包括对所述产物进行纯化的步骤。例如,所述纯化可以采用柱层析色谱柱分离。优选地,所述柱层析色谱柱分离的洗脱液为二氯甲烷/甲醇=(40~60):1(v/v),示例性为40:1、50:1、60:1。
[0033]
优选地,所述化合物1的合成路线如下:
[0034][0035]
根据本发明的实施方案,所述如式i所示结构的化合物的制备方法,包括以下步骤:
[0036]
(1)在催化剂作用下,将菲醌、4-(咪唑-1-基)苯甲醛、5-氨基间苯二甲酸甲酯与硫代吗啉以乙酸铵为溶剂合成化合物1;所述化合物1的结构式如下:
[0037][0038]
(2)将化合物1和4-溴甲基苯甲酸甲酯以乙腈为溶剂合成化合物2;所述化合物2的结构式如下:
[0039][0040]
(3)由化合物2在碱作用下,以乙醇和水为溶剂合成式i化合物;
[0041]
式i化合物的反应路线如下:
[0042][0043]
本发明还提供如式i所示结构的化合物在制备光电化学适配体传感器中的应用。
[0044]
本发明还提供一种复合材料,所述复合材料包括er-mof和位于er-mof表面的金纳米粒子。
[0045]
根据本发明的实施方案,所述er-mof表面修饰有式i所示结构的化合物。优选地,所述er-mof为纳米球。例如,所述er-mof的粒径为80-120nm。
[0046]
根据本发明的实施方案,所述金纳米粒子为金纳米颗粒(aunps)。优选地,所述金纳米颗粒的粒径为5-20nm,示例性为15nm。
[0047]
本发明还提供上述复合材料的制备方法,包括将er-mof和金纳米粒子进行反应,制备得到所述复合材料。
[0048]
根据本发明的实施方案,所述反应在haucl4、nabh4的存在下进行。优选地,所述haucl4、nabh4均以溶液形式加入反应体系中。例如,先分别配制haucl4、nabh4的水溶液,再将er-mof与haucl4溶液进行反应,然后再与nabh4溶液进行反应,得到所述复合材料。
[0049]
根据本发明的实施方案,所述er-mof、haucl4、nabh4的反应比为1mg:(10-30)μmol:
(0.5-2)μmol,示例性为1mg:10μmol:0.5μmol、1mg:20μmol:1μmol、1mg:30μmol:2mmol。
[0050]
优选地,er-mof与haucl4溶液的反应在冰浴条件下进行;所述反应的时间为2~4h,示例性为2h、3h、4h。
[0051]
根据本发明的实施方案,所述制备方法还包括对反应体系进行固液分离得到反应产物的过程。例如,所述固液分离可以采用本领域已知手段,比如离心。
[0052]
根据本发明的实施方案,所述制备方法还包括对固液分离得到的反应产物进行洗涤。例如,所述洗涤的溶剂为水。又如,所述洗涤的次数可以为一次、两次或更多次,优选为三次。
[0053]
根据本发明的实施方案,所述er-mof的制备方法,包括将式i所示结构的化合物与er源、聚乙烯吡咯烷酮溶于乙醇和dmf的混合溶剂中进行反应,得到er-mof。
[0054]
优选地,式i所示结构的化合物与er源的摩尔比为1:(1~5),示例性为1:1、1:2、1:5。
[0055]
优选地,所述er源例如可以选自ercl3·
6h2o。
[0056]
优选地,式i所示结构的化合物与聚乙烯吡咯烷酮的质量比为1:(2~10),示例性为1:2、1:5、1:10。
[0057]
优选地,乙醇和dmf的混合溶剂中,乙醇和dmf的体积比为1:(1~5),示例性为1:1、1:3、1:5。
[0058]
优选地,所述反应的温度为160~200℃,示例性为160℃、180℃、200℃;所述反应的时间为24-72h,示例性为24h、48h、72h。
[0059]
优选地,所述制备方法还包括待反应结束后,从反应后的混合物中分离得到er-mof固体产物的步骤。例如,离心。又如,所述离心的转速可以为6000~12000rpm,示例性为6000rpm、8000rpm、10000rpm、12000rpm。
[0060]
优选地,所述制备方法还包括对分离得到的产物进行洗涤、干燥。例如,将分离得到的产物依次用乙醇和蒸馏水离心洗涤至上清液清澈。
[0061]
本发明还提供上述复合材料在制备光电化学适配体传感器中的应用。
[0062]
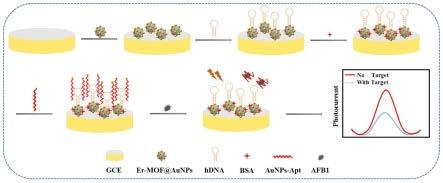
本发明还提供一种光电化学适配体传感器,其包括上述er-mof@aunps复合材料。
[0063]
根据本发明的实施方案,所述传感器还包括金纳米粒子修饰黄曲霉毒素b1适配体(aunps-apt)以及发卡型dna;er-mof@aunps复合材料与金纳米粒子修饰黄曲霉毒素b1适配体分别连接于发卡型dna的两端。
[0064]
根据本发明的实施方案,所述黄曲霉毒素b1适配体(apt)的序列为5'-gttgggcacgtgttgtctctctgtgtctcgtgcccttcgctaggcccaca-(ch2)
6-sh-3'。
[0065]
根据本发明的实施方案,所述发卡型dna的序列为sh-(ch2)
6-gcacatacgcatgctccctttacgctt tttttttacagagagacaacacgtggcgtatgtgc。
[0066]
根据本发明的实施方案,所述金纳米粒子修饰黄曲霉毒素b1适配体由金纳米粒子与黄曲霉毒素b1适配体在tcep还原剂作用下反应制备得到。
[0067]
优选地,黄曲霉毒素b1适配体与金纳米粒子的反应摩尔比为(1-10):1,示例性为1:1、5:1、8:1、10:1。
[0068]
优选地,黄曲霉毒素b1适配体与tcep的反应摩尔比为1:(50~200),示例性为1:50、1:100、1:200。
[0069]
优选地,金纳米粒子由haucl4经柠檬酸三钠还原制备得到。
[0070]
本发明还提供上述光电化学适配体传感器的制备方法,包括将er-mof@aunps复合材料与金纳米粒子修饰黄曲霉毒素b1适配体(aunps-apt)以及发卡型dna共价偶联,制备得到所述光电化学适配体传感器。
[0071]
本发明还提供上述光电化学适配体传感器在检测待测目标物黄曲霉毒素b1中的应用。
[0072]
本发明还提供上述光电化学适配体传感器检测黄曲霉毒素b1的方法,该方法包括将待测目标物黄曲霉毒素b1与所述光电化学适配体传感器混合。
[0073]
根据本发明的实施方案,所述方法还包括将含有待测目标物的待测试样品与所述光电化学适配体传感器混合后,测定光电化学适配体传感器的光电流强度,计算待测目标物的浓度。
[0074]
优选地,所述待测目标物的浓度通过代入待测目标物的浓度依赖型标准曲线计算得到。
[0075]
根据本发明的实施方案,所述方法还包括配制不同浓度的待测目标物溶液。
[0076]
根据本发明的实施方案,所述方法具体包括以下步骤:
[0077]
1)将er-mof@aunps复合材料修饰于电极上;
[0078]
2)将发卡型dna修饰于步骤1)得到的电极上;
[0079]
3)将金纳米粒子修饰的黄曲霉毒素b1适配体修饰于步骤2)得到的电极上;
[0080]
4)配制不同浓度的待测目标物黄曲霉毒素b1溶液;
[0081]
5)绘制待测目标物的浓度依赖型标准曲线;
[0082]
优选地,所述待测目标物的浓度依赖型标准曲线绘制的步骤如下:取将步骤3)制得的光电化学适配体传感器分别与步骤4)配制的已知浓度的待测目标物溶液混合,孵育,分别测定光电化学适配体传感器的光电流强度,以结合待测目标物黄曲霉毒素b1前后的光电流差值(δi=i-i0)为纵坐标,待测目标物溶液浓度的对数为横坐标,做出待测目标物的浓度依赖型标准曲线。
[0083]
6)检测待测目标物的浓度;
[0084]
将步骤3)制得的光电化学适配体传感器和未知浓度的待测目标物溶液混合,孵育,测定光电化学适配体传感器的光电流强度,代入步骤5)绘制的待测目标物的浓度依赖型标准曲线,得出待测目标物的浓度。
[0085]
根据本发明示例性的实施方案,所述黄曲霉毒素b1溶液的浓度大于0且小于等于20ng ml-1
,优选为0.005-20ng ml-1
。
[0086]
本发明还提供上述检测方法的用途,其用于黄曲霉毒素b1的检测;
[0087]
优选地,所述检测方法用于食品中黄曲霉毒素b1的检测。
[0088]
与现有技术相比,本发明的有益效果如下:
[0089]
(1)本发明采用er-mof@aunps作为光电活性材料,其优良的导电性能和较小的能带间隙能有效提高光电效率。通过au-s共价键固定发夹dna制备适配体捕获基底,发夹dna作为刚性二维结构具有良好的稳定性和抗干扰性,能有效减小传感器背景信号。金纳米修饰的适配体(aunps-apt)能够通过碱基互补配对与发夹dna实现特异性结合。利用金纳米粒子优异的导电性,大的比表面积等优点从而实现信号放大。本发明中的光电化学适配体传
感器,具有低成本、高灵敏度、高选择性等优点,可在可见光区域对真菌毒素实现快速、灵敏检测,有效克服了传统检测方法的不足。
[0090]
(2)本发明成功合成新型多羧基离子液体(pimbimbr离子液体),该离子液体与金属具有良好的配位能力。同时本发明首次提出将pimbimbr离子液体作为配体,并与金属er
3+
合成新型mof纳米材料。
[0091]
(3)本发明用er-mof@aunps作为光电材料,具有大的比表面积、良好的导电性能、更窄的能带带隙,能有效提高检测灵敏度。
[0092]
(4)本发明利用金纳米粒子修饰的黄曲霉毒素b1适配体,通过金纳米粒子的表面等离子共振效应和导电性能,实现信号放大,提高检测灵敏度。
[0093]
(5)本发明利用发夹dna作为适配体捕获基底,其刚性二维结构具有良好的稳定性和抗干扰性,能有效减小传感器背景信号。
[0094]
(6)本发明制备的传感器具有低成本、高灵敏度、高选择性等优点,可在可见光区域对黄曲霉毒素b1实现快速、灵敏检测,能有效克服传统检测方法的不足。
附图说明
[0095]
图1中(a)、(b)分别是本发明pimbimbr离子液体的核磁共振氢谱和傅里叶红外谱图。
[0096]
图2是本发明er-mof的场发射扫描电镜图。
[0097]
图3是本发明er-mof的紫外漫反射光谱图及能带带隙图。
[0098]
图4是本发明er-mof@aunps复合材料的透射电子显微镜图。
[0099]
图5是本发明er-mof@aunps复合材料的元素映射图。
[0100]
图6是本发明er-mof@aunps复合材料的x射线光电子能谱图。
[0101]
图7是本发明aunps的透射电子显微镜图。
[0102]
图8中(a)、(b)分别是本发明aunps和aunps-apt的紫外吸收光谱图。
[0103]
图9为本发明黄曲霉毒素b1的光电化学适配体传感器制备过程示意图。
[0104]
图10中(a)、(b)、(c)、(d)、(e)、(f)分别为本发明的光电化学适配体传感器制备过程中裸gce,er-mof@aunps/gce,hdna/er-mof@aunps/gce,bsa/hdna/er-mof@aunps/gce,aunps-apt/bsa/hdna/er-mof@aunps/gce,afb1/aunps-apt/bsa/hdna/er-mof@aunps/gce的交流阻抗图。
[0105]
图11中(a)、(b)、(c)、(d)、(e)、(f)分别为本发明的光电化学适配体传感器制备过程中裸gce,er-mof@aunps/gce,hdna/er-mof@aunps/gce,bsa/hdna/er-mof@aunps/gce,aunps-apt/bsa/hdna/er-mof@aunps/gce,afb1/aunps-apt/bsa/hdna/er-mof@aunps/gce的光电流-时间响应曲线。
[0106]
图12为本发明光电化学适配体传感器的光电流响应与抗坏血酸浓度的关系曲线图。
[0107]
图13为本发明光电化学适配体传感器的光电流响应与黄曲霉毒素b1孵育时间的关系曲线图。
[0108]
图14中(a)、(b)分别为本发明所制备的光电化学适配体传感器对于不同浓度黄曲霉毒素b1光电流响应情况图、传感器对黄曲霉毒素b1响应的线性关系曲线。
[0109]
图15为本发明制得的光电化学适配体传感器的抗干扰性能实验结果。
[0110]
图16中(a)、(b)分别为本发明制得的光电化学适配体传感器的储存稳定性和光电稳定性实验结果。
[0111]
图17为本发明制得的光电化学适配体传感器的重现性实验结果。
具体实施方式
[0112]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0113]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
[0114]
实施例1
[0115]
pimbimbr离子液体的制备方法,包括如下步骤:
[0116]
(1)将菲醌(1.041g,5mmol)、4-(咪唑-1-基)苯甲醛(0.861g,5mmol)、5-氨基间苯二甲酸甲酯(2.091,10mmol)、乙酸铵(0.0385g,0.5mmol)溶于150ml冰醋酸中,在氮气的保护下130℃反应3h。反应结束后,向其中加入氨水中和,然后用二氯甲烷萃取,收集有机层液体,进行柱层析分离纯化(洗脱剂:二氯甲烷:甲醇=50:1,v/v)。
[0117]
(2)将步骤(1)制得的产物(600mg,1.1mmol),4-溴甲基苯甲酸甲酯(506.8mg,2.2mmol)置于50ml单口烧瓶中,加入50ml乙腈溶解,85℃条件下加热回流48h。反应结束后,往反应液中加入无水乙醚,立即产生沉淀并进行抽滤,并用无水乙醚洗涤3次,收集滤饼。
[0118]
(3)将步骤(2)所得产物(570mg,0.58mmol)置于50ml单口烧瓶中,加入氢氧化钾(292.3mg,5.22mmol),加入20ml乙醇和蒸馏水(v:v=4:1)作为溶剂,80℃反应4h。反应结束后,将溶剂悬干,并加入40ml蒸馏水溶解,用浓盐酸调节ph为1~2,立即产生沉淀,用蒸馏水进行抽滤洗涤3次,然后收集滤饼进行真空干燥,即得到目标产物pimbimbr离子液体。
[0119]
图1中(a)为本实施例制得的pimbimbr离子液体的核磁共振氢谱图,1hnmr(600mhz,dmso-d6)δ:13.44(s,3h,cooh),8.97
–
8.91(m,2h),8.91
–
8.85(m,2h),8.73(q,j=1.6hz,1h),8.68(dd,j=7.9,1.4hz,1h),8.35(d,j=1.6hz,2h),7.78(ddd,j=8.0,6.9,1.1hz,2h),7.68(ddd,j=8.4,7.0,1.5hz,2h),7.54(ddd,j=8.3,7.0,1.3hz,2h),7.43
–
7.30(m,3h),7.24
–
7.14(m,3h),7.00(dd,j=8.4,1.2hz,2h),6.51
–
6.46(m,2h).通过图谱化学位移值以及分子中氢原子的种类和含量,从而证实本发明成功合成了pimbimbr离子液体。
[0120]
图1中(b)为本实施例制得的pimbimbr离子液体的傅里叶红外光谱图,其中3430cm-1
为水分子中o-h的振动峰,在1708cm-1
处的振动峰归属于-cooh官能团的特征峰,1605cm-1
和1500cm-1
处的两条谱带是苯环上骨架伸缩振动峰,1452cm-1
和1239cm-1
处的峰是咪唑环中c=c和c=n的骨架伸缩振动峰,758cm-1
和722cm-1
归属于咪唑环中=c-n-ch=和-ch=ch-n的面内弯曲振动。通过红外光谱图证明了本发明已成功制备出pimbimbr离子液体。
[0121]
实施例2
[0122]
er-mof的制备方法,包括如下步骤:
[0123]
将实施例1制得的pimbimbr离子液体(40mg,0.04mmol)和ercl3·
6h2o(30.5mg,0.08mmol)、聚乙烯吡咯烷酮(200mg)加入25ml聚四氟乙烯内衬不锈钢容器中,并加入12ml乙醇和dmf溶液(v:v=1:3),进行搅拌溶解后置于烘箱中加热至180℃反应24h。在12000rpm转速下,依次用无水乙醇和蒸馏水离心洗涤至上清液清澈。在60℃真空干燥下得到er-mof固体。
[0124]
图2为本实施例制得的er-mof纳米球的扫描电子显微镜表征图,从图中结果可以看出,制得的er-mof为直径80-120nm左右的球形。
[0125]
图3是本实施例制得的er-mof纳米球的紫外漫反射光谱图及能带带隙图,从图中可以看出,该材料在可见光区域具有良好的吸收和较窄的能带带隙(1.59ev),由此证明该材料具有良好的光电转换性能,有助于提高传感器的光电转换效率。
[0126]
实施例3
[0127]
er-mof@aunps复合材料的制备方法,包括如下步骤:
[0128]
称取实施例2制得的20mg er-mof于25ml茄形瓶中,并抽真空30min。在负压的条件下,向其注入20ml 20mm haucl4溶液,将其超声分散均匀。于冰浴条件下搅拌3h,进行离心收集固体,再将固体分散在10ml超纯水中,在剧烈搅拌下加入2ml 0.01m nabh4溶液,反应30s,溶液颜色变为黑色,停止反应。用超纯水离心洗涤3次,收集黑色固体得到er-mof@aunps复合材料。
[0129]
图4是本实施例制得的er-mof@aunps复合材料的透射电子显微镜图;从图中可以看出,在er-mof纳米球表面均匀分布了大量金纳米颗粒,其中金纳米颗粒的大小约为15nm。
[0130]
图5是本实施例制得的er-mof@aunps复合材料的元素映射图;通过元素映射图像,证实了整个er-mof@aunps纳米复合材料中au、er、c、n和o元素的均匀分布,由此表明在er-mof表面成功合成了aunps。
[0131]
图6是本实施例制得的er-mof@aunps复合材料的x射线光电子能谱图;通过xps分析了au-nps@er-mof纳米复合材料的表面化学状态和组成。图中84.8ev(au 4f
7/2
)和88.0ev(au 4f
5/2
)的峰归因于金纳米颗粒。在284.8ev、400ev和532ev处的峰值对应于c1s、n1s和o1s的能级。
[0132]
实施例4
[0133]
金纳米粒子的制备方法,包括如下步骤:
[0134]
将2ml质量分数为1%的haucl4溶液和48ml超纯水加入100ml圆底烧瓶中,快速搅拌下加热至100℃。加入5ml 38.8mm柠檬酸三钠溶液,待溶液变为酒红色,继续搅拌10min。停止反应,冷却至室温。
[0135]
图7是本实施例制得的aunps的透射电子显微镜图;从图中可以看出,本实施例制备的aunps呈球形,粒径均匀且粒径大小约为15nm左右。
[0136]
实施例5
[0137]
金纳米粒子修饰黄曲霉毒素b1适配体的制备过程如下:
[0138]
将10μl afb1适配体溶液(100μm)与2μl tcep还原剂(50mm)混合,室温下摇床反应2h,以打开afb1适配体中的二硫键。将活化后的afb1适配体溶液(10μl)加入实施例4制得的2ml 0.1μm aunps溶液,4℃下孵育12h后,以120μl/h的速度添加氯化钠溶液(1m),最终使氯化钠的浓度达到0.5m。静置孵育12h,得到aunps修饰的afb1适配体(aunps-apt),通过离心
分离,超纯水洗涤后,分散于tris-hcl(10mm,ph=7.4)缓冲溶液中,4℃下保存备用。
[0139]
图8中(a)、(b)分别是aunps和aunps-apt的紫外吸收光谱图;通过紫外-可见特征吸收表征,aunps的吸收峰位于520nm处。通过au-s键将afb1适配体固定在aunps上,得到aunps修饰的afb1适配体(aunps-apt),经紫外-可见光谱证实,afb1适配体被aunps标记后,aunps-apt的紫外可见吸收峰红移到525nm,且在257nm处出现了适配体的吸收峰,证明了该适配体已被aunps成功修饰。
[0140]
实施例6
[0141]
如图9所示,基于er-mof@aunps构建光电化学适配体传感器检测黄曲霉毒素b1的方法,包括如下步骤:
[0142]
(1)将直径3mm的玻碳电极用氧化铝进行抛光处理,分别用稀硝酸、无水乙醇、超纯水超声清洗干净(裸gce);
[0143]
(2)将电极吹干后,在其表面滴加6μl浓度为8mg ml-1
的er-mof@aunps复合材料,于37
°
烘箱烘干(er-mof@aunps/gce);
[0144]
(3)滴加6μl浓度为4μm的发卡型dna,并在4℃下孵育30min(hdna/er-mof@aunps/gce),随后用1%的牛血清蛋白(bsa)溶液,以封闭电极表面非特异性结合位点,并用ph为7.4的pbs缓冲溶液冲洗电极,4℃冰箱中晾干(bsa/hdna/er-mof@aunps/gce);
[0145]
(4)继续滴加6μl浓度为0.5μm的金纳米粒子修饰的黄曲霉毒素b1适配体溶液(aunps-apt),用ph为7.4的pbs缓冲溶液洗去未固定的适配体,得aunps-apt/bsa/hdna/er-mof@aunps/gce修饰电极,即成功制得光电化学适配体传感器,可用于黄曲霉毒素b1的检测;
[0146]
(3)将aunps-apt/bsa/hdna/er-mof@aunps/gce修饰电极分别置于不同浓度的黄曲霉毒素b1标准溶液中,其浓度分别为:0.005ng ml-1
,0.01ng ml-1
,0.05ng ml-1
,0.1ng ml-1
,0.5ng ml-1
,1ng ml-1
,5ng ml-1
,10ng ml-1
,20ng ml-1
,4℃孵育30min,然后用0.01m ph为7.4的pbs缓冲溶液洗净,得afb1/aunps-apt/bsa/hdna/er-mof@aunps/gce修饰电极,即结合了黄曲霉毒素b1的光电化学适配体传感器。
[0147]
(6)进行光电化学测试:以5w的白光灯为激发光源,采用三电极体系测进行试:以步骤(4)制得的光电化学适配体传感器为工作电极,hg/hg2cl2电极(饱和kcl)作为参比电极,铂丝电极作为对电极,光电流由chi660e电化学工作站(上海辰华仪器公司)测定。在含有0.05m抗坏血酸的0.1m pb缓冲溶液(ph=7.0)中进行测试,采用i-t测试手段,根据所得的光电流值与黄曲霉毒素b1标准溶液浓度之间的关系,绘制工作曲线。
[0148]
图10中(a)、(b)、(c)、(d)、(e)、(f)分别为本实施例6中为不同复合材料修饰电极所测得的阻抗图。从图中可以看出,在裸电极(gce)上经过er-mof@aunps修饰后,阻抗值略有增加(图中b)。进一步通过au-s键将hdna修饰至电极上(图中c),bsa阻断非特异性结合位点后(图中d),阻抗值连续增加。当引入aunps-apt后,电子转移阻断现象更加明显,因此阻抗值略微增加(图中e)。当识别黄曲霉毒素b1后,aunps-apt从电极表面释放出来,空间位阻减小,其阻抗值降低(图中f)。以上结果表明,本发明成功制备出检测黄曲霉毒素b1的光电化学适配体传感器。
[0149]
图11中(a)、(b)、(c)、(d)、(e)、(f)分别为本实施例6中不同复合材料修饰电极所测得的光电流-时间响应图,当在电极表面修饰au-nps@er-mof纳米复合材料后,光电流显
著提高(图中b)。随着hdna的固定(图中c)和bsa特异性阻断残留位点(图中d),光电流依次减小。随着aunps-apt引入电极,由于aunps具有良好的电导率和表面等离子体共振效应,光电流增加(图中e)。当传感器与afb1识别后,导致aunps-apt从电极表面释放,光电流降低(图中f)。由此表明本发明成功制备了检测黄曲霉毒素b1的光电化学适配体传感器。
[0150]
图12为本发明实施例6步骤(2)中er-mof@aunps/gce修饰电极光电流响应与抗坏血酸浓度的关系曲线图;从图中可知,随着抗坏血酸浓度从0增加到0.05m,er-mof@aunps/gce修饰电极的光电流逐渐增加。由于抗坏血酸作为电子供体,适当增加抗坏血酸的浓度会增加捕获空穴的可能性。当抗坏血酸浓度为0.05m时,er-mof@aunps/gce修饰电极的光电流达到最大值。但浓度从0.05m增加到0.25m后,浓度过高的抗坏血酸会阻碍电子转移,从而对光电流响应产生负面影响。因此,本发明选择0.05m作为抗坏血酸的最佳浓度。
[0151]
图13为本发明实施例6步骤(4)中黄曲霉毒素b1的孵育时间与光电流响应的关系图。从图中结果可以看出,随着孵育时间的增加,aunps-apt/bsa/hdna/er-mof@aunps/gce修饰电极识别黄曲霉毒素b1前后的光电流差值逐渐增大,并在30min时光电流差值达到最大。因此黄曲霉毒素b1的最佳孵育时间为30min。
[0152]
实施例7
[0153]
本发明采用光电流-时间法考察了实施例6中的光电化学适配体传感器对于不同浓度黄曲霉毒素b1的光电流响应情况。图14中(a)、(b)分别为实施例6所制备的光电化学适配体传感器对于不同浓黄曲霉毒素b1的光电流响应情况图、传感器黄曲霉毒素b1响应的线性关系曲线。从图中可以看出,当黄曲霉毒素b1浓度在0.005ng ml-1
~10ng ml-1
范围内,随着黄曲霉毒素b1浓度的增加,aunps-apt和黄曲霉毒素b1进行特异性识别,导致aunps-apt从传感器表面脱离。因此结合黄曲霉毒素b1前后的光电流差值(δi=i-i0)逐渐增大,δi与黄曲霉毒素b1浓度的对数[lg c
afb1
(ng ml-1
)]呈良好的线性关系,线性方程为:δi=52.44lg c
afb1
(ng ml-1
)+138.27(r2=0.995),检出限为19.59fg ml-1
(s/n=3)。由此表明本发明所制备的传感器对黄曲霉毒素b1具有较宽的检测范围和更低的检出限,可用于黄曲霉毒素b1的特异性、高灵敏检测。
[0154]
实施例8
[0155]
选择性是衡量光电化学传感器的实用性的重要指标之一。本发明通过选用常见干扰物赭曲霉毒素(ota)、玉米赤霉烯酮(zen)、脱氧雪腐镰刀菌烯醇(don)进行干扰实验来评估传感器的选择性。用实施例6步骤(4)所制备的aunps-apt/bsa/hdna/er-mof@aunps/gce修饰电极对100ng ml-1
ota、zen、don分别进行独立测试,结果如图15所示,从图中结果可知,aunps-apt/bsa/hdna/er-mof@aunps/gce修饰电极对所有干扰物的光电流响应均较弱,几乎与空白组相同。而将10ng ml-1
的afb1分别与100ng ml-1
ota、zen、don混合,并将传感器(实施例6步骤(4)所制备的aunps-apt/bsa/hdna/er-mof@aunps/gce修饰电极)在不同混合物中孵育30min后进行光电检测。与孵育单一的afb1的光电流响应相比,孵育afb1和干扰物的混合物后光电流无明显变化,由此表明该传感器对afb1具有良好的选择性。
[0156]
为了考察该传感器的储存稳定性,将6支实施例6步骤(4)所制备的aunps-apt/bsa/hdna/er-mof@aunps/gce修饰电极在4℃下储存一周,用于检测10ng ml-1
的afb1。如图16中(a)所示,该传感器保留了94%以上的初始光电流响应,由此表明该传感器具有良好的稳定性。
[0157]
为了评价传感器的光电稳定性,将afb1/aunps-apt/bsa/hdna/er-mof@aunps/gce在白光下连续激发15次,结果如图16中(b)所示。从图中可以看出,光电流没有显著变化,由此表明本发明制备的传感器具有良好的光电稳定性。
[0158]
为了评估该传感器的重现性,独立制备6支aunps-apt/bsa/hdna/er-mof@aunps/gce电极,分别在10ng ml-1
的afb1溶液中孵育30min后进行光电流测试,结果如图17所示,测试结果(511na,545na,537na,513na,492na,500na)的相对标准偏差(rsd)为4.01%。由此表明本发明传感器重现性良好。
[0159]
实施例9
[0160]
为了考察本发明所制备的光电化学适配体传感器用于真实样本分析的准确性。将处理后含有0.1ng ml-1
,0.5ng ml-1
和1.0ng ml-1
的afb1的三个真实玉米样品进行测定。结果如表1所示,不同浓度afb1测定的回收率分别为101%,105.4%,96.7%,平行测定结果的rsd均小于3%。由此证明本发明所制备的传感器具有良好的准确性,可用于实际样品中黄曲霉毒素b1的准确分析。
[0161]
表1玉米样品中afb1的回收率实验
[0162][0163]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1