鸡内金特异性多肽在鉴定鸡内金中的应用的制作方法
鸡内金特异性多肽在鉴定鸡内金中的应用
1.本技术是申请号为202010715915.6、申请日为2020年07月23日、发明名称为“鸡内金特异性多肽及其在鉴定鸡内金中的应用”的分案申请。
技术领域
2.本发明涉及分析化学领域,具体而言,涉及一种鸡内金特异性多肽及其在鉴定鸡内金中的应用。
背景技术:
3.鸡内金为雉科动物家鸡gallus gallus domesticus的干燥沙囊内壁。杀鸡后,取出鸡肫,立即剥下内壁,洗净,干燥。鸡内金原名又叫鸡肶胵里黄皮、鸡肶胵、鸡肫内黄皮、鸡黄皮、鸡食皮、鸡合子、鸡中金、化石胆、化骨胆等,其始载本草《神农本草经》曰:“鸡眦胵里黄皮,主泄利。”4.鸡内金性味甘,平。归脾、胃、小肠、膀胱经。有健胃消食,涩精止遗,通淋化石的功效。常用于食积不消,呕吐泻痢,小儿疳积,遗尿,遗精,石淋涩痛,胆胀胁痛。现代的临床研究还表明,鸡内金能很好地改善消渴及其并发症的临床症状。
5.然而鸡内金的质量标准研究并不完善,在2015年版《中国药典》一部鸡内金的标准中,只对其性状、水分、总灰分以及浸出物进行了控制,未有鉴别项方法。由于鸡内金的干燥品较脆,容易碎,外观上与鸭内金、鹅内金、鸽内金等禽类内金比较难以区分。而对于经过水煎煮后的煎液或者制成配方颗粒后,失去了饮片原有的性状,以现有的控制手段就更难区分了。
6.申请人搜索了鸡内金与其他禽类鉴别方法的文献报告,传统技术主要还是从性状进行区分,如邹烘来等《鸡内金与鸭内金、鹅内金的鉴别》以及刘小专的《怎样鉴别鸡内金与鸭内金》。陈振德等使用蛋白多肽高效毛细管电泳法鉴别鸡内金与鸭内金,通过鸡内金与鸭内金的hpce图谱存在的差异以表明两者之间有差异;吕武清等则通过淀粉酶、蛋白酶的活力,氨基酸和微量元素含量差异,表明鸡、鸭、鹅内金之间的差异。然而,上述方法较为复杂,且对于鸡内金的水煎液,上述文献的鉴别方法对区分鸡内金与鸭内金、鹅内金、鸽内金均不适用或者不具有专属性。
技术实现要素:
7.本发明的目的是提供一种鸡内金特异性多肽及其在鉴定鸡内金中的应用,该多肽特异性好,能够与鹅内金、鸭内金以及鸽内金进行区分。
8.本发明涉及一种鸡内金特异性多肽,其选自seq id no:1~4所示多肽中的一种或多种。
9.根据本发明的再一方面,本发明还涉及如上所述的鸡内金特异性多肽在鉴定鸡内金中的应用。
10.与现有技术相比,本发明的有益效果为:
11.本发明通过使用高分辨液质联用技术,结合蛋白组学理论,筛选出鸡内金的特征多肽,使用上述特征多肽可以快速准确地对鸡内金样品(例如鸡内金标准汤剂)中鸡内金成分进行鉴别,并能快速鉴别出鸡内金标准汤剂中是否掺有鸭内金、鹅内金和鸽内金等禽类内金。此方法具有很强的专属性,能为为鸡内金样品质量评价研究提供科学的实验依据,从而在质量上实现鸡内金样品的专属性鉴别,能够弥补标准汤剂由于不具饮片外观性状而造成鉴别不准确的缺陷,降低混伪品给中药市场带来的不良影响,确保公众用到优质、正品鸡内金制剂产品。同时也为鸡内金药材饮片质量标准的提升提供了一种新的手段。
附图说明
12.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
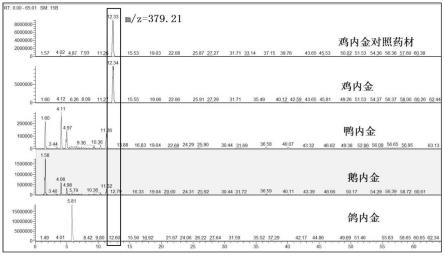
13.图1为本发明一个实施例中提取m/z=379.21下鸡内金、鸭内金、鹅内金和鸽内金的质谱图;
14.图2为本发明一个实施例中提取m/z=785.41下鸡内金、鸭内金、鹅内金和鸽内金的质谱图;
15.图3为本发明一个实施例中提取m/z=487.24下鸡内金、鸭内金、鹅内金和鸽内金的质谱图;
16.图4为本发明一个实施例中提取m/z=607.98下鸡内金、鸭内金、鹅内金和鸽内金的质谱图;
17.图5为本发明一个实施例中提取m/z=683.32下鸡内金、鸭内金、鹅内金和鸽内金的质谱图;
18.图6为本发明一个实施例中提取m/z=362.72下鸡内金、鸭内金、鹅内金和鸽内金的质谱图;
19.图7为本发明一个实施例中提取m/z=426.70下鸡内金、鸭内金、鹅内金和鸽内金的质谱图;
20.图8为本发明一个实施例中提取m/z=400.22下鸡内金、鸭内金、鹅内金和鸽内金的质谱图;
21.图9为本发明一个实施例中提取m/z=415.74下鸡内金、鸭内金、鹅内金和鸽内金的质谱图;
22.图10为本发明一个实施例中提取m/z=421.76下鸡内金、鸭内金、鹅内金和鸽内金的质谱图;
23.图11为本发明一个实施例中鸡内金多肽m/z=379.21与人工合成多肽的二级离子对比质谱图;
24.图12为本发明一个实施例中鸡内金多肽m/z=785.41与人工合成多肽的二级离子对比质谱图;
25.图13为本发明一个实施例中鸡内金多肽m/z=487.24与人工合成多肽的二级离子对比质谱图;
26.图14为本发明一个实施例中鸡内金多肽m/z=607.98与人工合成多肽的二级离子对比质谱图;
27.图15为本发明一个实施例中鸭鹅内金多肽m/z=683.32与人工合成多肽的二级离子对比质谱图;
28.图16为本发明一个实施例中鸭鹅内金多肽m/z=362.72与人工合成多肽的二级离子对比质谱图;
29.图17为本发明一个实施例中鸭鹅内金多肽m/z=426.70与人工合成多肽的二级离子对比质谱图;
30.图18为本发明一个实施例中鸽内金多肽m/z=400.22与人工合成多肽的二级离子对比质谱图;
31.图19为本发明一个实施例中鸽内金多肽m/z=415.74与人工合成多肽的二级离子对比质谱图;
32.图20为本发明一个实施例中鸽内金多肽m/z=421.76与人工合成多肽的二级离子对比质谱图;
33.图21为本发明一个实施例中混合鸡内金饮片鸡内金成分检出质谱图;
34.图22为本发明一个实施例中混合鸡内金标准汤剂鸡内金成分检出质谱图;
35.图23为本发明一个实施例中混合鸡内金饮片(5%比例)鸭内金、鹅内金成分检出质谱图;
36.图24为本发明一个实施例中混合鸡内金饮片(5%比例)鸽内金成分检出质谱图;
37.图25为本发明一个实施例中混合鸡内金标准汤剂(5%比例)鸭内金、鹅内金成分检出质谱图;
38.图26为本发明一个实施例中混合鸡内金标准汤剂(5%比例)鸽内金成分检出质谱图。
具体实施方式
39.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
40.因此,旨在本发明覆盖落入所附权利要求的范围及其等同范围中的此类修改和变化。本发明的其它对象、特征和方面公开于以下详细描述中或从中是显而易见的。本领域普通技术人员应理解本讨论仅是示例性实施方式的描述,而非意在限制本发明更广阔的方面。
41.本发明涉及一种鸡内金特异性多肽,其选自seq id no:1~4所示的多肽中的一种或多种。
42.根据本发明的再一方面,本发明还涉及如上所述的鸡内金特异性多肽在鉴定鸡内金中的应用。
43.在一些实施方式中,所述应用用于区分鸡内金与其他禽类内金,其中所述其他禽类内金选自鹅内金、鸭内金以及鸽内金中的一种或多种。
44.在一些实施方式中,所述应用用于鉴定鸡内金中是否掺杂其他禽类内金,其中所述其他禽类内金选自鹅内金、鸭内金以及鸽内金中的一种或多种;
45.其中,根据seq id no:5~7所示的多肽中的至少一种存在与否确定待检测物中是否存在鹅内金和/或鸭内金;
46.根据seq id no:8~10所示的多肽中的至少一种的存在与否确定待检测物中是否存在鸽内金。
47.特异性多肽的鉴定方式可选择本领域技术人员熟知的方式,例如通过能够与所述特异性多肽进行特异性结合的抗体及抗体片段、凝集素或适配体等。特异性的结合意味着结合剂对其相应的靶分子(特异性多肽)可以具有至少107l/mol的亲和力、或108l/mol、或更优选109l/mol的亲和力。也可通过生物质谱法等进行。鉴于在本发明中所鉴定的对象中通常成分复杂,因而优选的鉴定方法是基于色谱质谱联用的方法。
48.在一些实施方式中,所述应用基于色谱质谱联用的方法对待检测物进行鉴定,鸡内金特异性多肽在电喷雾离子化(esi)正离子模式下多反应监控(mrm)的母离子和子离子m/z如下所示:
[0049][0050]
在一些实施方式中,鹅内金、鸭内金以及鸽内金特异性多肽在电喷雾离子化(esi)正离子模式下多反应监控(mrm)的母离子和子离子m/z如下所示:
[0051][0052][0053]
在一些实施方式中,在进行色谱测定待检测物时,以流动相a和流动相b进行梯度洗脱;
[0054]
所述流动相a为乙腈;
[0055]
所述流动相b为0.07v/v%~0.13v/v%的甲酸水溶液。
[0056]
在一些实施方式中,所述梯度洗脱的条件为:
[0057][0058]
在一些实施方式中,所述梯度洗脱的流速为0.3~0.5ml/min,还可以选择0.4ml/min。
[0059]
在一些实施方式中,所述色谱所用色谱柱的固定相的主要官能团为c18官能团。
[0060]
在一些实施方式中,所述色谱柱为waters acquity uplc beh c18色谱柱。
[0061]
在一些实施方式中,所述色谱柱规格长度为100~200mm,内径为1.0~3.0mm,填料粒径为1.4~2.0μm。
[0062]
在一些实施方式中,所述色谱柱规格长度为150mm,内径为2.1mm,填料粒径为1.7μm。
[0063]
在一些实施方式中,所述色谱柱的柱温为25℃~35℃,也可以选择26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃或34℃。
[0064]
在一些实施方式中,所述待检测物经过0.20~0.24μm微孔滤膜滤过,优选为0.22μm微孔滤膜。
[0065]
在一些实施方式中,质谱条件为:
[0066]
电喷雾正离子模式,鞘气流速:30l/min;辅助气流速:10l/min;喷雾电压:3.30kv;毛细管温度:320℃;辅助气温度:320℃;
[0067]
其中上述条件涉及的各个数值参数的浮动范围为该数值参数
±
10%。
[0068]
在一些实施方式中,所述待检测物为鸡内金汤剂或饮片。
[0069]
饮片可以为原形药材饮片以及经过切制和/或炮炙的饮片。炮制的方法包括但不限于蒸、煮、炒、焙、炙、炮、煅、浸、飞等。
[0070]
鸡内金汤剂可以由鸡内金原形药材或饮片经过煎煮得到的;通常还包括去渣取汁,例如用320~380目筛网过滤。
[0071]
在一些实施方式中,当所述待检测物为饮片时,所述待检测物经过胰蛋白酶酶解处理。进一步地,酶解时间为8~16小时,也可选择12小时。
[0072]
在一些实施方式中,当所述待检测物为饮片时,所述待检测物经过研磨和/或超声处理;进一步地,超声的功率200~300w,频率40~60khz,超声时间为20~40分钟。
[0073]
待检测物经过预处理后能够有效去除杂质,释放出特异性多肽,从而增加检测的特异性和灵敏度。
[0074]
下面将结合实施例对本发明的实施方案进行详细描述。
[0075]
实施例1特异性多肽的筛选和人工合成验证
[0076]
1供试品溶液的制备
[0077]
取样品适量,研细,取约0.1g,加1%碳酸氢铵溶液50ml,超声处理(功率250w,频率50khz)30分钟,用0.22μm微孔滤膜滤过,精密移取100μl置微量进样瓶中,分别加胰蛋白酶
溶液10μl(取序列分析用胰蛋白酶,加1%碳酸氢铵溶液制成每1ml中含1mg的溶液,临用时配制),摇匀,37℃恒温酶解12小时,即得。
[0078]
2对照药材溶液的制备
[0079]
称取鸡内金对照药材粉末0.5g,加1%碳酸氢铵溶液50ml,加热回流30分钟,摇匀,用0.22μm微孔滤膜滤过,取续滤液100μl,置微量进样瓶中,加胰蛋白酶溶液(取胰蛋白酶,加1%碳酸氢铵溶液溶解,制成每1ml中含1mg的溶液,临用前现配制)10μl,摇匀,37℃恒温酶解12h,即得。
[0080]
3色谱条件
[0081]
waters acquity uplc beh c18色谱柱(150mm
×
2.1mm,1.7μm);流动相为乙腈-0.1%甲酸水溶液梯度洗脱;柱温为30℃,流速为0.3ml/min,进样2μl。
[0082]
梯度洗脱表
[0083][0084]
4质谱条件
[0085]
电喷雾正离子模式(hesi+),鞘气流速:30l/min;辅助气流速:10l/min;喷雾电压:3.30kv;毛细管温度:320℃;辅助气温度:320℃;进行full-ms-ddms2模式扫描。
[0086]
5测定
[0087]
分别精密吸取对照药材溶液与鸡内金、鸭内金、鹅内金、鸽内金供试品溶液各2μl,注入液相色谱仪,按上述条件测定并采集质谱图。
[0088]
6数据处理
[0089]
将所采集的质谱数据导入proteome discoverer 2.4分析软件,采用uniprot-aves数据库进行搜库,分别匹配出鸡内金、鸭内金、鹅内金、鸽内金所特有的特征肽段,各内金中的专属性多肽序列和相应质荷比,具体信息如下:
[0090]
[0091]
并通过质谱图的对比以进一步确定所选定质荷比的物种专属性,从图1至图4显示鸡内金的4个特征多肽只在鸡内金中存在,而在鹅内金、鸭内金和鸽内金中均不存在;从图5至图7显示鹅内金和鸭内金的3个特征多肽相同,并且在鸡内金和鸽内金中均不存在;从图8至图10显示鸽内金的3个特征多肽只存在于鸽内金中,在鸡内金、鸭内金和鹅内金中均不存在。
[0092]
7所选肽段的序列人工合成验证
[0093]
将上述筛选的序列委托吉尔生化(上海)有限公司进行人工合成,然后使用与样品相同的色谱和质谱条件进行测定,通过对比合成肽段与样品筛选肽段的相同质荷比下的保留时间和二级离子碎片,结果显示鸡内金、鸭内金、鹅内金和鸽内金中所有的特异性多肽保留时间和二级离子碎片均能与人工合成的一一对应,表明了所筛选多肽的序列均为正确序列。见图11至图20。
[0094]
实施例2检测掺有鸭内金、鹅内金和鸽内金的混合鸡内金饮片及标准汤剂
[0095]
选取实施例1中的鸡内金多肽2,鸭鹅内金多肽6,以及鸽内金多肽9,选择合适的二级离子,以prm方式检测掺有鸭内金、鹅内金和鸽内金的鸡内金饮片和标准汤剂样品。
[0096]
具体如下:
[0097]
1.鸡内金混合饮片样品制备
[0098]
称取鸡内金粗粉适量,按鸡内金重量的10%、5%、2%的混入鸭内金、鹅内金和鸽内金粉末,即得得3份混合内金样品。
[0099]
2.混合煎液(标准汤剂)制备
[0100]
取鸡内金适量置陶瓷药煲中,按鸡内金重量的10%、5%、2%的混入鸭内金、鹅内金和鸽内金,得3份混合内金样品。加水煎煮两次,第一次煎煮直接加入10倍量沸水中,武火(500w)煮沸后文火(200w)保持微沸30分钟,煎液经350目筛网趁热过滤,滤液迅速用冷水冷却。第二次加8倍量水,武火加热煮沸后文火保持微沸10分钟,煎液用350目筛网趁热过滤,滤液迅速用冷水冷却,合并两次煎液,即得。
[0101]
3供试品溶液的制备
[0102]
取混合鸡内金饮片0.1g及混合煎液适量(约相当鸡内金饮片0.1g)至不同50ml量瓶中,加1%碳酸氢铵溶液至刻度,超声处理(功率250w,频率50khz)30分钟,用0.22μm微孔滤膜滤过,精密移取100μl置微量进样瓶中,分别加胰蛋白酶溶液10μl(取序列分析用胰蛋白酶,加1%碳酸氢铵溶液制成每1ml中含1mg的溶液,临用时配制),摇匀,37℃恒温酶解12小时,即得各混合饮片和混合煎液的供试品溶液。
[0103]
4对照品溶液的制备
[0104]
取多肽序列seq id no:2、seq id no:6、seq id no:9相应的人工合成肽段对照品适量,精密称定,分别加甲醇制成每1ml含各多肽对照品10μg的溶液,即得。
[0105]
5色谱条件
[0106]
waters acquity uplc beh c18色谱柱(150mm
×
2.1mm,1.7μm);流动相为乙腈-0.1%甲酸水溶液,按下表梯度进行洗脱洗脱,柱温为30℃,流速为0.3ml/min。
[0107]
梯度洗脱表
[0108][0109]
6质谱条件
[0110]
电喷雾正离子模式(esi+),鞘气流速:30l/min;辅助气流速:10l/min;喷雾电压:3.30kv;毛细管温度:320℃;辅助气温度:320℃;以下表离子对,进行prm模式扫描。
[0111][0112]
7测定
[0113]
分别精密吸取对照药材溶液与个混合煎液供试品溶液各2μl,注入液相色谱仪,按上述条件测定并采集质谱图。
[0114]
8结果与分析
[0115]
试验结果显示,混合饮片和混合煎液中同时呈现与肽段seq id no:2对应的人工合成肽段对照品色谱保留时间一致的色谱峰(图21、图22),表明了方法能准确检测到了鸡内金的成分;
[0116]
在5%的混合饮片中,能同时呈现与肽段seq id no:6和肽段seq id no:9对应的人工合成肽段对照品色谱保留时间一致的色谱峰(图23、图24),即当鸡内金饮片样品中混有5%的鸭内金、鹅内金和鸽内金时,仍能检出鸭内金、鹅内金和鸽内金的成分。
[0117]
在5%的混合煎液中,能同时呈现与肽段seq id no:6和肽段seq id no:9对应的人工合成肽段对照品色谱保留时间一致的色谱峰(图25、图26),即当鸡内金标准汤剂样品中混有5%的鸭内金、鹅内金和鸽内金时,仍能检出鸭内金、鹅内金和鸽内金的成分。
[0118]
表明方法具有较高的灵敏度,能够有效地控制鸡内金的掺伪行为。
[0119]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0120]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1