一种生物标志物在制备检测帕金森病试剂盒中的应用
1.本发明属于临床医学领域,具体涉及一种生物标志物在制备试剂盒中的应用。
背景技术:
2.帕金森病(parkinson disease,pd)是老年人常见的神经系统变性疾病,65岁以上人群患病率为1.7%,以黑质多巴胺能神经元变性缺失和残存神经元内路易小体形成为特征。早期诊断对于提高患者的生存质量以及防止病情的恶化具有重要的意义。
3.pd的诊断依赖于主要的运动症状,包括静止性震颤、肌强直、运动迟缓和姿势步态异常。然而,基于运动症状的诊断具有局限性,由于临床表现的复杂性与重叠性,需要由专科医师进行评估,且评估结果易受到人为主观因素的影响,无法准确地将pd与具有类似pd临床表现的其他疾病进行区分,也无法检测pd的病理变化。因此,识别pd特异性生物标志物对于早期诊断pd和及早治疗至关重要。然而目前仍缺少方便、快速、高通量的早期识别pd的检测方法。
4.大量证据表明α-突触核蛋白(α-syn)在pd的发病机制中起关键作用。纤维化α-syn寡聚体已经被确定为路易小体的主要成分,这是散发性和家族性pd的主要病理特征。而且,α-syn基因的点突变和异常扩增与家族性pd有关。此外,α-syn基因启动子的多态性与增加pd的发病风险相关。因此,检测pd患者脑脊液和血浆中的α-syn的变化被认为是pd诊断的理想生物标志物。
5.然而,众多研究结果表明脑脊液中α-syn浓度的变化具有明显的不一致性,另外检测血浆中α-syn也被证明是不可靠的。
技术实现要素:
6.本发明的目的在于提供一种生物标志物在制备检测pd试剂盒中的应用。
7.根据本发明具体实施方式的生物标志物在制备试剂盒中的应用,其中,所述试剂盒用于评估或判断受试者发生pd的风险,所述生物标志物包括红细胞内的α-syn寡聚体和红细胞内的总蛋白。
8.根据本发明具体实施方式的生物标志物在制备试剂盒中的应用,所述生物标志物为外周血红细胞内的α-syn寡聚体的浓度和总蛋白的浓度,具体的,生物标志为外周血红细胞内的α-syn寡聚体的浓度/总蛋白的浓度,即α-syn寡聚体的浓度与总蛋白的浓度的比值。
9.本发明发现,溶血现象影响了脑脊液和血浆中α-syn变化的准确评估,而溶血引起的污染是不可避免的。因此,本发明将外周血红细胞内的α-syn寡聚体的含量/总蛋白浓度作为标志物,具有更高的准确性。
10.根据本发明具体实施方式的生物标志物在制备试剂盒中的应用,所述评估或判断包括以下步骤:
11.(1)测定所述受试者的血液样品中红细胞内的α-syn寡聚体浓度和总蛋白浓度;
12.(2)将步骤(1)测定得到的α-syn寡聚体蛋白的浓度、总蛋白的浓度与参考值进行
比较,以判断所述受试者发生pd的风险。
13.根据本发明具体实施方式的生物标志物在制备试剂盒中的应用,步骤(2)中,参考值为15.03ng/mg,当外周血红细胞中的α-syn寡聚体/总蛋白比值高于15.03ng/mg时,可判断受试者为pd。
14.根据本发明具体实施方式的生物标志物在制备试剂盒中的应用,采用酶联免疫吸附测定法(elisa)测定α-syn寡聚体的浓度。
15.根据本发明具体实施方式的生物标志物在制备试剂盒中的应用,所述elisa包括以下步骤:
16.非生物素化3d5单克隆抗α-syn抗体包被96孔elisa板;生物素化3d5抗体作为检测抗体;extravidin碱性磷酸酶与检测抗体偶联;加入底物对硝基苯磷酸盐(pnpp)显色;测定405nm和603nm处的吸光度值。具体的操作步骤为:
17.s1、非生物素化的3d5单克隆抗α-syn抗体包被在elisa板上,用含有0.05%吐温20的磷酸盐缓冲液(pbst)洗涤后,用含有2.5%明胶的pbst溶液进行封闭;
18.s2、将受试者的血液样品、α-syn寡聚体标准品用磷酸盐缓冲液(pbs)溶液稀释至500nm,分别添加到elisa板上,并进行孵育;
19.s3、elisa板上添加1μg/ml的生物素化3d5抗体,然后进行孵育;
20.s4、用pbst溶液洗elisa板,加入碱性磷酸酶后,进行孵育;
21.s5、elisa板的每个反应孔中添加pnpp,测定405nm和603nm处的吸光度值。
22.更为具体的,
23.非生物素化的3d5小鼠单克隆抗α-syn抗体包被在96孔elisa板上,用pbst溶液洗涤之后,用含有2.5%明胶的pbst溶液进行封闭。
24.将100μl红细胞样本以及制备好的α-syn寡聚体标准品用pbs溶液稀释至500nm,分别添加到96孔elisa板上,并在37℃下孵育2小时。
25.用pbst洗涤后,添加100μl用封闭缓冲液稀释至1μg/ml的生物素化3d5抗体,然后在37℃下孵育2小时。
26.用pbst溶液洗涤96孔elisa板,并加用封闭缓冲液稀释至1:5000的extravidin碱性磷酸酶在37℃孵育1小时。
27.用pbst溶液洗涤96孔elisa板4次,在每孔中加入100μlpnpp,用elisa检测仪(bio-tek,winooski,vt,usa)测量405nm和603nm处的吸光度值。
28.本发明中,包被抗体和检测抗体是识别α-syn同一表面抗原的相同抗体。使用3d5单克隆抗体识别人α-syn第115-121个氨基酸的表面抗原。在α-syn是单体的情况下,当表面抗原被包被抗体所结合,α-syn单体将没有多余的表面抗原位点被检测抗体相结合。检测抗体是生物素化的,其识别与包被抗体相同的表面抗原位点。对于α-syn寡聚体,由于其为几个α-syn单体重叠在一起,当α-syn寡聚体中的其中一个α-syn单体的表面抗原被包被抗体结合时,仍有其他α-syn单体的表面抗原被检测抗体相结合。因此,在本发明的elisa测定中,只有α-syn寡聚体可以发出信号被检测到。
29.其中,extravidin碱性磷酸酶,可与生物素化的3d5单克隆抗体结合,而pnpp是碱性磷酸酶的作用底物,当碱性磷酸酶和pnpp反应时,会形成黄色水溶性产物,该水溶性产物可被elisa检测仪检测,在405nm和603nm处检测吸光度值即可,吸光度值的高低代表被检测
α-syn寡聚体浓度的高低。
30.根据本发明具体实施方式的生物标志物在制备试剂盒中的应用,步骤s2中,所述α-syn寡聚体标准品的配制方法为:将α-syn样品用pbs溶解至100μm的终浓度,并在37℃下孵育48小时,并以500-2000rpm的速度连续振荡,通过上述方法,两个或多个α-syn单体会聚集形成α-syn寡聚体,因此α-syn寡聚体会有多个可被3d5单克隆抗体识别的表面抗原位点。
31.根据本发明具体实施方式的生物标志物在制备试剂盒中的应用,按照h-y分级,所述pd包括h-y分级1级、2级、3级和4级。
32.本发明的有益效果:
33.一方面,本发明确定了早期判断pd的一种可靠的生物标志物,即将pd患者外周血红细胞中α-syn寡聚体/总蛋白作为判断pd的生物标志物。收集了100名pd患者和102名健康对照者,验证了α-syn寡聚体/总蛋白作为pd生物标志物的准确性,并进一步提出,当外周血红细胞中α-syn寡聚体/总蛋白之间浓度的比值高于15.03ng/mg时,可判断为pd。
34.另一方面,α-syn寡聚体检测中,使用3d5单克隆抗体同时作为包被抗体和检测抗体,识别人α-syn第115-121个氨基酸的表面抗原,对于α-syn单体的情况下,其表面抗原被包被抗体所结合,α-syn单体将没有多余的表面抗原位点被检测抗体相结合;对于α-syn寡聚体,因为其为多个α-syn单体重叠在一起,当其中一个单体的表面抗原被包被抗体结合时,仍有其他α-syn单体的表面抗原被检测抗体相结合。从而,本发明的方法提高了α-syn寡聚体检测的准确性。
附图说明
35.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
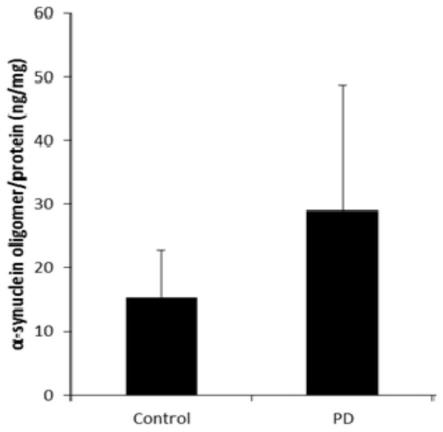
36.图1显示pd患者及健康对照者红细胞中α-syn寡聚体相对于红细胞总蛋白的情况;其中,control:健康对照组;pd:帕金森组;
37.图2显示不同h-y级的pd患者红细胞中α-syn寡聚体/总蛋白水平;
38.图3显示pd患者红细胞中α-syn寡聚体/总蛋白与(a)发病年龄、(b)病程、(c)年龄、(d)统一帕金森病评定量表(updrs)运动量表评分的相关性情况;
39.图4显示红细胞中α-syn寡聚体/总蛋白水平作为pd生物标志物的roc分析。
具体实施方式
40.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
41.updrs运动评分:用于综合评估pd患者的运动功能测评量表。
42.h-y分级:h-y分级提示着pd患者疾病的严重程度:1级:患者单侧肢体患病;1.5级:单侧肢体患病,并影响到躯干的肌肉,或另一侧肢体可疑受累;2级:双侧肢体患病,但平衡
没有受累;2.5级:患者平衡受到一定程度影响,在做后拉试验时可以自行恢复平衡;3级:患者存在姿势平衡障碍;4级:患者存在严重运动障碍,但能自己站立或行走;5级:患者在没有外人帮助时无法站立及行走,不能起床或生活在轮椅上。其中1-2.5级为早期pd,3-5级为中晚期pd。
43.α-syn标准品:sigma,st.louis,mo,usa;
44.extravidin碱性磷酸酶:sigma,st.louis,mo,usa;
45.黄色对硝基苯磷酸盐(pnpp):sigma,st.louis,mo,usa。
46.本发明的实施例主要包括了以下步骤:
47.1)收集pd患者及健康对照者的临床资料;
48.2)改良elisa法检测pd患者及健康对照者外周血红细胞中α-syn寡聚体浓度及与总蛋白浓度的比率;
49.3)分析pd患者红细胞中α-syn寡聚体/总蛋白与患者年龄、病程、updrs评分和疾病严重程度之间的相关性;
50.4)根据红细胞中α-syn寡聚体/总蛋白检测结果确定判断pd的最佳临界值。本研究方案由首都医科大学附属北京天坛医院伦理委员会批准。
51.所有受试者自愿参加,均被告知实验目的并签署知情同意书。
52.实施例1
53.1.1收集pd患者临床资料:
54.从天坛医院神经内科门诊收集pd患者及健康对照者。pd患者均符合国际帕金森和运动障碍学会(mds)2015年推出的pd临床诊断标准。排除标准:继发性帕金森综合征、帕金森叠加综合征;严重认知障碍、语言障碍等不能配合完成检查者;严重心肺疾病、肿瘤、肝肾疾病等慢性消耗性疾病者;精神障碍者。健康对照者入组要求既往无疾病史。
55.所有受试者均接受一般临床资料调查,包括:性别、年龄、pd发病年龄、病程、现病史、既往史、家族史等。由2位运动障碍专科医师完成对受试者的问诊、诊断、h-y分级、updrs测评,见表1。
56.表1 pd患者及健康对照者的临床资料
[0057][0058]
1.2采集pd患者及健康对照者的红细胞样本
[0059]
在edta涂层管中采集受试者全血(5ml)并等分。在2200
×
g和4℃下离心20分钟,从血浆中分离出红细胞。
[0060]
将红细胞沉淀物在无ca
2+
/mg
2+
的pbs缓冲液中洗涤三次,该缓冲液由137.5mm磷酸盐和150mm nacl(ph 7.4)组成,在冰上离心10分钟。
[0061]
除去上清液,将红细胞沉淀物在冰冷的pbs中1:1稀释,之后将红细胞样本储存在-80℃冰箱内,仅在分析时解冻。
[0062]
1.3制备α-syn寡聚体标准品:
[0063]
将纯化的α-syn样品用灭菌pbs溶解至100μm的终浓度。将盛有100μlα-syn溶液的eppendorf管用封口膜密封,在37℃下孵育48小时,并以1000rpm的速度连续振荡。将所得的α-syn寡聚体等分并储存在-80℃下。
[0064]
1.4建立使用3d5抗体检测α-syn寡聚体的elisa方法
[0065]
非生物素化的3d5小鼠单克隆抗α-syn抗体包被在96孔elisa板上,用pbst溶液洗涤之后,用含有2.5%明胶的pbst溶液进行封闭。
[0066]
将100μl红细胞样本以及制备好的α-syn寡聚体标准品用pbs溶液稀释至500nm,分别添加到96孔elisa板上,并在37℃下孵育2小时。
[0067]
用pbst洗涤后,添加100μl用封闭缓冲液稀释至1μg/ml的生物素化3d5抗体,然后在37℃下孵育2小时。
[0068]
用pbst溶液洗涤96孔elisa板,并加用封闭缓冲液稀释至1:5000的extravidin碱性磷酸酶在37℃孵育1小时。
[0069]
用pbst溶液洗涤96孔elisa板4次,在每个反应孔中添加100μl pnpp,用elisa检测仪测量405nm和603nm处的吸光度值。
[0070]
通过与α-syn寡聚体标准品的吸光度值进行比对,判断红细胞样本中α-syn寡聚体浓度的高低。
[0071]
将elisa板置于酶标仪上,读取各孔的吸光值,分别减去空白对照孔的吸光值进行调零,根据标准样品制作标准曲线,再分别计算各样品的抗体含量。
[0072]
1.5红细胞内蛋白质浓度的测量:
[0073]
使用双辛可宁酸(bca)蛋白质测定试剂盒(sigma,st.louis,mo,usa)测量红细胞样本在562nm处的吸光度值,通过比对蛋白质标准品的吸光度值来确定红细胞样本中总的蛋白质浓度。
[0074]
从标准品和样品吸光值中减去空白对照孔的吸光值,结合已知的蛋白质标准品的浓度和校正后的吸光值,用microsoftexcel做散点图,设蛋白质量为x,设吸光值为y,根据标准品做出标准曲线,得标准曲线方程y=ax;参照标准曲线,根据各蛋白样品校正后的吸光值计算蛋白浓度。
[0075]
1.6分析pd患者及健康对照者红细胞中α-syn寡聚体与总蛋白的浓度比率
[0076]
本发明考虑外周血红细胞数量的个体差异,将α-syn寡聚体的浓度标准化为红细胞总蛋白的浓度。
[0077]
pd患者及健康对照者红细胞中均检测到α-syn寡聚体,相对于红细胞总蛋白,pd患者的α-syn寡聚体水平明显高于健康对照者(29.0
±
19.8ng/mgvs.15.4
±
7.4ng/mg,p《0.001),结果见图1。
[0078]
1.7红细胞中α-syn寡聚体作为早期判断pd的生物标志物
[0079]
本发明分析了不同h-y分级的pd患者红细胞中α-syn寡聚体的水平,其中,h-y分级1-1.5级有22名pd患者,2-2.5级有58名pd患者,3级有16名pd患者,4级有4名pd患者。如前述方法分别计算不同h-y分级pd患者红细胞内α-syn寡聚体的水平。
[0080]
如图2所示,红细胞中的α-syn寡聚体/总蛋白在每个阶段的pd患者基本一致,分别为29.9
±
19.3ng/mg(1-1.5级)、28.2
±
19.7ng/mg(2-2.5级)、28.6
±
19.5ng/mg(3-3.5级)和26.9
±
20.7ng/mg(4-4.5级)(p=0.893)。说明在各病程阶段的pd患者(1-4.5级)红细胞中均可检测到α-syn寡聚体,并不受疾病严重程度的影响而产生变化,从而,α-syn寡聚体/总蛋白可作为早期判断pd发生的非常可靠的外周血生物标志物。
[0081]
1.8分析pd患者红细胞中α-syn寡聚体/总蛋白与发病年龄、病程、患者年龄、updrs运动评分之间的相关性
[0082]
pearson相关性方法分析了α-syn寡聚体/总蛋白与受试者的各项临床特征的相关性。
[0083]
应用spss 17.0统计软件首先确定各变量(α-syn寡聚体/总蛋白、发病年龄、病程、患者年龄、updrs运动评分)是否符合正态分布,如符合正态分布,应用spss软件中pearson相关性分析,pearson相关系数范围为(-1,+1),相关系数越接近0,相关关系越弱;越接近-1或+1,相关关系越强。
[0084]
结果如图3所示,pd患者红细胞中α-syn寡聚体/总蛋白与发病年龄(r=-0.142,p=0.117),病程(r=-0.003,p=0.970),患者年龄(r=-0.136,p=0.140)及updrs运动评分(r=-0.056,p=0.573)不相关。
[0085]
本发明使用多元线性回归进一步测试,应用spss 17.0统计软件将红细胞中α-syn寡聚体/总蛋白作为因变量,发病年龄、病程、患者年龄及updrs运动评分作为自变量,进行多元线性回归分析,判断自变量与因变量之间是否存在线性关系。
[0086]
本发明验证了α-syn寡聚体/总蛋白与患者年龄(p=1.361)、病程(p=0.830)、updrs评分(p=2.801)之间不具有相关性。
[0087]
综合以上结果,pd患者红细胞中α-syn寡聚体/总蛋白不受患者的年龄、病程及updrs运动评分的影响,可以作为一个稳定可靠的外周血生物标志物。
[0088]
1.9用roc曲线区分pd患者与健康对照者
[0089]
为了评估外周血红细胞中α-syn寡聚体/总蛋白比值在区分pd和健康对照者中的作用,进行了roc分析。
[0090]
应用spss 17.0统计软件进行roc曲线分析,曲线下面积称为auc,计算不同α-syn寡聚体/总蛋白比值下pd的真阳性率和假阳性率,采用约登指数(灵敏度+特异度-1)最大来寻找最佳临界值。
[0091]
结果如图4所示,15.03ng/mg的α-syn寡聚体/总蛋白的临界值是区分pd患者和对照组的最佳临界值,其灵敏度为79.0%(95%置信区间为70.9%-87.1%),特异性为64.7%(55.3%-74.1%),roc曲线下面积为0.76,因此,当外周血红细胞中α-syn寡聚体/总蛋白比值高于15.03ng/mg时,可判断为pd。
[0092]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1