拳参及其伪品药材草血竭、珠芽蓼的检测方法与流程
1.本发明属于医药技术领域,涉及药品的检测方法,尤其涉及拳参的检测方法,该方法能够有效地区分拳参及其伪品药材草血竭和珠芽蓼,该方法还能够有效地用于检查以作为拳参组方之一的中药组合物例如痢泻灵片中是否含有其它伪品药材例如草血竭、珠芽蓼等,为拳参药材及其制剂的质量监控提供了一种新的行之有效的方法。
背景技术:
2.拳参(bistortae rhizoma)为蓼科植物拳参polygonum bistorta l.的干燥根茎,春初发芽时或秋季茎叶将枯萎时采挖,除去泥沙,晒干,去须根。
3.拳参为蓼科植物蓼目的多年生草本,高50-90厘米。根茎肥厚扭曲,外皮紫红色。茎直立,单一或数茎丛生,不分枝。味苦、涩,性微寒。有清热解毒,消肿,止血之功效,常用于赤痢热泻,肺热咳嗽,痈肿瘰疬,口舌生疮,血热吐衄,痔疮出血,蛇虫咬伤。
4.拳参广泛分布于辽宁、内蒙古、河北、山西、陕西、安徽等地,拳参苦、涩,微寒,归肺、肝、大肠经,具有清热解毒、消肿、止血之功效,主要用于赤痢热泻、肺热咳嗽、痈肿瘰疬、口舌生疮、血热吐衄、痔疮出血、蛇虫咬伤等。
5.拳参(其在本发明中可以代号qs或q表示)药材同属植物多,并且它们的外观近似,长期以来均存在同属植物混用现象,真伪难以鉴别。其中,珠芽蓼(其在本发明中可以代号zyl或z表示)、草血竭(其在本发明中可以代号cxj或c表示)是用于拳参掺伪的最主要的两个品种。在药材市场及制剂市场经常存在有意掺伪或者无意误识,为表述方便,本文均称这些情形为掺伪和/或混伪。现行的2020年版《中国药典》中规定拳参的指标成分为没食子酸,而没食子酸也同样存在于珠芽蓼、草血竭中,并且含量较高。拳参药材市场混乱,真伪品掺杂现象严重。这也导致了中成药中拳参投料存疑。在本发明对拳参及其制剂进行掺伪检测时,如未另外说明,均是指使用珠芽蓼和/或草血竭进行掺伪。
6.临床上使用的痢泻灵片,是由拳参、穿心莲、苦参三者重量比为140:100:170的比例制成,为浅棕色片或糖衣片,除去糖衣后湿浅棕色,作为一种清热解毒口服类药品,痢泻灵片通常用于清热解毒、止痢、止泻,用于湿热痢疾、热泻。通过口服使用,一次6~8片,一日3次。痢泻灵片质量标准ws3-b-0439-90记载,拳参以药材直接粉碎入药,但是该质量标准中并没有提供鉴别痢泻灵片剂中的拳参真伪的方法。
7.因此,找到拳参的一种或多种特征性成分,以将其与伪品区别开来,并用于拳参及其制剂例如包含拳参的中成药痢泻灵片(拳参、穿心莲、苦参三者重量比为140:100:170)的质量控制,仍是本领域技术人员迫切期待的。
技术实现要素:
8.本发明的目的在于提供一种鉴别拳参及拳参制剂中的拳参及其伪品药材的方法。本发明人经过创造性的努力,发现一种或多种拳参的特征性成分,通过该特征性成分可以将拳参与其伪品区别开来,并用于拳参及其制剂例如包含拳参的中成药痢泻灵片的质量控
制。本发明基于此类发现而得以完成。
9.为此,本发明第一方面提供了检测拳参或其中药组合物中是否掺伪的方法,其使用液相色谱-质谱法对拳参或其中药组合物进行测定。
10.根据本发明第一方面的方法,其中所述中药组合物是由拳参和一种或者多种其它药材制成的。
11.根据本发明第一方面的方法,其中所述中药组合物是由拳参、穿心莲、苦参制成的。
12.根据本发明第一方面的方法,其中所述中药组合物是由拳参、穿心莲、苦参三者以重量比140:100:170制成的。
13.根据本发明第一方面的方法,其中所述中药组合物是由拳参、穿心莲、苦参三者以重量比140:100:170按如下方式制成:取拳参和穿心莲粉碎成细粉,取苦参加水煎煮二次,第一次2小时,第二次1.5小时,滤过,滤液浓缩至稠膏状,再与上述粉末混匀,制粒,干燥即得。
14.根据本发明第一方面的方法,其中所述中药组合物包括痢泻灵片。
15.根据本发明第一方面的方法,其中所述掺伪是向所述拳参或其中药组合物中掺入或混入伪品药材草血竭和/或珠芽蓼。
16.根据本发明第一方面的方法,其包括如下步骤:
17.(a)将拳参药材(或包含相当量的拳参药材的制剂或其它药材)粉碎、提取、过滤制备成供液相色谱-质谱分析使用的供试品溶液;
18.(b)质谱条件:esi-模式,毛细管电压为2.5~3.5kv,离子源温度100~150℃;锥孔电压15~45v,脱溶剂温度400~500℃;脱溶剂气流量(desolvation gas flow)600~900l/hr;
19.(c)液相色谱条件:色谱柱为c18色谱柱,以甲酸水溶液作为流动相a和乙腈作为流动相b进行梯度洗脱;
20.(d)将使用液相色谱-质谱(例如uplc-qtof-ms/ms)分析的三种药材(拳参、珠芽蓼和草血竭)采集的数据进行主成分分析、偏最小二乘法判别分析,筛选确定三个特征成分分别为:q376、z376和槲皮素-3-o-葡萄糖醛酸苷即c478,三种成分的检测信息如下表:
21.成分母离子定量离子定性离子分子量q376375.1271137376z376375.1271137376c478477.1301255,179,151478
22.(e)采用液相色谱-质谱方法,对步骤(d)方法筛选所得三个特征成分q376、z376和c478的峰面积进行相对定量;
23.(f)对于拳参或其中药组合物供试品,对三个特征成分q376、z376、c478进行定性后,峰面积按以下公式计算得到相对比值并进行比较,以此比较结果进行供试品的真伪判定:
24.则为拳参,
25.则为珠芽蓼,
26.且则为草血竭。
27.根据本发明第一方面的方法,步骤(a)中,所述的供试品溶液的制备包括,对药材或含药材中药组合物进行粉碎后,使用水或水与甲醇混合溶液进行提取处理,收集液体进行过滤。
28.根据本发明第一方面的方法,所述梯度洗脱程序包括0~5min,10% b;5~20min,10%-18% b;20~24min,18% b;24~34min,18%-40% b;34~40min,40%-100% b。
29.根据本发明第一方面的方法,所述梯度洗脱的流速为0.15~0.25ml/min。
30.根据本发明第一方面的方法,所述色谱柱规格为2.1mm
×
150mm,1.8μm。
31.根据本发明第一方面的方法,步骤(f)中,所述的定性方法包括:使用国家标准物质对照药材确定、根据保留时间确定、根据碎片信息确定。
32.根据本发明第一方面的方法,其包括如下步骤:
33.(a)供试品溶液配制法:将拳参药材(或包含拳参药材的制剂或其它药材)粉碎成可通过120目筛网的细粉,精密称取1g拳参药材(或相当于包含1g拳参的制剂、或等当于1g拳参的其它药材)粉末,加入40%甲醇50ml,超声提取40min,补加40%甲醇至50ml,使用0.22μm微孔滤膜过滤,滤液作为供试品溶液(以备液相色谱-质谱分析使用);
34.(b)质谱条件:毛细管电压(capillary)3kv;源温度(source temperature)110℃;脱溶剂温度(desolvation temperature)450℃;气帘气流量(cone gas flow)50l/hr;脱溶剂气流量(desolvation gas flow)800l/hr;
35.(c)液相色谱条件:流动相a为0.1%甲酸溶液,流动相b为乙腈;
36.洗脱梯度:0~5min,10% b;5~20min,10%-18% b;20~24min,18% b;24~34min,18%-40% b;34~40min,40%-100% b;
37.c18色谱柱(150mm
×
2.1mm,1.8μm),进样量2μl。
38.(d)将使用液相色谱-质谱(例如uplc-qtof-ms/ms)分析的三种药材(拳参、珠芽蓼和草血竭)的图谱数据进行多元统计分析,并分别将拳参、珠芽蓼和草血竭各自与另两种药材做偏最小二乘法判别分析,最终以多元统计分析、偏最小二乘法判别的vip值、p值、q值和power数值,筛选拳参及其伪品(即珠芽蓼和草血竭)的特征成分;经软件筛选出特征成分,对特征成分的裂解碎片、紫外吸收信息进行解析,筛选确定三个特征成分分别为:q376、z376和槲皮素-3-o-葡萄糖醛酸苷即c478,三种成分的检测信息如下表:
39.成分母离子定量离子定性离子rt/min分子量q376375.127113720.7376z376375.127113721.5376c478477.1301255,179,15125.5478
40.(e)采用三重四级杆质谱,对步骤(d)方法筛选所得三个特征成分q376、z376和c478的峰面积进行相对定量;
41.(f)对于拳参或其中药组合物供试品,分别记录其三个特征成分q376、z376、c478
的保留时间和峰面积,保留时间用于成分定性,峰面积按以下公式计算得到相对比值并进行比较,以此比较结果进行供试品的真伪判定:
42.则为拳参,
43.则为珠芽蓼,
44.且则为草血竭。
45.进一步的,本发明第二方面提供了一种中药组合物,其是由拳参、穿心莲、苦参制成的。
46.根据本发明第二方面的中药组合物,其是由拳参、穿心莲、苦参三者以重量比140:100:170制成的。
47.根据本发明第二方面的中药组合物,其是由拳参、穿心莲、苦参三者以重量比140:100:170按如下方式制成:取拳参和穿心莲粉碎成细粉,取苦参加水煎煮二次,第一次2小时,第二次1.5小时,滤过,滤液浓缩至稠膏状,再与上述粉末混匀,制粒,干燥即得。
48.根据本发明第二方面的中药组合物,其是痢泻灵片。
49.根据本发明第二方面的中药组合物,其在制备前和/或制备后,使用液相色谱-质谱法,对所用的药材拳参或制得的中药组合物进行测定,以检测其中的药材拳参或制得的中药组合物是否掺伪。
50.根据本发明第二方面的中药组合物,其在制备前和/或制备后,使用液相色谱-质谱法,对所用的药材拳参或制得的中药组合物进行测定,以检测其中的药材拳参或制得的中药组合物是否掺入或混入伪品药材草血竭和/或珠芽蓼。
51.根据本发明第二方面的中药组合物,使用如下液相色谱-质谱法检测其中的药材拳参或制得的中药组合物是否掺入或混入伪品药材草血竭和/或珠芽蓼:
52.(a)供试品溶液配制法:将拳参药材(或包含拳参药材的制剂或其它药材)粉碎成可通过120目筛网的细粉,精密称取1g拳参药材(或相当于包含1g拳参的制剂、或等当于1g拳参的其它药材)粉末,加入40%甲醇50ml,超声提取40min,补加40%甲醇至50ml,使用0.22μm微孔滤膜过滤,滤液作为供试品溶液(以备液相色谱-质谱分析使用);
53.(b)质谱条件:毛细管电压(capillary)3kv;源温度(source temperature)110℃;脱溶剂温度(desolvation temperature)450℃;气帘气流量(cone gas flow)50l/hr;脱溶剂气流量(desolvation gas flow)800l/hr;
54.(c)液相色谱条件:流动相a为0.1%甲酸溶液,流动相b为乙腈;
55.洗脱梯度:0~5min,10% b;5~20min,10%-18% b;20~24min,18% b;24~34min,18%-40% b;34~40min,40%-100% b;
56.c18色谱柱(150mm
×
2.1mm,1.8μm),进样量2μl。
57.(d)将使用液相色谱-质谱(例如uplc-qtof-ms/ms)分析的三种药材(拳参、珠芽蓼和草血竭)的图谱数据进行多元统计分析,并分别将拳参、珠芽蓼和草血竭各自与另两种药材做偏最小二乘法判别分析,最终以多元统计分析、偏最小二乘法判别的vip值、p值、q值和
power数值,筛选拳参及其伪品(即珠芽蓼和草血竭)的特征成分;经软件筛选出特征成分,对特征成分的裂解碎片、紫外吸收信息进行解析,筛选确定三个特征成分分别为:q376、z376和槲皮素-3-o-葡萄糖醛酸苷即c478,三种成分的检测信息如下表:
58.成分母离子定量离子定性离子rt/min分子量q376375.127113720.7376z376375.127113721.5376c478477.1301255,179,15125.5478
59.(e)采用三重四级杆质谱,对步骤(d)方法筛选所得三个特征成分q376、z376和c478的峰面积进行相对定量;
60.(f)对于拳参或其中药组合物供试品,分别记录其三个特征成分q376、z376、c478的保留时间和峰面积,保留时间用于成分定性,峰面积按以下公式计算得到相对比值并进行比较,以此比较结果进行供试品的真伪判定:
61.则为拳参,
62.则为珠芽蓼,
63.且则为草血竭。
64.根据本发明第一方面的方法或者第二方面的中药组合物,其中在配制供试品溶液时,使用供试品溶液配制法或者供试品溶液配制变型法进行。
65.本发明顺利地解决了以下问题或者实现了以下目的:
66.1)寻找拳参的特征成分,以区分拳参及其伪品药材。
67.2)基于其特征成分,建立含拳参中成药痢泻灵片中掺伪的检测方法。
附图说明
68.图1:成分20.79_376.0772n在15批次样品中的相对含量示意图,折线图。
69.图2:成分20.79_376.0772n在15批次样品中的相对含量示意图,散点图。
70.图3:成分25.49_478.0733n在15批次样品中的相对含量示意图,折线图。
71.图4:成分25.49_478.0733n在15批次样品中的相对含量示意图,散点图。
72.图5:槲皮素-3-o葡萄糖醛酸苷对照品图谱。
73.图6:拳参y2药材图谱。
74.图7:珠芽蓼t6药材图谱。
75.图8:草血竭s3药材图谱。
76.图9:拳参y2、珠芽蓼t6等比混合参比制剂图谱。
具体实施方式
77.通过下面的实施例可以对本技术进行进一步的描述,然而,本技术的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本技术的精神和范围的前提下,可以
对本技术进行各种变化和修饰。本技术对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本技术目的所使用的许多材料和操作方法是本领域公知的,但是本技术仍然在此作尽可能详细描述。以下实施例进一步说明本技术,而不是限制本技术。
78.下文制备或者操作的步骤,均是为了举例的目的,并基于各举例的可比较性而作了某些具体描述,本领域技术人员根据已有知识完全可以从中概括得到本技术涉及的产品或方法。
79.本发明使用的一些仪器、设备、试剂、试药均为本领域常用的,例如但不限于如下典型的品名:
80.实验设备:xevo g2-xs qtof质谱(沃特世股份有限公司),tsq vantage三重四级杆液质联用仪(赛默飞世尔科技有限公司),超声波清洗仪(宁波新芝生物科技股份有限公司),超纯水仪(苏州塞恩斯仪器有限公司),电子天平xpe204(梅特勒-托利多科技有限公司);
81.试剂:lc/ms级甲酸(赛默飞世尔科技有限公司),色谱级甲醇和色谱级乙腈(默克股份有限公司),亮氨酸脑啡肽标准物质(沃特世股份有限公司)。
82.药材:试验所用拳参及其伪品药材收集自亳州药材市场、安国药材市场、清平药材市场、成都莲花池药材市场、药材种植基地、饮片厂等多种渠道。不同批次药材或制剂的具体来源参见下文实施例1所记载的。
83.实施例1:拳参及其伪品药材草血竭、珠芽蓼的检测方法
84.本实施例使用液相色谱-质谱法对拳参及其伪品的药材或制剂进行检测,以判断药材或制剂是否为伪品或掺伪。
85.所用实验仪器和实验药材参见前文。
86.1.基于高分辨四级杆-飞行时间质谱的拳参鉴伪特征成分检测
87.本发明人在尝试性的试验中,分别考察40%、60%、80%和100%的甲醇超声提取拳参药材,以获得含有最丰富信息的质谱图谱为目标,最后确定40%甲醇提取药材是优选的提取溶剂。
88.(a)供试品溶液配制法:将拳参药材(或包含拳参药材的制剂或其它药材)粉碎成可通过120目筛网的细粉,精密称取1g拳参药材(或相当于包含1g拳参的制剂、或等当于1g拳参的其它药材)粉末,加入40%甲醇50ml,超声提取40min,补加40%甲醇至50ml,使用0.22μm微孔滤膜过滤,滤液作为供试品溶液(以备液相色谱-质谱分析使用)。供试品溶液配制变型法(在本发明中可称为变型法):将拳参药材(或包含拳参药材的制剂或其它药材)粉碎成可通过120目筛网的细粉,精密称取1g拳参药材(或相当于包含1g拳参的制剂、或等当于1g拳参的其它药材)粉末,加入5ml丙酮和0.2ml乙酸以及40%甲醇45ml,超声提取40min,补加40%甲醇至50ml,使用0.22μm微孔滤膜过滤,滤液作为供试品溶液(以备液相色谱-质谱分析使用)。
89.本发明人在一些实验中发现,当使用上述不添加丙酮和乙酸的供试品溶液配制法时,对于涉及包含苦参水煎提取物的拳参组合物例如市售中成药痢泻灵片或者参比制剂痢泻灵片,其中的典型成分q376在历次试验中难以检测到或者明显少于理论拳参药材测得量;对于不包含苦参水煎提取物的拳参组合物使用供试品溶液配制法或其变型法均能正常
检测到q376峰且峰面积基本上与所用等当量拳参药材相当;当将包含苦参水煎提取物的拳参组合物使用变型法制备供试品溶液时,q376峰明显并且峰面积基本上与所用等当量拳参药材相当;这些结果表明苦参水煎提取物可能会对拳参中的q376测定有影响。因此在本实施例1中若未另外别说明,供试品溶液配制法是指上述变型法。
90.本发明人通过大量的试验尝试进行液相色谱-质谱法的优化,最终确定了质谱及液相色谱的条件。
91.(b)质谱条件:毛细管电压(capillary)3kv;源温度(source temperature)110℃;脱溶剂温度(desolvation temperature)450℃;气帘气流量(cone gas flow)50l/hr;脱溶剂气流量(desolvation gas flow)800l/hr。
92.(c)液相色谱条件:流动相a为0.1%甲酸溶液,流动相b为乙腈;
93.洗脱梯度:0~5min,10% b;5~20min,10%-18% b;20~24min,18% b;24~34min,18%-40% b;34~40min,40%-100% b;
94.c18色谱柱(150mm
×
2.1mm,1.8μm),进样量2μl。
95.将供试品溶液使用上述质谱和色谱条件进行液相色谱-质谱即uplc-qtof-ms/ms分析。
96.本发明人在初期的研究工作中,综合参考药材dna检测结果、外观及维管束鉴别结果以及薄层鉴别结果,各选取5批次基源准确的拳参、珠芽蓼和草血竭药材,具体所用样品为如下批号的拳参、珠芽蓼或草血竭药材:y2、sd2、a2、a6、t3、sd1、sd1、t6、t13、w21、s3、y4、w1、w17、w19。
97.2.拳参鉴伪特征成分分析
98.(d)将使用uplc-qtof-ms/ms分析的三种药材(拳参、珠芽蓼和草血竭各5批,共15批次)的图谱数据进行多元统计分析,并分别将拳参、珠芽蓼和草血竭各自与另两种药材做偏最小二乘法判别分析,最终以多元统计分析、偏最小二乘法判别的vip值、p值、q值和power数值,筛选拳参及其伪品(即珠芽蓼和草血竭)的特征成分;经软件筛选出特征成分,对特征成分的裂解碎片、紫外吸收信息等进行解析,筛选确定三个特征成分分别为:q376、z376和槲皮素-3-o-葡萄糖醛酸苷(其在本文可以用代号cxj_478或c478表示),三种成分的检测信息如下表1。
99.表1:
100.成分母离子定量离子定性离子碰撞能(kv)rt/min*分子量q376375.12711378(一级)20(二级)20.79376.0772z376375.12711378(一级)20(二级)21.54376.0772c478477.1301255,179,15120(一级)40(二级)25.49478.0733
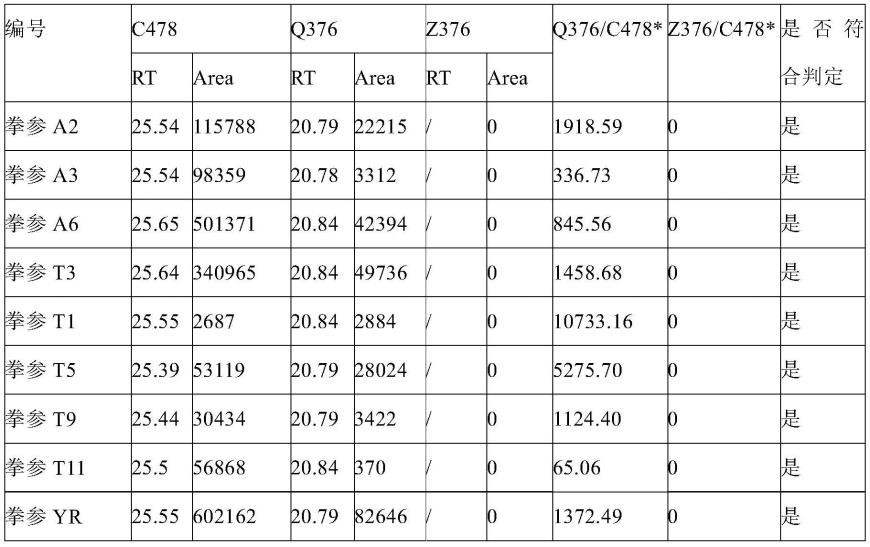
101.*注:本领域技术人员理解,保留时间在
±
0.1范围内波动是可以正常的。
102.(e)采用三重四级杆质谱,对步骤(d)方法筛选所得三个特征成分q376、z376和槲皮素-3-o-葡萄糖醛酸苷(其在本文可以用代号cxj_478或c478表示)的峰面积进行相对定量。
103.3.三种典型成分的定性
104.以上表1结果是照如下方式获得的。
105.拳参鉴伪特征成分的确定:将15批次拳参及其伪品的质谱检测数据导入
progenesis qi软件,根据所显示的得分,将其聚为三类,设定p《0.05,vip》1,得到470个成分,综合考虑q值和power值,并且参考各成分在15批样品中的含量分布,筛选出两个特征成分。分别是20.79_376.0772n和25.49_478.0733n。
106.成分20.79_376.0772n(记为q376),其色谱保留时间为20.79min,分子量为376.0772,加和离子有m+h,m+na和m+k。p值为0.000688,q值为0.00166,power值为0.991。表明该成分对于拳参及其伪品的区分具有显著性,且这一结果的可信度高。在15批次样品中该成分的相对含量示意图如图1和图2所示。
107.对该成分的正负离子模式下一、二级质谱图,以及紫外吸收光谱进行分析,暂时无法确定该成分准确的结构信息,也无法获得标准品进行比对,但可以使用保留时间20.79min表征,后续暂时对该成分以q376标识。本领域众所周知的,基于科学技术的发展规律,人们认识新事物的过程也是逐步的,尽管q376目前尚不清楚其准确结构信息且尚未能获得其标准品,暂时使用其保留时间表征是本领域通常认可的。如图1和图2所示的,拳参中的质谱检测数据中,成分q376的含量显著高于其它两种药材。
108.通过对比伪品珠芽蓼及草血竭样品的质谱图谱及紫外吸收光谱,发现珠芽蓼样品的质谱图在保留时间21.54min时,含有一成分与q376具有相同的分子量和相似的质谱裂解途径,具有相同的紫外吸收峰。区别是保留时间不同,以及二级质谱图中碎片峰强度不同,显示其为q376成分的同分异构体。暂时对该成分以z376成分标识。z376的保留时间为21.54min,其余质谱数据与q376相同。
109.另外,还在草血竭中发现一种具有显著更高含量的在本发明中可标记为cxj_478或c478的成分,即成分25.49_478.0733n,其保留时间为25.49min,分子量为478.0733,加和离子有m+h,m+na,m+k,p值为0.000122,q值为0.000488,power值≥0.9995。表明该cxj_478成分在区分草血竭与其他两种药材相比具有显著更高的含量,可信度较高。对该cxj_478成分的正负离子模式下一、二级质谱图,以及紫外吸收光谱进行分析,推测该成分为槲皮素葡萄糖醛酸苷,通过与标准品比对,确定其为槲皮素-3-o-葡萄糖醛酸苷(cas:22688-79-5)。
110.在15批次样品中该cxj_478成分的相对含量示意图如图3和图4所示。
111.上述结果显示,由15批次拳参及其伪品的成分分析,获得了三种特征成分,分别是拳参中含量较高的q376,珠芽蓼中含量较高(且与拳参特征成分q376同分异构体)的z376,以及草血竭含量较高的特征成分槲皮素-3-o-葡萄糖醛酸苷(c478,另外两种药材亦均含有)。为探讨是否能够通过此三种成分区分拳参及其伪品,本发明将采用三重四级杆质谱对三种成分进行定量分析。
112.4.三种典型成分的定量
113.使用本实施例1方法,确定了拳参的典型成分q376(rt=20.79min)、珠芽蓼的典型成分z376(rt=21.54min)、草血竭(另外二者亦均含有)的典型成分c478(rt=25.49min)。三种成分的典型谱图分别如图5~图9所示。
114.(f)对于每种药材或者制剂供试品,分别记录其三个特征成分q376、z376、c478的保留时间和峰面积,保留时间用于成分定性,峰面积按以下公式计算得到相对比值并进行比较,以此比较结果进行供试品的真伪判定:
115.则为拳参;
116.则为珠芽蓼;
117.且则为草血竭。
118.部分药材的三种典型成分的保留时间、峰面积及三者相对比值以及真伪判定结果见下表2(保留时间rt的单位为min)。
119.表2:
120.[0121][0122]
注*:结果为比值乘以10000倍。
[0123]
由上表数据可知,除1批珠芽蓼不满足其特征成分限制,其余批次均符合判定标准。这一批次的z376成分未检出,可能与药材质量有关。
[0124]
上表结果所检测的药材,涉及从各种途径收集到的拳参及其伪品样品22批,按照本实施例方法进行检测,通过这些药材验证了本实施例方法完全可以用于拳参药材混伪的鉴别。下表3列出了拳参鉴伪特征成分验证所用药材样品信息及检测结果。
[0125]
表3:
[0126]
[0127][0128]
注:标#表示供应商不能确定具体成分。
[0129]
5.痢泻灵片的参比制剂制备
[0130]
参比制剂的制备:本发明按照痢泻灵片质量标准ws3-b-0439-90的制备方法制备痢泻灵片:取140g拳参和100g穿心莲粉碎成细粉,取170g苦参加水煎煮二次,第一次2小时,第二次1.5小时,滤过,滤液浓缩至稠膏状,再与上述粉末混匀,制粒,干燥,压制成1000片,作为参比制剂。
[0131]
参比制剂配制所用的药材及批次信息分别为拳参(y2批次,山东家种)、珠芽蓼(t6批次,甘肃)、草血竭(s3批次,云南)、穿心莲(批号:201011003)、苦参(k1批次,山西)。具体的参比制剂配制材料比例见表4。
[0132]
表4:
[0133][0134]
注:170g苦参照上述标准方法所得干燥取提物重20.2g,因此在上表配比时苦参提
取物(以干燥品加入)的量为2g,相当于17g苦参药材,与药品标准的投料比例相同;
③
~
⑤
参比制剂中的部分拳参用其它药材代替。
[0135]
6.痢泻灵片中的拳参药味混伪掺伪的检测
[0136]
抽验获得到的14批次不同批号的市售痢泻灵片样品,对这些样品中的拳参药味混伪掺伪情况使用本实施例1的方法进行检测,将痢泻灵片(若包衣则去除包衣使成素片)粉碎成细粉,照供试品溶液的制备方法即变型法处理得到制剂供试品溶液,使用本实施例的液相色谱-质谱法对这些供试品溶液进行测定,以验证该方法是否能用于痢泻灵片中拳参药味掺伪的鉴别。所涉及的痢泻灵片来源如下:
[0137]
来自某a公司的生产于2019年到2021年间的片剂5批次,编码p1~p5;
[0138]
来自某b公司的生产于2020年到2021年间的片剂4批次,编码p6~p9;
[0139]
来自某c公司的生产于2020年到2021年间的片剂5批次,编码p10~p14。
[0140]
上述片剂编码为本技术人在本文中编列。
[0141]
经测定,上述参比制剂以及市售制剂的痢泻灵片中拳参药味掺伪检测结果列明于下表5,其中保留时间rt的单位为min。
[0142]
表5:
[0143]
[0144][0145]
注*:结果为比值乘以10000倍。
[0146]
从上表结果可见,参比制剂的结果与投料相符;14批次样品中,均未按处方量投放拳参,除了p3、4、6批次外,其余11批次均含有珠芽蓼,p3、4、6批次疑含有草血竭。
[0147]
根据上述结果,表明本发明实施例1的方法可以有效地检测拳参及其制剂中的混伪掺伪状态,尤其是用于检测拳参及其制剂中是否存在或掺入伪品药材草血竭、珠芽蓼。
[0148]
实施例2:测定中药组合物痢泻灵片中的拳参
[0149]
本实施例所用药材:拳参(sd8批次,某单位提供,检定为正品)、穿心莲(批号:201011003)、苦参(k1批次,山西)。苦参水煎提取物的制备:将药材苦参加水煎煮二次,第一次2小时,第二次1.5小时,滤过,滤液浓缩至稠膏状,取一部分干燥,得苦参水煎提取物(稠膏和干颗粒两种状态被选择用于下面的对照片剂制备);dz1(对照片剂)的制备:取140g拳参和100g穿心莲粉碎成细粉,与由170g苦参得到的苦参水煎提取物(稠膏)混匀,制粒,干燥,压制成1000片,得对照片剂,记为dz1,其相当于表4正品片剂
②
并且期待能够获得表5之编号
②
样品的类似检测结果;dz2(对照片剂)的制备:取140g拳参和100g穿心莲粉碎成细粉,与由90g苦参得到的苦参水煎提取物(稠膏)混匀,制粒,干燥,压制成1000片,得对照片剂;dz3(对照片剂)的制备:取140g拳参和100g穿心莲粉碎成细粉,与由30g苦参得到的苦参水煎提取物(稠膏)混匀,制粒,干燥,压制成1000片,得对照片剂;dz4(对照片剂)的制备:取140g拳参和100g穿心莲粉碎成细粉,与由0g苦参得到的苦参水煎提取物(稠膏)混匀,制粒,干燥,压制成1000片,得对照片剂;dz5(对照片剂)的制备:取140g拳参、100g穿心莲、170g苦参粉碎成细粉,混匀,制粒,干燥,压制成1000片,得对照片剂;dz6(对照片剂)的制备:取140g拳参、100g穿心莲、90g苦参粉碎成细粉,混匀,制粒,干燥,压制成1000片,得对照片剂。为研究起见,以上制备的各种片剂成形性不良的问题,不予关注。参照实施例1的液相色谱-质谱进行检测,使用不添加丙酮和乙酸的供试品溶液配制法配制供试品溶液,结果:sd8和dz1~dz6全部试样的z376未检出;sd8的c478峰面积为364752、q376峰面积为74071、q376
×
10000/c478=2030.7,sd8为拳参;dz1~dz6的c478峰面积在360264~368487范围内且与sd8相当;dz4~dz6的q376峰面积在73143~74974范围内、q376
×
10000/c478=1997~2063,均为拳参,例如dz4的q376
×
10000/c478=2022.6;dz3的q376峰面积为17345、q376
×
10000/c478=474.1,为拳参但特征峰q376/c478比明显降低;dz2的q376峰面积为2462、q376
×
10000/c478=71.1,为拳参但特征峰q376/c478比明显降低;dz1的q376峰面积为143、q376
×
10000/c478=3.89,不能认定为拳参,结果不能接受;sd8和dz1~dz6全部试样的c478峰rt=25.53~25.66min、q376峰rt=20.71~20.80min,例如sd8的c478峰rt=
25.65min、q376峰rt=20.73min;这些结果表明,使用实施例1之液相色谱-质谱进行检测,使用不添加丙酮和乙酸的供试品溶液配制法配制供试品溶液,涉及苦参水煎提取物的对照片剂的q376/c478显著降低甚至结果不能接受。另外,参照实施例1的液相色谱-质谱进行检测,使用变型法配制供试品溶液,结果:sd8和dz1~dz6全部试样的z376未检出;sd8的c478峰面积为364254、q376峰面积为73862、q376
×
10000/c478=2027.7,sd8为拳参;dz1~dz6的c478峰面积在361046~372117范围内、q376峰面积在72846~74832范围内、q376
×
10000/c478=1959~2055,均为拳参,例如dz1的c478峰面积368324、q376峰面积74832、q376
×
10000/c478=2031.7;sd8和dz1~dz6全部试样的c478峰rt=25.51~25.67min、q376峰rt=20.73~20.82min,例如sd8的c478峰rt=25.63min、q376峰rt=20.75min;这些结果表明,使用实施例1之液相色谱-质谱进行检测,使用添加丙酮和乙酸的变型法配制供试品溶液,不同配方比例的q376/c478结果基本相同。以上结果表明,使用本发明方法测定由拳参等药材制成的痢泻灵片是有效的。在本发明上述各种操作步骤中,虽然其描述的具体步骤在某些细节上或者语言描述上与下文具体实施方式部分的制备例中所描述的步骤有所区别,然而,本领域技术人员根据本发明全文的详细公开完全可以概括出以上所述方法步骤。
[0150]
本发明的任一方面的任一实施方案,可以与其它实施方案进行组合,只要它们不会出现矛盾。此外,在本发明任一方面的任一实施方案中,任一技术特征可以适用于其它实施方案中的该技术特征,只要它们不会出现矛盾。下面对本发明作进一步的描述。
[0151]
本发明所引述的所有文献,它们的全部内容通过引用并入本文,并且如果这些文献所表达的含义与本发明不一致时,以本发明的表述为准。此外,本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍然希望在此对这些术语和短语作更详尽的说明和解释,提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。
[0152]
以上所述实施例仅是为充分说明本技术而所举的较佳的实施例,本技术的保护范围不限于此。本技术领域的技术人员在本技术基础上所作的等同替代或变换,均在本技术的保护范围之内。本技术的保护范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1