一种基于糖代谢差异的细胞功能成像方法和应用
1.本发明涉及生物成像领域,具体涉及一种基于糖代谢差异的细胞功能成像方法和应用。
背景技术:
2.功能成像技术已成为继计算机断层扫描(ct)和磁共振成像(mri)之后肿瘤成像领域一座新的里程碑。不同于直接显示肿瘤物理形状的ct和mri,功能成像技术可以根据肿瘤的特定功能——包括肿瘤不同于正常组织的物质与能量代谢水平——进行显影。目前,以正电子发射断层扫描技术(pet)为代表的功能成像已被广泛应用于肿瘤的临床诊断。基于肿瘤组织的有氧糖酵解水平高于正常组织,且肿瘤细胞需要大量己糖为其生理活动(包括增殖、迁移、侵袭等)提供能量,pet技术常使用同位素f
18
标记的葡萄糖(fdg)作为造影剂,利用肿瘤的糖代谢水平更高来对其显影。对于pet技术,代谢水平的差异是功能成像的基础,差异越大越能获得具有更高灵敏度和对比度的成像结果。在上述原理的指导下,研究和寻找差异较大的物质代谢途径,开发相应的造影剂是功能成像技术重要的研究方向。
3.然而,肿瘤细胞在分子水平和代谢途径方面并无统一且独有的特征,仅在代谢水平与其他正常细胞不同,仅利用肿瘤与正常组织代谢的相对差异来进行功能成像难以避免背景信号的产生,如果在此基础上构建一种提高代谢差异的策略,有机会提高功能成像技术的准确性。
技术实现要素:
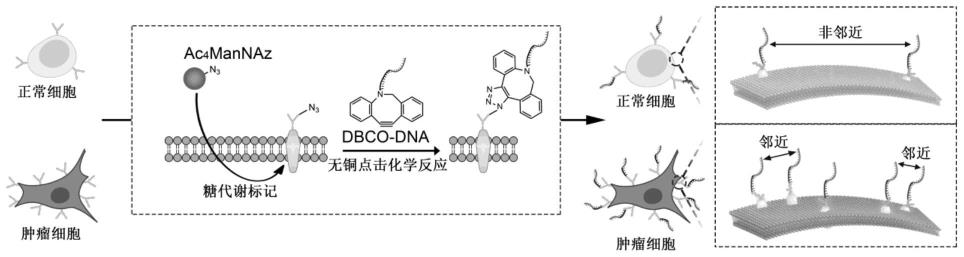
4.为了克服现有技术的不足,本发明的主要目的在于提供一种基于糖代谢差异的细胞功能成像方法,基于放大糖代谢差异的成像策略,即邻位增强型功能成像(pefi),构建一种放大肿瘤细胞与正常细胞之间糖代谢水平差异的成像方法。由于肿瘤细胞快速生长和分裂的需要,其比正常细胞具有更高的糖代谢水平。如将肿瘤细胞和正常细胞同样喂以化学标记的甘露糖,肿瘤细胞膜表面糖蛋白的糖链上的化学标记会远高于正常细胞。在这种情况下,肿瘤细胞表面化学标记的糖蛋白相邻概率会远高于正常细胞,这时,如果巧妙地利用“两个相邻的化学标记的糖蛋白”作为输出信号的话,肿瘤细胞的输出信号则会被大幅度提升,相对地,正常细胞的输出信号会大大降低。这种邻位增强信号的策略可以将代谢差异成倍扩大,达到降低分析的背景信号、提高准确性的目的。
5.本发明的另一目的是提供上述基于糖代谢差异的细胞功能成像方法在细胞水平和动物水平上多种类型肿瘤成像检测和分析中的应用,用于体外多种类型肿瘤成像检测和分析准确度高,在临床检验上对肿瘤的准确识别和分析方面具有重要的应用价值。
6.本发明的上述目的通过如下技术方案来实现:
7.本发明第一方面提供一种基于糖代谢差异的细胞功能成像方法,基于肿瘤细胞与正常细胞之间存在的糖代谢水平差异进行邻位增强型功能成像,以两个邻近的dna标记的糖蛋白作为输出信号,通过邻位增强信号将肿瘤细胞与正常细胞的代谢差异成倍扩大,具
体地,包括以下步骤:
8.步骤1:通过基于点击化学的糖代谢标记法构建dna工程化的细胞,即细胞经四酰化-n-叠氮基乙酰-甘露糖胺(ac4mannaz)代谢后,其膜蛋白的糖链上标记有叠氮(n3)基团;
9.步骤2:通过无铜点击化学反应使二苯并环辛炔(dbco)基团修饰的dna链(dbco-dna)连接到细胞膜表面的n3基团上,其中:
10.细胞膜上两条邻近的dbco-dna共同互补结合一条环状dna(circle),circle与首尾修饰以tamra荧光基团和bhq2猝灭基团的茎环状dna链分子信标(beacon)结合,使beacon打开茎环结构,在细胞膜上两条邻近的dbco-dna处输出荧光信号。
11.作为优选,所述基于糖代谢差异的细胞功能成像方法,包括如下步骤:
12.步骤a:设计用于细胞表面工程化的dbco-dna、用于结合细胞膜上邻近dna的circle以及用于信号输出的beacon序列;
13.步骤b:步骤a中设计的dbco-dna连接在经ac4mannaz代谢后的肿瘤细胞表面,再使用步骤a中设计的circle与beacon在细胞表面输出信号进行细胞功能成像;
14.步骤c:将多种肿瘤细胞系和正常细胞系通过ac4mannaz处理1~84h,并比较肿瘤细胞与正常细胞的糖代谢水平随代谢时间的变化;
15.步骤d:步骤c中所得肿瘤细胞与正常细胞的糖代谢水平差异最大的处理时间作为糖代谢时间,通过步骤b完成基于糖代谢差异的肿瘤细胞邻位增强型功能成像。
16.优选地,步骤a中,所述用于细胞表面工程化的dbco-dna序列为:
[0017]5’‑
dbco-ttttttttttttttttttttcagagtcaagaggagtgagt-3’(seq id no:1)。
[0018]
优选地,步骤a中,所述用于结合细胞膜上邻近dna的circle序列为:
[0019]5’‑
cagagcaagagggtgggttggggcagtttactcactcctttttttttttttttt tttttttttttttttactcactccttttagggagggttggacagatagagtg-3’(seq id no:2)。
[0020]
优选地,步骤a中,所述用于输出信号的beacon序列及基团修饰为:
[0021]5’‑
tamra-cgtgcgctctgccccaacccaccctcttgctctgcactctatctgtcc aaccctccctagcgcacg-bhq2-3’(seq id no:3)。
[0022]
优选地,步骤b中,将贴壁培养的肿瘤细胞使用含50μm ac4mannaz的培养基培养72h,使细胞膜蛋白的糖链上代谢出n3基团;再换成含2μm dbco-dna的pbs与细胞孵育0.5h,使dbco-dna通过点击化学反应结合在细胞膜上的n3基团上,得到dna工程化的肿瘤细胞;再依次用含2μm circle的pbs和含2μm beacon的pbs与细胞反应各0.5h;最后用激光共聚焦显微镜对细胞进行拍照成像与图像分析。
[0023]
优选地,步骤c中,将贴壁培养的肿瘤细胞和正常细胞分别用含50μm ac4mannaz的培养基处理1~84h,再换成含25μm dbco-cy5的pbs与细胞孵育0.5h,最后用激光共聚焦显微镜对各组细胞进行成像,并使用image j软件比较分析肿瘤细胞与正常细胞在不同糖代谢时间下的成像结果。
[0024]
更优选地,步骤c中,所述肿瘤细胞包括但不限于hela细胞、a549细胞和hepg2细胞,所述正常细胞包括但不限于l02细胞、293t细胞和mcf10a细胞。
[0025]
优选地,步骤d中,使用肿瘤细胞与正常细胞糖代谢水平差异最大的处理时间作为糖代谢时间,即将不同肿瘤细胞与正常细胞分别用含50μm ac4mannaz的培养基处理36h,再用含2μm dbco-dna的pbs与细胞反应0.5h,此时肿瘤细胞表面的dna密度高于正常细胞,dna
相互邻近的概率也高于正常细胞;后续的操作与步骤b一致,最后用激光共聚焦显微镜对各组细胞进行成像,并使用image j软件对各组细胞进行分析。
[0026]
本发明另一方面还提供上述基于糖代谢差异的细胞功能成像方法在体外肿瘤成像检测和分析中的应用。
[0027]
本发明另一方面还提供上述基于糖代谢差异的细胞功能成像方法在细胞水平或动物水平上肿瘤成像检测和分析中的应用。
[0028]
与现有技术相比,本发明的有益效果在于:
[0029]
1、本发明基于肿瘤细胞与正常细胞糖代谢水平的差异性,构建一种基于糖代谢差异的细胞功能成像,由于肿瘤细胞具有比正常细胞更高的代谢效率和唾液酸表达量,使得肿瘤细胞表面工程化结合的dna密度远高于正常细胞,dna相互邻近的概率也远高于正常细胞。因此,肿瘤细胞表面dbco-dna由于量多而邻近率高,使得肿瘤细胞膜上产生大量的荧光信号;正常细胞表面dbco-dna由于量少而难以邻近,使得正常细胞膜上只能产生极少量的荧光信号,通过对肿瘤细胞的邻位增强型功能成像实现对肿瘤细胞的准确识别分析的同时,大大降低对正常细胞的假阳性。
[0030]
2、本发明中采用的pefi技术具有普遍性和通用性,能够准确区分多种类型的肿瘤细胞与正常细胞。
[0031]
3、本发明采用的pefi技术用于体外多种类型肿瘤成像检测和分析准确度高,在多种类型肿瘤的精准识别中表现出重要的临床应用价值。
附图说明
[0032]
图1为实施例中基于点击化学的糖代谢标记法构建dna工程化细胞的示意图。
[0033]
图2为实施例中基于糖代谢水平差异对肿瘤细胞和正常细胞功能成像的示意图。
[0034]
图3为实施例中circle与beacon的互补结合的(a)凝胶电泳与(b)荧光强度结果。
[0035]
图4为实施例中对hela细胞进行邻位增强型功能成像的共聚焦成像结果。
[0036]
图5为实施例中ac4mannaz在肿瘤细胞与正常细胞内不同时间下的代谢成像结果与荧光强度分析;(a)通过荧光成像分析ac4mannaz代谢的示意图;(b)ac4mannaz在肿瘤细胞与正常细胞内的代谢随时间变化的共聚焦成像图;(c)对(b)中的共聚焦成像图进行的荧光强度分析。
[0037]
图6为实施例中多种类型的肿瘤细胞与正常细胞pefi成像的共聚焦成像结果与荧光强度分析;(a)通过pefi对肿瘤细胞与正常细胞进行分析的共聚焦成像图;(b))对(a)中的共聚焦成像图进行的荧光强度分析。
[0038]
图7为实施例中通过pefi对小鼠腹部肿瘤病灶进行荧光指导手术切除前后的成像结果。
具体实施方式
[0039]
下面结合具体实施例进一步阐述本发明,这些实施例仅用于说明本发明而不用于限制本发明的范围。
[0040]
实施例1
[0041]
本实例提供一种基于糖代谢差异的细胞功能成像技术,包括如下操作:
[0042]
(1)circle与beacon的结合与信号输出验证:将circle和beacon混合至pbs中,在混合液中二者终浓度均为500nm。将混合液置于37℃恒温水浴锅中避光反应0.5~1h,反应结束后,circle和beacon结合后的构象变化通过15%非变性聚丙烯酰胺凝胶电泳进行分析,与circle结合后beacon的荧光强度通过荧光光谱仪进行分析,用540nm的激发波长激发beacon中修饰的tamra荧光基团,并在550nm到700nm的波长范围内进行荧光强度检测。电泳结果如附图3a所示,circle与beacon混合后出现了明显的新条带,表明circle与beacon互补结合生成了新的产物;荧光结果如附图3b所示,加入circle后,beacon由荧光猝灭转为荧光恢复状态,证明circle可以结合并打开beacon,使其荧光恢复。
[0043]
(2)细胞培养:人宫颈癌细胞(hela细胞)、人非小细胞肺癌细胞(a549细胞)、人肝癌细胞(hepg2细胞)和人胚胎肾细胞(293t)用含有10%胎牛血清和1%抗生素(链霉素和青霉素)的dmem培养基中培养,人正常肝细胞(l02细胞)用含10%胎牛血清和1%抗生素(链霉素和青霉素)的rpmi-1640培养基培养,人乳腺上皮细胞(mcf10a细胞)用乳腺上皮细胞完全培养基培养,细胞均培养于含有5%二氧化碳的37℃的恒温细胞培养箱中。
[0044]
(3)基于糖代谢差异的细胞功能成像:将hela细胞置于玻底培养小皿中,待细胞贴壁后,将各细胞培养基更换成含有50μm ac4mannaz的培养基,并将细胞置于培养箱培养72h。在用d-pbs洗三次后,加入2μm dbco-dna在37℃下孵育0.5h。d-pbs洗三次后,向细胞表面加入2μm circle,在37℃下孵育0.5h。移除circle并用d-pbs洗三次后,加入2μm beacon,在37℃下孵育0.5h。在上述所有条件的基础上设置三个对照组,分别为只不含ac4mannaz的未糖代谢组(w.o.ac4mannaz)、只不含dbco-dna的未dna工程化组(w.o.dbco-dna)和只不含circle的未输出信号组(w.o.circle)。用4% pfa固定细胞在避光室温下对细胞固定10min,d-pbs洗三次后用dapi对细胞核在避光室温下染10min,之后用d-pbs洗三次。最后使用激光共聚焦显微镜对细胞进行成像。结果如图4所示,在经过pefi分析后,hela细胞膜上有明显的荧光信号产生。而在其他对照组中,在分别不加入ac4mannaz、dbco-dna或circle的情况下加入beacon后,细胞表面没有或只有及其微弱的荧光信号。证明pefi的可行性,即先通过糖代谢标记法对细胞进行表面dna工程化,后通过circle、beacon与细胞表面dna的互补组装而进行功能成像分析,缺少任一条件(包括糖代谢标记、dna工程化、circle的结合等)都不会使细胞表面产生荧光信号。
[0045]
实施例2
[0046]
本实施例基于实施例1中的细胞功能成像方法,根据肿瘤细胞与正常细胞糖代谢水平的差异性,提供一种针对肿瘤细胞的邻位增强型功能成像技术,包括如下操作:
[0047]
(1)糖代谢水平差异分析:将hela细胞、a549细胞、hepg2细胞、l02细胞、293t细胞和mcf10a细胞置于玻底培养小皿中,待细胞贴壁后,将各细胞培养基更换成含有50μm ac4mannaz的培养基,并将细胞置于培养箱分别培养2~84h。对照组使用不加ac4mannaz的培养基培养的细胞。之后移除培养基,用d-pbs洗三次,向小皿内加入25μm dbco-cy5并在37℃下避光孵育0.5h。再次移除反应溶液,并用d-pbs洗三次,向小皿内加入4%多聚甲醛(pfa)在避光室温下对细胞固定10min,用d-pbs洗三次。最后用dapi对细胞核进行染色,在避光室温下染10min,之后用d-pbs洗三次。使用激光共聚焦显微镜对细胞进行成像,并使用image j软件对成像结果进行分析。结果如图5所示,随着代谢时间的增长,肿瘤细胞组(hela细胞、a549细胞和hepg2细胞)表面产生的荧光强度逐步提升,而正常细胞组(l02细胞、293t细胞
和mcf10a细胞)的荧光最初增长缓慢,到60h后才有明显提升。由荧光强度分析得出在两组细胞代谢36h左右时相对荧光差值最大,也就是说,糖代谢时间为36h时肿瘤细胞与正常细胞之间的糖代谢水平差异最大。
[0048]
(2)邻位增强型细胞功能成像:将hela细胞、a549细胞、hepg2细胞、l02细胞、293t细胞和mcf10a细胞分别传代,并取1
×
104个细胞接种于的共聚焦玻底小皿中。待细胞贴壁后,使用含50μm ac4mannaz的培养基进行代谢36h,在用dpbs洗三次后,加入2μm dbco-dna在37℃下孵育0.5h。dpbs洗三次后,向细胞表面加入2μm circle,在37℃下孵育0.5h。移除circle并用dpbs洗三次后,加入2μm beacon,在37℃下孵育0.5h。用4%多聚甲醛固定细胞并用dpai进行染色,最后使用激光共聚焦显微镜对细胞进行成像,并使用image j软件对成像结果进行分析。结果如图6所示,对于肿瘤细胞hela细胞、a549细胞和hepg2细胞,其表面可以观察到明显的荧光信号;而正常细胞l02细胞、293t细胞和mcf10a细胞表面几乎观察不到荧光信号。荧光统计分析结果同样证实了pefi分析下的肿瘤细胞组荧光强度远高于正常细胞组。结果表明pefi能够将肿瘤细胞与正常细胞代谢水平的差异转化为细胞表面dna相邻概率的差异,从而增强两种细胞的信号输出差距,这样可以准确地识别分析肿瘤细胞,并降低对正常细胞的假阳性。
[0049]
实施例3
[0050]
本实施例基于实施例1,以小鼠腹膜瘤成像为例,将pefi技术用于在动物水平上的体内肿瘤组织的准确识别成像,包括如下操作:
[0051]
所有动物实验严格遵循机构动物护理和使用委员会的指导原则。小鼠乳腺癌细胞4t1-荧光素酶标记(4t1-luc细胞)用含有10%胎牛血清(fbs)的dmem培养基培养,然后收集至每100μl 5
×
105个,腹腔注射于spf级balb/c五周龄雌性裸鼠(18-20g左右)体内。待5天后小鼠体内形成小肿瘤结节,体内尾静脉注射ac4mannaz(40mg/kg),持续三天。然后尾静脉注射dbco-ldna(2μm,10ml/kg),一天后麻醉小鼠,打开腹腔喷洒含circle(2μm,10ml/kg)与带有cy5和bhq2双修饰的beacon(2μm,10ml/kg)混合液,10min后用生理盐水冲洗未结合的dna。通过小动物成像系统监对腹腔肿瘤同时进行生物发光和荧光成像。结果如图7所示,腹部肿瘤部位的荧光成像结果与生物发光成像结果位置基本一致,且荧光边缘清晰,背景信号弱,表明pefi能够在体内有效区分肿瘤组织与正常组织。在pefi的荧光指导下进行手术摘除肿瘤病灶,之后再次进行腹部成像,结果显示几乎观察不到荧光信号与生物发光信号,证明肿瘤病灶已在荧光指导下被准确完全切除。该结果表明pefi在临床肿瘤切除手术的指导中有潜在应用价值。
[0052]
上述实施例基于肿瘤细胞和正常细胞糖代谢水平的差异性,构建一种基于糖代谢差异的邻位增强型功能成像方法,用于细胞水平和动物水平上肿瘤成像分析。先使用ac4mannaz处理细胞,使其表面代谢出n3基团;之后用dbco-dna与n3连接,进行细胞表面dna工程化,再通过引入circle与beacon的结合使细胞表面的邻近膜糖蛋白产生信号。通过评估ac4mannaz分别在肿瘤细胞与正常细胞中的糖代谢水平,选择36h为后续在肿瘤及正常细胞内的糖代谢时间,并通过共聚焦荧光成像,将肿瘤细胞与正常细胞代谢差异转化为细胞表面dna相邻概率差异,从而准确地识别分析多种类型肿瘤细胞,并降低了正常细胞的假阳性。在动物水平上构建了小鼠腹膜瘤模型,通过pefi分析有效区分肿瘤组织与正常组织,并在肿瘤切除手术起到荧光指导作用,在临床检验上对肿瘤的准确识别分析中具有重要的应
用价值。
[0053]
本发明不限于上述实施例,还可以根据本发明的发明创造的目的做出多种变化,并进行其他多种细胞成像和动物成像中的应用。凡依据本发明技术方案的精神实质和原理下做的改变、修饰、替代、组合或简化,均应为等效的置换方式,只要符合本发明的发明目的,只要不背离本发明的技术原理和发明构思,都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1